应用圆柏花粉变应原皮试液诊断圆柏花粉过敏性疾病的有效性和安全性
李 宏,程 璇,尹 佳,王瑞琦,王良录,孙劲旅,文利平,顾建青,关 凯,岳凤敏,徐 涛
[中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科,过敏性疾病精准诊疗研究北京市重点实验室,中国医学科学院临床免疫研究中心,北京 100730]
ChinJAllergyClinImmunol,2017,11(4):351- 357
圆柏学名Sabina chinensis (L.) Antoine,英文名China Savin,属于圆柏属(Sabina)柏科(Cupressaceae),原产中国东北南部及华北等地,日本、朝鲜也产。1986年中国第一次气传致敏花粉调查报告显示:全国30个监测地区空气中均报告有大量圆柏花粉[1]。圆柏树为常绿乔木,可高达20 m,树冠尖塔形或圆锥形,是我国传统的园林树种。近年各地多采用圆柏进行荒山造林,园林绿化,行道植树,空气中柏树花粉含量也随之增高,临床过敏患者也随之大量涌现。圆柏花粉是最主要的春季致敏花粉之一。研究显示,花粉季节大气中漂浮的圆柏花粉浓度可高达294 g/m3[2]。圆柏花粉过敏流行具有很强的季节性, 在北方地区,每年三月中旬至4月中旬是圆柏花粉症的发病期。症状表现为反复持续性喷嚏,流涕不止,鼻堵严重只能张口呼吸,夜间无法入睡。双眼红肿奇痒,眼分泌物增多。面部皮肤红肿痒,脱皮。部分患者有咳嗽,喘憋,听力下降等症状。尤其在圆柏绿化为主的小区,每年春季大批患者集中发病,严重影响患者的日常工作学习和生活。因此,针对圆柏花粉过敏的诊治刻不容缓。皮肤试验是过敏性疾病病因学诊断的基本方法,具有简单快速、成本低和敏感性高等特点[3- 4]。北京协和医院变态反应科应用本院变应原制剂室研制的圆柏花粉变应原制剂,通过皮内试验和特异性免疫治疗,近20年来已成功诊断和治疗了大批圆柏诱发的春季过敏性鼻炎和过敏性咳嗽的患者。本研究用圆柏花粉变应原注射原液 1∶100稀释液对受试者做皮内试验 ,分别以变态反应专科医师临床综合诊断和血清特异性IgE (specific IgE,sIgE)检测结果为金标准和相对金标准,回顾性评价该皮内试验用于诊断圆柏花粉过敏的有效性和安全性。
对象与方法
对象
入选标准:(1)受试者年龄为4~75岁(含4岁和75岁),男女不限; (2)2009年2月至7月在北京协和医院变态反应科就诊者;(3)在入选当天,已在北京协和医院变态反应科完成20种常规吸入变应原皮内试验者;(4)在入选当天,已在北京协和医院变态反应科用Phaidia Uni-CAP检测系统完成至少1种以上吸入过敏原sIgE检测者;(5)已签署知情同意书。
排除标准:(1)仅有吸入变应原皮内试验结果者;(2)仅有变应原sIgE试验结果者;(3)使用非Phadia Uni-CAP系统检测sIgE者;(4)凡在皮肤试验进行之前3 d内曾经口服短效抗组胺药物或3周内口服长效抗组胺药物者;(5)有严重过敏反应或严重过敏史者;(6)皮肤划痕征阳性者;(7)做皮内试验时正在或2周内曾患皮肤湿疹、皮肤感染、皮炎或外伤者;(8)试验前1 d口服糖皮质激素超过相当于泼尼松10 mg/d量者;(9)试验前1 d内在将进行皮肤试验的上臂部使用糖皮质激素油膏者;(10)4周内服用糖皮质激素者;(11)有严重影响全身状态的疾病者;(12)处在过敏性疾病急性发作期者,如过敏性哮喘;(13)有肾上腺素禁忌证者;(14)妊娠期及哺乳期妇女;(15)研究者认为不适合参加试验的其他情况。
剔除标准:(1)皮内试验中阳性对照为阴性或阴性对照为阳性结果者;(2)无任何记录者。
方法
研究设计:选择2009年2月10日至2009年7月10日在北京协和医院变态反应科就诊并已完成20种常规吸入变应原(包括圆柏花粉)皮内试验和至少1种变应原(包括圆柏花粉)血清特异性IgE检测的患者至少1 000例。对其圆柏花粉皮内试验结果和sIgE结果进行登记,由登记医师依据患者(的)病史、症状、体征和血清圆柏花粉sIgE检查结果进行综合分析并做出变态反应专科医师临床综合特异性诊断。分别以变态反应专科医师临床综合特异性诊断为金标准,以血清圆柏花粉sIgE检测结果为相对金标准,评价应用圆柏花粉注射原液1∶100稀释液进行皮内试验检测圆柏花粉过敏的敏感度、特异度、阳性预期值和阴性预期值。
登记入组当天由变态反应专科医师面对面询问患者在完成皮内试验之后是否出现不良反应并记录。分析不良反应发生情况,对圆柏花粉注射原液1:100稀释液进行皮内试验的安全性进行评价。
皮内试验:皮内试验所用圆柏花粉过敏原浸液和对照液均由北京协和医院变应原制剂室提供,圆柏花粉过敏原浸液浓度为1∶20(W/V)[5],皮内试验所用皮试液用过敏原溶媒新鲜配制后4 ℃冰箱避光保存。圆柏花粉皮内皮试液需稀释至1∶100(W/V)浓度,阴性对照液用过敏原溶媒,阳性对照分别用0.1 mg/ml和0.01 mg/ml磷酸组织胺。皮内试验由5位有经验的专科护士完成,操作方法见文献[6],结果判定标准:将风团直径<5 mm、≥5 mm、≥10 mm、≥15 mm、≥20 mm分别定为,(-)(+)(++)(+++)(++++)级。 皮内试验结果由护士判断,判断结果的护士不了解患者病史和临床症状。
血清特异性IgE检测:所有入选者完成皮内试验后立即抽取静脉血2~5 ml,离心取血清后,用Phadia公司Uni-CAP100过敏原检测系统(RASTFEIA法),检测圆柏花粉sIgE。结果分级标准,将sIgE水平为<0.35、≥0.35、≥0.7、≥3.5、≥17.5、≥50、≥100 kUa/L定义为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ级。检测由2位有经验的专业人士负责并报告结果,报告者不了解血清提供者的病史和临床诊断。
不良反应分类
局部不良反应:对圆柏花粉过敏者经皮内试验后,局部出现风团和红晕,此为正常的阳性反应,但若风团和红晕反应过大(风团直径>40 mm),则视为局部不良反应。皮试5~6 h后在注射局部可出现迟发相反应,即水肿越来越重,范围越来越大,甚至可波及整个前臂,皮肤潮红,皮温升高,奇痒,胀痛,轻者24 h可消退,重者则需2~3 d甚至1周方可逐渐消退。
与教学科研双肩挑的教师人员相比,从事机能实验教学的实验人员工作地位较低。这是由于在处理教学与科研的关系上,各高校普遍存在一定的失衡现象[2],高校各项政策都向科研倾斜,进一步降低了较少有机会参与科研工作的技术人员的地位。从加强高校教学建设的角度,增加对教学的投入,重视实验教学,关注实验人员的工作状态,理解他们的诉求,给他们提供可以继续发展的机会,这将直接影响实验技术人员的工作积极性,从根本上提高其工作地位[3],使其愿意在教学工作上投入精力。
全身不良反应:轻度全身反应可表现为过敏性鼻结膜炎的症状,如喷嚏、流涕、眼痒、眼结膜肿胀;中度全身反应可表现为在局部不良反应的同时,全身出现急性荨麻疹或血管性水肿,有的表现为干咳、胸闷,憋气和哮喘发作;重度全身反应为过敏性休克,但极为罕见,过敏性休克的表现有血压急剧下降至休克水平,意识障碍,在休克前期及早期可出现与过敏有关的症状,如皮痒、皮疹、喷嚏、哮喘等。
数据库的建立及管理:变态反应专科医师根据入选者的原始观察记录,保证将数据准确、完整、清晰、及时地载入病例报告表。然后将病例报告表送交本临床试验的数据管理人员,由其统一建立数据库。全部入选者的临床综合特异性诊断,皮内试验结果和血清特异性IgE结果输入数据库。为防止输入误差,先后由2人分别输入,然后再由第3人专门负责输入并核对全部数据。全部数据由中国协和医科大学基础医学院临床流行病统计学教研室计算各项指标。
统计学方法
分别以变态反应专科医师临床综合特异性诊断和Uni-CAP诊断为金标准,以Uni-CAP sIgE诊断为相对金标准,分析圆柏花粉皮内皮试液进行皮内试验的有效性。通过灵敏度、特异度、阳性预测值和阴性预测值、准确度、ROC曲线等指标进行描述,分析用圆柏花粉过敏原皮试液进行皮内试验出现的不良反应的比率和各种不良反应的构成情况。应用SPSS 13.0统计学软件对数据进行分析。
结 果
以变态反应专科医师临床综合特异性诊断为金标准的有效性评价
以变态反应专科医师临床综合诊断作为金标准,以圆柏花粉皮内试验结果≥(+)为诊断界值时,变态反应专科医师临床综合诊断和圆柏花粉皮内试验均为阳性135例,两者均为阴性503例,圆柏花粉皮内试验灵敏度的点估值为0.957 4(可信区间为92.41%~99.08%),特异度的点估值为0.714 5(可信区间为68.11%~74.79%),阳性预测值为0.401 8,阴性预测值为0.988 2,准确度的点估值为0.755 0(表1,2)。以圆柏花粉皮内试验结果≥(++)为诊断界值时,变态反应专科医师临床综合诊断和圆柏花粉皮内试验均为阳性64例,两者均为阴性686例,圆柏花粉皮内试验灵敏度的点估值为0.453 9(可信区间为37.17%~53.61%),特异度的点估值为0.974 4(可信区间为96.28%~98.61%),阳性预测值为0.780 5,阴性预测值为0.899 1,准确度的点估值为0.887(表1,3)。
ROC曲线下面积为0.891,95%的可信区间为(0.864,0.918)(图1)。
以Uni-CAP sIgE诊断为金标准的有效性评价
以圆柏变应原sIgE诊断作为评价标准,当以圆柏花粉皮内试验结果≥(+)为诊断界值时,圆柏花粉皮内试验和sIgE检测结果均为阳性127例,均为阴性14例,圆柏花粉皮内试验灵敏度的点估值为

表1 皮肤试验结果与临床综合诊断比较Table 1 Comparison between IDT and clinical comprehen- sively specific diagnosis (n)
IDT:皮内试验

表2 以临床综合诊断为金标准的皮内试验反应性诊断结果[≥(+)]Table 2 Using clinical comprehensively specific diagnosis as gold standard, the results of IDT [≥(+)]
IDT:皮内试验;AUC:药时曲线下面积;CI:置信区间
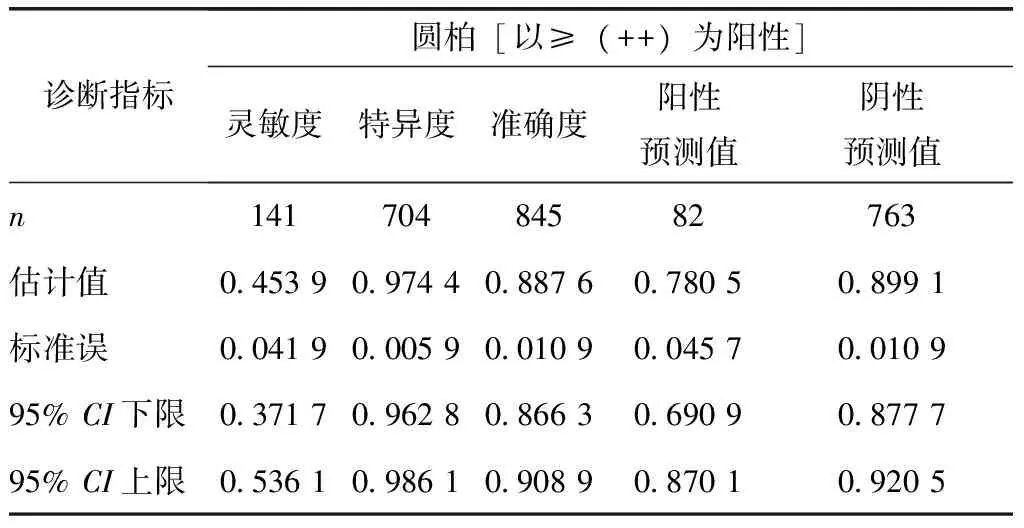
表3 变应原皮肤试验反应性(以变态反应医师临床综合诊断为金标准)[≥(++)]Table 3 Using clinical comprehensively specific diagnosis as gold standard, the results of IDT[≥(++)]
IDT:皮内试验;CI:置信区间

图1 圆柏皮肤试验结果ROC曲线Fig 1 Skin test results of ROC curves of Sabina chinensis

(n)

表5 以sIgE为金标准皮内试验反应性诊断结果[≥(+)]Table 5 Using Uni-CAP sIgE detection results as gold standard, the results of IDT[≥(+)]
IDT:皮内试验;CI:置信区间
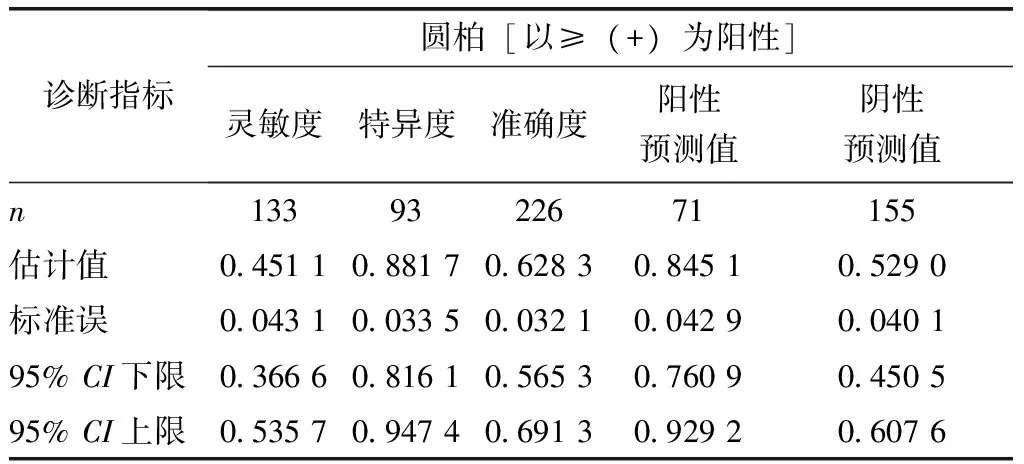
表6 以sIgE为金标准皮内试验反应性诊断结果[≥(++)]Table 6 Using Uni-CAP sIgE detection results as gold standard, the results of IDT[≥(++)]
IDT(Intradermal Test):皮内试验;CI:置信区间
0.954 9(可信区间为91.96%~99.02%),特异度的点估值为0.150 5(可信区间为7.79%~22.32%),阳性预测值为0.616 5,阴性预测值为0.700 0,准确度的点估值为0.623 9(表4,5)。
以圆柏花粉皮内试验结果≥(++)为诊断界值时,圆柏花粉皮内试验和sIgE检测结果均为阳性60例,均为阴性82例,圆柏花粉皮内试验灵敏度的点估值为0.451 1(可信区间为36.66%~53.57%),特异度的点估值为0.881 7(可信区间为81.61%~94.74%),阳性预测值为0.845 1,阴性预测值为0.529 0,准确度的点估值为0.628 3(表4,6)。
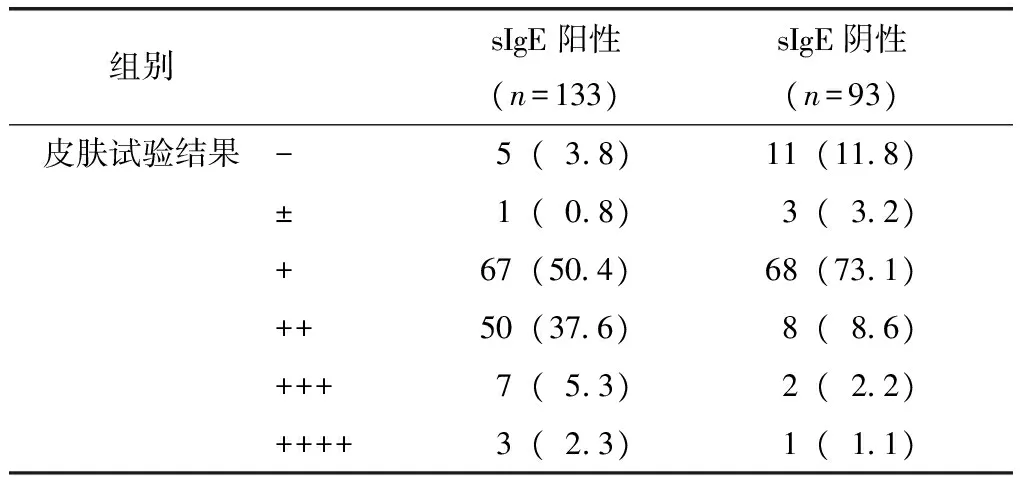
表7 以sIgE为金标准的皮内试验结果分布Table 7 Using Uni-CAP sIgE detection as gold standard,the distribution of IDT results [n(%)]

表8 不同水平sIgE阳性组皮肤试验反应程度Table 8 Different response levels of nIDT in sIgE positive group
安全性分析
在全部1 043例受试者中,115例在进行皮内试验后出现不良反应,其中113例出现局部不良反应,占总例数的10.83%,不良反应出现频率最多的是注射部位持续红肿超过24 h,共有79例,其次为注射部位硬结,共有55例,各占总例数的7.57%和5.27%。其他局部不良反应还有远离皮试部位的瘙痒、红斑和风团,分别有8例,5例和3例,占总例数的比例均不到1%,分别为0.77%,0.48%和0.29%。仅有2名受试者在进行皮内试验后出现全身性的不良反应,其中1例出现鼻痒、喷嚏、流涕;1例出现恶心、腹痛,其圆柏花粉皮内试验结果为(-),此例全身性不良反应与圆柏花粉皮试无关。
安全评价统计包括了所有20种过敏原检测,因此综合各种过敏原引起的较强反应,花粉引起不良反应的比例较高; 出现与圆柏花粉变应原有关的不良反应 [圆柏花粉变应原皮试结果≥(++++)]有4例,占总人数的0.3835%。不良反应出现频率最多的是注射部位持续红肿>24 h,共有5例,其次为注射部位硬结,共有3例,各占总例数的0.48%和0.29%。其他局部不良反应还有风团、红斑及远离皮试部位的瘙痒各1例,占总例数的比例不到0.1%。仅有1例在进行皮内试验后出现与圆柏花粉变应原有关的全身性不良反应,表现为鼻痒、喷嚏、流涕,症状为一过性,此例圆柏花粉皮内试验结果为(++++),同时蒿属花粉皮内试验结果为(++++),此例圆柏花粉皮试很可能是全身性不良反应的部分原因。
讨 论
圆柏花粉是春季空气中最主要的致敏花粉之一。研究显示,花粉季节大气中漂浮的圆柏花粉浓度可高达294 g/m3[2]它能导致过敏性鼻炎、过敏性结膜炎、过敏性咳嗽、哮喘和过敏性皮炎等。目前我国尚无针对圆柏花粉变应原的皮肤检测试剂。由于其具有简单快速、低花费和高敏感性的特点,皮肤试验一直是过敏性疾病病因学诊断最基本的手段之一[7- 9]。目前,广泛使用的皮肤试验方法有两种,皮内试验和点刺试验。其中皮内试验是我国变态反应临床近50年来广泛采用的方法。由北京协和医院研制的圆柏花粉皮内皮试液主要用于过敏性疾病的特异性诊断,已在北京协和医院和国内700余家医院用于临床数十年。本研究运用ROC曲线探讨圆柏花粉皮内皮试液对圆柏花粉过敏性疾病的诊断价值。
所有入选的1 043例受试者中16例内试验后出现皮肤试验假阳性或者组胺假阴性。根据剔除标准的规定,将上述假阳(阴)性的受试者从有效性评价中剔除,但是所有受试者均进入安全性评价,最终有效性评价1 027例,安全性评价1 043例。
当用皮内试验检查结果与变态反应专科医师临床综合特异性诊断结果进行对比时,如以皮内试验结果≥(+)和≥(++)为诊断界值时,皮内试验的灵敏度分别为0.957 4和0.453 9;特异度分别为0.714 5和0.974 4,阳性预测值分别为0.401 8和0.780 5,阴性预测值分别为0.988 2和0.899 1,准确度分别为0.755 0和0.887 6。可以看出采用皮内试验反应(++)作为其阳性结果判定标准时,用圆柏变应原注射原液1:100稀释液皮内诊断圆柏花粉过敏有更好的准确度。以≥(+)为阳性判断标准时敏感度较高,以≥(++)为阳性判断标准时特异度较高。
ROC曲线AUC可以综合评价一个诊断试验的灵敏度和特异度,可以通过检验总体ROC曲线下AUC是否等于0.5来评价某诊断试验是否有价值。本试验的AUC为0.891,95%的可信区间为0.864~0.918,因此可以认为圆柏花粉变应原原液1∶100稀释液皮内试验诊断圆柏花粉过敏的临床应用诊断价值较高。
另外,再以Phadia Uni-Cap sIgE诊断作为次要评价标准,将圆柏花粉皮内试验检查结果与圆柏变应原sIgE诊断结果进行对比,以皮内试验结果≥(+)为诊断界值时,其灵敏度为0.954 9,特异度为0.150 5,阳性预测值为0.616 5,阴性预测值为0.700 0,准确度为0.623 9,以皮内试验结果≥(++)为诊断界值时,灵敏度为0.451 1,特异度为0.881 7,阳性预测值为0.845 1,阴性预测值为0.529 0,准确度为0.628 3。圆柏花粉皮内试验检查结果与圆柏变应原sIgE诊断结果相比,以皮内试验结果≥(+)为诊断界值时,特异度仅为0.150 5。其原因可能由于变应原花粉原料不同所致。圆柏变应原sIgE检测试剂的变应原来自欧洲的刺柏(Juniperus sabinoides),而协和圆柏变应原注射原液原料来自中国本土的圆柏(Sabina chinensis),二者在变应原组份方面可能存在差异。从表8可以看出皮试后皮肤反应的强度的分布趋势:随着sIgE浓度的增加,皮肤低反应程度出现概率减少,皮肤高反应程度出现概率增加。
皮肤试验受皮试液、皮试设施、受试者、操作者以及合并用药等各方面的影响较大,不可避免地存在假阳性和假阴性反应[10- 11]。本试验因皮肤对照试验的假阳性和假阴性反应剔除了16例入选有效性数据集。试验中如阳性对照出现阴性结果,合并用药是临床诊疗中最常见也是最首要考虑的因素,因此在皮肤试验操作前要仔细询问患者近期使用的合并用药,并需要根据不同药物的性质停药几天至数天。如若阴性对照出现风团甚至是阳性结果可能由于:操作时用力过度,导致皮肤出血;试验中与阳性对照液或变应原液混合造成的干扰;皮肤划痕症及荨麻疹的影响。
在全部1 043例受试者中,出现与圆柏花粉变应原有关的不良反应[圆柏花粉变应原皮试结果≥(++++)]4例,占总人数的0.383 5%。仅有1例受试者在进行皮内试验后出现与圆柏花粉变应原有关的全身性的不良反应, 占总人数的0.095 9%,表现为鼻痒、喷嚏、流涕,症状为一过性。此例圆柏花粉皮内试验结果为(++++),同时蒿属花粉皮内试验结果为(++++)。
综上所述,圆柏变应原注射原液1∶100稀释液进行皮肤试验,具有良好的安全性,较好的灵敏度和特异度,可用于圆柏花粉引起的过敏性疾病辅助诊断,还可为特异性脱敏治疗提供可靠的客观依据。
[1]叶世泰,张金谈,顾瑞金,等. 中国气传致敏花粉调查[M].北京:北京出版社,1991.
[2]姚丽娜,张宏誉. 北京气传柏树花粉浓度监测分析[J]. 中国公共卫生,2009,12:749- 751.
[3]李强. 如何正确开展临床诊断性研究: 诊断性研究的评价方法及评价指标[J]. 中国全科医学,2006,9:342- 343.
[4]Schwindt CD, Hutcheson PS, Leu SY,et al. Role of intradermal skin tests in the evaluation of clinically relevant respiratory allergy assessed using patient history and nasal challenges[J]. Ann Allergy Asthma Immunol, 2005,94:627- 633.
[5]乔秉善. 变态反应学实验技术[M].北京: 中国协和医科大学出版社,2002.
[6]叶世泰. 变态反应学[M]. 北京:科学出版社,1998.
[7]Demoly P, Piette V, Bousquet J. In vivo methods for study of allergy. in Middleton’s allergy principles and practice[M]. 6th ed. Philadelphia, 2003.
[8]Skin tests used in type Ⅰ allergy testing position paper. Sub-committee on skin tests of the European academy of allergology and clinical immunology[J]. Allergy, 1989, 44: 22- 30.
[9]Dolen WK. Skin Testing Techniques[J]. Immunol Allergy Clini North America, 2001, 21:273- 279.
[10] Schwindt CD, Hutcheson PS, Leu SY, et al. Role of intradermal skin tests in the evaluation of clinically relevant respiratory allergy assessed using patient history and nasal challenges[J]. Ann Allergy Asthma Immunol, 2005, 94:627- 633.
[11] 顾瑞金.帕特森变态反应性疾病[M].6版.北京:人民卫生出版社,2004:139- 141.