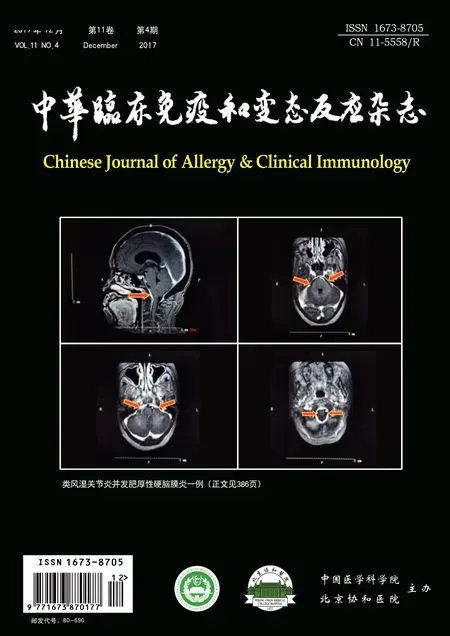
类风湿关节炎并发肥厚性硬脑膜炎一例
张丽华,王秀娟,林 涛,焦瑞英,庞丽霞
(呼伦贝尔市人民医院风湿免疫科, 内蒙古自治区 021008)
近年来,随着对类风湿关节炎并发症的不断探索研究以及影像学的发展,发现类风湿关节炎可继发多种多样的血管炎病变,其中以继发肥厚性硬脑膜炎 (hypertrophic cranial pachymeningitis,HCP)为罕见。现将本科收治的1例类风湿关节炎继发HCP报道如下。
临床资料

图1 颅脑增强MRI(2015年2月):脑干及双侧小脑半球周围硬脑膜肥厚,T1WI、T2WI均接近等信号,增强扫描明显强化(箭头所指处)
患者女性,50岁,教师。主因多关节肿痛5年余、声音嘶哑伴头痛1年余,2014年12月起于我科多次住院治疗。患者5年前(2012年)无明显诱因出现双手掌指关节、双膝关节肿痛,晨僵>1 h,无发热,无皮疹,无口腔溃疡,无口干、眼干,未进行诊治;2014年2月出现声音嘶哑,语速减慢,间断头痛,就诊于北京某三甲医院,实验室检查:抗环瓜氨酸肽(cyclic citrullinated peptide,CCP)抗体321 U/ml,抗角蛋白抗体(antikeratin antibody,AKA)、红细胞沉降率(erythrocyte sedimentation rate,ESR)及超敏C反应蛋白(hypersensitive C reactive protein,hs-CRP)均升高(具体数值不详),诊断类风湿关节炎,建议口服药物,患者拒绝,自行口服中药(具体成分不详)。2014年4月患者声音嘶哑逐渐加重,同时有饮水呛咳、吞咽困难,多关节肿痛加重,于2014年6月和9月于黑龙江某医院住院治疗,诊断为类风湿关节炎、肥厚性硬脑膜炎(未提供影像资料),给予甲强龙40 mg/d静点、针灸等治疗后饮水呛咳、吞咽困难、关节肿痛明显减轻,出院后给予泼尼松8片(40 mg)/d,甲氨蝶呤10 mg/周,甲氨蝶呤出院后口服2次自觉胃区不适停用,后改为环磷酰胺隔日100 mg口服,环磷酰胺口服后恶心、呕吐,自行停用环磷酰胺。2014年12月头痛持续加重,声音嘶哑,听力下降,进食少,乏力、纳差,关节肿痛不明显,消瘦明显;后一般状态差,头痛、声音嘶哑加重,吞咽困难,饮水呛咳,消瘦明显。2015年2月于本科住院治疗,入院查体心肺腹(-),体型消瘦,声音嘶哑,周身关节无肿胀及压痛,四肢肌力正常,肌压痛阴性,神经系统生理反射存在,病理反射(-)。肢体深、 浅感觉未见异常, 脑膜刺激征阴性。实验室检查:血、尿、便常规均未见异常。生化:肝功、肾功、血糖、血脂、离子均(-);凝血、传染病筛查均(-),C反应蛋白(C reactive protein,CRP)11.5 mg/L,ESR 34 mm/1 h;抗心磷脂抗体IgM 28.3 U↑(正常参考值<20 U),抗核抗体(antinuclear antibody,ANA)、抗可提取核抗原(extractable nuclear antigen,ENA)谱、抗双链DNA(double strands deoxyribonucleicacid,dsDNA)、抗中性粒细胞核周抗体(anti-antineutro-philic perinuclear antibody,pANCA)、抗中性粒细胞胞质抗体(anti-antineutrophilic cytoplasmic antibody,cANCA)均阴性。肿瘤标记物(-),脑脊液压力200 mmH2O(1 mmH2O=0.098 kPa),脑脊液实验室检查:常规未见异常;生化检查氯略低、蛋白略高,其他实验室检查及培养均阴性。颅脑MRI(图1):(1)脑桥、延髓及双侧小脑半球周围脑膜肥厚、强化,符合肥厚性硬脑膜炎或炎性改变;(2)脑白质脱髓鞘改变。考虑原发病病情反复,给予甲泼尼龙500 mg/d连续3 d后改为泼尼松 50 mg/d口服及环磷酰胺0.2 g 隔日静点,腰椎鞘内注射生理盐水4 ml+甲氨蝶呤5 mg+地塞米松10 mg每周1次,连续鞘内注射治疗4次,患者头痛明显减轻且快速消失,声音嘶哑、吞咽困难逐渐减轻后出院;出院予口服泼尼松30 mg/d、环磷酰胺100 mg/d。出院后一般状态良好,精神状态及饮食良好;出院后4个月内患者无头痛,声嘶、吞咽困难逐渐缓解,较出院时好转,后因患者胃区不适、反酸,自行停用环磷酰胺口服药物,泼尼松口服12.5 mg/d,再次出现头痛、头晕症状,午后明显,夜间休息后可缓解,恶心、呕吐,进食差,无发热,无关节肿痛,2015年8月28日再次于我科住院治疗,入院后给予对症治疗后胃区不适、恶心、呕吐症状消失,仍有头痛,给予行腰椎穿刺术测脑脊液压力为195 mmHg(1 mmHg=0.133 kPa),给予鞘内注射1次[0.9%氯化钠溶液4 ml+甲氨蝶呤5 mg+地塞米松2 ml(10 mg)(总液体6 ml)],停用环磷酰胺换用吗替麦考酚酯治疗,出院时患者头痛明显减轻。病程中无发热,无口干、眼干,无双手雷诺现象,无反复口腔溃疡,无皮疹,无肌肉酸痛等症状。随访至今,患者一般状态良好,无头痛,声音嘶哑消失,无吞咽困难,体重逐渐上升,目前已正常工作。
讨 论
HCP是一种罕见的以硬脑膜弥漫或局部显著增厚为特征的慢性纤维化炎症性疾病。依据病因分为特发性硬脊膜炎和继发性硬脊膜炎。二者均以长期剧烈头痛和脑神经受累为常见表现,如未得到恰当治疗症状可在数月内逐渐加重,神经系统受累范围逐渐扩大严重影响患者生活质量,甚至危及生命。临床表现复杂多样[1],该例HCP以类风湿关节炎起病,类风湿关节炎未规律治疗,后出现声音嘶哑、头痛的临床表现,渐进加重,间歇性头痛,从出现头痛至发现病变位置约半年多时间,以头痛为表现的HCP,易漏诊、误诊,特别是有免疫性疾病的患者,应特别警惕既往无头痛病史的、新发的头痛症状,及时行颅脑MRI、脑脊液等实验室检查,很多研究也发现HCP的脑脊液的压力、生化、常规检查无特异性,但可作为鉴别诊断的依据[2- 3],最重要的手段为MRI检查[4]。HCP临床特点有渐进性加重的间歇性头痛,不伴意识障碍、感觉及运动障碍,在MRI中可提示硬脑膜及小脑幕均增厚并明显强化,其影像学表现有一定特征性,即MRI显示颅底区、天幕及大脑镰多部位硬脑膜受累,呈条带状或斑块状增厚;肥厚的硬脑膜T1WI 呈低、略低信号,T2WI呈明显低信号,增强后可明显强化[5]。同时排除具有相似临床表现和影像学特点的疾病,如低颅压头痛、软脑膜炎、蛛网膜下腔出血、转移瘤等疾病[6- 7]。若经治疗后临床症状加重或影像学检查硬脑膜病变仍明显,此时强烈建议行硬脑膜活检[8]。HCP是一种非特异性硬脑膜慢性进行性炎症反应[9],其病因可分为特发性和继发性两类,继发性原因有感染性、肿瘤性及自身免疫性因素[10]。治疗上目前国内有报道用大剂量糖皮质激素及环磷酰胺以及甲氨蝶呤、硫唑嘌呤等免疫抑制治疗特发性及继发性HCP[11]。本例患者以类风湿关节炎为首发症状,后出现声音嘶哑及头痛等临床表现,该患者无感染性、肿瘤的临床表现及病史,糖皮质激素及免疫抑制剂治疗后头痛临床症状好转,使用大剂量激素及免疫抑制剂治疗后有效,随访至今无复发,有报道其机制可能与血管炎刺激硬脑膜、颅神经引起颅内压力变化、神经缺血等因素有关[12]。根据文献报道引起HCP的自身免疫性疾病中,抗中性粒细胞胞浆抗体相关性血管炎是最常见的病因[13- 14],有文献报道髓过氧化物酶-抗中性粒细胞胞浆抗体在所有肥厚性硬脊膜炎患者中的阳性率为27%[15- 19],也有一些报道指出HCP多伴有免疫学指标异常[20- 22],因此许多学者认为HCP与免疫疾病存在共同的自身免疫发病机制。国外文献报道引起HCP的有类风湿关节炎、干燥综合征、韦格纳肉芽肿等其他免疫系统疾病[23- 26],发病机制考虑继发血管炎可能,而类风湿关节炎继发HCP相关国内报道极少,所以需要更多专家、学者的重视和共识,以积累更多关于诊断及治疗的经验。
综上所述,本例考虑类风湿关节炎继发血管炎。临床工作中对病因不明的临床表现需引起注意,对不典型症状如持续剧烈头痛、声音嘶哑、吞咽困难加等症状予以重视,避免漏诊、误诊。关于治疗:继发性HCP应先寻找病因,针对病因进行治疗[27]。由于HCP的治病原因大多与自身免疫机制有关,应用激素或联合免疫抑制剂能够取得良好的疗效[10],亦有文献报道[28]高剂量糖皮质激素和环磷酰胺治疗后症状仍复发者,可应用利妥昔单抗及其他生物制剂治疗免疫病,疗效确切且可减少激素使用剂量,但用于治疗免疫病继发HCP未见临床报道,需进一步临床工作中不断探索及积累更多经验。该患者鞘内注射后无不良反应发生,疗效尚好,关于疗程等有待于临床上进一步观察。
[1]钱伟东, 陈守康, 屈洪党. 肥厚性硬脑膜炎5例报道及文献复习[J]. 蚌埠医学院学报, 2010, 35: 564- 567.
[2]熊斌, 姚生, 刘建国, 等. 特发性肥厚性硬脑膜炎的临床、病理特点及治疗体会[J]. 中国神经免疫学和神经病学杂志, 2008, 15: 179- 182.
[3]张海玲, 董秦雯, 熊斌, 等. 影像呈结节状占位样的特发性肥厚性硬脑膜炎临床分析[J]. 中华内科杂志, 2014, 53: 127- 130.
[4]齐新, 崔丽英. 特发性肥厚性硬脑膜炎[J]. 中国神经免疫学和神经病学杂志, 2008, 15: 305- 307.
[5]刘新平, 张桂芬. 肥厚性硬脑膜炎16例临床分析[J]. 中风与神经疾病, 2011, 28: 1125- 1126.
[6]Zhang H, Dong Q, Xiong B, et al. A clinical analysis of idiopathic hypertrophic cranial pachymeningitis with a nodular space-occupying effect[J]. Zhonghua Nei Ke Za Zhi, 2014, 53: 127- 130.
[7]Shi CH, Niu ST, Zhang ZQ. Clinical image and pathology of hypertrophic cranial pachymeningitis[J]. Genet Mol Res, 2014, 13: 10501- 10509.
[8]彭伟, 杨志强, 周永涛, 等. 肥厚性硬脑膜炎8例临床分析[J]. 中风与神经疾病, 2014, 31: 47- 49.
[9]韩倩.肥厚性硬脑膜炎的诊疗(综述)[J].中国城乡企业卫生,2011,142:36- 38.
[10] 孙臻, 卢瑞春, 苗丹, 等. 特殊的肥厚性硬脑膜炎2例报告并文献复习[J]. 中国临床神经科学, 2016, 24: 46- 51.
[11] 张春生, 张美云, 毕宏烨, 等. 肥厚性硬脑膜炎一例[J]. 脑与神经疾病杂志, 2015, 23: 88- 94.
[12] Khalil M, Ebner F, Fazekas F, et al. Neurological picture. Idiopathic hypertrophic cranial pachymeningitis: a rare but treatable cause of headache and facial pain[J]. J Neurol Neurosurg Psychiatry, 2013, 84: 354- 355.
[13] Sanchez-Garcia M, Gomez-Delgado F, Gomez-Garduo A, et al. Hypertrophic pachymeningitis associated with cerebral spinal fluid hypovolemia as initial presentation of systemic lupus erythematous[J]. Lupus, 2014, 23: 197- 200.
[14] Yokoseki A, Saji E, Arakawa M, et al. Hypertrophic pachymeningitis: significance of myeloperoxidase anti-neutrophil cytoplasmic antibody[J]. Brain, 2014, 137: 520- 536.
[15] 韩燕飞, 谢琰臣, 王会刚, 等. 经病理确诊的肥厚性硬脑膜炎一例[J]. 中国神经免疫学和神经病学杂志, 2011, 18: 66- 67.
[16] Nakamagoe K1, Hosaka A, Kondo Y, et al. A case of idiopathic hypertrophic cranial pachymeningitis present-ing high values of matrix metalloproteinase[J]. BMJ Case Rep, 2010, pii: bcr06.2009.2016.
[17] Yuh WT, Drew JM, Rizzo M, et al. Evaluation of pachymeningitis by contrast-enhanced MR imaging in a patient with rheumatoid disease[J]. AJNR Am J Neuroradiol, 1990, 11: 1247- 1248.
[18] Martin N, Masson C, Henin D, et al. Hypertrophic cranial pachymeningitis: assessment with CT and MR imaging[J]. AJNR Am J Neuroradiol, 1989, 10: 477- 484.
[19] Sugiyama Y, Shimizu M, Hoshi A, et al. An old man presenting with fluctuating bilateral multiple cranial nerve palsies and positive test for perinuclear antineutrophil cytoplasmic antibody[J]. No To Shinkei, 1999, 51: 825- 832.
[20] Bhatia R, Tripathi M, Srivastava A, et al. Idiopathic hypertrophic cranial pachymeningitis and dural sinus occlusion: two patients with long-term follow up[J]. J Clin Neurosci, 2009, 16: 937- 942.
[21] 张海鸥, 林志坚. 肥厚性硬脑膜炎的临床表现及影像学特征[J]. 中风与神经疾病杂志, 2007, 24: 306- 308.
[22] 刘颖,王玉.病因学上可能为继发性的肥厚性硬脑膜炎临床特点分析[J].中风与神经疾病杂志,2007,27: 637- 640.
[23] Kanemoto M, Ota Y, Karahashi T, et al. A case of idiopathic hypertrophic cranial pachymeningitis manifested only by positive rheumatoid factor and abnormal findings of the anterior falx[J]. Rheumatol Int, 2005, 25: 230- 233.
[24] Higgins WL, Marano GD. Gallium imaging of rheuma-toid pachymeningitis[J]. Clin Nucl Med, 1986, 11: 350- 351.
[25] Otsuka M, Fujiwara T, Kuwata Y, et al. A case of rheumatoid pachymeningitis[J]. Rinsho Shinkeigaku, 1997, 37: 834- 840.
[26] Li JY, Lai PH, Lam HC, et al. Hypertrophic cranial pachymeningitis and lymphocytic hypophysitis in Sjögren’s syndrome[J]. Neurology, 1999, 52: 420- 423.
[27] Yao Y, Wang Z, Yang W, et al. Hypertrophic Cranial Pachymeningitis Caused by Pseudomonas stutzeri Associated With Connective Tissue Disease[J]. Ann Pharmacother, 2015, 49: 745- 746.
[28] Kasaj A, Willershausen B, Zafiropoulos GG. Flexible gingival epithesis: treatment of recession defects[J]. Dent Today, 2010, 29: 108, 110- 111.