外周血中辅助性T细胞17及相关因子在胃癌患者中的变化及意义
刘爱民
·论著·
外周血中辅助性T细胞17及相关因子在胃癌患者中的变化及意义
刘爱民
目的 观察外周血中辅助性T细胞17(Th17)及相关因子在胃癌患者中的变化及意义。方法 选择2015年3月至2016年8月胃癌患者42例(观察组),其中早期胃癌(Ⅰ、Ⅱ期)22例,晚期胃癌(Ⅲ、Ⅳ期)20例,并设同期健康体检者42例(对照组),应用细胞流式细胞术测定2组血浆Th17细胞,应用酶联免疫吸附试验(ELISA)检测血浆Th17细胞相关因子白细胞介素-1β(IL-1β)、IL-6、IL-23及IL-17情况,进行组间及观察组早期胃癌(22例)、晚期胃癌(20例)及黏液癌(12例)、腺癌(24例)、未分化癌(6例)比较。结果 2组IL-1β、IL-6、IL-23、IL-17水平及Th17细胞表达比较,观察组高于对照组,差异有统计学意义(P<0.05);早期胃癌患者与晚期胃癌患者IL-1β水平比较差异无统计学意义(P>0.05),IL-6、IL-23、IL-17水平及Th17细胞表达比较差异有统计学意义(P<0.05),晚期胃癌患者高于早期胃癌患者。观察组黏液癌、腺癌、未分化癌IL-1β、IL-6、IL-23、IL-17及Th17细胞表达情况比较差异均无统计学意义(P>0.05)。结论Th17及相关因子与胃癌有密切相关性,其检测结果有助于临床做出准确判断。
外周血中辅助性T细胞17;IL-6;IL-23;IL-17;胃癌;临床应用
胃癌(gastriccancer)是我国最常见的恶性肿瘤之一,其发病率目前位于第2位,死亡率位于第3位[1,2],发病率约占全球46.8%[3],也是我国消化道恶性肿瘤死亡率的首位疾病,全国每年平均死亡率约为16/10万[4]。胃癌作为全球高发肿瘤,发病率及病死率有逐年上升的趋势,其发生、发展的机制较为复杂,过程中涉及到多个靶点、多个环节的综合作用结果[5]。由于胃癌发病的隐匿性和高度转移性,大多数患者就诊时已发展为中晚期[6]。因此,胃癌早期诊断至关重要。本研究为了确定外周血中辅助性T细胞17(Th17)及其相关因子在胃癌发病及不同分期是否有相关性,为临床治疗胃癌提供免疫学依据。
1 资料与方法
1.1 一般资料 选择本院肿瘤科2015年3月至2016年8月胃癌患者42例(观察组),男20例,女22例;年龄33~66岁,平均年龄(51.23±10.27)岁;临床分期[7]:早期胃癌(Ⅰ、Ⅱ期)22例,晚期胃癌(Ⅲ、Ⅳ期)20例;黏液癌(印戎细胞癌)12例,腺癌24例,未分化癌6例。排除患有严重肾脏、肝脏、心血管、代谢、消化、泌尿、神经或精神系统、自身免疫系统疾病者;经研究者判断不能进入临床试验者;依从性差的患者。并设同期本院体检中心健康体检者42例(对照组),男19例,女23例;年龄32~65岁,平均年龄(50.87±10.13)岁。2组性别比、年龄比较差异无统计学意义(P>0.05)。
1.2 观察指标及方法
1.2.1 仪器与试剂:CD3PE-Cy5抗体、CD4FITCPE抗体、CD8AFITC抗体、CD25APC抗体、人Treg染色体试剂盒、Foxp3抗体及同型对照IgG2,均购自美国eBioscience公司;佛波酯、离子霉素、布雷菲德菌素A、FIX&PERM试剂盒均购自美国ENZO公司;淋巴细胞分离液(Ficoll-Hypaque)、流式细胞仪分析仪为美国BD公司产品;固定破膜剂购自美国Invitrogen公司;酶联免疫吸附试验(ELISA)试剂盒为北京嘉美诺斯生物科技有限公司,酶标仪应用TECANferrdouEvolyzer(瑞士)全自动免疫工作站。
1.2.2 观察方法:采集观察组(均为手术治疗前者)和对照组清晨空腹状态下采集外周静脉血4ml,分为2份,每份2ml,分别加入肝素钠抗凝管中,其中一份以2 500r/min离心7min,冻存在-80℃低温冰箱中备检测。应用ELISA检测血浆Th17细胞相关因子白细胞介素-1β(IL-1β)、IL-6、IL-23及IL-17情况。Th17细胞流式细胞术测定:将另外一份2ml静脉血肝素抗凝分离出单核细胞溶液加入布雷菲得菌素A、离子霉素、佛波酯工作液中,然后将试管放入细胞培养箱中,37℃条件下培养5h,留上层血浆,培养后的培养液分2份,均为100μl,分别置于2个流式管中,即Th17细胞管和同型对照管,并做好标记。在Th17细胞管和同型对照管中均加入推荐量CD3及CD8抗体,室温避光15min后再采用流式细胞仪进行检测。

2 结果
2.1 2组IL-1β、IL-6、IL-23、IL-17及Th17细胞表达情况比较 2组IL-1β、IL-6、IL-23、IL-17水平及Th17细胞表达比较差异有统计学意义(P<0.05),观察组高于对照组。见表1。
表1 2组IL-1β、IL-6、IL-23、IL-17及Th17细胞表达情况比较


组别IL⁃1β(ng/L)IL⁃6(ng/L)IL⁃23(ng/L)IL⁃17(ng/L)Th17细胞表达(%)观察组65.9±7.0∗188.7±18.7∗235.1±17.6∗87.1±13.4∗3.49±0.41∗对照组31.4±6.341.9±10.789.7±8.831.9±8.52.19±0.40
注:与对照组比较,*P<0.05
2.2 观察组早期胃癌(Ⅰ、Ⅱ期)、晚期胃癌(Ⅲ、Ⅳ期)IL-1β、IL-6、IL-23、IL-17及Th17细胞表达情况比较 早期胃癌患者与晚期胃癌患者IL-1β水平比较差异无统计学意义(P>0.05),IL-6、IL-23IL-17水平及Th17细胞表达比较差异有统计学意义(P<0.05),晚期胃癌患者高于早期胃癌患者。见表2。
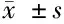

分期IL⁃1β(ng/L)IL⁃6(ng/L)IL⁃23(ng/L)IL⁃17(ng/L)Th17细胞表达(%)早期胃癌(n=22)57.1±5.5134.8±17.9∗178.7±9.8∗58.4±6.9∗3.29±0.47∗晚期胃癌(n=20)77.9±6.6253.7±15.7286.5±13.8105.7±8.76.41±0.45
注:与对照组比较,*P<0.05
2.3 观察组黏液癌、腺癌、未分化癌IL-1β、IL-6、IL-23、IL-17及Th17细胞表达比较 观察组黏液癌、腺癌、未分化癌IL-1β、IL-6、IL-23、IL-17及Th17细胞表达情况比较差异均无统计学意义(P>0.05)。见表3。
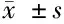

类别IL⁃1β(ng/L)IL⁃6(ng/L)IL⁃23(ng/L)IL⁃17(ng/L)Th17细胞表达(%)黏液癌(n=12)68.1±7.6188.7±16.7211.1±11.278.2±7.43.35±0.42腺癌(n=24)70.2±6.8203.4±17.6220.4±12.481.3±9.23.43±0.39未分化癌(n=6)67.7±7.1187.3±16.8208.4±13.077.7±10.33.39±0.43
3 讨论

IL-6可促进多种细胞的增殖和分化细胞因子,陈金华等[19]观察了IL-6在胃癌发生中的作用,结果表明胃癌组织分化程度、淋巴结转移情况及浸润深度与IL-6关系密切,有协同趋势。IL-6是一种自分泌生长因子,与自身靶细胞IL-6R结合,并激活JAK/STAT信号传导通路。活化Stat3,使Survivin表达上调,靶细胞生长甚至过度增殖,凋亡被抑制,从而促进肿瘤形成。
观察结果表明,Th17细胞在胃癌患者外周血中存在高表达,晚期胃癌患者Th17细胞表达高于早期胃癌患者,均高于健康人群;晚期胃癌患者IL-17水平高于早期胃癌患者,证明了Th17细胞分泌IL-17的主要特征;胃癌患者中黏液癌、腺癌、未分化癌IL-17及Th17细胞表达情况比较差异均无统计学意义(P>0.05)。作为协同诱导Th17细胞的细胞因子IL-1β、IL-6、IL-23,2组IL-1β、IL-6及IL-23比较差异有统计学意义(P<0.05),观察组高于对照组;早期胃癌患者与晚期胃癌患者IL-1β水平比较差异无统计学意义(P>0.05),IL-6、IL-23比较差异有统计学意义(P<0.05),晚期胃癌患者高于早期胃癌患者。胃癌患者中黏液癌、腺癌、未分化癌IL-1β、IL-6、IL-23、IL-17及Th17细胞表达情况比较差异均无统计学意义(P>0.05)。说明Th17及相关因子与胃癌有密切相关性,其检测结果有助于临床做出准确判断,为胃癌免疫治疗提供了实验室依据。
1 陈万青,张思维,郑荣寿,等.中国2009年恶性肿瘤发病和死亡分析.中国肿瘤,2013,:2-12.
2 陈灏珠主编.实用内科学.第12版.北京:人民卫生出版社,2005.109.
3FerlayJ,ShinHR,BrayF,etal.Estimatesofworldwideburdenofcancerin2008:Globocan2008.IntJCancer,2010,127:2893-2917.
4 沙杰,李学良.早期胃癌内镜诊断进.国际消化病杂志,2011,31:209-212.
5ParkSS,RyuJS,MinBW,etal.Impactofskipmetastasisingastriccancer.ANZJSurg,2005,75:645-649.
6MaeharaY,HasudaS,KogaT,etal.Postoperativeoutcomeandsitesofrecurrenceinpatientsfollowingcurativeresectionofgastriccancer.BrJSurg,2000,87:353-357.
7EdgeSB,ByrdDR,ComptonCC,etal.AJCCcancerstagingmanual.7thed.NewYork:Springer-Verlag,2010:117-126.

9McGeachyMJ,CuaDJ.Th17celldifferentiation:thelongandwindingroad.Immunity,2008,28:445-453.
10DuanMC,HanW,JinPW,etal.DisturbedTh17/TregBalanceinPatientswithNon-smallCellLungCancer.Inflammation,2015,38:2156-2165.
11 庄园,邹全明.Th17:新兴的辅助T细胞.细胞与分子免疫学杂志,2008,24:935-937.
12ZouW,RestifoNP.T(H)17cellsintumourimmunityandimmunotherapy.NatRevImmunol,2010,10:248-256.
13LiuT,PengL,YuP,etal.IncreasedcirculatingTh22andTh17cellsareassociatedwithtumorprogressionandpatientsurvivalinhumangastriccancer.JClinImmunol,2012,32:1332-1339.
14LenoirM,DelCarmenS,Cortes-PerezNG.LactobacilluscaseiBL23regulatesTregandTh17T-cellpopulationsandreducesDMH-associatedcolorectalcancer.JGastroenterol,2016,51:862-873.
15YangG,LiH,YaoY,etal.Treg/Th17imbalanceinmalignantpleuraleffusionpartiallypredictspoorprognosis.OncolRep,2015,33:478-484.
16LenoirM,DelCarmenS,Cortes-PerezNG.LactobacilluscaseiBL23regulatesTregandTh17T-cellpopulationsandreducesDMH-associatedcolorectalcancer.JGastroenterol,2016,51:862-873.
17DeMarzoAM,NakaiY,NelsonWG.Inflammation,atrophy,andprostatecarcinogenesis.UrolOncol,2007,25:398-400.
18TosoliniM,KirilovskyA,mlecnikB,etal.ClinicalimpactofdifferentclassesofinfiltratingTcytotoxicandhelpercells(Th1,th2,treg,th17)inpatientswithcolorectalcancer.CancerRes,2011,71:1263-1271.
19 陈金华,廖浩,王小莉,等.IL-6及IL-6R和Survivin在胃癌组织中的表达及意义.现代医药卫生,2008,24:3173-3174.
10.3969/j.issn.1002-7386.2017.07.031
056001 河北省邯郸市中心医院门诊部
R
A
1002-7386(2017)07-1064-03
2016-09-10)

