赤芍醇提物对血管内皮细胞一氧化氮合成和分泌的影响*
史海霞, 杨嘉君, 聂绪强,薛永亮,卞 卡
1)上海交通大学附属第九人民医院北院中医科 上海 201900 2)上海中医药大学穆拉德中药现代化研究中心 上海 201023 3)上海交通大学附属第六人民医院神经内科 上海 200233 4)遵义医学院药学院 贵州遵义 563000 5)河南大学第一附属医院心血管内科 河南开封 475001 6)乔治·华盛顿大学生物化学与分子生物学系 美国 华盛顿 20037
赤芍醇提物对血管内皮细胞一氧化氮合成和分泌的影响*
史海霞1,2)#, 杨嘉君3)#, 聂绪强2,4),薛永亮2,5),卞 卡2,6)
1)上海交通大学附属第九人民医院北院中医科 上海 201900 2)上海中医药大学穆拉德中药现代化研究中心 上海 201023 3)上海交通大学附属第六人民医院神经内科 上海 200233 4)遵义医学院药学院 贵州遵义 563000 5)河南大学第一附属医院心血管内科 河南开封 475001 6)乔治·华盛顿大学生物化学与分子生物学系 美国 华盛顿 20037
#通信作者:史海霞, 女,1973年1月生,博士,主治医师,研究方向:心脑血管疾病的中医药防治,E-mail:haixia.0101@163.com;杨嘉君,女,1968年7月生,博士,主任医师,研究方向:中西医结合心脑血管疾病的治疗,E-mail:yangjiajunfzy@sina.com
赤芍;蛋白激酶B;内皮型一氧化氮合酶;一氧化氮;人脐静脉内皮细胞
目的:观察赤芍95%乙醇提取物(PVL)对人脐静脉内皮细胞(HUVECs)中一氧化氮(NO)合成和分泌的影响。方法:分别用0.025、0.050、0.100 g/L PVL孵育HUVECs,利用荧光染料DAF-FM DA及硝酸还原酶法检测细胞内、外NO含量,同时设空白对照组和乙酰胆碱阳性对照组。用0.100 g/L的PVL孵育HUVECs 0、2、5、10、15、30、60、120 min,采用Western blot检测细胞中Akt、eNOS总蛋白及Akt Ser473、eNOS Ser1177和eNOS Thr495磷酸化蛋白表达水平。结果:PVL可剂量依赖性地提高HUVECs细胞内、外NO含量(P<0.05)。0.100 g/L的PVL作用120 min内,eNOS Ser1177、Akt Ser473的磷酸化及eNOS Thr495的脱磷酸化水平均随时间改变有不同程度的变化(P<0.05)。结论:PVL可能通过激活Akt-eNOS-NO信号通路而增强内皮细胞NO的合成和分泌,从而发挥其内皮依赖性舒张血管的作用。
赤芍为毛茛科植物芍药(PaeonialactifloraPall.)或川赤芍(PaeoniaveitchiiLynch)的干燥根。赤芍属于传统活血化瘀药,味苦,性微寒,归肝经,具有清热凉血,散瘀止痛的功效。现代药理研究表明其具有抗凝、抗血栓[1]、抗血小板聚集[2]、抑制平滑肌细胞增生[3]、预防血管重塑[4]、保护血管内膜功能[5]等作用。前期的研究结果[6]表明,赤芍的乙醇提取物具有内皮依赖性舒张血管功能,其作用机制与一氧化氮(nitric oxide, NO)有关。该研究在前期研究基础上,观察了赤芍95%乙醇提取物(简称PVL)对人脐静脉内皮细胞(human umbilical vein endothelium cells, HUVECs)NO、蛋白激酶B(protein kinase B, PKB或Akt)、内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)表达的影响,探讨其内皮依赖性舒张血管作用的机制。
1 材料与方法
1.1 主要仪器及试剂 HEPA CLASS 100型CO2细胞培养箱和全波长多功能微孔板读数仪(美国Thermo公司),倒置相差显微镜(日本奥林巴斯公司),SpectraMax 190酶标仪(美国Molecular Devices公司),Centrifuge 5810R低温高速离心机(德国Eppendorf公司),蛋白质电泳及转印系统(美国Biorad公司)。PVL由上海中医药大学穆拉德中药现代化研究中心提供。A013型硝酸还原酶法NO检测试剂盒(南京建成生物工程研究所),鼠抗eNOS单克隆抗体、抗磷酸化eNOS(p-eNOS) Ser1177单克隆抗体(美国BD公司),兔抗p-eNOS Thr495、Akt、磷酸化Akt(p-Akt)Ser473单克隆抗体(美国CST公司)。
1.2 细胞来源 HUVECs(CRL-1730,美国ATCC公司) 用含体积分数10% 新生牛血清的DMEM培养基于37 ℃、体积分数5% CO2培养箱内培养,3 d传代1次,取4~8代细胞用于实验。
1.3 PVL对HUVECs培养上清液中NO含量的影响 将HUVECs接种于96孔板,实验分5组(乙酰胆碱组,空白对照组及PVL低、中、高剂量组),每组6个复孔,实验重复3次。每孔加入左旋-精氨酸(L-Arg)预孵育30 min后,PVL低、中、高剂量组分别加入0.025、0.050、0.100 g/L的PVL 37 ℃孵育24 h,乙酰胆碱组加入1×10-5mol/L的乙酰胆碱;收集上清液,采用NO检测试剂盒检测NO含量。
1.4 PVL对HUVECs胞内NO含量的影响 HUVECs 以50 000个/孔接种于96孔板,加入L-Arg和荧光染料DAF-FM DA预孵育30 min后,洗去细胞外残余染料,按1.3实验分组,加入相应试剂37 ℃避光孵育20 min后,用荧光酶标仪测定荧光值,用以表示NO含量,激发波长为495 nm,发射波长为515 nm。
1.5 PVL对HUVECs中p-eNOS Ser1177、p-eNOS Thr495和p-Akt Ser473蛋白表达的影响 HUVECs按1×106个/皿接种于直径10 cm的培养皿,37 ℃培养,更换无血清DMEM培养基过夜;更换含PVL(0.100 g/L)的无血清DMEM培养基,37 ℃孵育0、2、5、10、15、30、60、120 min。离心提取蛋白,用BCA试剂盒进行蛋白质浓度测定,蛋白质样品分装冻存于-80 ℃冰箱。采用SDS-PAGE分离蛋白,每孔上样量20~30 μL,经120 g/L SDS-PAGE凝胶电泳,将所需条带转运至PVDF膜上,50 g/L脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,1×TBST洗膜3次,二抗室温孵育2 h,1×TBST洗膜3次,随后化学发光法显色,经暗室曝光,胶片经扫描仪扫描后用凝胶分析软件Quantity One分析,计算各条带OD值。以0 min的数据为1,标化其他时间点数据。磷酸化蛋白的表达水平以磷酸化蛋白OD/总蛋白OD表示。实验重复3次。抗体名称及稀释度见表1。
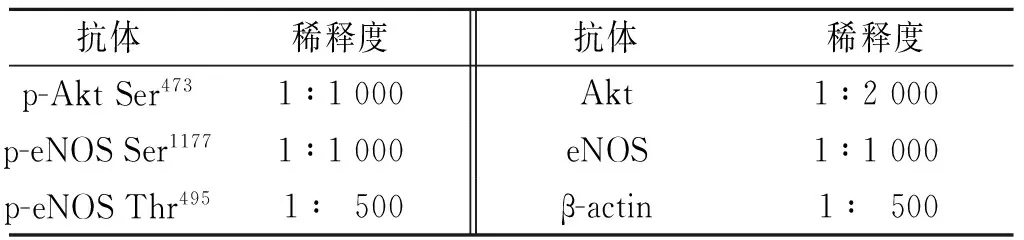
表1 抗体及稀释度
1.6 统计学处理 数据采用Graphpad Prism 6.0软件分析。组间各指标的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 PVL对HUVECs细胞内、外NO含量的影响
不同浓度PVL培养后HUVECs细胞内、外NO含量测定结果见表2,从表2可以看出,PVL可以使HUVECs细胞内、外NO含量上升,其作用呈剂量依赖性。

表2 不同质量浓度PVL作用后HUVECs细胞内、外NO的含量
*:与空白对照组比较,P<0.05;#:与PVL低剂量组比较,P<0.05;△:与PVL中剂量组比较,P<0.05。
2.2 PVL对HUVECs中eNOS及Akt磷酸化的影响 Western blot检测结果见图1、表3。结果显示,PVL处理HUVECs 120 min对eNOS总蛋白和Akt无影响;但是可以促进eNOS Ser1177和Akt Ser473的磷酸化,10 min后达峰值,之后两者磷酸化水平逐渐降低;而15 min 后eNOS Thr495磷酸化水平显著降低,随后缓慢恢复。
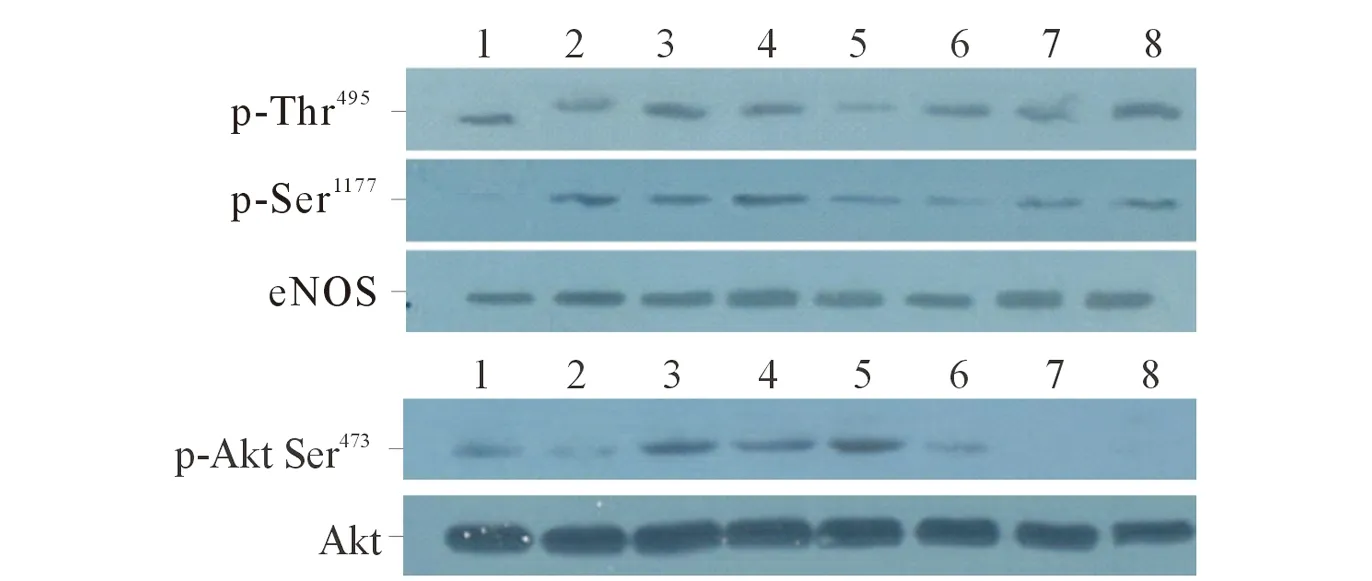
1~8:分别为0、2、5、10、15、30、60、120 min。图1 PVL作用后HUVECs中eNOS和Akt磷酸化蛋白的表达

表3 PVL作用不同时间后HUVECs中eNOS、Akt磷酸化蛋白的表达水平
*:与其他时间点比较,P<0.05。
3 讨论
内皮源性NO是一种重要的内皮功能调节因子,在血管内环境稳态的调节中发挥重要作用,其调节作用主要是通过调节血管张力和血压、抑制血管平滑肌细胞增殖和迁移、抑制血小板聚集、抑制单核细胞和血小板的黏附等来实现的[7]。eNOS存在于内皮细胞、心肌细胞、血小板以及肥大细胞、肾上皮细胞等实质细胞中,是体内NO合成的关键酶[8]。eNOS是由两个相同的亚基组成的同源二聚体酶,二聚体化是其完全活化的前提[9-10]。eNOS在内皮细胞中呈构成性表达,因此,对eNOS活性调控的研究多集中于翻译后蛋白水平的调控,也就是翻译后修饰,包括酰化、钙/钙调素结合、S-亚硝基化和磷酸化等,其中由蛋白激酶和磷蛋白磷酸酶介导的磷酸化和去磷酸化网络是主要的翻译后修饰[11-12]。目前研究[13-14]表明,eNOS的磷酸化可以发生于丝氨酸、苏氨酸和酪氨酸位点,Ser1177、Ser635、Ser617和Tyr83磷酸化可上调eNOS活性, Ser116、Thr495和Tyr653磷酸化则下调eNOS活性。最经典的功能性磷酸化序列是位于还原酶区的丝氨酸位点(人的eNOS Ser1177)和位于钙调素结合区的苏氨酸位点(人的eNOS Thr495)[11]。许多激酶可以介导eNOS Ser1177的磷酸化从而激活eNOS,如PKB/Akt、蛋白激酶A、AMP激活的蛋白激酶、蛋白激酶G和钙/钙调素依赖的蛋白激酶-2等[15-18],其中以PI3K/Akt通路最为关键[19-21]。
赤芍出自《开宝本草》,属于传统活血化瘀药,其乙醇提取物具有内皮依赖性舒张血管的功能[6]。该实验观察了PVL对HUVECs细胞内、外NO含量的影响。NO是一种活性很强的自由基小分子,化学性质活泼,半衰期仅3~5 s,在体内很快代谢为NO2ˉ和NO3ˉ,该实验所采用的NO检测试剂盒就是通过测定其代谢生成的亚硝酸盐及硝酸盐含量来间接检测NO水平,这也是目前普遍采用的NO检测方法,其原理是基于化学显色反应:利用硝酸还原酶特异性将NO3ˉ还原为NO2ˉ,NO2ˉ遇硝酸盐显色剂可生成淡红色偶氮化合物,通过比色可间接测得NO浓度。由于采用比色法检测,考虑到PVL的颜色有可能会对实验数据产生干扰,故在实验中设置了不加细胞的阴性对照,将实测数据减去阴性对照数据作为最终测定结果,以排除PVL的颜色干扰。结果显示,在0.025~0.100 g/L的浓度范围内,PVL能剂量依赖性地促进HUVECs合成和分泌NO。进一步实验结果表明,PVL处理120 min内对HUVECs中eNOS总蛋白表达无影响,但是可以促进eNOS Ser1177的磷酸化,磷酸化水平在作用10 min后达峰值,其后逐渐恢复;而eNOS Thr495发生脱磷酸化,磷酸化水平在作用15 min后达最低,其后缓慢恢复。与此同时,作者还观察到,PVL还可以上调Akt磷酸化蛋白的表达,Akt磷酸化水平在作用10 min后达峰值,其后逐渐降低,时间曲线与eNOS Ser1177相似,提示Akt信号通路参与了PVL对eNOS Ser1177磷酸化的诱导,PVL内皮依赖性舒张血管作用的机制与eNOS Ser1177磷酸化介导的eNOS活性上调、NO生成增加有关。
综上所述,该研究证实PVL内皮依赖性舒张血管的作用机制至少部分是通过Akt-eNOS-NO信号通路实现的,这为临床广泛应用赤芍改善心脑血管疾病相关症状提供了理论支持,至于是单体成分的作用或是几种成分的协同作用尚有待进一步深入研究。
[1]章丽,赵冰洁,袁嘉瑞,等.牡丹皮、赤芍与白芍对急性血瘀模型大鼠活血功效的比较研究[J].中草药,2016,47(15):2676
[2]王潇毅,田晓轩,张砚,等.基于活性筛选和靶标网络预测的蒲黄和赤芍选择性抑制血小板聚集作用[J].中国实验方剂学杂志,2017,23(1):120
[3]朱慧民,金国健,林福禧.赤芍对家兔血管内膜平滑肌细胞增生的影响[J].中国中医急症,2005,14(4):349
[4]朱慧民,樊锦秀,石涵,等.赤芍提取物对高脂家兔颈动脉实验性血管重塑的干预作用[J].中国中医药科技,2008,15(5):341
[5]朱慧民,樊锦秀,石涵,等.赤芍药提取物对兔颈动脉介入术后增殖内膜相关基因表达的影响[J].中华中医药杂志,2008,23(11):1023
[6]史海霞,侯辉丽,聂绪强,等.赤芍乙醇提取物对大鼠胸主动脉张力的影响及机制研究[J].中医学报,2013,28(6):850
[7]MONCADA S,HIGGS EA.The discovery of nitric oxide and its role in vascular biology[J].Br J Pharmacol,2006,147(Suppl 1):S193
[8]SESSA C,HARRISON K,BARBER M,et al.Molecular cloning and expression of a cDNA encoding endothelial cell nitric oxide synthase[J].J Biol Chem,1992,267(22):15274
[9]FÖRSTERMANN U,BOISSEL P,KLEINERT H.Expressional control of the ′constitutive′ isoforms of nitric oxide synthase(NOS Ⅰ and NOS Ⅲ)[J].FASEB J,1998,12(10):773
[10]BALLIGAND JL,FERON O,DESSY C.eNOS activation by physical forces: from short-term regulation of contraction to chronic remodeling of cardiovascular tissues[J].Physiol Rev,2009,89(2):481
[11]FLEMING I.Molecular mechanisms underlying the activation of eNOS[J].Pflugers Arch,2010,459(6):793
[12]DUDZINSKI M,MICHEL T.Life history of eNOS: partners and pathways[J].Cardiovasc Res,2007,75(2):247
[13]MICHEL T,VANHOUTTE PM.Cellular signaling and NO production[J].Pflugers Arch,2010,459(6):807
[14]FLEMING I,FISSLTHALER B,DIMMELER S,et al.Phosphorylation of Thr(495) regulates Ca(2+)/calmodulin-dependent endothelial nitric oxide synthase activity[J].Circ Res,2001,88(11):E68
[15]DIMMELER S,FLEMING I,FISSLTHALER B,et al.Activation of nitric oxide synthase in endothelial cells by Akt-dependent phosphorylation[J].Nature,1999,399(6736):601
[16]FULTON D,GRATTON P,MCCABE J,et al.Regulation of endothelium-derived nitric oxide production by the protein kinase Akt[J].Nature,1999,399(6736):597
[17]MICHELL J,TIGANIS T,STAPLETON D,et al.Coordinated control of endothelial nitric-oxide synthase phosphorylation by protein kinase C and the cAMP-dependent protein kinase[J].J Biol Chem,2001,276(21):17625
[18]THOMAS R,CHEN K,KEANEY F.Hydrogen peroxide activates endothelial nitric-oxide synthase through coordinated phosphorylation and dephosphorylation via a phosphoinositide 3-kinase-dependent signaling pathway[J].J Biol Chem,2002,277(8):6017
[19]DU XL,EDELSTEIN D,DIMMELER S,et al.Hyperglycemia inhibits endothelial nitric oxide synthase activity by posttranslational modification at the Akt site[J].J Clin Invest,2001,108(9):1341
[20]XU B,CHIBBER R,RUGGIERO D,et al.Impairment of vascular endothelial nitric oxide synthase activity by advanced glycation end products[J].FASEB J,2003,17(10):1289
[21]FEDERICI M,MENGHINI R,MAURIELLO A,et al.Insulin-dependent activation of endothelial nitric oxide synthase is impaired by O-linked glycosylation modification of signaling proteins in human coronary endothelial cells[J].Circulation,2002,106(4):466
(2016-12-26收稿 责任编辑王 曼)
Effect of ethanol extract ofPaeoniaveitchiiLynch on production and secretion of nitric oxide in HUVECs
SHIHaixia1,2),YANGJiajun3),NIEXuqiang2,4),XUEYongliang2,5),BIANKa2,6)
1)DepartmentofTraditionalChineseMedicine,NO.9People'sHospital,ShanghaiJiaotongUniversity,Shanghai201900 2)MuradResearchCenterforModernizedChineseMedicine,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201023 3)DepartmentofNeurology,NO.6People'sHospital,ShanghaiJiaotongUniversity,Shanghai200233 4)SchoolofPharmacy,ZunyiMedicalUniversity,Zunyi,Guizhou563000 5)DepartmentofCardiovascular,theFirstAffiliatedHospital,HenanUniversity,Kaifeng,Henan475001 5)DepartmentofBiochemistryandMolecularBiology,GeorgeWashingtonUniversity,WashingtonDC,USA20037
PaeoniaveitchiiLynch;protein kinase B;endothelial nitric oxide synthase;nitric oxide;human umbilical venus endothelial cell
Aim: To investigate the effect of 95% ethanol extract ofPaeoniaveitchiiLynch(PVL) on production and secretion of nitric oxide(NO) in cultured human umbilical vein endothelium cells(HUVECs). Methods: The HUVECs were incubated in different concentration(0.025, 0.050, 0.100 g/L) PVLinvitro, respectively. The content of NO inside and outside HUVECs were measured by DAF-FM DA and Griess reaction. The expression levels of Akt, eNOS, p-Akt Ser473, p-eNOS Ser1177and p-eNOS Thr495in HUVECs cultured with 0.100 g/L PVL for 0,2,5,10,15,30,60,120 min were assessed by Western blot. Results: PVL increased the extracellular and intracellular NO production in a dose-dependent manner in cultured HUVECs(P<0.05). PVL also changed the phosphorylation of Akt Ser473, eNOS Ser1177and dephosphorylation of eNOS Thr495in HUVECs at different time points(P<0.05). Conclusion: PVL could increase the NO production in HUVECs, thus play a role of endothelium dependent vasodilation, and the mechanism may be related to the activation of Akt-eNOS-NO signal transduction pathway.
10.13705/j.issn.1671-6825.2017.02.013
*上海市科委生物医药重点项目子课题 14401970303;上海交通大学医学院附属第三人民医院科研项目 syz2011-02;上海交通大学附属第六人民医院预研基金 LYZY-0175
R972

