重组开菲尔菌粒发酵性能及菌相组成研究
高洁,孙静,黄建,何国庆,龚凌霄,霍军生*
(1.中国疾病预防控制中心营养与健康所,北京100050;2.浙江大学生物系统工程与食品科学学院,浙江杭州310058;3.北京工商大学食品学院,北京100048)
重组开菲尔菌粒发酵性能及菌相组成研究
高洁1,孙静1,黄建1,何国庆2,龚凌霄3,霍军生1*
(1.中国疾病预防控制中心营养与健康所,北京100050;2.浙江大学生物系统工程与食品科学学院,浙江杭州310058;3.北京工商大学食品学院,北京100048)
为了简化开菲尔混菌发酵体系的菌种复杂程度,并保留开菲尔特有的发酵风味,对来源于拉萨、成都、乌鲁木齐、西宁4个地区的开菲尔菌粒进行了重组培养,得到重组菌粒TK-ZJUJ06。高通量测序分析检测到其细菌菌相组成为8个属,分别为乳杆菌属(39.46%)、明串珠菌属(0.62%)、乳球菌属(43.28%)、链球菌属(0.54%)、醋酸菌属(11.53%)、希瓦氏菌属(0.67%)、不动杆菌属(0.05%)以及假单胞菌属(0.14%);生理生化培养方法及26S rDNA序列分析测得其酵母菌相为酿酒酵母(Saccharomyces cerevisiae)。发酵性能及挥发性成分分析结果表明,该重组菌粒发酵性能优良,酸度117°T,挥发性脂肪酸含量65%。与对照相比,菌相组成简单,并能够保留开菲尔特有的发酵风味。
开菲尔;重组菌粒;微生物组成;发酵性能;挥发性成分
开菲尔(kefir)是高加索山脉及我国西藏、新疆等地传统的发酵乳制品,是由天然形成的开菲尔菌粒对牛、羊乳等发酵而成。开菲尔菌粒为乳白色,有弹性的胶装颗粒,该颗粒由多种乳酸菌、醋酸菌、酵母菌等混菌附着在其分泌的胞外多糖等代谢产物上而形成[1]。在自然环境下,开菲尔菌粒的形成条件十分特殊,据传最初是在牧民的马奶酒囊中发现。目前已有研究对其形成机制进行了探索和推断,微生物产生的胞外多糖被认为是最初的“粘合剂”[2],使不同的菌相得以互相附着,它们又分泌各自的代谢产物,如蛋白质、脂肪等物质,构成颗粒的基质成分[3],菌体与代谢产物不断堆积,逐渐形成相对独立的微生态系统[4]。发酵过程同时具有乳酸发酵[5]、醋酸发酵和酵母菌进行的酒精发酵[6],不仅形成了独特的风味,更具有对健康有益的特性。然而,由于天然混菌体系的复杂性,人们在用各种手段进行菌相分析时,也发现了一些风险菌甚至未知菌,如假单胞菌属,希瓦氏菌属等[1]。它们在发酵体系中的作用尚不明确,又难以从体系中去除,导致无法控制其发酵过程,也就无法进行工业化生产,极大阻碍了开菲尔饮品的发展。
在现代的医药化工领域,发酵过程一般采用纯种发酵[7],而传统发酵食品,纯种发酵难以达到生产需求[8],其复杂的成分和特有的风味往往是多个菌相共同发酵的产物[9]。开菲尔菌粒形成环境特殊,人工纯菌复配形成的混菌体系很难形成相似的颗粒。本研究将不同地区来源的开菲尔菌粒进行混合重组,通过酸度及凝乳测定观察发酵性能和菌粒形成情况,采用高通量测序及传统分离纯化培养相结合的方法观察菌相变化,以评价重组开菲尔菌粒的特性,为其菌相的简化提供理论基础。
1 材料与方法
1.1 材料与试剂
开菲尔菌粒(TK-ZJUJ01、TK-ZJUJ02、TK-ZJUJ03、TK-ZJUJ01-04):分别来源于拉萨、成都、乌鲁木齐、西宁。
酿酒酵母(Saccharomyces cerevisiae)DG115 CGMCC NO.3262:中国普通微生物菌种保藏管理中心。
脱脂乳培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、生理生化试验培养管:杭州微生物试剂有限公司。
核糖核酸酶(ribonuclease,RNase)A、苯酚、氯仿、异丙醇(均为分析纯):国药集团化学试剂有限公司;Taq酶、脱氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphate,dNTP)、脱氧核糖核酸(deoxyribonucleicacid,DNA)Marker、MgCl2、聚合酶链反应(polymerase chain reaction,PCR)Buffer、溶菌酶、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、琼脂糖:美国Sigma试剂公司。
1.2 仪器与设备
Kjeltec 2300型全自动凯氏定氮仪:丹麦FOSS公司;6890-5973型色谱质谱联用仪:美国惠普公司;菲罗门ZB-5 MS色谱柱(25 mm×30 m×0.5 μm):美国Phenomenex公司;Nanodrop-1000微量紫外分光光度计:美国赛默飞(THERMO)公司;Illumina HiSeq 2000 DNA测序仪:美国Illumina公司;ALS-1296 PCR仪:伯乐(BioRad)生命医学产品有限公司。1.3方法
1.3.1 开菲尔菌粒复配培养
将不同来源的开菲尔菌粒无菌研磨至絮状后进行不同组合的等量重组培养(见表1),按照5%接种量加入灭菌脱脂乳中,28℃恒温培养,每24 h传代一次,连续培养7 d。

表1 开菲尔菌粒复配组合比例Table 1 Compound composite ratio of kefir grains
1.3.2 发酵性能测定
根据国家标准GB19302—2010《发酵乳》和GB5413.34—2010《乳和乳制品酸度的测定》[10-11],测定重组菌粒11~15,考察5个重组样品的发酵能力:包括是否凝乳、是否产气、乳清析出情况、酸度、蛋白含量等。以原始开菲尔菌粒TK-ZJUJ03为对照(CK)。
酸度数值以采用吉尔涅尔度(°T)表示,其计算公式如下:

式中:X为酸度,°T;c为NaOH标准液物质的量浓度,mol/L;V为消耗NaOH标准液体积,mL;m为试样质量,g;0.1为酸度理论定义NaOH物质的量浓度,mol/L。
蛋白含量采用凯氏定氮法测定,其计算公式如下:
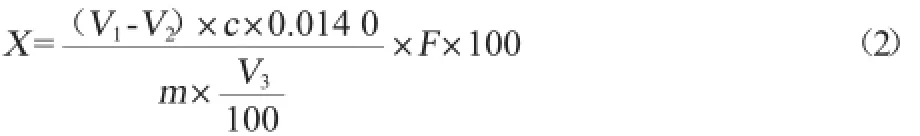
式中:X为蛋白质含量,g/100 g;V1为消耗H2SO4或HCl标准液的体积,mL;V2为空白消耗H2SO4或HCl标准液的体积,mL;V3为吸取消化液的体积,mL;c为H2SO4或HCl标准液浓度,mol/L;0.014 0为1.0 mL H2SO4标准液相当的氮的质量,g;m为试样质量,g;F为氮换算为蛋白质的系数,纯乳与纯乳制品为6.38。
1.3.3 菌种组成分析
选择发酵性能优良的复配菌粒,按照5%接种量加入脱脂乳培养基中,28℃恒温培养,每24 h传代一次,连续培养30 d后,进行菌种组成分析。对于细菌,参照高洁等[12]的方法提取样品中总DNA,PCR扩增16S rDNA V6区,并进行高通量测序鉴定。
细菌16SrDNAV6区通用引物:上游-967F(5′-CAACG CGAAGAACCTTACC-3′);下游-1046R(5′-CGACAGCC ATGCANCACCT-3′)。
对于酵母菌,采用平板涂布法进行传统分离纯化培养[13],将菌粒进行无菌研磨,生理盐水稀释后涂布于YPD琼脂培养基上,28℃恒温培养,对分离到的单菌落进行生理生化鉴定和26S rDNA序列分析。
酵母菌26S rDNA通用引物:上游-NL1(5′-GCCATAT CAATAAGCGGAGGAAAAG-3′);下游-LS2(5′-ATTCC CAAACAACTCGACTC-3′)。
1.3.4 挥发性成分测定
选择发酵性能优良、能够形成颗粒且菌相组成相对简化的重组菌粒,在28℃恒温条件下对脱脂乳发酵24 h后,发酵好的开菲尔于4℃条件下后熟24 h,二氯甲烷法[14]提取挥发性成分。以原始开菲尔菌粒TK-ZJUJ03为对照(CK),采用气质联用(gas chromatography-mass spectrometry,GC-MS)法分析[15]。
气相色谱条件:菲罗门ZB-5 MS色谱柱(25 mm×30 m× 0.5 μm),载气氮气(He),流速0.80 mL/min;多阶程序升温:初始温度35℃,保持时间10 min;然后3℃/min升温至210℃,保持时间10 min;最后6℃/min升温至230℃,保持时间5 min;进样温度为250℃;不分流进样。
质谱条件:电离方式为电子电离(electronic ionization,EI)源,电子能量70 eV,检测电压350 V,传输线温度280℃,离子源温度230℃,离子扫描模式,29~300 m/z。
定性定量方法:GC-MS分析得到总离子流色谱图(total ion chromatogram,TIC)后,通过计算机检索与美国国家标准技术研究所(nationalinstituteofstandardsandtechnology,NIST)数据库比对解谱对挥发性成分进行定性分析,根据色谱图的出峰面积对其进行定量分析。
1.3.5 结果统计
利用统计分析软件SPSS 16.0处理得到的数据,采用ANOVA进行方差分析,比较P值,P≥0.05为无显著差异,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 重组开菲尔菌粒的发酵性能
不同复配组合菌粒的发酵性能如表2所示。由表2可知,在全部重组菌粒中都观察到了不同程度的凝乳、产气以及乳清析出的现象[16],其中13和15有菌粒形成现象,其余各组未见菌粒形成或只观察到絮状物。

表2 不同重组开菲尔菌粒的发酵性能Table 2 Fermentation performance of recombination kefir grains
微生物产生代谢产物的种类和数量与环境密切相关,特别是有些物质是多种微生物共同代谢的结果,因此,不同环境下的开菲尔菌粒的菌相和基质成分不尽相同。此外,至今尚有某些未知菌相和基质成分,使得这一问题更加复杂化,推测也是人工纯菌复配培养未见形成颗粒的原因。
选择有颗粒形成的重组菌粒13和15,以及对照菌粒CK进一步测定其酸度和蛋白含量结果见图1。由图1可知,其酸度分别为128°T、117°T和79°T,蛋白含量分别为2.6%、2.1%和2.4%。国标GB19302—2010中对酸牛乳酸度的规定为≥70°T,重组开菲尔菌粒发酵完成后的酸度值结果表明,其产酸能力能够达到国家标准对发酵乳的要求。将菌粒13命名为TK-ZJUJ05,菌粒15命名为TK-ZJUJ06,做进一步研究。

图1 不同开菲尔菌粒发酵乳的酸度及蛋白质含量Fig.1 Acidity and protein contents of fermented milk by different kefir grains
2.2 重组开菲尔菌粒的菌相变化
2.2.1 细菌菌相组成
原始开菲尔菌粒TK-ZJUJ03、重组菌粒TK-ZJUJ05的细菌菌相分析结果已经在本作者前期文献中发表[11-12]。菌粒TK-ZJUJ06的高通量测序结果见表3。

表3 高通量测序结果Table 3 Results of high throughput sequencing
对下机数据进行拼接和分析得到与物种对应的片段tags进行物种注释。在确定分类水平时,基本原则是能注释到的分类等级尽量低,并且能注释到的tags数量尽量多。而实际情况是可以比对的tags数量会随着注释等级的降低而减少。计算结果发现,能注释到“属”水平的tags有95%,而能注释到“种”水平的tags少于1%,因此,综合注释原则和实际情况考虑,选择注释到“属”。使用BLASTN软件包[17]对tags进行序列比对和物种分析,物种注释结果见图2。由图2可知,目标菌粒中比对得到8个属,各属及其比例分别为:乳杆菌属(Lactobacillus)(39.46%),明串珠菌属(Leuconostoc)(0.62%),乳球菌属(Lactococcus)(43.28%),链球菌属(Streptococcus)(0.54%),醋酸菌属(Acetobacter)(11.53%),希瓦氏菌属(Shewanella)(0.67%),不动杆菌属(Acinetobacter)(0.05%)以及假单胞菌(Pseudomonas)(0.14%)。其中,乳杆菌属(Lactobacillus),乳球菌属(Lactococcus)和醋酸菌属(Acetobacter)为该重组菌粒中的优势菌属,也是食品中常见的菌属,而其余各属(Streptococcus中只有Streptococcus thermophilus被认可)不在《可用于食品的菌种名单》(卫办监督发〔2010〕65号)中,暂定其为风险菌。
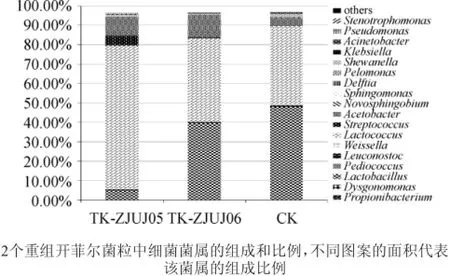
图2 细菌菌相组成Fig.2 Composition of bacterial flora
经过多次传代培养后,重组开菲尔菌粒逐渐形成一个新的微生态系统,与CK比较可知,原有优势菌相在新体系中组成稳定(图2):TK-ZJUJ03中有乳杆菌属(Lactobacillus)47.89%,乳球菌属(Lactococcus)40.93%,醋酸菌属(Acetobacter)4.50%,合计93.32%;TK-ZJUJ05中有乳杆菌属(Lactobacillus)5.01%,乳球菌属(Lactococcus)74.13%,醋酸菌属(Acetobacter)9.86%,合计89%;TK-ZJUJ06中有乳杆菌属(Lactobacillus)39.46%,乳球菌属(Lactococcus)43.28%,醋酸菌属(Acetobacter)11.53%,合计94.27%。非优势菌相在新微生态系统形成过程中有所损失:原始菌粒中的Dysgonomonas、Pelomonas和Weissella三个属在重组后的新菌粒中未见出现。
重组kefir菌粒与CK风险菌比例见表4。由表4可知,重组菌粒TK-ZJUJ06,风险菌比例显著下降。Dysgonomonas、Pelomonas和Weissella三个属在原始菌粒TK-ZJUJ03中没有检测到,但在其它原始菌粒中有不同比例的出现,相关数据发表在作者前期的研究中[11-12],表面在重组的过程中形成了新的微生态系统。对照组的风险菌所占比例为4.34%,重组菌粒TK-ZJUJ05的风险菌所占比例为7.04%,而重组菌粒TK-ZJUJ06的风险菌所占比例为2.02%,该比例显著低于原始菌粒,符合本实验中重组筛选的方向。
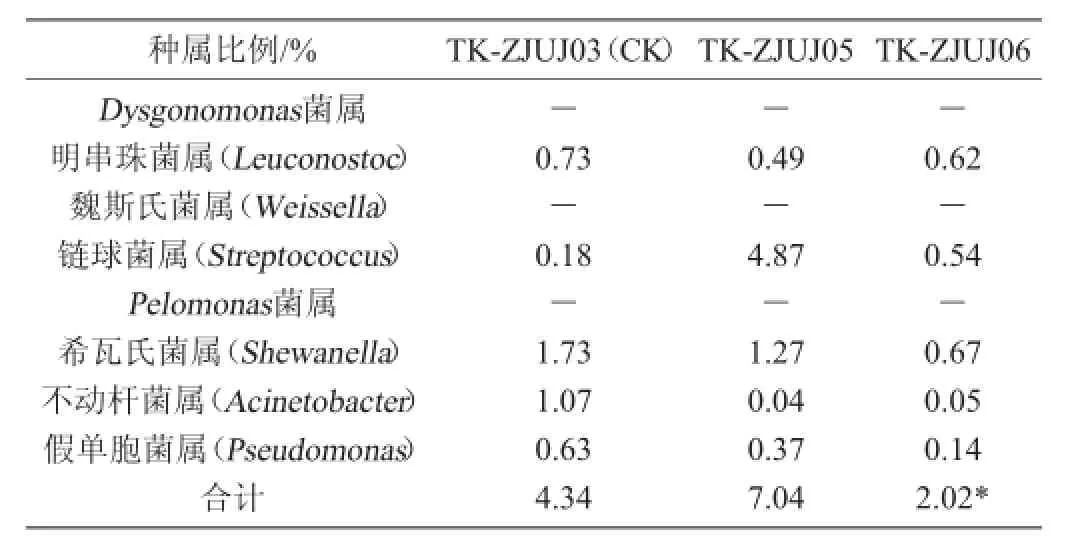
表4 重组开菲尔菌粒与对照组风险菌比例Table 4 Proportion of risky bacteria in recombined kefir grains and the contrast
2.2.2 酵母菌分离鉴定
TK-ZJUJ05和TK-ZJUJ06在YPD培养基上共分离得到纯培养57株,分别进行生理生化鉴定,并与标准菌株对比,结果见表5。根据酵母菌的镜检结果、是否产孢子、发酵试验[18]以及标准菌株试验结果,YPD培养基上得到的纯培养物共分为6组:TK-ZJUJ05 Y1~TK-ZJUJ05 Y3,TK-ZJUJ06 Y1~TK-ZJUJ06 Y3。初步鉴定结果表明,6组菌株生理生化特性相似,均为酵母菌属(Saccharomyces)。

表5 TK-ZJUJ05和TK-ZJUJ06中酵母菌属生理生化试验结果Table 5 Results of physiological and biochemical experiments of yeasts from TK-ZJUJ05 and TK-ZJUJ06
在生理生化鉴定结果的基础上,进行26S rDNA序列分析。提取纯培养物DNA,使用1.3.3中的酵母序列引物扩增目的片段,对PCR产物测序并与美国国家生物技术信息中心NCBI数据库信息比对,利用BioEdit 7.0.9和MEGA 4.1序列分析软件处理数据,邻接(neighbor-joining,NJ)法构建进化树(见图3)。结合生理生化鉴定结果发现,两个重组菌粒中只分离得到一种酵母菌,为酿酒酵母菌(Saccharomyce cerevisiae)。与细菌组成多样性程度降低相类似,在不同菌粒重新组合培养过程中,来源不同的多种酵母菌之间也存在竞争排斥,导致某些酵母菌被淘汰。酿酒酵母(S.cerevisiae)在菌粒微生态系统的形成与维持中有重要作用,也是开菲尔起泡性和独特风味的重要来源。在已有的对开菲尔进行纯菌发酵的尝试中,酿酒酵母是不可缺少的重要菌相[19]。

图3 TK-ZJUJ05(A)及TK-ZJUJ06(B)中酵母菌进化树图谱Fig.3 Cladogram of yeasts from TK-ZJUJ05(A)and TK-ZJUJ06(B)
菌种组成研究表明,在复配培养的过程中,与原有天然菌粒相比,重组菌粒TK-ZJUJ06细菌组成多样性程度下降,优势菌相组成保持稳定,风险菌组成比例降低;酵母菌组成被简化,只分离得到单一菌种酿酒酵母(S.cerevisiae)。同时,该菌粒保持了开菲尔菌特有的颗粒状态、发酵乳的凝乳性和特有的起泡性。这正符合筛选标准:在菌相组成尽可能简单的情况下,保持开菲尔发酵乳的组织状态和特性,以便更好的控制其发酵过程和代谢产物的稳定性。在此基础上,对TK-ZJUJ06的发酵风味做进一步研究。
2.3 TK-ZJUJ06发酵乳挥发性成分分析
采用气质联用法(GC-MS)进行挥发性成分测定,分析比较TK-ZJUJ06和CK发酵乳的挥发性成分组成。其中挥发性成分的总离子流色谱图见图4,经数据库比对解谱得到二者的挥发性成分组成见表6。

表6 TK-ZJUJ06和对照组开菲尔挥发性组分相对含量Table 6 Relative contents of volatile components of kefir from TK-ZJUJ06 and the contrast
风味是影响食品质量的重要指标。对于发酵乳而言,其中主要呈味物质是乳酸,形成了酸奶共有的风味,而不同品种的发酵乳独特的风味则是由多种复杂的物质复合而成,其中挥发性物质所起到的作用尤为重要。对TK-ZJUJ06发酵乳挥发性成分解谱,共鉴定到13种挥发性化合物,分别是烷烃类7种,脂肪酸类5种以及其他物质1种,其中烷烃类物质(如十九烷、二十烷等),以及脂肪酸类物质在乳酸菌发酵产物中已有报道或较为常见[20-21];酚类物质在普通发酵乳中出现较少,但在酵母进行的乙醇发酵过程中产生较多,而开菲尔的发酵特性正是存在酵母进行的乙醇发酵;酸类物质在发酵乳中普遍存在。

图5 不同开菲尔中挥发性组分相对含量比较Fig.5 Comparison of relative contents of volatile components from different kefir
由图5可知,与CK相比,TK-ZJUJ06发酵乳中烷烃类物质所占比例下降,脂肪酸类物质相对含量较高,酚、酸类物质组成差异不大。除CK中的(Z,Z)-9,12-十八烷二烯酸外,重组菌粒开菲尔中所含有的脂肪酸种类与对照组相同。上述结果表明,重组菌粒能够较好的保留开菲尔特有的发酵风味,其挥发性脂肪酸含量较CK有所升高,能带来更好的口感。
3 结论
来自于拉萨、成都、乌鲁木齐和西宁四个地区的开菲尔菌粒等量复配培养,得到了最优重组菌粒TK-ZJUJ06。与原始菌粒相比,该菌粒菌种组成简化:细菌组成中乳杆菌属(Lactobacillus),乳球菌属(Lactococcus)及醋酸菌属(Acetobacter)等优势菌相组成稳定,占细菌总数的94.27%,风险菌比例显著下降,占细菌总数的2.02%,酵母菌组成为单一的酿酒酵母(Saccharomyce cerevisiae);发酵性能稳定并较好的保留了开菲尔特有的发酵特性和风味。在发酵风味保留较好的情况下,简化的菌相组成更有利于代谢产物的稳定性和发酵过程的控制,因此可以作为进一步工业驯化的菌种深入研究。
[1]高洁,俞丹,陈頔,等.传统发酵乳开菲尔的研究进展[J].中国食品学报,2016,16(4):204-211.
[2]林晓珊,吴虹,杨汝德.中华开菲尔共生菌的分离与鉴定[J].现代食品科技,2009,25(10):1233-1235.
[3]GOLOWCZYC M A,MOBILI P,GARROTE G L,et al.Protective action ofLactobacillus kefircarrying S-layer protein againstSalmonella enterica serovar enteritidis[J].Int J Food Microbiol,2007,118(3):264-273.
[4]张列兵,苑伍申,程涛,等.开菲尔粒表面超微结构及微生物在开菲尔粒表面分布的研究[J].中国乳品工业,1998(1):14-15.
[5]AGATA L,JAN P.Production of fermented goat beverage using a mixed starter culture of lactic acid bacteria and yeasts[J].Eng Life Sci,2012, 12(4):486-493.
[6]ZAJŠEK K,GORŠEK A.Mathematical modelling of ethanol production by mixed kefir grains yeast population as a function of temperature variations[J].Biochem Eng J,2010,49(49):7-12.
[7]OKANO K,TANAKA T,OGINO C,et al.Biotechnological production of enantiomeric pure lactic acid from renewable resources:recent achievements,perspectives,and limits[J].Appl Microbiol Biotechnol, 2010,85(3):413-423.
[8]CHENG H.Volatile flavor compounds in yogurt:a review[J].Crit Rev Food Sci Nutr,2010,50(10):938-50.
[9]李海燕,乔成亚,刘振民,等.开菲尔发酵剂发酵特性研究[J].中国酿造,2016,35(2):30-34.
[10]中华人民共和国卫生部.GB 19302—2010食品安全国家标准发酵乳[S].北京:中国标准出版社,2010.
[11]中华人民共和国卫生部.GB 5413.34—2010食品安全国家标准乳和乳制品酸度的测定[S].北京:中国标准出版社,2010.
[12]GAO J,GU F Y,HE J,et al.Metagenome analysis of bacterial diversity in Tibetan kefir grains[J].Eur Food Res Technol,2013,236(3):549-556.
[13]GAO J,GU F,ABDELLA N H,et al.Investigation on culturable microflora in Tibetan kefir grains from different areas of China[J].J Food Sci,2012,77(8):M425-M433.
[14]MAGALHÃES K T,DRAGONE G,PEREIRA G V D M,et al.Comparative study of the biochemical changes and volatile compound formations during the production of novel whey-based kefir beverages and traditional milk kefir[J].Food Chem,2011,126(1):249-253.
[15]NING L,FUPING Z,HAITAO C,et al.Identification of volatile components in Chinese Sinkiang fermented camel milk using SAFE,SDE,and HS-SPME-GC/MS[J].Food Chem,2011,129(3):1242-1252.
[16]谢爱英,党亚丽,李芳芳,等.不同巴氏杀菌条件对酸奶品质的影响[J].食品科学,2011,32(9):14-17.
[17]HUSE S M,DETHLEFSEN L,HUBER J A,et al.Exploring microbial diversity and taxonomy using SSU rRNA hypervariable tag sequencing [J].Plos Genet,2008,4(11):212-220.
[18]BARNETT J A,PAYNE R W,YARROW D.Yeast-characteristic and identification(3rd edn)[M].Cambridge:Cambridge University Press, 2000:50-56.
[19]BESHKOVA D M,SIMOVA E D,SIMOV Z I,et al.Pure cultures for making kefir[J].Food Microbiol,2002,19(5):537-544.
[20]徐俐,戴岳宗.乳酸菌对酸汤挥发性物质的影响[J].食品科学,2008,29(11):505-509.
[21]GÜLER Z,GÜRSOYBALCI A C.Evaluation of volatile compounds and free fatty acids in set types yogurts made of ewes',goats'milk and their mixture using two different commercial starter cultures during refrigerated storage[J].Food Chem,2011,127(3):1065-1071.
Fermentation performance and microbial composition of recombination kefir grain
GAO Jie1,SUN Jing1,HUANG Jian1,HE Guoqing2,GONG Lingxiao3,HUO Junsheng1*
(1.National Institute for Nutrition and Health,Chinese Center for Disease Control and Prevention,Beijing 100050,China; 2.College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China; 3.School of Food and Chemical Engineering,Beijing Technology and Business University,Beijing 100048,China)
In order to simplify the microbial complexity in kefir fermentation system and keep the unique flavor of kefir,a recombination kefir grain TK-ZJUJ06 was got by restructuring cultivation of kefir grains from Lhasa,Chengdu,Urumchi and Xining.By high throughput sequencing analysis, there are 8 genera in the bacteria composition,Lactobacillus(39.46%),Leuconostoc(0.62%),Lactococcus(43.28%),Streptococcus(0.54%),Acetobacter(11.53%),Shewanella(0.67%),Acinetobacter(0.05%),andPseudomonas(0.14%),respectively.The yeasts were detected asSaccharomyces cerevisiaeby physiology and biochemistry experiments and 26S rDNA sequential analysis.The results of fermentation performance and volatile components analysis showed that the fermentation performances of recombinant strains were good with acidity 117°T and volatile fatty acids content 65%.Compared with the contrast,recombination grain TK-ZJUJ06 had a simple composition of microorganism,and kept the unique flavor of kefir.
kefir;recombination kefir grain;microbial composition;fermentation performance;volatile components
TS252.54
0254-5071(2017)03-0126-06
10.11882/j.issn.0254-5071.2017.03.026
2016-12-09
高洁(1983-),女,助理研究员,博士,研究方向为益生菌,肠道微生态。
*通讯作者:霍军生(1962-),男,研究员,博士,研究方向为食品生物技术,强化食品。

