尼美舒利联合奥沙利铂对食管癌模型大鼠微血管密度及免疫功能的影响
王丕明,冉旺旺,谭柏清,罗维晓(.武警山东省总队医院检验科,济南 5004;.山东博科生物产业有限公司,济南 5000)
尼美舒利联合奥沙利铂对食管癌模型大鼠微血管密度及免疫功能的影响
王丕明1*,冉旺旺1,谭柏清2#,罗维晓2(1.武警山东省总队医院检验科,济南 250014;2.山东博科生物产业有限公司,济南 250200)
目的:研究尼美舒利联合奥沙利铂对食管癌模型大鼠微血管密度及免疫功能的影响。方法:取48只大鼠建立食管癌模型后随机分为模型组、奥沙利铂组、尼美舒利组和联用组,每组12只。建模后1 d,模型组大鼠尾iv 5%的葡萄糖注射液1 mL,每周3次,ig等量羧甲基纤维素钠溶液,每周1次;奥沙利铂组大鼠尾iv奥沙利铂13.6 mg/kg,每周3次;尼美舒利组大鼠ig尼美舒利20 mg/kg,每周1次;联用组大鼠同法给予奥沙利铂和尼美舒利,给药时间为8周。观察各组大鼠肿瘤生长情况、肿瘤组织微血管密度、外周血免疫功能指标。结果:与模型组比较,各给药组大鼠肿瘤体积、瘤质量、肿瘤组织的积分吸光度和阳性血管密度均降低(P<0.05);奥沙利铂组和联用组大鼠外周血CD3+、CD4+T细胞数和CD4+/CD8+比值均降低,CD8+T细胞数均增加(P<0.05)。与尼美舒利组比较,奥沙利铂组和联用组大鼠肿瘤体积、瘤质量、肿瘤组织的积分吸光度和阳性血管密度,以及外周血CD3+、CD4+T细胞数和CD4+/CD8+比值均降低,抑瘤率和CD8+T细胞数均增加(P<0.05),其中联用组较奥沙利铂组更明显(P<0.05)。结论:奥沙利铂联合尼美舒利能够更有效地抑制食管癌的生长,其机制可能与抑制肿瘤组织中血管新生、增强免疫有关。
食管癌;大鼠;尼美舒利;奥沙利铂;微血管密度;免疫功能
食管癌是预后较差的消化道恶性肿瘤,临床上早期诊断食管癌较为困难,确诊时多为进展期,部分患者通过手术切除后仍需继续接受化疗,而晚期患者则失去手术时机,仅能通过化疗来延长生存时间[1]。铂类化疗药物是细胞周期非特异性的化疗药物,对细胞具有杀伤作用,被广泛用于消化道恶性肿瘤的治疗。但是,癌细胞在化疗过程中会产生耐药性而影响化疗效果[2]。近年来,环氧合酶2(COX-2)与恶性肿瘤的关系受到了越来越多的重视,COX-2过表达能够促进癌细胞的增殖、迁移。尼美舒利是选择性COX-2抑制剂,对COX-2的活性具有显著抑制作用[3]。笔者将尼美舒利和奥沙利铂联用,研究其对人食管癌模型大鼠微血管密度及免疫功能的影响,以期为临床食管癌的治疗提供参考。
1 材料
1.1 仪器
7600型全自动生化分析仪(日本日立公司);Cyto-FLEX型流式细胞分析仪和Allegra 64R型高速冷冻离心机(美国贝克曼库光特公司);HPIAS-1000型高彩色病理图像分析系统由同济大学提供。
1.2 药品与试剂
尼美舒利片(广东惠德勤药业有限公司,批号:H19980132,规格:每片0.1 g);注射用奥沙利铂(杭州赛诺菲安万特民生制药有限公司,批号:J20100064,规格:每瓶50 mg);酶联免疫吸附(ELISA)试剂盒(南京建成生物公司);流式细胞术试剂盒(美国BD公司)。
1.3 细胞及其培养基
人食管癌Eca109细胞购买于AGTT细胞库,细胞培养基和血清购买于美国Thermo公司。
1.4 动物
清洁级SD大鼠48只,周龄6~8周,体质量160~220 g,购于山东大学动物实验中心,许可证号为SCXK(鲁)20151205,饲养于温度20~25℃、湿度40%~60%条件下。本次研究经医院动物伦理委员会批准。
2 方法
2.1 食管癌移植瘤模型的建立
参照文献[4],采用皮下接种人食管癌细胞建立食管癌模型大鼠。培养Eca109细胞,胰蛋白酶常规消化传代,取传代扩增且处于对数生长期的细胞进行消化,离心收集细胞后用D'Hanks溶液重悬,调节细胞密度至1× 107mL-1。在大鼠右侧前肢的腋下注射0.5 mL细胞悬液,取成瘤大鼠(肿瘤体积约为100 mm3)用于实验。
2.2 分组与给药
将建模成功的大鼠随机分为模型组、奥沙利铂组、尼美舒利组和联用组,每组12只。建模后1 d,模型组大鼠尾iv 5%的葡萄糖注射液1 mL,每周3次,ig等量羧甲基纤维素钠溶液,每周1次;奥沙利铂组大鼠尾iv奥沙利铂13.6 mg/kg,每周3次,奥沙利铂用5%的葡萄糖注射液溶解;尼美舒利组大鼠ig尼美舒利20 mg/kg,每周1次,尼美舒利用羧甲基纤维素钠溶液溶解;联用组大鼠同法给予奥沙利铂和尼美舒利。给药时间为8周。
2.3 标本采集
给药8周后,颈椎脱臼法处死大鼠,眼球取血用于免疫功能检测;解剖得到肿瘤组织并用生理盐水清洗,每只大鼠的肿瘤组织分为两份,一份用4%福尔马林固定后石蜡包埋、制作石蜡切片,另一份用液氮冷冻后保存在-80℃冰箱待用。
2.4 肿瘤生长情况考察
用游标卡尺测量移植瘤长径(a)、短径(b),计算移植瘤体积(V=ab2π/6);称取瘤体质量,计算抑瘤率[(模型组瘤质量-给药组瘤质量)/模型组瘤质量×100%]。
2.5 肿瘤组织微血管密度测定
参照文献[5],取食管癌移植瘤组织标本,用多聚甲醛固定48 h后,常规脱水、浸蜡、包埋、染色(染色蛋白为CD31),在100倍显微镜下,采集3~5个阳性细胞较多的区域,输入高彩色病理图像分析系统,计算积分吸光度、面密度阳性率。积分吸光度=阳性面密度×积分光度;面密度阳性率=阳性目标面密度/(阳性目标面密度+阴性目标面密度)×100%。
2.6 免疫功能考察
处死大鼠后眼球取血2 mL,分别与CD3、CD4、CD8的荧光标记单克隆抗体共同孵育后,在流式细胞仪上测定CD3+、CD4+、CD8+T细胞数,计算CD4+/CD8+比值。
2.7 统计学方法
3 结果
3.1 肿瘤生长情况
与模型组比较,各给药组大鼠肿瘤体积、瘤质量均降低(P<0.05);与尼美舒利组比较,奥沙利铂组和联用组大鼠肿瘤体积、瘤质量均降低,抑瘤率均升高(P<0.05),其中联用组较奥沙利铂组差异更明显(P<0.05)。各组大鼠肿瘤生长情况见表1。
表1 各组大鼠肿瘤生长情况(±s,n=12)Tab 1 Situation of cancer growth in rats of each group(±s,n=12)
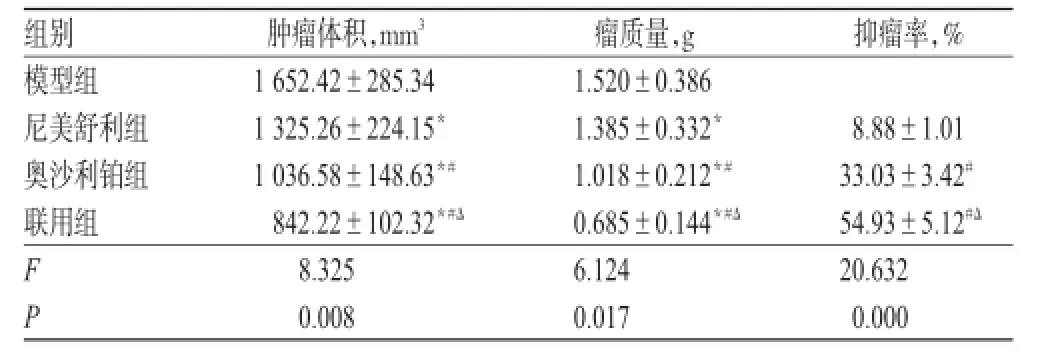
表1 各组大鼠肿瘤生长情况(±s,n=12)Tab 1 Situation of cancer growth in rats of each group(±s,n=12)
注:与模型组比较,*P<0.05;与尼美舒利组比较,#P<0.05;与奥沙利铂组比较,ΔP<0.05Note:vs.model group,*P<0.05;vs.nimesulide group,#P<0.05;vs.oxaliplatin group,ΔP<0.05
?
3.2 肿瘤组织微血管密度
与模型组比较,各给药组大鼠肿瘤组织的积分吸光度、面密度阳性率均降低(P<0.05);与尼美舒利组比较,奥沙利铂组和联用组大鼠积分吸光度、面密度阳性率均降低(P<0.05),其中联用组较奥沙利铂组差异更明显(P<0.05)。各组大鼠积分吸光度和面密度阳性率的测定结果见表2。
表2 各组大鼠积分吸光度和面密度阳性率的测定结果(±s,n=12)Tab 2 Determination results of integral absorbance and positive rate of surface density in rats of each group(±s,n=12)

表2 各组大鼠积分吸光度和面密度阳性率的测定结果(±s,n=12)Tab 2 Determination results of integral absorbance and positive rate of surface density in rats of each group(±s,n=12)
注:与模型组比较,*P<0.05;与尼美舒利组比较,#P<0.05;与奥沙利铂组比较,ΔP<0.05Note:vs.model group,*P<0.05;vs.nimesulide group,#P<0.05;vs.oxaliplatin group,ΔP<0.05
?
3.3 免疫功能
与模型组和尼美舒利组比较,奥沙利铂组、联用组大鼠外周血CD3+、CD4+T细胞数和CD4+/CD8+比值均降低,CD8+T细胞数增加(P<0.05),其中联用组效果较奥沙利铂组更明显(P<0.05)。各组大鼠免疫功能的测定结果见表3。
表3 各组大鼠免疫功能的测定结果(±s,n=12)Tab 3 Determination results of immune function of rats in each group(±s,n=12)
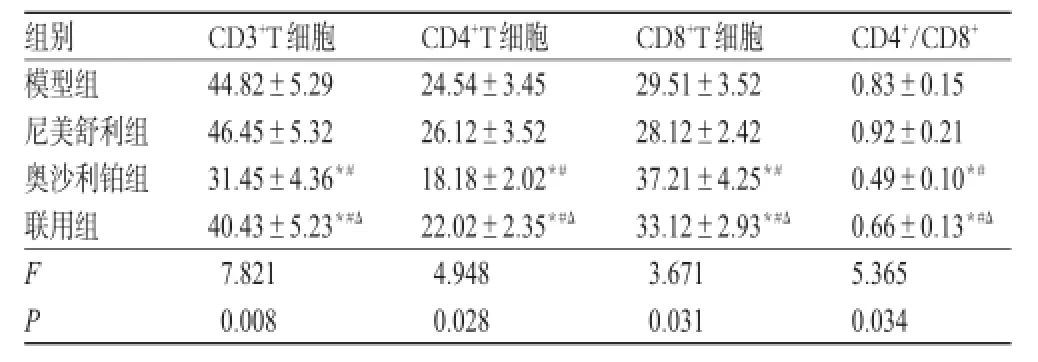
表3 各组大鼠免疫功能的测定结果(±s,n=12)Tab 3 Determination results of immune function of rats in each group(±s,n=12)
注:与模型组比较,*P<0.05;与尼美舒利组比较,#P<0.05;与奥沙利铂组比较,ΔP<0.05Note:vs.model group,*P<0.05;vs.nimesulide group,#P<0.05;vs.oxaliplatin group,ΔP<0.05
?
4 讨论
食管癌患者在诊断时多数已发展至中晚期,常采用联合化疗来抑制病情发展。奥沙利铂为第三代铂类药物,具有广谱的抗癌活性,且毒性比顺铂、卡铂小,是治疗食管癌理想的化疗药物,但单独使用效果不甚理想[6]。近年来,越来越多的研究证实COX-2能够促进恶性肿瘤的发生发展,也有研究证实COX-2选择性地抑制剂尼美舒利能够抑制食管癌细胞的增殖[7]。由此笔者推测,使用尼美舒利能够抑制食管癌的发展。本研究中,各给药组大鼠肿瘤体积明显低于模型组,且联用组效果最明显,与国内外报道[8-9]一致,提示尼美舒利联合奥沙利铂有助于抑制肿瘤的生长,这也可以从瘤质量与抑瘤率的比较中得到证实。
血管新生是恶性肿瘤发生发展的重要环节,肿瘤组织局部新生的血管能够为细胞的生长提供必需的养分,同时也能够为细胞的转移提供通路[10]。微血管密度是评估肿瘤血管生成状态的“金标准”,可反映肿瘤组织的血流灌注情况[11]。肿瘤生成血管数目越多,肿瘤能够获得的营养、供养就越丰富,发生肿瘤转移与复发的几率就越高[12]。研究表明,微血管密度与食管鳞癌的浸润与转移相关,恶性肿瘤组织中微血管密度均异常升高[13]。COX-2所催化产生的前列腺素E2(PGE2)具有促进血管新生的作用,而尼美舒利则能够通过选择性抑制COX-2来拮抗血管新生过程。本文研究中,联用组大鼠积分吸光度、阳性血管面密度明显低于尼美舒利组、奥沙利铂组,提示尼美舒利联合奥沙利铂有助于抑制食管癌组织中血管新生。
化疗药物在杀伤癌细胞的同时也会对机体正常的组织造成损伤,免疫功能破坏是化疗过程中常见的不良反应[14]。CD3是成熟T细胞的表面标志,CD4和CD8则分别是辅助性和抑制性T细胞的表面标志[15]。CD4/CD8更能反映机体免疫状态,一旦动态平衡被打破,就提示机体免疫功能受到损伤。本研究中,奥沙利铂组、联用组大鼠CD3+、CD4+、CD4+/CD8+明显低于模型组,CD8+明显高于模型组,说明奥沙利铂单用以及联合尼美舒利均会造成免疫功能损伤。尼美舒利组、联用组大鼠CD3+、CD4+、CD4+/CD8+明显高于奥沙利铂组,CD8+明显低于奥沙利铂组,提示在奥沙利铂化疗的基础上给予尼美舒利能够减轻化疗药物所引起的免疫功能损伤。
本研究结果表明,奥沙利铂联合尼美舒利有助于抑制食管癌肿瘤生长,其机制可能与改善免疫功能、抑制血管新生有关。本研究的局限性在于观察指标较少,未对血清肿瘤标志物等其他指标进行比较,但是本文仅仅是一个实验性研究,尼美舒利、奥沙利铂联合应用于临床还有待于进一步的探索。
[1] Servagi-Vernat S,Crehange G,Roullet B,et al.PhaseⅡstudy of a platinum-based adapted chemotherapy regimen combined with radiotherapy in patients 75 years and older with esophageal cancer[J].Drugs Aging,2015,32(6):487-493.
[2] 陈思丹.奥沙利铂联合贝伐单抗与卡培他滨方案治疗老年晚期胃癌疗效及安全性评估[J].海南医学院学报,2014,20(4):490-496.
[3] Kumagai Y,Sobajima J,Higashi M,et al.Coexpression of COX-2 and iNOS in angiogenesis of superficial esophageal squamous cell carcinoma[J].Int Surg,2015,100(4):733-743.
[4] Guan B,Li H,Yang Z,et al.Inhibition of farnesoid X receptor controls esophageal cancer cell growth in vitro and in nude mouse xenografts[J].Cancer,2013,119(7):1321-1329.
[5] 张慧,黄立中,田莎,等.构建食管癌移植瘤模型及不同剂量六神丸干预后的微血管密度的变化[J].中国组织工程研究,2015,19(5):776-771.
[6] 冯立宁,武智聪,何萍,等.3种食管癌术后辅助化疗方案的药物经济学评价[J].中国药房,2015,26(14):1887-1889.
[7] 李佳,林德安,刘志明.尼美舒利对人胰腺癌PANC-1细胞生长及细胞周期分布的影响[J].广西医科大学学报,2013,30(1):27-30.
[8] 郎哲,陈刚,王东昌.尼美舒利联合奥沙利铂对人肺癌裸鼠移植瘤生长及淋巴转移的抑制作用[J].中华肿瘤杂志,2015,34(10):739-744.
[9] Oyama K,Fujimura T,Ninomiya I,et al.Cyclooxygenase(COX)-2 expression in a rat duodenoesophageal reflux model and chemoprevention of adenocarcinoma by the selective COX-2 inhibitor nimesulide[J].Nihon Shokakibyo Gakkai Zasshi,2007,104(8):1183-1191.
[10] Sakurai T,Okumura H,Matsumoto M,et al.Endoglin(CD105)is a useful marker for evaluating microvessel density and predicting prognosis in esophageal squamous cell carcinoma[J].Anticancer Res,2014,34(7):3431-3438.
[11] Hong YM,Gan WG,Xu ZH.Significance of the expression of integrin β1,VEGF and MVD in hypopharyngeal squamous cell carcinoma[J].Genet Mol Res,2014,13(3):6455-6465.
[12] 陈浩林,秦雪睛,何家杰,等.PTEN、血管内皮生长因子和微血管密度在大肠癌组织中的表达及其临床意义[J].海南医学院学报,2013,19(10):1393-1395.
[13] 陶识博,张蕾,张云汉,等.食管鳞癌中MTAI、MMP-P和MVD的表达及其临床病理意义[J].河南大学学报(医学版),2010,29(1):29-33.
[14] Nozaki Y,Nishida T,Hori Y,et al.Chemoradiotherapy is effective for primary esophageal adenosquamous cell carcinoma but ineffective for the metastatic adenocarcinoma component[J].Nihon Shokakibyo Gakkai Zasshi,2015,112(2):278-286.
[15] 张伟,于在诚.食管癌患者不同术式围手术期细胞免疫与体液免疫的监测分析[J].广东医学,2015,36(10):1545-1547.
(编辑:邹丽娟)
Effects of Nimesulide Combined with Oxaliplatin on Microvessel Density and Immune Function of Esophageal Cancer Model Rats
WANG Piming1,RAN Wangwang1,TAN Baiqing2,LUO Weixiao2(1.Clinical Laboratory,Armed Police Shandong Corps Hospital,Jinan 250014,China;2.Shandong Biobase Bio-industrial Co.,Ltd.,Jinan 250200,China)
OBJECTIVE:To study the effects of nimesulide combined with oxaliplatin on microvessel density and immune function of esophageal cancer model rats.METHODS:48 rats were selected to establish esophageal cancer model and then randomly divided into model group,oxaliplatin group,nimesulide group and combination group,with 12 rats in each group.1 d after modeling,model group was given 5%Glucose injection 1 mL via tail vein,3 times a week,and constant volume of Sodium carboxymethylcellulose solution,once a week.Oxaliplatin group was given oxaliplatin 13.6 mg/kg via tail vein,3 times a week.Nimesulide group was given nimesulide 20 mg/kg intragastrically,once a week.Combination group was given oxaliplatin and nimesulide with same usage as above.The administration lasted for 8 weeks.The cancer growth,microvessel density of cancer tissue,peripheral blood immune function index were observed in four groups.RESULTS:Compared with model group,cancer size,cancer weight,integral absorbance of cancer and positive vessel density were all decreased in treatment groups(P<0.05).The number of peripheral blood CD3+,CD4+T cells and CD4+/CD8+were all decreased in oxaliplatin group and combination group,while the number of CD8+T cells was decreased(P<0.05).Compared with nimesulide group,cancer size,cancer weight,integral absorbance of cancer,positive vessel density,the number of peripheral blood CD3+,CD4+T cells and CD4+/CD8+were all decreased in oxaliplatin group and combination group,while tumor inhibition rate and the number of CD8+T cells were all increased(P<0.05);combination group was more significant than oxaliplatin group(P<0.05).CONCLUSIONS:Oxaliplatin combined with nimesulide can effectively inhibit cancer growth of esophageal cancer,the mechanism of which may be associated with inhibiting angiogenesis of tumor tissue and strengthening immune function.
Esophageal cancer;Rat;Nimesulide;Oxaliplatin;Microvessel density;Immune function
R965
A
1001-0408(2017)04-0505-04
2016-06-21
2016-10-24)
*主管技师。研究方向:免疫医学检验。电话:0531-67965811。E-mail:wpmearth@163.com
#通信作者:高级工程师,硕士。研究方向:体外诊断试剂。电话:0531-58626068。E-mail:tbq.@biobase.cn
DOI10.6039/j.issn.1001-0408.2017.04.20

