单针藻的化学成分及其体外抗菌、抗氧化活性研究Δ
赵震宇,罗宁,陈晨,李昂,马莎莎,刘积光,王孟,刘平怀(海南大学材料与化工学院/海南大学热带作物种质资源保护与开发利用教育部重点实验室,海口 570228)
·实验研究·
单针藻的化学成分及其体外抗菌、抗氧化活性研究Δ
赵震宇*,罗宁,陈晨,李昂,马莎莎,刘积光,王孟,刘平怀#(海南大学材料与化工学院/海南大学热带作物种质资源保护与开发利用教育部重点实验室,海口 570228)
目的:研究单针藻的化学成分,并对其中分离出的化合物进行体外抗菌、抗氧化活性考察。方法:对单针藻乙醇提取物经石油醚、乙酸乙酯和正丁醇萃取,利用硅胶柱色谱、高效液相色谱、气相色谱-质谱法对单针藻乙酸乙酯部位萃取物进行分离和化学成分分析,并根据理化性质和核磁共振谱等分析鉴定化合物的结构;对分离出的4种化合物分别采用刃天青法测定其对铜绿假单胞菌、白色念珠菌、枯草芽孢杆菌、大肠埃希菌的最低抑菌浓度(MIC),1,1-二苯基-2-苦基-肼基(DPPH)法测定自由基清除率[以半数清除浓度(IC50)计]、亚铁还原能力法(以FRAP值计)测定总还原能力。结果:从单针藻乙酸乙酯萃取部位的E4、E5段分离得到化合物1~6,分别被鉴定为豆甾醇、邻苯二甲酸二丙酯、3-吲哚甲酸、黑麦草素、黑麦草内脂、5-羟基-3,4-二甲基-5-戊基-2(5H)-呋喃酮;化合物3~6的MIC在10~500µg/mL内,IC50在22.02~71.01µg/mL内,FRAP值在(62.04±5.36)~(281.22±8.3)µmol/L内。结论:单针藻含有多种脂类和烷酸类物质,具有一定的体外抗菌、抗氧化活性。
单针藻;乙酸乙酯部位;萃取物;化学成分;鉴定;抗菌;抗氧化
单针藻(Monoraphidium dybowskii)属于绿藻门单针藻属。单针藻具有生长速度快、生物量高、油脂含量高等优点,文献表明其藻粉中含有丰富的油脂、粗纤维、蛋白质、多糖和色素,并含有较高含量的镁、钙、锌、铁等矿物质元素[1]。
目前对单针藻的研究主要集中在培养及采收方面[2],而对其化学成分、活性等研究尚未见文献报道。故笔者以单针藻(C29)为研究对象,较系统性地分析单针藻乙酸乙酯部位的化学成分并考察其抗菌、抗氧化活性,为单针藻在医药领域的开发与利用提供科学依据。
1 材料
1.1 仪器
P230高效液相色谱仪(辽宁省大连依利特公司);xMark酶标仪(美国Bio-Rad公司);RV10旋转蒸发仪(德国IKA公司);Hp6890/5973MSD气相色谱-质谱联用(GC-MS)仪(美国惠普公司);Varian Unity600核磁共振(NMR)仪(美国Varian公司)。
1.2 药材、对照品与试剂
样品采集自海南省儋州市宝岛新村,由海南大学材料与化工学院生物工程实验室经细胞形态学及分子生物学鉴定为单针藻Monoraphidium dybowskii,经培养、絮凝采收、冷冻干燥处理后制成藻粉,放入-40℃冰箱备用;头孢他啶注射液(山东罗欣药业集团股份有限公司,批号:H20080170,纯度:95%);1,1-二苯基-苦基-肼基(DPPH,英国Johnason Matthey公司,批号:MFCD-00007231,纯度:96%);2,6-二叔丁基对甲酚(BHT,广州化学试剂厂,批号:MCFD00026300,纯度:98%);维生素C[VC,阿拉丁(上海)有限公司,批号:MFCD-00064328,纯度:98%];其他试剂均为国产分析纯。
1.3 菌株
铜绿假单胞菌(P.aeruginosa)、白色念珠菌(M.albican)、枯草芽孢杆菌(B.subtilis)、大肠埃希菌(E.coli)均来自海南大学材料与化工学院生物工程实验室。
2 方法与结果
2.1 单针藻浸膏提取
称取单针藻粉3 kg,用5倍体积无水乙醇连续浸泡5次,每次5 d,每天搅拌浸泡液3~5次,浸提液经减压浓缩得无醇味乙醇提取物。将干燥后的乙醇提取物305 g分散于去离子水中成悬浮液,再采用极性由小到大的石油醚、乙酸乙酯和正丁醇萃取3次,得石油醚萃取物(PE)200 g、乙酸乙酯萃取物(EA)110 g、正丁醇萃取物(NA)11 g和水相萃取物(WH)18 g。
2.2 乙酸乙酯部位浸膏的分离与鉴定
2.2.1 分离、鉴定方法 选取抗菌及抗氧化活性较强的EA装入硅胶层析柱中,以石油醚-乙酸乙酯(100∶0、95∶5、90∶10、80∶20、70∶30、60∶40、50∶50、30∶70、0∶100)进行梯度洗脱,获得E1~E10共10个流分,其中E1为黄色油状物,E2为淡黄色固体,E3为棕黄色油状物。对其进行GC-MS分析。洗脱部分通过硅胶柱色谱、高效液相色谱等手段,对E4和E5再次进行分离,用石油醚-乙酸乙酯进行洗脱。采用薄层色谱法对所得流分进行合并,由于E6~E10含量过少,难以进行化合物分离,所以本文将不对这5个流分进行进一步分析。通过半制备高效液相色谱仪,从E4中分离出化合物1(4.7 mg)、化合物2(4.5 mg)[条件:甲醇-水(70∶30),流速为3.0 mL/ min];从E5中分离出化合物3(14.5 mg)、化合物4(31.7mg)、化合物5(29.3 mg)和化合物6(18.0 mg)[条件:甲醇-水(85∶15),流速为3.0 mL/min]。脂溶性成分采用GC-MS进行分析,经面积归一法测得各组分的相对含量,并对其成分采用MS、1H-NMR、13C-NMR等进行鉴定。GC条件:石英毛细管柱HP-FFAP(0.25 mm×30 m,0.25µm);程序升温从160开始,以6℃/min升至250℃,保持5 min;载气为He,柱流量为1.0 mL/min;进样口温度为250℃,分流比为50∶1。MS条件:电子轰击离子源,电离电压70 eV,电子源温度230℃,扫描范围10~500 aum,进样量1.0µL。
2.2.2 乙酸乙酯部位脂溶性成分E1~E3的GC-MS分析 从单针藻乙酸乙酯部位共获得3份脂溶性成分E1~E3,经GC-MS分析后显示,E1和E2成分基本相同,主要成分为酯类,其次是烷烃类、硅氧烷类和烯烃类;酯类中主要以十六碳和十八碳脂肪酸为主,适合作生物柴油的原料;硅氧烷类可以用于防火剂和润滑剂等。由于E1与E2在医药方面应用不大,故本文只对E3进行分析。E3分析结果见表1。

表1 单针藻乙酸乙酯部位脂溶性E3成分分析结果Tab 1 Analysis result of fat-soluble component E3 in ethyl acetate extract from M.dybowwskii
由表1结果看出,从E3中共分离鉴定出9种化合物,占总含量的99.78%,其主要成分为烷酸类(97.08%)、酯类(2.28%),还含有少量的胆固醇(0.20%)和豆甾醇(0.22%)。
2.2.3 E4~E5分离出的化合物鉴定 对E4~E5分离出的6个化合物通过MS、NMR等方法鉴定其结构,结果分别为豆甾醇(化合物1,4.7 mg)、邻苯二甲酸二丙酯(化合物2,4.5 mg)、3-吲哚甲酸(化合物3,14.5 mg)、黑麦草素(化合物4,31.7 mg)、黑麦草内酯(化合物5,29.3 mg)和5-羟基-3,4-二甲基-5-戊基-2(5H)-呋喃酮(化合物6,18.0 mg)。
化合物1:白色针状结晶,易溶于甲醇;EI-MS:412.4(M+),351.3,300.2,255.2,207.0,133.1,97.1,55.2;1HNMR(C6D6,600 MHz)δ:5.45(1H,m,H-6),5.31(1H,dd,J=16.14,7.03 Hz,H-22),5.15(1H,dd,J=15.75,5.87 Hz,H-23),3.55(1H,m,H-3),1.25,1.15,1.12,1.03,1.01,0.96(6个CH3)。化合物1的数据与文献[3]报道一致,故鉴定化合物1为豆甾醇。
化合物2:无色油状物,易溶于甲醇;1H-NMR(CDCl3,600 MHz)δ:7.72(2H,dd,J=8.7,3.0 Hz,H-2,H-5),7.53(2H,m,H-3,H-4),4.30(2H,m,H-1′,H-1″),1.72(4H,s,H-2′,H-2″),0.97(6H,s,H-3′,H-3″);13C-NMR(CDCl3,150 MHz)δ:167.9(C-7,C-8),132.5(C-1,C-6),131.1(C-2,C-5),129.1(C-3,C-4),65.7(C-1′,1″),29.9(C-2′,C-2″),13.9(C-3′,C-3″)。化合物2的数据与文献[4]报道一致,故鉴定化合物2为邻苯二甲酸二丙酯。
化合物3:白色粉末,易溶于甲醇;1H-NMR(DMSO-d6,800 MHz)δH:10.92(1H,s,3-COOH),8.47(1H,brs,NH),7.60(1H,d,J=7.7 Hz,H-4),7.33(1H,d,J=8.0 Hz,H-7),7.17(1H,s,H-2),7.06(1H,t,J=7.4 Hz,H-5),6.98(1H,t,J=7.3 Hz,H-6);13C-NMR(DMSO-d6,200 MHz)δC:167.5(s,3-COOH),136.1(s,C-7a),127.1(s,C-3a),124.0(d,C-2),121.0(d,C-6),118.5(d,C-5),118.3(d,C-4),111.4(d,C-7),109.2(s,C-3)。化合物3的数据与文献[5]报道一致,故鉴定化合物3为3-吲哚甲酸。
化合物4:白色粉末,易溶于甲醇;1H-NMR(CD3OD,800 MHz)δH:5.77(1H,s,H-3),4.09(1H,m,H-6),2.46(1H,ddd,J=11.7,3.9,2.2 Hz,H-7a),2.00(1H,ddd,J=13.0,4.2,2.2 Hz,H-5a),1.58(3H,s,H-8),1.41(1H,t,J=11.7 Hz,H-7b),1.30(3H,s,H-9),1.28(3H,s,H-10),1.28(1H,overlap,H-5b);13C-NMR(CD3OD-d6,200 MHz)δC:184.5(s,C-3a),174.5(s,C-2),114.2(d,C-3),89.1(s,C-7a),65.7(d,C-6),51.2(t,C-5),49.8(t,C-7),36.6(s,C-4),30.8(q,C-8),26.3(q,C-9),25.8(q,C-10)。化合物4的数据与文献[6]报道一致,故鉴定化合物4为黑麦草素。
化合物5:白色粉末,易溶于甲醇;1H-NMR(CD3OD,800 MHz)δH:5.75(1H,s,H-3),4.22(1H,m,H-6),2.43(1H,dt,J=13.8,2.6 Hz,H-5a),2.00(1H,dt,J=14.3,2.6 Hz,H-7a),1.76(3H,s,H-10),1.75(1H,dd,J=13.8,3.9 Hz,H-5b),1.53(1H,dd,J=14.3,3.6 Hz,H-7b),1.46(3H,s,H-8),1.27(3H,s,H-9);13C-NMR(CD3OD-d6,200 MHz)δC:186.3(s,C-3a),175.0(s,C-2),113.8(d,C-3),89.5(s,C-7a),67.7(d,C-6),48.4(t,C-5),46.9(t,C-7),37.7(s,C-4),31.5(q,C-8),27.9(q,C-9),27.5(q,C-10)。化合物5的数据与文献[6]报道一致,故鉴定化合物5为黑麦草内酯。
化合物6:白色粉末,易溶于甲醇;1H-NMR(CD3OD,800 MHz)δH:1.92(3H,d,J=1.0 Hz,H-11),1.78(3H,d,J=8.4 Hz,H-12),1.84(2H,m,H-6),1.29(4H,overlap,H-8/9),1.18(2H,m,H-7),0.88(3H,t,J=7.2 Hz,H-10);13C-NMR(CD3OD-d6,200 MHz)δC:175.1(s,C-2),160.9(s,C-4),126.2(s,C-3),109.7(s,C-5),37.4(t,C-6),33.2(t,C-7),24.3(t,C-8),24.0(t,C-9),14.8(q,C-10),11.3(q,C-11),8.7(q,C-12)。化合物6的数据与文献[7]报道一致,故鉴定化合物6为5-羟基-3,4-二甲基-5-戊基-2(5H)-呋喃酮。
2.3 体外抗菌、抗氧化活性测定
2.3.1 测定方法 以头孢他啶为阳性对照,根据文献[8]的方法,采用刃天青法对4种含量较高的化合物(化合物3、4、5、6)进行抗菌(铜绿假单胞菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌)活性测定,计算最低抑菌浓度(MIC)。将样品稀释成500、250、175、100、50、25、10、5、1µg/mL,并连同刃天青溶液加入至96孔板中培养的菌液中进行试验。
以BHT、VC为阳性对照,根据文献[9]的方法,采用DPPH法测定自由基清除率,将样品稀释成200、150、100、75、50、20、10、2µg/mL系列质量浓度,并根据公式:清除率(%)=(A0-A样品)/A0×100%(A0为空白对照吸光度,A样品为样品的吸光度),计算化合物3、4、5、6对自由基的清除率、半数清除浓度(IC50);参照文献[10]的方法,采用亚铁还原能力法[以FRAP(Ferric reducing antioxidant potential assay)值计]测定总还原能力,化合物3、4、5、6用甲醇溶解并制备成1 mg/mL,按下式计算总还原能力:A=0.001 46T+0.119 42(R2=0.993 55)(A为吸光度,T为FRAP值)。
2.3.2 4种化合物的体外抗菌活性测定结果 各样品对4株菌的MIC结果见表2。
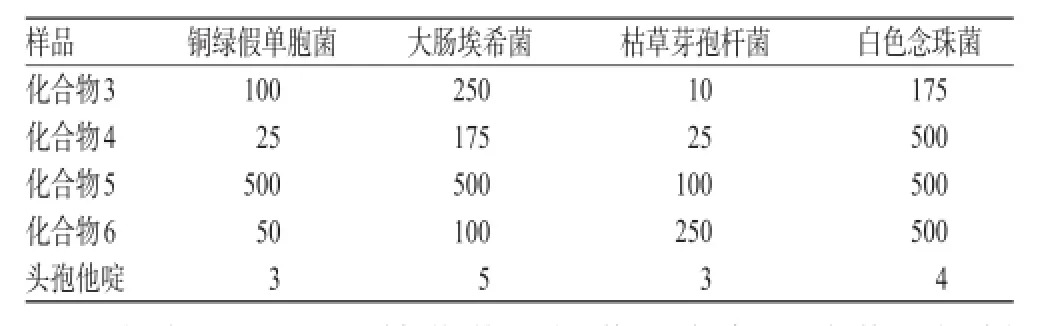
表2 各样品对4株菌的MIC结果(µg/mL)Tab 2 MIC of samples on 4 strains(µg/mL)
由表2可见,对枯草芽孢杆菌和白色念球菌的抑制作用以化合物3最强,MIC分别为10µg/mL和175µg/mL;对铜绿假单胞菌的抑制作用以化合物4最强,MIC为25 µg/mL;对大肠埃希菌的抑制作用以化合物6最强,MIC为100µg/mL。
2.3.3 4种化合物的体外抗氧化活性测定结果 (1)自由基清除率。各样品的DPPH清除率、IC50测定结果见表3。
由表3可见,各样品对DPPH自由基清除能力的强弱以IC50判断从大到小为VC>BHT>化合物3>化合物5>化合物4>化合物6。其中化合物3的IC50在4种化合物中最低,表明其对DPPH自由基的清除能力最强;化合物3和5次之,化合物6对DPPH自由基的清除能力最弱。

表3 各样品的DPPH清除率、IC50、FRAP值Tab 3 DPPH clearance rate,IC50and FRAPof sample
(2)总还原能力。各样品的FRAP值测定结果见表3。
由表3可见,阳性对照VC和BHT均具有很强的还原能力,4种化合物也均表现出一定的还原能力;4种化合物中以化合物3的还原能力最强,化合物6的还原能力最弱,二者FRAP值分别为(281.22±8.3)、(62.04± 5.36)µmol/L。6种样品的FRAP值从高到低排序为VC>BHT>化合物3>化合物5>化合物4>化合物6。
3 讨论
通过对单针藻的化学成分进行分析,表明单针藻富含多种脂类、烷酸类物质,且具有较强的体外抗菌和抗氧化活性,提示单针藻可作为天然抗菌抗氧化剂的来源,并将在医药领域具有广阔的研究前景。
[1] 罗宁,刘平怀,陈晨,等.单针藻营养成分分析[J].粮食与饲料工业,2015,11(11):51-54.
[2] 张玲,刘平怀,吴娇娜,等.小球藻化学成分的研究[J].中国中药杂志,2015,40(7):1325-1329.
[3] 甘秀梅,梁志远,姜金仲.冷小花抗菌活性成分研究[J].中国药学杂志,2014,49(23):2069-2072.
[4] Li X,Yao YH,Zheng YN.Chemical constituents of mangrove plant Excoecaria agallocha[J].Chinese Journal of Natural Medicines,2006,114(13):188-189.
[5] 梁炜薇,王大成,程鸿,等.人参内生球毛壳菌株RSQMK-9的化学成分研究[J].天然产物研究与开发,2014,26(8):1202-1206.
[6] 马勤阁.调料九里香的化学成分研究[D].北京:北京协和医学院,2013.
[7] 苏丽丽,唐旭利,张婧,等.中国南海海底柏柳珊瑚化学成分研究[J].中国海洋药物,2011,30(5):18-22.
[8] 许琼情.广南天料木茎化学成分及生物活性研究[D].海口:海南大学,2012.
[9] 陈德力,肖曼,刘平怀.海南核果木抗氧化活性[J].精细化工,2011,28(11):1103-1106.
[10] 杨再波,谌连桃,吴应红,等.密蒙花花蕾不同提取部位的抗氧化活性研究[J].中国药房,2016,27(1):32-34.
Study on Chemical Compounds and in vitro Antibacterial and Antioxidant Activities of Monoraphidium dybowskii
ZHAO Zhenyu,LUO Ning,CHEN Chen,LI Ang,MA Shasha,LIU Jiguang,WANG Meng,LIU Pinghuai(College of Materials and Chemical Engineering,Hainan University/Key Laboratory of Protection and Development Utilization of Tropical Crop Germplasm Resources,Ministry of Education,Haikou 570228,China)
OBJECTIVE:To study chemical compounds ofMonoraphidium dybowskii,and to investigate thein vitroantibacterial and antioxidant activities of isolated compounds.METHODS:The ethanol extract ofM.dybowskiiwere extracted with aether petrolei,ethyl acetate and n-butyl alcohol.The ethyl acetate extract was separated fromM.dybowskiiand chemical components were analyzed by sillica gel column chromatogram,HPLC and GC-MS.Their structures were identified according to physicochemical properties and NMR.MIC of 4 isolated compounds toPseudomonas aeruginosa,Candida albicans,Bacillus subtilisandEscherichia coliwere determined by resazurin disc test.Free radical scavenging rate(concluated by IC50)and reducing capacity were measured by 1,1-diphenyl-2-picryl-diazanyl(DPPH)and ferric reducing antioxidant power(FRAP)assay.RESULTS:Compounds 1-6 were obtained from E4 and E5 segments of ethyl acetate extract ofM.dybowskii,and their structures were identified as stigmasterol,diisonoyladipate,indole-3-carboxylic acid,(+)-epiloliolide,(-)-loliolide,5-hydroxy-3,4-dimethy-5-pentyl-2(5H)-furanone. MIC of compounds 3-6 were 10-500µg/mL,and IC50ranged 22.02-71.01µg/mL;FRAP ranged(62.04±5.36)-(281.22±8.3)µmol/L.CONCLUSIONS:M.dybowskiicontains multiple lipid and alkanoic acid,and possesses certainin vitroantibacterial and antioxidant activities.
Monoraphidium dybowskii;Ethyl acetate;Extract;Chemical components;Identification;Antibacterial;Antioxidant
R284.2
A
1001-0408(2017)04-0465-04
2016-06-18
2016-07-16)
(编辑:刘萍)
国家科技支撑计划项目(No.2011BAD14B01);国家科技型中小企业技术创新基金项目(No.13C26244604892);海南省中药现代化科技专项(No.ZY201327);海南省产学研一体化项目(No. CXY20150034)
*硕士研究生。研究方向:天然产物化学、天然药物、微藻资源开发与利用。电话:0898-66291892。E-mail:1006905863@qq.com
#通信作者:教授,研究员,硕士。研究方向:天然产物化学、天然药物、微藻资源开发与利用。电话:0898-66291892。E-mail:pinghuailiu@aliyun.com
DOI10.6039/j.issn.1001-0408.2017.04.09

