右美托咪定预处理对异丙酚诱导发育期大鼠离体海马神经细胞损伤的影响
杨剑,刘婷婷,熊兴龙,严莉,刘婉玲
(1贵州医科大学附属医院,贵阳550004;2贵州医科大学附属白云医院)
·基础研究·
右美托咪定预处理对异丙酚诱导发育期大鼠离体海马神经细胞损伤的影响
杨剑1,刘婷婷1,熊兴龙1,严莉2,刘婉玲1
(1贵州医科大学附属医院,贵阳550004;2贵州医科大学附属白云医院)
目的观察右美托咪定预处理对异丙酚诱导的发育期大鼠离体海马神经细胞损伤的影响。方法体外培养新生SD大鼠海马神经细胞,按随机数字表法分为对照组、异丙酚组、右美托咪定预处理组。对照组正常培养12 h;异丙酚组在培养液中加入12 μg/mL异丙酚孵育12 h;右美托咪定预处理组下设5个浓度组,分别加入0.002 5、0.025、0.25、2.5、25 μg/mL右美托咪定预处理30 min,再加入12 μg/mL异丙酚继续孵育12 h。采用MTT法检测海马神经细胞存活率、HE染色光镜下观察海马神经细胞形态学变化。结果与对照组比较,异丙酚组、右美托咪定预处理组神经细胞存活率均降低(P<0.05或<0.01);与异丙酚组比较,右美托咪定预处理组神经细胞存活率均升高(P<0.05或<0.01),右美托咪定浓度较高组的神经细胞存活率高于右美托咪定浓度较低组(P均<0.05)。对照组神经细胞形态正常;异丙酚组出现明显的神经细胞损伤,细胞体积变小,胞质呈空泡样改变,胞核固缩深染;右美托咪定预处理组神经细胞损伤程度较异丙酚组减轻,随右美托咪定浓度的增高,神经细胞损伤程度逐渐减轻,其中2.5、25 μg/mL右美托咪定预处理的海马神经细胞更接近于正常细胞,受损细胞数目明显减少。结论0.002 5~25 μg/mL的右美托咪定预处理可减轻异丙酚诱导的发育期大鼠离体海马神经细胞损伤。
右美托咪定;预处理;异丙酚;发育期神经系统;神经细胞损伤;大鼠
婴幼儿时期全身各系统尤其是大脑处于快速发育、成熟的阶段。全身麻醉药对婴幼儿发育期神经系统的影响一直广受关注。研究表明,异丙酚可导致未成年大鼠脑神经系统受损,使发育期神经系统出现神经细胞退行性改变,并且其影响可持续至成年[1]。右美托咪定为α2肾上腺素能受体激动剂,具有镇静、镇痛等作用。近年研究发现,右美托咪定具有器官保护及脑神经保护作用[2],可减轻七氟烷等吸入麻醉药诱导的发育期大鼠神经毒性[3,4]。关于右美托咪定对异丙酚诱导的发育期大鼠离体海马神经细胞损伤的影响少见报道。2014年3月~2015年3月,我们通过体外培养大鼠海马神经细胞,给予不同浓度的右美托咪定预处理,观察其能否减轻异丙酚引起的发育期大鼠离体海马神经细胞损伤,为临床小儿麻醉合理用药提供实验依据。
1 材料与方法
1.1 材料 健康7日龄SD大鼠140只,体质量12~16 g,雌雄不限,由贵州医科大学实验动物中心提供。DMED/F12培养基500 mL(GIB-CO公司),胎牛血清(贵州鼎国生物科技有限责任公司),胰蛋白酶(Worthington公司,美国);异丙酚中/长链脂肪乳注射液(Fresenius Kabi公司,德国),盐酸右旋美托咪定(江苏恒瑞药业有限公司),MTT(上海谱振生物科技有限公司)。
1.2 海马神经细胞的分离与培养 大鼠断颈处死,置冰盘上,在解剖显微镜下分离脑组织,于视交叉后1~2 mm沿冠状面取海马组织标本,置于预冷的PBS液中并清洗。用剪刀剪碎脑组织,加入0.125%胰酶消化2 min,加入含10%胎牛血清的DMED/F12培养基终止胰酶反应。200目滤网过滤、离心,加入新鲜培养基吹匀制成单细胞悬液。胎盘蓝染色进行细胞计数,将海马神经细胞按照2×105~3×105/mL接种于6孔板、96孔板及50 mL培养瓶中。37 ℃、5% CO2培养箱内培养。48 h后全量换液,以后每2天全量换液1次,相差显微镜定期观察神经细胞的生长情况。
1.3 海马神经细胞的鉴定 采用神经元特异性烯醇化酶(NSE)免疫荧光染色法。细胞培养至第7天,弃去培养基,用温育的PBS液冲洗细胞2次,4%多聚甲醛室温条件下固定15 min。PBS冲洗,在4 ℃条件下用0.1% Triton-X-100透膜15 min。PBS冲洗,4% BSA室温封闭30 min。用稀释后的NSE一抗(1∶100)在4 ℃冰箱中孵育过夜,PBS冲洗,37 ℃条件下加入二抗(1∶100)孵育1 h。最后用PBS冲洗3次,DAPI染细胞核并用荧光显微镜拍照。海马神经细胞胞质染色呈绿色,细胞核呈蓝色,细胞形态呈树突状生长。
1.4 细胞分组与处理 将体外原代培养的海马神经细胞随机分为对照组、异丙酚组、右美托咪定预处理组。对照组正常培养;异丙酚组培养至第7天时,加入12 μg/mL异丙酚继续孵育12 h;右美托咪定预处理组下设5个浓度组,分别加入0.002 5、0.025、0.25、2.5、25 μg/mL右美托咪定预处理30 min后,再加入12 μg/mL异丙酚继续孵育12 h。每组设6个复孔。
1.5 海马神经细胞存活率检测 采用MTT法。取各组细胞加入MTT 20 μL/孔,置于CO2培养箱中孵育4 h,弃上清,加入DMSO 150 μL/孔,置于酶标仪上,在490 nm波长下检测各孔的吸光度OD值。
1.6 海马神经细胞形态学观察 采用HE染色法。超净台中操作,取6孔培养板,用移液器在每孔内滴加一滴PBS液,将盖玻片放入,再用移液器将制备好的细胞悬液滴在盖玻片上,于上述培养箱内培养,让生长的细胞自然附着贴壁于玻片,制成细胞爬片。取盖玻片(细胞面朝上),苏木精染色4 min,蒸馏水漂洗,1%盐酸乙醇分色数秒立刻水洗,碳酸锂返蓝;0.5%伊红染色,蒸馏水漂洗,95%乙醇脱水,二甲苯透明,中性树胶封片固定。光学显微镜下观察细胞形态学特点。
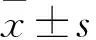
2 结果
2.1 各组海马神经细胞存活率比较 对照组、异丙酚组的神经细胞存活率分别为92.93%±0.12%、24.37%±0.07%,右美托咪定预处理组加入0.002 5、0.025、0.25、2.5、25 μg/mL右美托咪定预处理后的神经细胞存活率分别为39.95%±0.11%、52.04%±0.14%、57.18%±0.34%、61.70%±0.25%、74.93%±0.12%。与对照组比较,异丙酚组、右美托咪定预处理组神经细胞存活率均降低(P<0.05或<0.01)。与异丙酚组比较,右美托咪定预处理组神经细胞存活率均升高(P<0.05或<0.01)。右美托咪定浓度较高组的神经细胞存活率高于浓度较低组(P均<0.05)。
2.2 各组海马神经细胞形态学变化比较 对照组细胞形态基本正常,胞体饱满较大,轴突清晰,胞质均匀,折光性强有明显的立体感,大多数细胞呈锥形体、双极、三角形或不规则形,多极突起交织成网状并形成神经细胞网络支撑物。异丙酚组出现明显的神经细胞损伤,细胞体积变小、胞质不均匀,空泡样改变,胞核固缩深染,细胞间网络结构被破坏。右美托咪定预处理组加入0.002 5、0.025、0.25 μg/mL右美托咪定预处理后,细胞损伤程度减轻,固缩深染的细胞核数量减少,2.5、25 μg/mL右美托咪定预处理后的神经细胞更接近于正常细胞,轴突较清晰,体积变小的细胞及固缩深染的细胞核数目明显减少。
3 讨论
异丙酚是临床小儿全身麻醉中常用的静脉麻醉药。异丙酚的主要效应靶点为GABA受体,通过激动GABA受体降低兴奋性突触传递而产生全麻作用。Jin等[5]报道,在脑发育高峰期,过度激动的GABA受体可导致神经细胞凋亡,并引起远期学习记忆缺陷。我们的前期研究[6]证实,12 μg/mL异丙酚作用24 h可引起发育期大鼠离体海马神经细胞显著凋亡;另有研究[7,8]证实,异丙酚可对发育期大鼠神经细胞产生损害作用,作用于不同神经通路导致突触可塑性改变,损害其认知及记忆功能。右美托咪定为高选择性激动α2肾上腺素能受体,具有良好的镇静、镇痛效果,目前逐步应用于小儿临床麻醉及ICU镇静中[9]。邑俊华等[10]报道,0.01~100 μmol/L右美托咪定预处理可减轻甚至逆转异丙酚对胎鼠的神经毒性作用。另有研究[3,11]显示,右美托咪定能改善不同全身麻醉药诱导的发育期大鼠神经损害。在大脑皮质损伤过程中,右美托咪定可以抑制神经细胞凋亡[12]。
海马是脑内学习记忆形成、发生的重要结构,其对不良刺激造成的损伤最为敏感。啮齿类动物的大脑发育高峰期出现于出生后7 d[8],此时期脑内神经细胞及突触等神经结构快速发育,同时也是大脑最易受损的时期。因此本研究选择7日龄的发育期大鼠作为研究对象,将其海马神经细胞离体培养至第7天(生长状态最活跃),然后进行药物处理。结果显示,异丙酚组神经细胞存活率明显降低,光镜下可见海马神经细胞损伤明显;而加入0.002 5、0.025、0.25、2.5、25 μg/mL右美托咪定预处理后再加入异丙酚,海马神经细胞存活率升高,海马神经细胞损伤程度减轻。提示右美托咪定预处理能够减轻异丙酚诱导的发育期大鼠离体海马神经细胞损伤,且浓度较高组的效果更佳。葛东健等[13]报道,右美托咪定可减轻利多卡因诱发大鼠大脑皮层神经细胞凋亡,本研究结果与其相符。
综上所述,在0.002 5~25 μg/mL范围内,右美托咪定预处理能够减轻异丙酚对发育期大鼠离体海马神经细胞的损伤作用。本研究目前仅限于离体海马神经细胞体外培养,后续我们将通过动物模型实验,进一步研究右美托咪定对异丙酚诱导的发育期大鼠远期学习记忆障碍的影响。
[1] Yu D, Jiang Y, Gao J, et al.Repeated exposure to propofol potentiates neuroapoptosis and long-term behavioral deficits in neonatal rats[J]. Neuroscience Letters, 2013,534(8):41-46.
[2] 兰琛.右美托咪定对大鼠脑缺血再灌注后神经细胞凋亡的影响[J].山东医药,2016,56(22):39-40.
[3] Liao Z, Cao D, Han X, et al. Both JNK and P38 MAPK pathways participate in the protection by dexmedetomidine against isoflurane-induced neuroapoptosis in the hippocampus of neonatal rats[J]. Brain Res Bull, 2014,107(8):69-78.
[4] Wang WY, Wang H, Luo Y, et al. The effects of metabotropic glutamate receptor 7 allosteric agonist N,N′-dibenzhydrylethane-1, 2-diamine dihydrochloride on developmental sevoflurane neurotoxicity: role of extracellular signal-regulated kinase 1 and 2 mitogen-activated protein kinase signaling pathway[J]. Neuroscience, 2012,205(3):167-177.
[5] Jin HL, Zhang J, Wei L, et al. Neurodevelopmental implications of the general anesthesia in neonate and infants[J]. Experimental Neurology, 2015,272(10):50-60.
[6] 杨剑,严莉,高鸿,等.不同浓度异丙酚对新生大鼠离体海马神经元凋亡的影响[J].中华麻醉学杂志,2012,32(11):1350-1352.
[7] Pearn ML, Hu Y, Niesman IR, et al. Propofol neurotoxicity is mediated by p75 neurotrophin receptor activation[J]. Anesthesiology, 2012,116(2):352-361.
[8] 贺丹,陶虓嫣,廖淳杰,等.异丙酚麻醉对新生大鼠海马PKA-CREB信号通路的影响[J].中华麻醉学杂志,2013,33(10):1198-1201.
[9] 赵燕,高巨,林舜艳,等.右美托咪定术前滴鼻对全麻患儿术后行为改变的影响[J].临床麻醉学杂志,2016,32(3):222-225.
[10] 邑俊华,梁羽冰,覃怡,等.右美托咪定预处理对异丙酚孵育的大鼠海马神经元细胞活力的影响[J].临床麻醉学杂志,2013,29(5):488-490.
[11] Duan X, Li Y, Zhou C, Huang L, et al. Dexmedetomidine provides neuroprotection: impact on ketamine-induced neuroapoptosis in the developing rat brain[J]. Acta Anaesthesiol Scand, 2014,58(9):1121-1126.
[12] Rodríguez-González R, Sobrino T, Veiga S, et al. Neuroprotective effects of dexmedetomidine conditioning strategies: Evidences from an in vitro model of cerebral ischemia[J]. Life Sciences, 2016,144(1):162-169.
[13] 葛东健,祁宾,李金玉,等.右美托咪定对利多卡因诱发大鼠皮层神经元凋亡的影响[J].中华麻醉学杂志,2013,33(9):1079-1081.
10.3969/j.issn.1002-266X.2017.42.008
R741
A
1002-266X(2017)42-0029-03
贵州省科技计划课题(黔科合LH字2014-7119)。
2017-03-17)

