乌头碱A环中间体的合成
王志秀, 夏栋梁, 宋 颢
(四川大学 华西药学院,四川 成都 610041)
·快递论文·
乌头碱A环中间体的合成
王志秀, 夏栋梁, 宋 颢*
(四川大学 华西药学院,四川 成都 610041)
以(R)-(-)-香芹酮为原料,经环氧异构开环反应、[3+2]环加成反应和Kemp消除反应等关键步骤,共9步反应合成了乌头碱A环中间体(1R,2R,4R,6S)-2-苯甲氧基-6-羟基-1-羟甲基-4-丙烯基环己烷腈,总收率25.7%;其结构经1H NMR,13C NMR, IR, MS(ESI)确证。
(R)-(-)-香芹酮; 乌头碱; A环中间体; 环氧异构化; [3+2]环加成; Kemp消除; 合成
乌头属植物,在我国药用历史悠久,具有祛风除湿、温经止痛等药用价值。乌头碱(aconitine, Chart 1)作为首个被发现的乌头属生物碱,早在1833年就被Geiger小组[1]从欧乌头(aconitum napellus L)中分离得到,但直到1959年才通过大量的化学降解和单晶X-衍射确定其结构。结构分析表明,乌头碱属于C19-二萜生物碱,具有高度复杂的六环笼状结构,包括一个氮杂双环[3.3.1]壬烷环系,一个反式稠合的七元环在内的两个双环[3.2.1]辛烷体系,包括4个季碳在内的14个连续手性中心和9个含氧官能基,是二萜生物碱中结构最为复杂、氧化程度最高、含氧取代最多的天然产物,化学合成极具挑战性。虽然乌头碱被首次分离至今已近200年,许多课题组在C19-二萜生物碱[2-3]骨架合成方面累积了大量经验,但至今仍然没有一例全合成报道。在骨架合成方面,也仅Bois小组[4]和Kazuyuki小组[5]分别在2007年和2016年报道了乌头碱B/C/D环和C/D环骨架的合成。
本文以 (R)-(-)-香芹酮为原料,经环氧重排开环[6],[3+2]环加成反应[7],Kemp消除反应[8-10]等关键步骤,共9步反应完成乌头碱A环中间体(1R,2R,4R,6S)-2-苯甲氧基-6-羟基-1-羟甲基-4-丙烯基环己烷腈的合成(8, Scheme 1),总收率25.7%,其结构经1H NMR,13C NMR, IR和MS(ESI)确证。该化合物与乌头碱A环的所有官能团具有相同的构型,为乌头碱的全合成研究奠定了一定的基础。

Chart 1

Scheme 1
1 实验部分
1.1 仪器与试剂
X4型数字显微熔点仪;Autopol VI Automativ型旋光检测仪(CDCl3为溶剂);Varian Unit INOVA 400型和600型高分辨超导核磁共振仪(CDCl3为溶剂,TMS为内标);Perkin-Elmerft型红外光谱仪(KBr压片);Agilent 1260 infinity型液相-质谱联用仪。
(1S,2R,4S,6S)-1-甲基-4-丙烯基-7-氧杂二环[4.1.0]庚烷-2-醇(1)按文献[12]方法合成;对甲氧基苄基羟胺按文献[11]方法合成;其余所用试剂均为分析纯或化学纯,溶剂经常规干燥处理。
1.2 合成
(1) (1S,2R,4S,6S)-2-苯甲氧基-1-甲基-4-丙烯基-7-氧杂二环[4.1.0]庚烷 (2)的合成

(2) (1S,3R,5R)-3-苯甲氧基-2-亚甲基-5-丙烯基环己烷-1-醇(3)的合成

(3) (1S,3R,5S)-3-苯甲氧基-2-亚甲基-5-丙烯基环己基-2-硝酸酯基乙酸酯(4)的合成

(4) (3aS,5aS,7S,9R,9aS)-9-苯甲氧基-3-(4-甲氧基苯甲基)-7-丙烯基环己基-1H,4H,7H苯并呋喃[3,3a-c]异恶唑-4-酮(6)的合成

(5) (5aS,7S,9R,9aS)-9-苯甲氧基-7-丙烯基-5a,6,8,9-四氢-1H,4H,7H-苯并呋喃[3,3a-c]异恶唑-4-酮(7)的合成

(6) 8的合成

2 结果与讨论
以(R)-(-)-香芹酮为起始原料,参考文献[12]方法合成1, 1中羟基经苄醚保护得2,利用2,2,6,6-四甲基哌啶锂和二乙基氯化铝形成的复合试剂的N-Al核心对环氧的亲和力[6],环氧发生高区域选择性异构化反应,得烯丙醇化合物3; 3经三步反应得硝酸酯4; 4在NaOAc作用下消除硝酸酯形成乙醛酸酯[15-16]中间体,该中间体置换溶剂后与羟胺化合物缩合形成肟的C—N—O 1,3-偶极中间体5; 5升温后迅速和环外双键发生立体专一性[3+2]环加成反应[7],进而成功构建乌头碱A环骨架的C4季碳。经DDQ促进的PMB脱保护氧化得到噁唑啉中间体7[17-18];7在LiOH作用下内酯环开环,经高温促进的Kemp消除反应打开噁唑啉环得到二醇氰基中间体8。
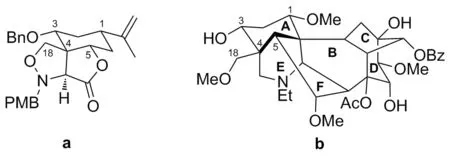
Chart 1
在4的合成中,三步反应均不需纯化,极大地简化了合成方法,节约合成成本。经[3+2]环加成反应完成巧妙构建了难以通过常规方法构建乌头碱A环骨架的C4季碳中心(a, Chart 1),经X-衍射单晶实验(图1),确证关键中间体6的构型为1R, 3R, 4R, 5S,与乌头碱A环所有官能团具有相同的构型(b, Chart 1),从而为骨架A片段的简洁合成提供了保障;所合成中间体8作为乌头碱A环的母核,既可直接修饰其C1,C3,C4,C18和C19,其C5和C11也可进一步官能团化。

图1 6的X-衍射单晶图
以(R)-(-)-香芹酮为原料,经9步反应合成了乌头碱A中间体(1R,2R,4R,6S)-2-苯甲氧基-6-羟基-1-羟甲基-4-丙烯基环己烷腈(8)。8与乌头碱A环的所有官能团具有相同的构型。为乌头碱的全合成研究奠定了基础。
[1] Wiesner K, Götz M, Simmons D L. The structure of aconitine[J].Tetrahedron Lett,1959,1(2):15-24.
[2] Wang F P, Chen Q H, Liu X Y. Diterpenoid alkaloids[J].Nat Prod Rep,2010,27(4):529-570.
[3] Wang F P, Chen D L, Deng H Y,etal. Futher revisions on the diterpenoid alkaloids reported in a JNP paper[J].Tetrahedron,2014,70(15):2582-2590.
[4] Rosemary M C, Bois J D. C—H amination in synthesis:An approach to assembly of the B/C/D ring system of Aconitine[J].Org Lett,2007,9(26):5465-5468.
[5] Akinobu M, Akihiko K, Kazuyuki S. Reductive cyclization strategy for construction of the highly oxygenated CD ring system of aconitine[J].Tetrahedron Lett,2016,57(41):4585-4587.
[6] Arata Y. Shin T. Koichiro O,etal. Organoalumnium reagent of type R1R2NAlEt2which allow regiospecific isomerization of eposides to allylic alcohols[J].J Am Chem Soc,1974,96(20):6513-6514.
[7] David M T, Tschaen R W, Steven M W. Regiochemical control by nonbonded interactions in a intramolecular nitrone cycloaddition[J].J Org Chem,1986,51(13):2604-2605.
[8] Takahisa O, Rika O, Shigeru N. Asymmetric synthesis of aerothionin,a marine dimeric spiroisoxazoline natural product,employing optically active spiroisoxazoline derivative[J].Tetrahedron Lett,2006,47(5):727-731.
[9] Rong H L, Josep C, Henry rapoport. Enantiospecific synthesis of natural (-)-cocaine and unnatural (+)-cocaine from D- and L-glutamic Acid[J].J Org Chem,1998,63(12):4069-4078.
[10] Paolo Q, Bruna B, Achille P,etal. Conversion of a nitrosocarbonyl hetero Diels-Alder cycloadduct to useful isoxazoline-carbocyclic aminols[J].Tetrahedron,2009,65(51):10679-10684.
[11] Pan L, Chun R W, Jing J Z,etal. One-pot synthesis of dihydrobenzisoxazoles from hydroxylamines, acetylenedicarboxylates, and arynesviain situ generation of nitrones[J].Can J Chem,2013,91(1):43-50.
[12] Yan C. Tong J. Enantioselective synthesis of a key A-ring Intermediate for the preparation of 1α,25- dihydroxyvitamin D3[J].Org Lett,2011,13(1):86-89.
[13] 殷宪龙,段文贵,林桂汕,等. 新型α-龙脑烯醛基噻二唑-磷酸酯化合物的合成及其抑菌活性[J].合成化学,2016,24(9):745-751.
[14] 苏进财,翁智兵,周国春. STAT3抑制剂(HO-3867)的合成工艺改进[J].合成化学,2016,24(2):155-159.
[15] Nathan K, Harry W F. A new and convenient synthesis of glyoxals,glyoxalate esters andα-diketones[J].J Am Chem Soc,1966,88(4):865-866.
[16] Barry B S, Tao L. Total synthesis of (±)-deoxypenostatin A. approaches to the syntheses of penostatins A and B[J].J Org Chem,2000,65(25):8490-8498.
[17] Paola C, Gabriella R, Federico F,etal. An improved synthesis of enatiomerically pure CIP-AS, a potent and selective AMPA-kainate receptor agonist[J].Tetrahedron,2001,12(9):1363-1367.
[18] Pan L, Hung J G, Li H S,etal. Oxidative conversion of isoxazolidines to isoxazolines[J].J Org Chem,1998,63(2):366-369.
Synthesis of Intermediate for Ring-A of Aconitine
WANG Zhi-xiu, XIA Dong-liang, SONG Hao*
(West China School of Pharmacy, Sichuan University, Chengdu 610041, China)
The intermediate of ring-A of aconitine,(1R,2R,4R,6S)-2-(benzyloxy)-6-hydroxy-1-(hydroxymethyl)-4-(prop-1-en-2-yl)-cyclohexanecarbonitrile, was synthesized by nine steps reaction from (R)-(-)-carvone, using epoxide isomerised opening, [3+2]-cycloaddition and Kemp elimination as key transformations. The structure was confirmed by1H NMR,13C NMR, IR, and MS(ESI).
(R)-(-)-carvone; aconitine; ring-A intermediate; epoxide isomerization; [3+2]-cycloaddition; Kemp elimination; synthesis
2016-10-08;
2017-01-12
国家自然科学基金资助项目(21572140)
王志秀(1992-),女,汉族,湖北石首人,硕士研究生,主要从事药物合成的研究。 E-mail: vivianwangzhixiu@163.com
宋颢,副教授,硕士生导师, E-mail: haoright@163.com
O625.67
A
10.15952/j.cnki.cjsc.1005-1511.2017.03.16251

