猪油与植物黄油对大鼠不同部位脂肪组织单核细胞趋化蛋白-1表达水平的影响
王楠楠,刘福定,白英龙*,贾丽红,翟玲玲,魏 薇
·论著·
猪油与植物黄油对大鼠不同部位脂肪组织单核细胞趋化蛋白-1表达水平的影响
王楠楠1,刘福定2,白英龙1*,贾丽红1,翟玲玲1,魏 薇1
目的 探究猪油与植物黄油饮食对不同部位脂肪组织单核细胞趋化蛋白-1(MCP-1)表达水平的影响。方法 2015年4—6月,选取健康的初断乳SPF级、Wistar雄性大鼠49只,随机分为对照组(CON组,n=7)、猪油组(L组,n=21)、植物黄油组(M组,n=21)。CON组大鼠采用基础饲料喂养,L组大鼠采用含猪油的高脂饲料喂养,M组大鼠采用含植物黄油的高脂饲料喂养。3组大鼠均饲养8周,结束时将L组和M组大鼠按体质量增加量的前1/3和后1/3分别分为猪油-肥胖倾向组(L-OP组,n=7)、植物黄油-肥胖倾向组(M-OP组,n=7)和猪油-肥胖抵抗组(L-OR组,n=7)、植物黄油-肥胖抵抗组(M-OR组,n=7),其余弃去。比较5组大鼠体质量增加量、附睾周脂肪系数、肾周脂肪系数及皮下、附睾周、肾周脂肪组织MCP-1表达水平。结果 L-OP组、M-OP组大鼠体质量增加量均大于CON组(P<0.05);L-OP组、M-OP组、M-OR组大鼠附睾周脂肪系数均大于CON组(P<0.05);L-OP组、L-OR组、M-OP组、M-OR组大鼠肾周脂肪系数均大于CON组(P<0.05)。5组大鼠附睾周脂肪组织MCP-1表达水平比较,差异无统计学意义(P0.05);L-OP组、L-OR组、M-OP、M-OR组大鼠皮下脂肪组织MCP-1表达水平均高于CON组(P<0.05);M-OP组、M-OR组大鼠肾周脂肪组织MCP-1表达水平均高于CON组(P<0.05)。结论 与猪油相比,植物黄油更能引起皮下、肾周脂肪组织MCP-1表达水平升高。
猪油;植物黄油;脂肪组织;单核细胞趋化蛋白-1
王楠楠,刘福定,白英龙,等.猪油与植物黄油对大鼠不同部位脂肪组织单核细胞趋化蛋白-1表达水平的影响[J].中国全科医学,2017,20(9):1071-1075.[www.chinagp.net]
WANG N N,LIU F D,BAI Y L,et al. Effect of lard and margarine on the expression of MCP-1 in different adipose tissues of rats[J].Chinese General Practice,2017,20(9):1071-1075.
脂肪组织是体内负责能量储存与代谢的重要器官,近年来发现其还具有强大的内分泌功能[1-3],其分泌的脂肪因子、炎性因子等使肥胖机体表现为慢性低炎症状态。单核细胞趋化蛋白-1(monocyte chemoattractant protein 1,MCP-1)是脂肪组织分泌的主要炎性因子之一,在肥胖发生、发展及相关并发症的病理、生理机制中扮演重要角色[4-6]。饮食是肥胖发生的重要危险因素,脂肪酸的构成也对肥胖的发生、发展起关键作用[7-8]。猪油是我国传统饮食中重要的脂肪来源,而近些年随着西方饮食的影响,植物黄油在人们日常饮食中所占比例也越来越高。在关注高脂饮食对血糖、血脂影响的同时,更应关注其对脂肪组织炎性反应的影响。本研究采用含猪油/植物黄油的高脂饲料喂养实验大鼠,诱导肥胖动物模型,并观察不同部位脂肪组织MCP-1表达水平的差异,旨在探究不同类型高脂膳食对脂肪组织炎性反应的影响。
1 材料与方法
1.1 主要试剂与仪器 Anti-MCP-1抗体(Abcam 公司,美国),GAPDH抗体(Cell Signaling公司,美国),山羊抗兔-HRP抗体(北京鼎国昌盛生物技术有限责任公司,中国),琼脂糖免疫沉淀(Santa Cruz公司,美国),ECL化学发光试剂盒(Millpore公司,美国)等。多功能成像仪(Azure公司,美国),半干式转膜仪(Bio-Rad公司,美国),电泳仪(北京市六一仪器厂,中国)等。
1.2 动物饲养及分组 2015年4—6月,选取健康的初断乳SPF级、Wistar雄性大鼠49只,在温度20~24 ℃、相对湿度40%~70%的环境下适应性喂养1周后,随机分为对照组(CON组,n=7)、猪油组(L组,n=21)、植物黄油组(M组,n=21)。CON组大鼠采用基础饲料喂养,L组大鼠采用含猪油的高脂饲料喂养,M组大鼠采用含植物黄油的高脂饲料喂养。3组大鼠均饲养8周,饲养期间维持12 h/d光照,昼夜循环,自由进食、水。饲养结束后,将L组和M组大鼠按体质量的增加量由高至低排序,体质量增加量位于上游的前1/3大鼠判定为肥胖倾向(obesity prone,OP)大鼠,位于下游的后1/3大鼠判定为肥胖抵抗(obesity resistant,OR)大鼠,位于中游的1/3大鼠弃去[9];各亚组分别记为猪油-肥胖倾向组(L-OP组)、植物黄油-肥胖倾向组(M-OP组)、猪油-肥胖抵抗组(L-OR组)、植物黄油-肥胖抵抗组(M-OR组),每组7只。
本研究价值:
超重与肥胖已成为世界瞩目的重大公共卫生问题,高脂饮食是诱发肥胖的重要原因,脂肪酸类型也对肥胖的发生、发展起重要作用。单核细胞趋化蛋白-1(MCP-1)由脂肪组织分泌,具有促进巨噬细胞的浸润和分化等重要作用,与炎性疾病的关系非常密切,为了解不同类型高脂饲料对脂肪组织MCP-1生成的影响,本研究采用含猪油/植物黄油的高脂饲料诱导肥胖动物模型,观察二者对外周(皮下)和内脏(附睾周、肾周)脂肪组织MCP-1表达水平的影响,结果对临床具有一定的指导意义。
1.3 饲料的配制 基础饲料由中国医科大学实验动物部提供,能量密度为1 500 kJ/100 g,其配方中蛋白质、脂肪、碳水化合物提供的热量分别占总热量的18.9%、20.9%、53.7%。含猪油/植物黄油的高脂饲料自行配制,能量密度为2 010 kJ/100 g,每100 g饲料中分别添加猪油/植物黄油20 g,其中蛋白质、脂肪、碳水化合物提供的热量分别占总热量的16.1%、50.9%、29.2%。
1.4 样本的采集与处理 所有大鼠饲养8周后经乙醚麻醉后处死,剥离全部皮下、附睾周、肾周脂肪并称重;称取皮下、附睾周、肾周脂肪组织100~150 mg于-80 ℃冰箱中冻存,以备后续检测。
1.5 附睾周、肾周脂肪系数计算方法 脂肪系数=〔某部位脂肪质量(g)/体质量(g)〕×100%。
1.6 Western blotting法检测皮下、附睾周、肾周脂肪组织MCP-1表达水平 取冻存组织融化后匀浆,提取组织总蛋白,使用红外微定量分析仪测定皮下、附睾周、肾周脂肪组织总蛋白水平,样品处理具体操作如下:取每个样本总蛋白50 μg,加入Anti-MCP-1抗体2 μl,于4 ℃摇床上孵育1 h,再加入琼脂糖免疫沉淀20 μl,于4 ℃摇床过夜,第2天2 500 r/min离心5 min(离心半径6.85 cm),收集沉淀,采用PBS反复清洗3遍,加入loading buffer,煮沸5 min使蛋白变性;进行聚丙烯酰胺凝胶电泳(12%分离胶和5%浓缩胶),上样体积为每孔50 μg;转膜,封闭液封闭1 h;分别加入Anti-MCP-1抗体(1∶2 000)、GAPDH抗体(1∶2 000)、山羊抗兔-HRP抗体(1∶2 000)孵育,按ECL化学发光试剂盒操作说明进行化学发光检测,分别记录皮下、附睾周、肾周脂肪组织MCP-1表达水平。
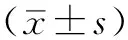
2 结果
2.1 5组大鼠体质量增加量、附睾周脂肪系数、肾周脂肪系数比较 5组大鼠体质量增加量、附睾周脂肪系数、肾周脂肪系数比较,差异有统计学意义(P<0.05);其中L-OP组、M-OP组大鼠体质量增加量均大于CON组,差异有统计学意义(P<0.05);L-OP组、M-OP组、M-OR组大鼠附睾周脂肪系数均大于CON组,差异有统计学意义(P<0.05);L-OP组、L-OR组、M-OP组、M-OR组大鼠肾周脂肪系数均大于CON组,差异有统计学意义(P<0.05,见表1)。
2.2 5组大鼠皮下、附睾周、肾周脂肪组织MCP-1表达水平比较 5组大鼠皮下、肾周脂肪组织MCP-1表达水平比较,差异有统计学意义(P<0.05);5组大鼠附睾周脂肪组织MCP-1表达水平比较,差异无统计学意义(P0.05);其中L-OP组、L-OR组、M-OP组、M-OR组大鼠皮下脂肪组织MCP-1表达水平均高于CON组,差异有统计学意义(P<0.05);M-OP组、M-OR组大鼠肾周脂肪组织MCP-1表达水平均高于CON组,差异有统计学意义(P<0.05,见表2)。
3 讨论
肥胖的发生受多种因素影响,其中高脂饮食是肥胖发生、发展的主要原因[10],而且食物中脂肪酸的类型也对肥胖发生、发展起重要作用[7,11]。脂肪组织作为体内强大的内分泌器官,其可以分泌多种激素、趋化因子、脂肪因子等,其中MCP-1具有激活脂肪组织炎性反应[12]、促进巨噬细胞的浸润和分化等重要作用[13],比其他脂肪因子具有更深远的研究意义。鉴于有研究已证实不同部位脂肪组织的代谢及内分泌功能存在明显差异[14-15],为了解不同类型高脂饲料对脂肪组织MCP-1生成的影响,本研究采用含猪油/植物黄油的高脂饲料诱导肥胖动物模型,观察其对外周(皮下)和内脏(附睾周、肾周)脂肪组织MCP-1表达水平的影响。
5 组大鼠体质量增加量、附睾周脂肪系数、肾周脂肪系数比较( x ± s)
Table 1 Comparison of increasing amount of body weight,epididymal fat coefficients and perinephric fat coefficients of rats among the 5 groups

组别只数体质量增加量(g)附睾周脂肪系数(%)肾周脂肪系数(%)CON组7282±200.57±0.090.51±0.13L-OP组7348±19a0.92±0.16a1.06±0.25aL-OR组7276±210.80±0.260.82±0.12aM-OP组7379±28a1.19±0.38a1.24±0.40aM-OR组7290±281.12±0.15a1.30±0.18aF值27.2366.91911.537P值<0.001<0.001<0.001
注:CON组=对照组,L-OP组=猪油-肥胖倾向组,L-OR组=猪油-肥胖抵抗组,M-OP组=植物黄油-肥胖倾向组,M-OR组=植物黄油-肥胖抵抗组;与CON组比较,aP<0.05
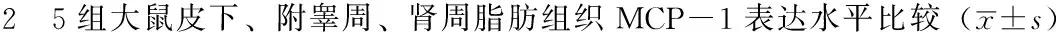
Table 2 Comparison of expression level of MCP-1 in subdermal,epididymal and perinephric adipose tissues of rats among the 5 groups
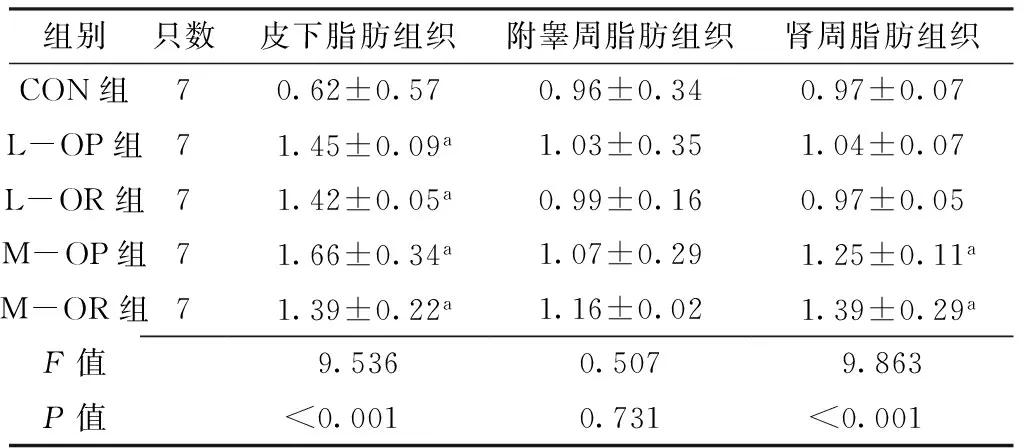
组别只数皮下脂肪组织附睾周脂肪组织肾周脂肪组织CON组70.62±0.570.96±0.340.97±0.07L-OP组71.45±0.09a1.03±0.351.04±0.07L-OR组71.42±0.05a0.99±0.160.97±0.05M-OP组71.66±0.34a1.07±0.291.25±0.11aM-OR组71.39±0.22a1.16±0.021.39±0.29aF值9.5360.5079.863P值<0.0010.731<0.001
注:与CON组比较,aP<0.05
3.1 猪油/植物黄油致肥胖的发生、发展 高脂饲料诱导动物模型是研究肥胖相关发病机制的重要工具,其中体质量增加是诊断肥胖的必要依据。前期研究显示,能量密度相同而脂肪酸类型不同的高脂饲料可以对实验大鼠产生相同的肥胖诱导作用[7]。本研究中含猪油/植物黄油的高脂饲料均可使OP大鼠的体质量增加,这为前期研究[7]补充了新的有利证据。尽管两种高脂饲料喂养的OR大鼠体质量增加量与CON组间无差异,但肾周脂肪系数均高于CON组,提示猪油/植物黄油高脂饮食均可致实验动物体脂肪蓄积,导致肥胖。
3.2 不同部位脂肪组织MCP-1表达水平 MCP-1的主要细胞来源为巨噬细胞和内皮细胞[16],此外脂肪细胞也是MCP-1的重要来源之一[17],其在肥胖发生过程中的作用是当前研究热点。有研究结果显示,高脂饲料可引起实验小鼠附睾周脂肪组织MCP-1表达水平增高[18-19],CRANFORD等[20]将MCP-1缺陷型小鼠饲以高脂饲料喂养,发现小鼠体质量增加更多,糖代谢紊乱加剧,且脂肪组织炎性细胞浸润更明显,据此提出MCP-1是高脂诱导的小鼠肥胖脂肪组织炎性反应中必不可少的成分。
机体内的脂肪组织存在区域差异,其代谢特性差异较大[14-15]。本研究观察到猪油/植物黄油高脂饲料喂养的大鼠皮下脂肪组织MCP-1表达水平高于对照大鼠,提示猪油与植物黄油均可引起皮下脂肪组织炎性反应。本研究结果支持以往人群研究结论,肥胖患者皮下脂肪组织中MCP-1表达水平较正常对照人群明显升高,糖尿病患者皮下脂肪组织中MCP-1表达水平较非糖尿病人群明显升高[21]。由于皮下脂肪在机体分布范围广,推测这也可能是肥胖发生、发展过程中引发2型糖尿病等并发症的原因之一。
本研究采用脂肪提供热量占总热量52%的猪油和植物黄油高脂饲料喂养实验大鼠8周,未见L-OP组、L-OR组、M-OP组、M-OR组附睾周脂肪组织MCP-1表达水平发生明显变化。ENOS等[19]采用脂肪提供热量占总热量40%的高脂饲料喂养实验动物16周,观察到实验组附睾周脂肪组织MCP-1表达水平与对照组相比明显升高,与本研究结果不同,原因在于受试对象、膳食脂肪含量和实验时间不同,其结果提示附睾周脂肪组织MCP-1表达水平受膳食中脂肪含量、喂养时间等因素影响。
肥胖相关肾小球病是一种常见的肥胖并发症,其发生、发展与炎性因子水平上调密切相关[22]。研究表明,高脂饲料可引起肾脏病变模型小鼠肾脏MCP-1表达水平明显升高[23]。本研究中M-OP组、M-OR组大鼠肾周脂肪组织MCP-1表达水平明显升高,提示植物黄油可以造成肾周脂肪组织炎性反应,推测肾周脂肪组织MCP-1表达水平升高对高脂饮食诱导肥胖大鼠的肾脏损害可能也起到一定作用。
本研究结果显示,经8周猪油/植物黄油高脂饲料喂养大鼠,尽管未能引起OR大鼠体质量明显增加,但Western blotting结果显示,L-OR组、M-OR组大鼠皮下脂肪组织和M-OR组肾周脂肪组织MCP-1表达水平较CON组均明显升高,提示现实生活中除肥胖患者外,还应多关注OR群体,虽然该群体外在体质量并未发生显著改变,但其体内特定部位可能已经存在炎性损害。
综上所述,含猪油/植物黄油的高脂膳食均可以导致脂肪组织炎性状态的形成,与猪油相比,植物黄油更能引起皮下、内脏(肾周)等多部位脂肪组织MCP-1表达水平升高,这可能是高脂膳食引发肥胖并发2型糖尿病、肥胖相关肾小球病等疾病的原因之一。
作者贡献:王楠楠、刘福定进行实验实施、资料收集整理并撰写论文;贾丽红、翟玲玲、魏薇进行审校;白英龙进行实验设计、质量控制并对文章负责。
本文无利益冲突。
[1]GALIC S,OAKHILL J S,STEINBERG G R.Adipose tissue as an endocrine organ[J].Mol Cell Endocrinol,2010,316(2):129-139.DOI:10.1016/j.mce.2009.08.018.
[2]BOOTH A,MAGNUSON A,FOUTS J,et al.Adipose tissue:an endocrine organ playing a role in metabolic regulation[J].Horm Mol Biol Clin Investig,2016,26(1):25-42.DOI:10.1515/hmbci-2015-0073.
[3]SMITKA K,MARESOVA D.Adipose tissue as an endocrine organ:an update on pro-inflammatory and anti-inflammatory microenvironment[J].Prague Med Rep,2015,116(2):87-111.DOI:10.14712/23362936.2015.49.
[4]WAGNER M,SAMDAL STEINSKOG E S,WILG H.Adipose tissue macrophages:the inflammatory link between obesity and cancer?[J].Expert Opin Ther Targets,2015,19(4):527-538.DOI:10.1517/14728222.2014.991311.
[5]HARFORD K A,REYNOLDS C M,MCGILLICUDDY F C,et al.Fats,inflammation and insulin resistance:insights to the role of macrophage and T-cell accumulation in adipose tissue[J].Proc Nutr Soc,2011,70(4):408-417.DOI:10.1017/S0029665111000565.
[6]PANEE J.Monocyte Chemoattractant Protein 1(MCP-1) in obesity and diabetes[J].Cytokine,2012,60(1):1-12.DOI:10.1016/j.cyto.2012.06.018.
[7]BUETTNER R,PARHOFER K G,WOENCKHAUS M,et al.Defining high-fat-diet rat models:metabolic and molecular effects of different fat types[J].J Mol Endocrinol,2006,36(3):485-501.
[8]MURPHY A M,LYONS C L,FINUCANE O M,et al.Interactions between differential fatty acids and inflammatory stressors-impact on metabolic health[J].Prostaglandins Leukot Essent Fatty Acids,2015,92:49-55.DOI:10.1016/j.plefa.2014.05.003.
[9]LEVIN B E.Arcuate NPY neurons and energy homeostasis in diet-induced obese and resistant rats[J].Am J Physiol,1999,276(2 Pt 2):R382-387.
[10]PERUSSE L,BOUCHARD C.Gene-diet interactions in obesity[J].Am J Clin Nutr,2000,72(5 Suppl):1285s-1290.
[11]LIONETTI L,MOLLICA M P,DONIZZETTI I,et al.High-lard and high-fish-oil diets differ in their effects on function and dynamic behaviour of rat hepatic mitochondria[J].PLoS One,2014,9(3):e92753.DOI:10.1371/journal.pone.0092753.
[12]ZHOU H R,KIM E K,KIM H,et al.Obesity-associated mouse adipose stem cell secretion of monocyte chemotactic protein-1[J].Am J Physiol Endocrinol Metab,2007,293(5):E1153-1158.
[13]AMANO S U,COHEN J L,VANGALA P,et al.Local proliferation of macrophages contributes to obesity-associated adipose tissue inflammation[J].Cell Metab,2014,19(1):162-171.DOI:10.1016/j.cmet.2013.11.017.
[14]IBRAHIM M M.Subcutaneous and visceral adipose tissue:structural and functional differences[J].Obes Rev,2010,11(1):11-18.DOI:10.1111/j.1467-789X.2009.00623.x.
[15]SACKMANN-SALA L,BERRYMAN D E,MUNN R D,et al.Heterogeneity among white adipose tissue depots in male C57BL/6J mice[J].Obesity(Silver Spring),2012,20(1):101-111.DOI:10.1038/oby.2011.235.
[16]EGASHIRA K.Molecular mechanisms mediating inflammation in vascular disease:special reference to monocyte chemoattractant protein-1[J].Hypertension,2003,41(3 Pt 2):834-841.
[17]HARMAN-BOEHM I,BLUHER M,REDEL H,et al.Macrophage infiltration into omental versus subcutaneous fat across different populations:effect of regional adiposity and the comorbidities of obesity[J].J Clin Endocrinol Metab,2007,92(6):2240-2247.
[18]HERRERO L,SHAPIRO H,NAYER A,et al.Inflammation and adipose tissue macrophages in lipodystrophic mice[J].Proc Natl Acad Sci U S A,2010,107(1):240-245.DOI:10.1073/pnas.0905310107.
[19]ENOS R T,DAVIS J M,VELAZQUEZ K T,et al.Influence of dietary saturated fat content on adiposity,macrophage behavior,inflammation,and metabolism:composition matters[J].J Lipid Res,2013,54(1):152-163.DOI:10.1194/jlr.M030700.
[20]CRANFORD T L,ENOS R T,VELAZQUEZ K T,et al.Role of MCP-1 on inflammatory processes and metabolic dysfunction following high-fat feedings in the FVB/N strain[J].Int J Obes(Lond),2016,40(5):844-851.DOI:10.1038/ijo.2015.244.
[21]CHACON M R,FERNANDEZ-REAL J M,RICHART C,et al.Monocyte chemoattractant protein-1 in obesity and type 2 diabetes.Insulin sensitivity study[J].Obesity(Silver Spring),2007,15(3):664-672.
[22]XU Z G,LANTING L,VAZIRI N D,et al.Upregulation of angiotensin Ⅱ type 1 receptor,inflammatory mediators,and enzymes of arachidonate metabolism in obese Zucker rat kidney:reversal by angiotensin Ⅱ type 1 receptor blockade[J].Circulation,2005,111(15):1962-1969.
[23]LUO M,LUO P,ZHANG Z,et al.Zinc delays the progression of obesity-related glomerulopathy in mice via down-regulating P38 MAPK-mediated inflammation[J].Obesity(Silver Spring),2016,24(6):1244-1256.DOI:10.1002/oby.21463.
(本文编辑:毛亚敏)
Effect of Lard and Margarine on the Expression of MCP-1 in Different Adipose Tissues of Rats
WANGNan-nan1,LIUFu-ding2,BAIYing-long1*,JIALi-hong1,ZHAILing-ling1,WEIWei1
1.DepartmentofChildandAdolescentHealthandMaterialandChildHygiene,SchoolofPublicHealth,ChinaMedicalUniversity,Shenyang110122,China2.DepartmentofQualityManagement,HuangshiCentralHospital,EdongHealthcare,Huangshi435000,China
*Correspondingauthor:BAIYing-long,Associateprofessor;E-mail:ylbai@cmu.edu.cn
Objective To discuss the effects of lard and margarine on the expression level of monocyte chemoattractant protein 1(MCP-1) in different adipose tissues of rats.Methods From April to June 2015,49 healthy SPF-grade male Wistar rats in early weaning were assigned randomly into three groups:control group(CON group,n=7),lard group(L group,n=21) and margarine group(M group,n=21).Rats in CON group were fed with basal forage,rats in L group were provided with high-fat diet containing lard and rats in M group were given high-fat diet containing margarine.At the end of the 8-week feeding of rats in the three groups,rats in L group and M group were further divided into two groups according to the increasing amount of body weight,rats in the top one-third of growth were taken as L-OP group(n=7),M-OP group(n=7),rats in the bottom one-third of growth as L-OR group(n=7),M-OR group(n=7),and the left were excluded from this study.The increasing amount of body weight,epididymal and perinephric fat coefficients and the expression level of MCP-1 in subdermal,epididymal and perinephric adipose tissues of rats in the 5 groups were compared.Results The increasing amount of body weight of rats in L-OP group and M-OP group was greater than that in CON group(P<0.05).The epididymal fat coefficients in L-OP group,M-OP group and M-OR group were both greater than those in CON group(P<0.05).The perinephric fat coefficients in L-OP group,L-OR group,M-OP group and M-OR group were all greater than those in CON group(P<0.05).There was no significant difference in the expression level of MCP-1 in epididymal adipose tissues of rats in the 5 groups(P0.05);the expression level of MCP-1 in subdermal adipose tissues of rats in L-OP group,L-OR group,M-OP group and M-OR group was higher than that in CON group(P<0.05);the expression level of MCP-1 in perinephric adipose tissues of rats in M-OP group and M-OR group was higher than that in CON group(P<0.05).Conclusion Compared with lard,margarine are more likely to cause the increasing of the expression level of MCP-1 in subdermal and perinephric adipose tissues.
Lard;Margarine;Adipose tissue;Monocyte chemoattractant protein 1
国家自然科学基金资助项目(81373018)
R 329
A
10.3969/j.issn.1007-9572.2017.09.010
2016-09-12;
2016-12-26)
1.110122辽宁省沈阳市,中国医科大学公共卫生学院儿少卫生与妇幼保健学教研室
2.435000湖北省黄石市,鄂东医疗集团黄石市中心医院质量管理部
*通信作者:白英龙,副教授;E-mail:ylbai@cmu.edu.cn

