味觉受体及其传感器研究与应用
庞广昌,陈庆森,胡志和,解军波
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
味觉受体及其传感器研究与应用
庞广昌,陈庆森,胡志和,解军波
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
中国传统饮食和食品的烹制与加工讲究色、香、味俱全,其中“酸、甜、苦、辣、咸五味调和”又构成其核心标准。国际上也分为“五味”,分别为“酸、甜、苦、咸、鲜”,其中少了辣味,多了鲜味。也有人建议将脂肪的味道定义为“香”味,但是中国人的“香”实际上是“香气”,属于嗅觉,而非味觉。大量研究证明,多数味觉受体作为营养传感系统,如苦、甜、鲜都属于G蛋白偶联受体超家族成员,而且其分布并不限于味蕾、肠道等,其他组织均有分布,是药物筛选的重要靶标。然而,到目前为止,市场上进行味觉测定仍然依赖于电子鼻和电子舌等仪器设备,味觉受体传感器及其有关技术则仍处于探索和研究阶段。其主要原因是:味觉受体和其他大多数受体一样,在与配体识别和启动信号传递时主要依赖于弱相互作用,如何将这些弱相互作用转变为传感器可以处理并放大的光、声、电、磁、热等信号,从而实现其定量测定是一个关键性难题。但是,由于味觉受体在医药筛选、食品添加剂、食品的功能性评价和代谢综合征预防等方面的巨大应用与开发前景,其检测方法一直是科学家关注的焦点之一。本文将针对味觉受体及其传感器检测技术的研究进展进行综合评述,讨论其未来发展和应用前景。
G蛋白偶联受体;生物传感器;味觉受体;电子舌
G蛋白偶联受体(G protein coupled receptor,GPCRs)作为一个由上千个成员构成的受体超家族,一直是科学家关注的焦点。其原因在于,它作为营养传感器受体,通过胞内复杂的信号途径对机体或细胞的物质代谢、能量代谢和信号交流发挥至关重要的作用[1]。不仅如此,GPCRs还通过和多条细胞信号途径进行“Cross talking”也就是“串音”,从而发挥免疫调节、细胞趋化、自吞噬、有性生殖控制等重要功能。在医药学领域,有40%以上的药物是通过GPCRs为靶点而筛选得到。在食品和营养方面,作为主要的营养传感系统,GPCRs则控制着生物的取食方式、营养吸收及其定量化和生存状态。包括人类在内的高等动物的视觉、听觉、嗅觉和味觉基本上都依赖于GPCRs的传感作用。有营养的物质一般都表现为“愉悦的甜、鲜、咸味”,并以此作为“奖赏机制”;而抗营养或腐败、有毒的成分则往往表现为“令人讨厌的苦、酸、辣味”,以此提醒回避,并作为一种安全和防御机制。味觉系统还决定了进食量,一旦超过一定的限制,其“愉悦”感就会减弱或消失,而代之以“饱腹感”,甚至产生“厌恶”感,从而停止进食。从这个意义来看,食品科学和医药科学的目的都同样是探索如何通过调节GPCRs来保证机体的营养摄取、吸收、控制,从而维持生物功能、维护机体健康、防御和治疗疾病。
1 GPCRs的结构与功能
很多国际一流的科学家都为GPCRs的研究付出了巨大努力。研究发现,GPCRs都具有一个共同的七跨膜结构域、胞外结构域和胞内结构域。其胞内结构域非常保守,主要是用来激活G蛋白信号传递与放大系统,构成其功能基础[2]。对其胞外结构域的比较研究证明,它们具有非常巨大的多样性,是达尔文“正”选择的典型代表,因而构成了不同物种获取营养的途径、方式、生存与适应不同生态位的基础[3-4]。
GPCRs及其与配体(配基)的相互作用构成其传递细胞信号、发挥生物功能的基础,因而备受关注。但是作为一种膜蛋白,其分离纯化,特别是形成单晶却一直是本领域的难题之一。尽管科学家付出了巨大努力,但是真正能够获得单晶从而对其空间结构进行精确解析的只有A组GPCRs成员,B组受体目前还没有突破,C组只有个别受体获得了高分辨率解析。然而,这些有限的研究结果已经足以证明GPCRs和配体(基)相互作用的多样性和复杂性,以致科学家用“分子签名”一词来形容[5]。既然要拿到某种GPCR的结晶并不容易,那就应该以其基因和DNA序列为突破口进行研究。事实上,这方面的研究已经取得了巨大成功[6]。在GPCRs的味觉传感研究方面,Nelson[7]、Zhao[8]、Li Xiaodong[9]等系统研究了味觉受体1型(taste receptor type 1,T1R)1和T1R3与鲜味传感的关系,证明谷氨酸单钠盐、次黄嘌呤核苷酸(hypoxanthine monophosphate,IMP)和鸟苷酸(guanosine monophosphate,GMP)等“鲜味(人类)”的确是由T1R1+T1R3的异二聚体进行传感的。另外,通过人类和鼠科动物对不同氨基酸传感及其通过味蕾细胞的瞬时感受阳离子通道家族M成员5(transient receptor potential cation channel subfamily M member 5,TRPM5)控制的钙内流激活作用和受试者标准化鼓索神经响应(normalized chorda tympani responses)等,对味蕾受体激活细胞信号传递并通过传入神经传递脉冲信号进行味觉传感的情况做了研究,结果表明:鼠科动物与人类在传感“鲜味”时具有明显的区别,鼠科动物对几乎所有氨基酸都能传感“鲜味”,而人类则只对谷氨酸和天冬氨酸单钠盐(味精)传递“鲜味”神经信号[10]。而且Nelson等[7]证明:当用人类T1R1+T1R3基因取代鼠科动物的基因以后,鼠科动物就会表现出和人类相同的“鲜味”传感谱,Zhao等[8]则进一步通过在“鲜味”味蕾细胞中表达κ-阿片受体(κ-opioid receptor),证明该细胞获得了可以传递阿片类成分的细胞信号;Rawal等[11]经过比对人类鲜味受体T1R1胞外结构域的DNA序列及其与味觉的关系证明:其多样性的确决定了不同人群之间的味觉差异。这提示味觉的传感主要取决于受体的胞外结构域,而胞内激活G蛋白信号放大与传递系统以及离子通道、神经信号传递等途径则是共同的,换言之,味觉感受是由受体和配基的相互作用及其在味觉组织上的分布和表达情况所“编码”[12]。
2 味觉受体的分布与功能
味觉受体的概念本身就会毫无疑问地将这些受体局限在机体的味觉系统。但是,奇怪的是,近年来发现这些味觉受体竟然在其他器官中也有表达,而且这些“异位表达”竟是一种普遍现象。显然,其功能已经远远超出传感味觉那么简单,它们应该还有其他功能[13],但是因为在这些部位并非通过激活神经元将信号传递到大脑,所以不能感知它们的作用[14]。T1Rs(鲜味、甜味)和T2Rs(苦味)GPCRs已经在很多组织中发现[7,15]。研究表明,味觉受体可能就是内分泌系统调节与控制的介导者[16]。味觉信号可以调节激素分泌,而激素,如肾上腺素[17]则可以通过循环系统调节机体的能量内平衡(energy homeostasis),包括食欲肽(orexigenic peptides)、神经肽(neuropeptide)Y等[18-19]。这显然意味着味觉上皮并不简单地传感外部信号,而是在传递这些信号到神经系统的同时,也传递代谢内分泌信号[20]。同样,已经有越来越多的证据表明味觉传感作用可能具有调节多种激素,如胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)[21]、大麻素类(cannabinoids)[22]都可能受味觉受体,特别是T1Rs的调节。Lagerstrom[23]和Riera[24]等在综述了大量文献的基础上提出:分布在味觉组织上的味觉受体可以将进食的成分作为味觉信号传递到大脑,所以可以感受到这些成分的味道;而分布在胃肠,特别是肠道系统的味觉受体则通过分泌胃肠激素等信号成分作用于机体的代谢与内分泌系统,或者通过交感-副交感神经系统作用于下丘脑、脑垂体,调节机体的神经内分泌系统(图1)。可见,这些受体不仅在味觉物质,或食品添加剂的筛选、检测和功能评价中具有重要的应用价值,在药物筛选和功能评价方面的应用潜力也已经引起科学界的密切关注[23]。
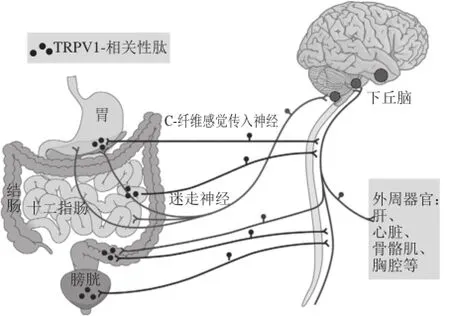
图 1 不同部位味觉受体的生理功能[24]Fig. 1 Taste receptors distributed in different parts may play different physiological functions[24]
现代生活方式病(modern lifestyle diseases),特别是糖尿病和心脑血管疾病的不断蔓延,极大地促进了低能量和无能量味觉添加剂的生产和销售,并已经使其发展成为巨大的产业。但是,在这个产业中,目前所进行的味觉(酸、甜、苦、咸、鲜)评价基本上都是通过电子舌。对这些调味品的评价方法与细胞受体无关,而实际上消费者食用这些食品后势必存在这些味觉成分和机体内各种相关受体之间的相互作用,从而具有一定的生理功能,而这些功能对机体的健康作用却不能得到评价。已经有科学家在总结了大量研究证据的基础上,对低卡(卡洛里)或无卡甜味剂的生理作用及其安全性提出质疑和担心[25],尽管也有人认为这些低卡和无卡甜味剂对糖尿病和心脑血管疾病患者是安全的[26]。不过人们仍然不能回避这些味觉物质在体内通过与其受体相互作用所产生的代谢、生理与内分泌作用。鲜味添加剂或鲜味物质的研究也已经形成巨大的产业,在整个餐饮和食品加工制作、烹饪等行业中发挥举足轻重的作用。已知“鲜味”和氨基酸、肽类以及嘌呤成分密切相关[27],尽管IMP和GMP作为鲜味物质,与嘌呤代谢疾病有一定的联系,但是氨基酸和呈味肽类产品的研究与开发已经成为功能性食品、营养添加剂和调味品研究的热门领域。而大量的研究证明,这些氨基酸、短肽类营养成分和核苷酸类成分都是通过和鲜味受体T1R1+T1R3相互作用进行味觉传感并发挥生理功能[28],所以毫无疑问,能够对“鲜味”受体进行系统化和定量化研究具有重要的理论意义和应用价值。
2.1 鲜味受体及其分布与功能
氨基酸和呈味核苷酸可以产生鲜味,鲜味可以让人感受到食物可口的味道,是由日本科学家发现的第5种基本味觉感受。由T1R1和T1R3组成的异二聚体是鲜味的味觉受体,T1R1/T1R3主要在舌前部的菌状乳突味蕾内的Ⅱ型细胞中共表达[7]。另外一种鲜味受体是代谢型谷氨酸受体(metabotropic glutamate receptor,mGluR),人在服用该受体的抑制剂之后,舌咽神经和鼓索神经对谷氨酸钠盐产生的兴奋被显著抑制,说明mGluR主要在舌后部分布,并介导谷氨酸钠盐产生的鲜味味觉[29-30],该受体不对其他核苷酸和氨基酸敏感。在鼠科动物中,T1R1/T1R3异二聚体对20 种L-氨基酸都有着较宽的传感范围,并且,氨基酸与呈味核苷酸的共同作用能使人感觉到强烈的鲜味协同增强效应。小鼠T1R1或T1R3单基因敲除后对谷氨酸钠盐的感知能力减弱[8],T1R1/T1R3双基因敲除后则丧失了对于鲜味味道的感受能力[31]。人类的味觉只能品尝到两种氨基酸(天冬氨酸盐和谷氨酸盐)产生的鲜味,而很多的动物实验表明,哺乳动物可以对几乎所有L-氨基酸产生喜好感。人类和动物间经过不断进化,已经在大自然中处于不同的生态位,造成不同物种鲜味传感机制的差异、营养传感和偏好上的多样性。
T1R1是膜受体,属于G蛋白偶联受体C家族,胞内与Gα、Gβ和Gγ3个亚基相偶联。味觉物质与受体结合后,导致受体的构象变化,使Gα和Gβγ亚基分离,Gα和Gβγ被激活后分别介导各自的下游信号途径,受体-配体结合产生的信号利用细胞内的级联放大系统进行信号放大,并活化细胞表面的离子通道,促进钙离子内流,将细胞产生的神经递质释放到细胞外。Wauson等[32]系统研究了T1R1/T1R3的分布,证明该受体几乎分布在所有的组织、器官和细胞中。哺乳动物雷帕霉素靶蛋白复合物1(the mammalian target of rapamycin complex 1,mTORC1)能够集成营养信息,特别是氨基酸营养,从而对蛋白质合成和细胞生长发挥重要调节作用。当氨基酸缺乏(饥饿)时,mTORC1通过激活自吞噬作用为最重要的蛋白质合成提供氨基酸保证。文献[32]用大量的实验证明T1R1/T1R3作为食物中氨基酸状态和可利用程度的传感系统将信号传递给mTORC1,干扰T1R1/T1R3受体的信号传递可以改变mTORC1的细胞定位。下调该信号途径抑制因子的表达可以上调关键性氨基酸的运载体,阻断翻译起始,诱导自吞噬作用。这些发现证明了T1R1/T1R3作为氨基酸传感器实现氨基酸营养状态和mTORC1之间的通讯,在氮源传感、吸收和代谢方面发挥重要功能(图2)。
2.2 甜味受体及其分布与功能
甜味受体是由T1R2构成,和鲜味受体共用T1R3,亦即以异二聚体的形式传感甜味信号[15,33]。甜味受体作为GPCRs超家族成员,也在其他组织、器官和细胞中表达,如呼吸道[34]。已经有证据表明甜味受体可能涉及免疫调节和应答[35]。甜味受体也表达在胃肠道,如肠内分泌L-细胞和K-细胞,通过分泌GLP-1和葡萄糖依赖性促胰岛素肽(glucose-dependent insulinotropic peptide)发挥生理作用。肠绒毛顶部的这些细胞暴露到肠腔中摄取葡萄糖等甜味营养,同时激活甜味受体,刺激胰岛素的分泌[35],这些胰岛素统一受胰岛β-细胞的统筹与控制。甜味受体也可以上调小肠上皮细胞葡萄糖运载体的表达,增加葡萄糖的吸收和运输[36]。有研究认为,甜味受体在各种类型细胞表达实质上是一种控制糖代谢的机制。所以,甜味受体表达于胰岛的β-细胞[37]、脂肪细胞[38]和下丘脑葡萄糖响应神经元[39]。这些研究结果显然提出一个必须面对的问题:人工甜味添加剂是否也能发挥这些作用?至少应该弄清楚这些问题[40]。已经有大量研究证明,不像葡萄糖之类的能量甜味剂那样,人工甜味剂不能增加胰岛素或肠降糖素的释放[25]。例如,Anton等[41]报道:饮食添加蔗糖的茶、乳酪或饼干后测定其体内的胰岛素水平明显高于以阿斯巴甜或甜叶菊作为甜味剂的同样食品。另一项研究也表明在饭前食用天然甜味剂-蔗糖或三氯蔗糖,然后进餐同量的土豆,食用三氯蔗糖者的胰岛素、GLP-1或肠抑胃肽(gastric inhibitory polypeptide,GIP)并不升高,而蔗糖食用者则明显升高[42]。其原因可以解释为:蔗糖在肠道里和三氯蔗糖具有明显不同的生理作用,而这些生理作用是由于它们和受体作用及其激活的信号途径不同(图2)。
2.3 苦味受体及其分布与功能
“苦味”作为五味之一,最显著的特点就是阈值极低,许多苦味物质不仅可以赋予食品苦味,还有降血压、抗肿瘤、调节免疫等功能[43]。生活中苦味也是不可或缺的,当它与其他味感调节得当时,能起到改善食品风味的作用[44]。膳食中的苦味成分,特别是植物性多酚、黄酮类化合物,都有抗氧化、降低心血管疾病和肿瘤发病率的作用,所以常常被称作“植物营养素”,而且随着人们对苦味物质的认识,苦味食品也开始受到人们的关注[45]。现在苦味受体T2Rs已经被鉴定出来,且也是GPCRs超家族成员,这种受体对很多苦味物质都有响应,例如存在于食物和药物中的苦味物质主要包括:生物碱、萜类、糖苷类和苦味肽类,另外还有胆汁、某些氨基酸等。T2Rs受体作为哮喘病治疗药物的筛选靶点已经受到研究人员的广泛关注[46]。作用于苦味受体的化合物可以促进细胞的钙离子内流,从而舒缓平滑肌,减少哮喘患者呼吸道阻塞。这同时也促使科学家对该受体味觉以外的分布进行了调查,并已经证明其分布广泛,特别是在呼吸道[47-49]。所以有人提出,分布在呼吸道中的苦味受体通过味觉依赖性Gβγ作用于电压依赖性钙通道(the voltage-dependent Ca2+channels)发挥活化钾离子通道的作用[49],这也是很多抗过敏、抗哮喘药物都很苦的重要原因。中国人一直认为“良药苦口利于病”其原因可能正是由于苦味受体的作用(图2)。

图 2 鼠科动物苦、甜、鲜味受体及其传感作用[50]Fig. 2 Taste receptors and transduction in murine animals[50]
2.4 辣味受体及其分布与功能
辣味作为“五味”之一在以中国人为代表的东方国家中占据重要地位。但是,在西方人的“五味”中没有辣味,也许正因如此,至今没有测定辣味的电子舌上市。不过辣味受体早已作为痛(热)觉传感受体被发现[51],辣椒素就是这种受体的激活剂。辣味传感主要是通过激活瞬时感受器电位香草素受体亚家族(the transient receptor potential vanilloid subtype ion channel,TRPV)1从而激活离子通道。随后大量的研究集中在以该受体为靶标进行止痛药物的筛选研究方面[46],其检测方法也基本上依赖于该受体所造成的离子通道上的变化[52]。本课题组利用大鼠味蕾组织进行固定化,研制出一种新型电化学型辣味受体传感器,其检测限达到1×10-13mol/L,并可以进行动力学分析,真正实现了对辣椒素发挥辣味作用的定量化评价[53]。
辣味受体(capsaicin receptor)-TRPV1也被定义为伤害性受体,同样可以被胞外质子激活[54]。毫无疑问,传入神经对辣味和酸味等伤害性受体传感发挥重要作用。辣味受体的作用受炎症细胞因子的激活,对酸性pH值、高温也非常敏感(图3)。所以概括起来,TRPV1传感辣味、酸味和高温。
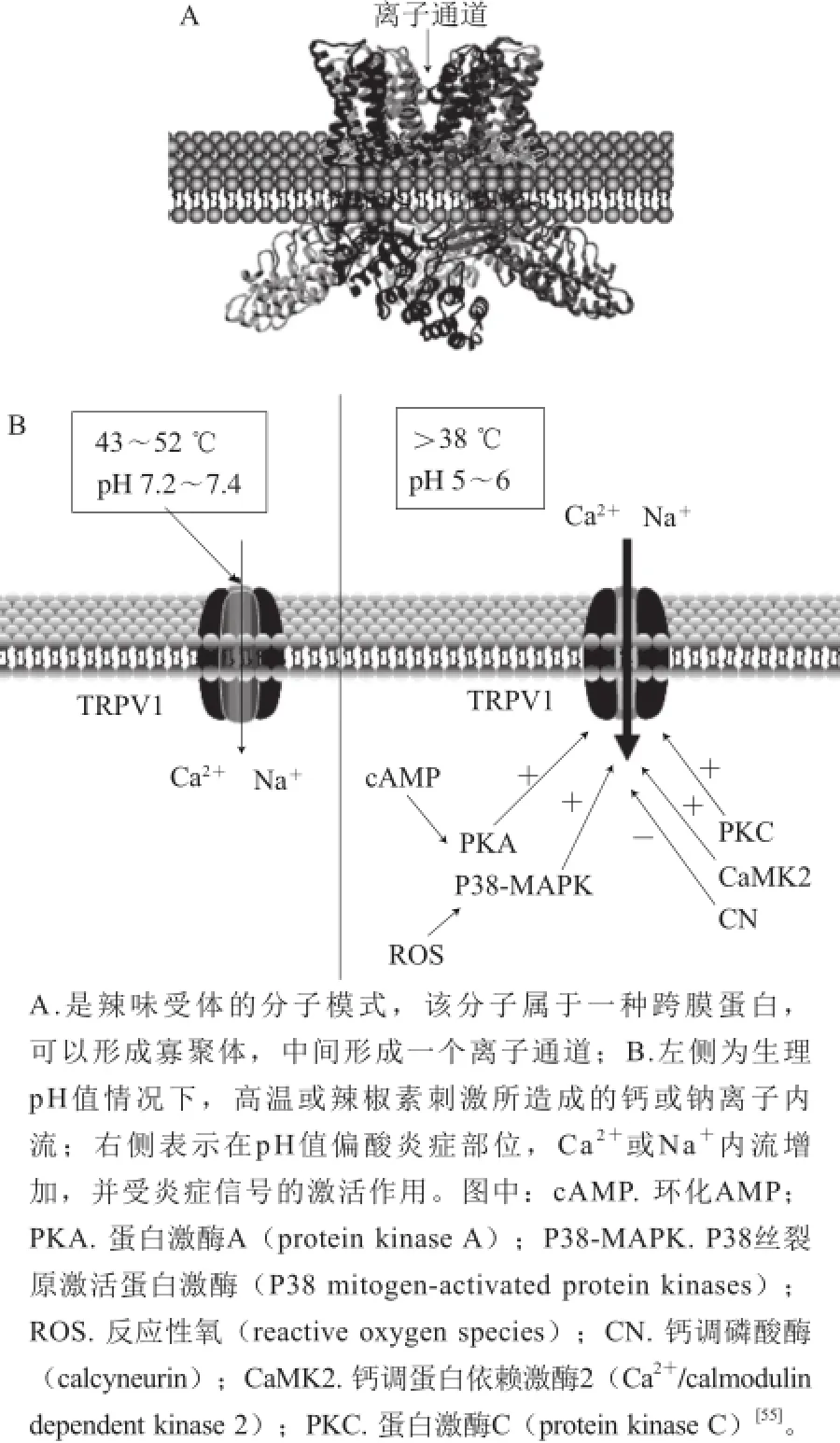
图 3 辣味受体TRPV1及其与激活因子的相互作用[55]Fig. 3 TRPV1 channel subunit and interaction sites for several TRPV1 activators[55]
2.5 咸味受体及其分布与功能
咸味的研究虽然很早,但是否存在咸味受体直到2010年才尘埃落定。在鼠科动物中,咸味(食盐)传感有两种机制:一种对利尿剂阿米洛利(amiloride)敏感,另一种机制就是对阿米洛利感觉迟钝[56]。对于人类,咸味没有阿米洛利利尿敏感性。动物对低浓度食盐的作用与上皮Na+通道(ENaCs)相联系,也有人认为低盐受体就是Na+通道[57]。ENaC是由α、β、γ 3个亚基构成,它们形成孔状结构,发挥钠离子通道的作用。ENaCα被敲除后可以减少动物对低盐溶液的敏感性[58]。对高盐浓度的传感就更加复杂,根据神经信号传递情况可以看到,很多都表现出对KCl和NaCl的敏感性[59]。传递咸味信号的神经纤维主要分布在舌头的背腹部。到目前为止,对于高盐传感受体仍然莫衷一是。也曾经有人提出高盐传感受体实际上就是辣味受体TRPV1[60],但是后来又被否定了[59]。显然,介导高盐传感的细胞并不是特异性的,至少有两个细胞群,它们既可以传感苦味,也可以传感酸味[61]。对苦味传感细胞的TRPM5或磷酸肌醇特异性磷酸酯酶Cβ2(phosphoinositide-specific phospholipase Cβ2,PLCβ2)灭活后,同时对高盐传感也会消失,但是酸味细胞多囊性肾病2样1基因(polycystic kidney disease 2-like 1,PKD2L1)不表达时,其他部件也被消除[62]。显然,小鼠细胞关闭PKD2L1基因表达以及TRPM5灭活后仍然保持对高盐的吸引,这有可能是通过阿米洛利敏感性通道实现的[63]。到底多大盐浓度可以激活这两种类型的细胞并不完全清楚。高盐也可以通过这种受体的变构作用激活苦味传感细胞,而酸味传感则需要其细胞顶部环境通过高盐溶液改变酸碱平衡[58]。Chandrashekar等[58]通过系统的实验证明咸味作为对NaCl摄取的一种“奖赏”,实际上是通过上ENaC作为咸味传感受体(图4)。而该受体如何通过和NaCl相互作用控制细胞内的信号途径,以及受体-配体结构与功能及其量效关系尚需深入研究。迄今为止,只发现低盐溶液对哺乳动物具有吸引作用,而且适量的NaCl是动物生理活性所必需。但是,过高浓度的食盐对机体也会产生伤害作用,高浓度的食盐是否也是通过受体传感,如果是,那会是什么受体尚需探索和研究。

图 4 哺乳动物咸味受体[58]Fig. 4 The salt taste receptors in mammals[58]
2.6 酸味受体及其分布与功能
酸味受体[62]:动物对酸味的传感主要是靠舌头和上颚上皮上的味觉受体细胞。它们可以对酸性pH值和弱有机酸作出电化学响应[63]。在过去若干年,研究者假设了多种负责传感酸味的受体,包括ASICs、HCNs、K+通道,以及近来的TRP通道PKD2L1和PKD1L3[64]。这些假设往往被基因敲除实验所否定。例如敲除老鼠的PKD2L1或PKD1L3基因后,其传感酸味刺激的神经脉冲只有微量的衰减[65]。尽管如此,细胞表达PKD2L1仍然是其传感酸味所需要的[61]。显然,有关基因敲除实验的逻辑推理是值得怀疑的,当有不止一个基因传感同一种味道时,敲除其中任何一个基因都不会影响其他受体对该味道的传感,因为其他基因会取而代之。细胞表达PKD2L1对酸味作出响应是通过质子选择通道(proton-selective ion channel)进行[66]。该质子选择通道在对酸作出响应时不受Na+的干扰。至于该质子通道的分子基础尚未得到鉴定。当质子进入酸味传感细胞后会促使其酸化,从而产生细胞信号传递。值得注意的是,味觉细胞表达一系列静息双孔钾离子通道(resting two-pore K+channel)[67],这些通道可能被细胞内酸化作用所阻断,从而使细胞进一步去极化。另外,TRPA1是一种“伤害性受体(nociceptor)”也可以对乙酸作出响应[68](图5)。哺乳动物对酸味的传感实际上是通过质子选择性离子通道的顶部进入所发出的信号。弱酸也可能通过穿入细胞膜使胞浆酸化从而导致钾离子通道关闭,产生膜的去极化作用,激活酸味传感细胞。

图 5 酸味受体[68]Fig. 5 Sour taste receptors[68]
总之,味觉受体除辣味受体不属于GPCRs外,其他如鲜味、甜味、苦味都属于GPCRs,咸味和酸味传感比较复杂,只有微咸的受体比较明确,不属于GPCRs。酸味主要是通过离子和质子通道来传递损伤性信号,也不属于GPCRs。不过,这些受体都与胞内小G蛋白(small G proteins)有复杂的关系,其细胞信号传递的详细机制有待深入研究。
3 味觉受体传感的测定方法
在味觉受体的检测方面,由于生物化学及分子生物学对味觉信号传递以及作用机制,特别是医药科学领域以GPCRs作靶标进行药物筛选的需要,对其与配体(基)相互作用规律及其激活/抑制剂作用规律方面进行了大量研究,并已经取得了举世瞩目的进展[69]。这些技术主要是基于GPCRs与配基作用所产生的细胞生理变化,如对离子通道的作用[70]所产生的神经脉冲信号(多用于嗅觉信号编码与传递)[71]、针对分子互作的表面等离子体共振技术(surface plasmon resonance,SPR)[72],以及适于高通量细胞微孔筛选平台(microtiter plate-based high-throughput screening platforms)和活细胞微操作(live-cell screening assays)技术,包括细胞微阵列(cell microarrays)、细胞微流(cell microf l uidics)等[73]。遗憾的是,这些技术往往只适用于某一特定的目的,难以实现真正意义的定量化。
虽然有不少科学家致力于味觉受体传感器的研究,而且在受体与配体互作所产生的光[74]、声[29]、电[75]、热[76]变化的基础上进行味觉受体传感器的研究与开发,但这些研究基本上仍然是基于活细胞受体与配体(基)互作所产生的Ga2+内流等离子通道的变化[77],而这些变化都依赖于细胞的种类、生理活性、所处的环境、细胞之间的相互作用、细胞内信号传递途径及其“串音(crosstalking)”、各种离子通道之间的控制和状态等复杂因素,因此尚处于探索阶段。已经进入市场的基于SPR技术的分子互作仪虽然可以用来进行非标受体-配体互作检测[78],但是因其难以实现高通量、技术要求复杂、操作精细、成本高,难以实现常规的“味觉”检测。
值得一提的是,Duan Xuexin等[79]在SPR技术的基础上发明了一种硅纳米线形成电场效应晶体管技术(silicon nanowires conf i gured as f i eld-effect transistors,Si-NW FETs),该技术可以用作亲和性生物传感器,实现蛋白-受体之间亲和性和动力学测定。该技术主要可用于大分子之间的相互作用,但是难以用于味觉受体与味觉成分的测定,因为味觉物质不仅多种多样,而且大多数都是各种有机分子,如糖、核苷酸、氨基酸、芳香族化合物(如苦味)等,同时也有短肽、糖类衍生物,甚至很多金属离子也有味觉。另一方面,这类物质似乎并非仅仅通过与受体之间的亲和作用发挥传感功能,所以SPR或者Si-NW FET都难以实现味觉受体-配体作用的定量化测定。
4 电子舌测定味觉成分
在食品营养、调味和感官评价领域,其检测方法主要集中在以感官为基础的电子鼻和电子舌技术的研究与应用,目前已经有各种仪器、设备上市。但是此类传感器主要是开发具有对味觉或嗅觉成分作出响应的材料(膜、电极或粒子),从而根据不同人群的感官评价指标进行比对和定量化。这种定量化实质上仍然是一种对味觉成分浓度的测定,其优点是重复性好、不需要对味觉物质进行预处理、成本较低等;但是缺点也很明显,与真正的味觉传感、神经、生理作用没有直接联系。
5 味觉受体传感器研究进展
虽然对嗅觉受体,特别是昆虫触角上的嗅觉受体进行微型传感器的研究已经取得了很多重要进展[71],但是在味觉受体传感器研究,特别是电化学型味觉受体传感器方面则很少有成功的报道。Chen Peihua等[80]将具有酸味传感受体的细胞进行培养,用光寻址传感器(lightaddress able potentiometric sensor,LAPS)识别酸味刺激并与无酸溶液作比较,酸味传感受体细胞经受酸味刺激以后就会改变其动作电位,并可通过LAPS对这些细胞外的信号进行记录。经过对这些信号进行一段时间的分析和提取,过滤掉与味觉受体无关的信号后即可以对味觉受体的作用进行研究。用这种方法所得到的信息虽然可能与味觉受体对味觉刺激相关,但是,由于其细胞的状态、细胞和细胞之间的相互作用以及胞内信号途径的复杂“Cross-talking”,难以得出味觉受体和味觉刺激的动力学规律,更难以进行精确的味觉测定和评价。
到目前为止,对味觉传感的定量化方法实质上是基于3 种机制之一:1)基于活细胞离子通道或细胞活性成分的标记;2)所谓非标-SPR法,主要是通过测定受体-配体之间的结合与解离特性;3)电子舌,主要是基于人们对若干基本味觉物质的品尝经验对味觉物质作用于敏感材料所产生的电化学响应进行味觉评价。第3种机制与细胞受体无关,而第1种机制必须面对复杂的细胞内不同信号途径之间的“Cross-talking”以及细胞本身的状态等复杂因素的影响,而第2种机制不仅要克服如何实现高通量、降低成本等问题,其测定结果也需要持审慎的态度。因为味觉受体对味觉物质,特别是小分子物质,例如对酸味(pH值)、咸味的传感似乎与受体-配体之间的结合-解离作用没有直接关系。
本课题组自1996年至今,在生物传感器研究方面进行了10多年的探索,特别是在纳米免疫传感器的研究方面取得了较大突破。本课题组以交联辣根过氧化物酶(horseradish peroxidase,HRP)的电子媒介体硫堇-壳聚糖为桥联剂,吸附纳米金于玻碳电极,借助纳米金吸附固定HRP制备了H2O2生物传感器。利用计时电流法对H2O2进行测定,结果表明该生物传感器检测的线性范围为1×10-7~1×10-4mol/L,检测限为5.0×10-8mol/L。其寿命、稳定性、重现性及选择性都表现突出[81]。在此基础上,本课题组以壳聚糖作为桥联剂连接金纳米粒子于玻碳电极,用纳米金固定HRP标记的抗牛免疫球蛋白(immunoglobulin,IgG)构建了检测牛IgG的电化学免疫传感器。通过交流阻抗法和循环伏安法表征电极组装过程的电化学特性,用电流-时间法测定PBS缓冲液稀释的标准牛IgG。结果显示,免疫反应前后稳态电流的变化率与牛IgG的质量浓度的对数在10-1~104ng/mL范围内呈良好的线性相关,相关系数为0.997 6。该传感器重现性及稳定性良好、成本低、操作简单,可用于含牛免疫球蛋白样品的定量检测[82-83]。以壳聚糖为桥联剂固定第一层纳米金于玻碳电极并吸附固定抗蜡样芽孢杆菌BALB/c单克隆抗体,以滴电极方式将硫堇-壳聚糖/纳米金-HRP复合物固定于上述电极并吸附抗蜡样芽孢杆菌单克隆抗体构建了双层纳米金修饰的蜡样芽孢杆菌电化学免疫传感电极。利用循环伏安法、交流阻抗法等表征电极组装的各个阶段,利用计时电流法对蜡样芽孢杆菌进行测定,结果显示,该传感器的响应电流与菌浓度在5×101~5×104CFU/mL范围内呈线性关系,相关系数为0.996 6,检测限为10 CFU/mL[84],为实现蜡样芽胞杆菌的快速定量和在线检测奠定了基础。
该技术的重要意义在于建立了一个用于结合BALB/c小鼠单克隆抗体的纳米免疫传感器及其辣根过氧化物酶信号放大系统。事实上,免疫球蛋白本身就是B-细胞受体(B cell receptor,BCR)经过转型开关作用转变成抗体,它和抗原之间的互作与受体和配体之间的互作基本上是相同的。因此有理由推测:既然可以把抗体-抗原之间的弱相互作用转变为电化学信号,那么也应该可以将其他受体和配体之间的信号转变为电化学信号从而研制出电化学型受体传感器。于是本课将这一信号放大系统用于电化学型味觉受体传感器的研究,并取得了突破性进展。一方面将该放大系统用于小鼠GPR70受体(T1R1,NCBI编号:AF337040.1)鲜味电化学生物传感器的研究,另一方面利用Oligo法进行基因合成,酶切法连接至真核表达载体pcDNA3.1,转化DH5α菌株获得质粒载体,再使用脂质体转染法转染至CHO-K1细胞,培养并表达,获得了目的受体蛋白-GPR70。然后利用该受体胞内结构域中的多个巯基和纳米金-硫堇-壳聚糖连接,通过HRP进一步放大该受体胞外结构域与配基之间的相互作用的信号,研制出鼠GPR70电化学型鲜味传感器,经实际检测表明:该鲜味受体传感器能够对谷氨酸钠和多种TCA代谢中间化合物(5×10-14~7×10-12mol/L)进行测定,呈现酶-底物相似的双曲线动力学方程,于是按双曲线进行回归,相关系数为0.974 5;在谷氨酸钠浓度为5×10-14~1×10-12mol/L时,谷氨酸钠浓度和检测信号的差值呈线性关系,相关系数为0.991 5;通过双倒数法对实验结果进行回归分析,受体-配基相互作用浓度/活性常数(达到最大活性一半时的配体浓度)为1.316 4×10-12mol/L。该方法的优点是用固定的纳米-辣根过氧化物酶替代细胞内的信号通路和信号放大系统,从而避免了细胞内复杂的信号途径之间的“Crosstalking”,容易实现高通量,但是缺点也很明显:不能反映受体在流动性的细胞膜上的相互作用以及细胞内通过细胞信号传递和多条信号途径之间的“Cross-talking”所产生的真实生物学效应。
为了能够更加真实地检测受体-配体互作所产生的真实生物学效应,对上述纳米受体传感器所检测的规律与固定化大鼠味蕾组织所构建的味觉生物传感器进行了比较,结果表明:这两种传感器显示出十分相似的灵敏度和动力学特征[53]。通过这两种受体传感器,不仅可以比较人工信号放大系统和细胞信号放大系统之间的关系,还能够由此定量化研究受体与配基之间的互作动力学,甚至构效关系[85],实现通过目前最成熟、最普遍的电化学型传感器定量化测定味觉的目的。对组织或细胞受体传感器的设计和测定原理如图6所示。当对不同浓度的待测分子进行测定时,相当于向传感系统中输入配体信号X,则可以测定到系统的输出信号Y,于是可以得到Y和X的函数关系,这一函数关系表达了受体-配体之间的相互作用、受体在细胞膜上的相互作用、继而所产生的胞内信号放大和传递途径以及由此所产生的总体生物学效应。当然其前提是X和Y之间有函数关系(例如:相关性)。显然,这里X和Y是自变量和因变量之间的关系,也就是因果关系,是不可逆的,当然不排除正反馈或负反馈作用。该传感器不仅可以用来进行味觉、嗅觉测定,预计在药物筛选、功能性食品评价等方面具有极广泛的应用前景。
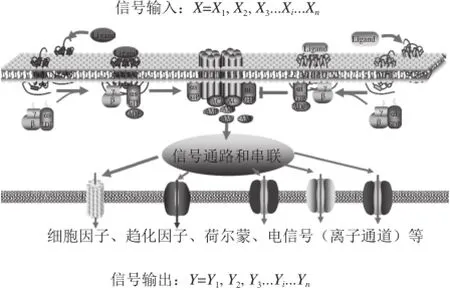
图 6 细胞作为信号放大系统对味觉受体传感信号测定示意图Fig. 6 Schematic diagram of a taste receptor sensor based on cells as signal amplif i cation system
6 结 语
味觉受体构成人和动物对环境和营养的传感与控制,不仅存在与味蕾等味觉组织,几乎分布于机体所有的器官、组织和细胞。之所以人体感觉不到它们存在于味觉以外的组织,是因为只有味觉组织所传感的信号传递到大脑,其他如肠道受体主要是传递到下丘脑或脑垂体,通过代谢和内分泌作用调节营养的吸收、运输、贮存、分解和内分泌,同时也调节摄食量、饱腹感和食欲。目前对味觉测定商品化的仪器设备主要是电子舌或电子鼻,实际上是对味觉成分的测定,跟味觉受体没有直接关系。而大量实验结果证明:味觉受体在味觉成分的作用下具有非常重要的调节神经、生理、免疫和内分泌等功能。而如果人工调味剂对机体的生理、代谢和内分泌具有不同的作用,甚至有害,那么其潜在的健康问题就值得关注,可见味觉受体传感器的研究极具迫切性。
事实上,味觉受体早就引起了科学家的密切关注,因为大多数嗅觉和味觉受体都是GPCR超家族成员,是药物筛选最重要的靶点。但是由于受体-配体之间的相互作用非常复杂,而且多属于弱相互作用,难以转化为电信号进行测定。所以到目前为止,研究主要是基于在味觉受体接受到配体的抑制剂、激活剂刺激时细胞所产生的离子通道或分泌物的变化,这些变化可以通过各种分子标记来进行定量化测定。最近,由于SPR技术的成熟与仪器设备的市场化,通过该技术进行非标受体-配体互作测定已经吸引了众多科学家的目光。但是,这些研究主要是为了进行非标筛选药物,鲜见用于味觉测定的报道。
在味觉受体电化学传感器的研究方面只有很少的报道。Chen Peihua等[80]通过将酸味受体细胞培养并吸附在印刷丝网电极构成的培养板上,通过光寻址技术测定加入酸味物质所产生的信号变化,在数据处理时过滤掉与酸味物质响应无关的信号,研制出酸味受体传感器,但是该传感器的干扰因素多而且复杂,难以实现精确的定量测定。
本课题组成功地将抗原-抗体之间的弱相互作用转化为电化学信号,从而在研制出电化学型纳米金免疫传感器的基础上,将该技术用于受体传感器的研究,将大鼠体外表达的T1R1鲜味受体蛋白自组装到纳米金上,通过辣根过氧化物酶进一步放大信号,制成可以定量测定鲜味物质-谷氨酸单钠盐的电化学型传感器。该传感器结合固定化组织或细胞传感器技术,可以为鲜味物质,包括氨基酸、肽类、IMP和GMP及其与味觉受体作用规律、生物功能评价等研究提供高敏感、特异性、定量化、操作简单、价格便宜、重复性好的检测方法。该技术的建立与完善将有望为极具多样性的GPCRs及其与配基(体)互作规律、信号途径、生物学功能等研究提供一个通用的技术平台,同时可以用于人类和动物的味觉测定。
[1] FREDRIKSSON R, LAGERSTROM M C, LUNDIN L G, et al. The G-proteincoupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and f i ngerprints[J]. Molecular Pharmacology, 2003, 63(6): 1256-1272. DOI:10.1124/ mol.63.6.1202.
[2] AUDET M, BOUVIER M. Restructuring G-protein-coupled receptor activation[J]. Cell, 2012, 151(1): 14-23. DOI:10.1016/ j.cell.2012.09.003.
[3] SCHLINKMANNA K M, HONEGGERA A, TÜRECI E, et al. Critical features for biosynthesis, stability, and functionality of a G proteincoupled receptor uncovered by all-versus-all mutations[J]. Proceedings of the National Academy of Sciences, 2012, 109(25): 9810-9815. DOI:10.1073/pnas.1202107109.
[4] DODEVSKI I, PLÜCKTHUN A. Evolution of three human GPCRs for higher expression and stability[J]. Journal of Molecular Biology, 2011, 408: 599-615. DOI:10.1016/j.jmb.2011.02.051.
[5] VENKATAKRISHNAN A J, DEUPI X, LEBON G, et al. Molecular signatures of G-protein-coupled receptors[J]. Nature, 2013, 494: 185-194. DOI:10.1038/nature11896.
[6] REIMANN F, TOLHURST G, GRIBBLE F M. G-protein-coupled receptors in intestinal chemosensation[J]. Cell Metabolism, 2012, 15: 421-431. DOI:10.1016/j.cmet.2011.12.019.
[7] NELSON G, CHANDRASHEKAR J, HOON M A, et al. An amino-acid taste receptor[J]. Nature, 2002, 416: 199-202. DOI:10.1038/nature726.
[8] ZHAO G Q, ZHANG Y, HOON M A, et al. The receptors for mammalian sweet and umami taste[J]. Cell, 2003, 115: 255-266. DOI:10.1016/S0092-8674(03)00844-4.
[9] LI X D, STASZEWSKI L, XU H, et al. Human receptors for sweet and umami taste[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(7): 4692-4696. DOI:10.1073/ pnas.072090199.
[10] MAGA J A. Flavor potentiators[J]. Critical Reviews in Food Science and Nutrition, 1983, 18: 231-312. DOI:10.1080/10408398309527364.
[11] RAWAL S, HAYES J E, WALLACE M R, et al. Do polymorphisms in the TAS1R1 gene contribute to broader differences in human taste intensity?[J]. Chemical Senses, 2013, 38: 719-728. DOI:10.1093/ chemse/bjt040.
[12] BRADFORD W, BUCKHOLZ A, MORTON J, et al. Eukaryotic G protein signaling evolved to require G protein–coupled receptors for activation[J]. Science Signaling, 2013, 6(276): 37. DOI:10.1126/ scisignal.2003768.
[13] ZHANG X H, de la CRUZ O, PINTO J M, et al. Characterizing the expression of the human olfactory receptor gene family using a novel DNA microarray[J]. Genome Biology, 2007, 8(5): R86. DOI:10.1186/ gb-2007-8-5-r86.
[14] 庞广昌, 陈庆森, 胡志和, 等. 五味调与营养平衡及其信号传导[J].食品科学, 2012, 33(13): 1-20.
[15] NELSON G, HOON M A, CHANDRASHEKAR J, et al. Mammalian sweet taste receptors[J]. Cell, 2001, 106(3): 381-390. DOI:10.1016/ S0092-8674(01)00451-2.
[16] MARTIN B, MAUDSLEY S, WHITE C M, et al. Hormones in the naso-oropharynx: endocrine modulation of taste and smell[J]. Trends in Endocrinology & Metabolism, 2009, 20(4): 163-170. DOI:10.1016/ j.tem.2009.01.006.
[17] KAWAI F, KURAHASHI T, KANEKO A. Adrenaline enhances odorant contrast by modulating signal encoding in olfactory receptor cells[J]. Nature Neuroscience, 1999, 2(2): 133-138. DOI:10.1038/5686.
[18] TONG J, MANNEA E, AIMÉ P, et al. Ghrelin enhances olfactory sensitivity and exploratory sniff i ng in rodents and humans[J]. Journal of Neuroscience the Off i cial Journal of the Society for Neuroscience, 2011, 31: 5841-5846. DOI:10.1523/JNEUROSCI.5680-10.2011.
[19] TRELLAKIS S, TAGAY S, FISCHER C, et al. Ghrelin, leptin and adiponectin as possible predictors of the hedonic value of odors[J]. Regulatory Peptides, 2011, 167: 112-117. DOI:10.1016/ j.regpep.2010.12.005.
[20] FIRESTEIN S, MENINI A. The smell of adrenaline[J]. Nature Neuroscience, 1999, 2: 106-108. DOI:10.1038/5661.
[21] JANG H J, KOKRASHVILI Z, THEODORAKIS M J, et al. Gutexpressed gustducin and taste receptors regulate secretion of glucagonlike peptide-1[J]. Proceedings of the National Academy of Sciences, 2007, 104(38): 15069-15074. DOI:10.1073pnas.0706890104.
[22] YOSHIDA R, OHKURI T, JYOTAKI M, et al. Endocannabinoids selectively enhance sweet taste[J]. Proceedings of the National Academy of Sciences, 2010, 107(2): 935-939. DOI:10.1073/ pnas.0912048107.
[23] LAGERSTROM M C, SCHIOTH H B. Structural diversity of G proteincoupled receptors and signif i cance for drug discovery[J]. Nature Reviews Drug Discovery, 2008, 7(4): 339-357. DOI:10.1038/nrd2518.
[24] RIERA C E, DILLIN A. Emerging role of sensory perception in aging and metabolism[J]. Trends in Endocrinology & Metabolism, 2016, 27(5): 294-303. DOI:10.1016/j.tem.2016.03.007.
[25] SWITHERS S E. Artificial sweeteners produce the counterintuitive effect of inducing metabolic derangements[J]. Trends in Endocrinology & Metabolism, 2013, 24(9): 431-441. DOI:10.1016/j.tem.2013.05.005. Epub2013Jul10.
[26] JOHNSTON C A, FOREYT J P. Robust scientif i c evidence demonstrates benefits of artificial sweeteners[J]. Trends in Endocrinology & Metabolism, 2014, 25(1): 1. DOI:10.1016/j.tem.2013.09.007.
[27] WHITE J F, NOINAJ N, SHIBATA Y, et al. Structure of the agonist-bound neurotensin receptor[J]. Nature, 2012, 490: 508-513. DOI:10.1038/nature11558.
[28] RALIOU M, GRAUSO M, HOFFMANN B, et al. Human genetic polymorphisms in T1R1 and T1R3 taste receptor subunits affect their function[J]. Chemical Senses, 2011, 36: 527-537. DOI:10.1093/ chemse/bjr014.
[29] ZHANG Y, HOON M A, CHANDRASHEKAR J, et al. Coding of sweet, bitter, and umami tastes: different receptor cells sharing similar signaling pathways[J]. Cell, 2003, 112(3): 293-301. DOI:10.1016/ S0092-8674(03)00071-0.
[30] KUSUHARA Y, YOSHIDA R, OHKURI T, et al. Taste responses in mice lacking taste receptor subunit T1R1[J]. The Journal of Physiology, 2013, 591(7): 1967-1985. DOI:10.1113/jphysiol.2012.236604.
[31] DAMAK S, RONG M Q, YASUMATSU K, et al. Detection of sweet and umami taste in the absence of taste receptor T1R3[J]. Science, 2003, 301: 850-853. DOI:10.1126/science.1087155.
[32] WAUSON E M, ZAGANJOR E, LEE A Y, et al. The G proteincoupled taste receptor T1R1/T1R3 regulates mTORC1 and autophagy[J]. Molecular Cell, 2012, 47(6): 851-862. DOI:10.1016/ j.molcel.2012.08.001.
[33] KINNAMON S C, Taste receptor signalling-from tongues to lung[J]. Acta Physiologiae, 2012, 204(2): 158-168. DOI:10.1111/j.1748-1716.2011.02308.x.
[34] LEE R J, COHEN N A. Taste receptors in innate immunity[J]. Cellular and Molecular Life Sciences, 2014, 72(2): 217-236. DOI:10.1007/ s00018-014-1736-7.
[35] KOJIMA I, NAKAGAWA Y. The role of the sweet taste receptor in enteroendocrine cells and pancreatic β-cells[J]. Diabetes & Metabolism Journal, 2011, 35(5): 451-457. DOI:10.4093/dmj.2011.35.5.451.
[36] JANG H J, KOKRASHVILI Z, THEODORAKIS M J, et al. Gutexpressed gustducin and taste receptors regulate secretion of glucagonlike peptide1[J]. Proceedings of the National Academy of Sciences, 2007, 104(38): 15069-15074. DOI:10.1073/pnas.0706890104.
[37] NAKAGAWA Y, NAGASAWA M, YAMADA S, et al. Sweet taste receptor expressed in pancreatic β-cells activates the calcium and cyclic AMP signaling systems and stimulates insulin secretion[J]. PLoS ONE, 2009, 4(4): e5106. DOI:10.1371/journal.pone.0005106.
[38] MASUBUCHI Y, NAKAGAWA Y, MA J, et al. A novel regulatory function of sweet taste-sensing receptor in adipogenic differentiation of 3T3-L1 cells[J]. PLoS ONE, 2013, 8(1): e54500. DOI:10.1371/ journal.pone.0054500.
[39] REN X Y, ZHOU L G, TERWILLIGER R, et al. Sweet taste signaling functions as a hypothalamic glucose sensor[J]. Frontiers in Integrative Neuroscience, 2009, 3: 1-16. DOI:10.3389/neuro.07.012.2009.
[40] KOJIMA I, NAKAGAWA Y, HAMANO K, et al. Glucose-sensing receptor T1R3: a new signaling receptor activated by glucose in pancreatic β-cells[J]. Biological and Pharmaceutical Bulletin, 2015, 38(5): 674-679. DOI:10.1248/bpb.b14-00895.
[41] ANTON S D, MARTIN C K, HAN H M, et al. Effects of stevia, aspartame, and sucrose on food intake, satiety, and postprandial glucose and insulin levels[J]. Appetite, 2010, 55(1): 37-43. DOI:10.1016/j.appet.2010.03.009.
[42] WU T, ZHAO B R, BOUND M J, et al. Effects of different sweet preloads on incretin hormone secretion, gastric emptying, and postprandial glycemia in healthy humans[J]. American Journal of Clinical Nutrition, 2012, 95(1): 78-83. DOI:10.3945/ajcn.111.021543. [43] WONG G T, GANNON K S, MARGOLSKEE R F. Transduction of bitter and sweet taste by gustducin[J]. Nature, 1996, 381: 796-800. DOI:10.1038/381796a0.
[44] BRAND J G, ZEEBERG B R, CAGAN R H. Biochemical studies of taste sensation. V. binding of quinine to bovine taste papillae and taste bud cells[J]. International Journal of Neuroscience, 1976, 7(1): 37-43. DOI:10.3109/00207457609147199.
[45] DESHPANDE D A, WANG W C H, MCILMOYLE E L, et al. Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction[J]. Nature Medicine, 2010, 16(11): 1299-1304. DOI:10.1038/nm.2237.
[46] SISIGNANO M, PARNHAM M J, GEISSLINGER G. Drug repurposing for the development of novel analgesics[J]. Trends in Pharmacological Sciences, 2015, 37(3): 172-183. DOI:10.1016/ j.tips.2015.11.006.
[47] SANDERSON M J, MADISON J M. Bitter treats for better breathing[J]. Nature Medicine, 2010, 16(11): 1190-1191. DOI:10.1038/nm1110-1190.
[48] BELVISI M G, DALE N, BIRRELL M A, et al. Bronchodilator activity of bitter tastants in human tissue[J]. Nature Medicine, 2011, 17: 776-778. DOI:10.1038/nm0711-776b.
[49] MORICE A H, BENNETT R T, CHAUDHRY M A, et al. Effect of bitter tastants on human bronchi[J]. Nature Medicine, 2011, 17(7): 775. DOI:10.1038/nm0711-775.
[50] ZHANG C H, LIFSHITZ L M, UY K F, et al. The cellular and molecular basis of bitter tastant-induced bronchodilation[J]. PLoS Biology, 2013, 11(3): e1001501. DOI:10.1371/journal.pbio.1001501.
[51] CATERINA M J, SCHUMACHER M A, TOMINAGA M, et al. The capsaicin receptor: a heat activated ion channel in the pain pathway[J]. Nature, 1997, 389: 816-824. DOI:10.1038/39807.
[52] RANDHAWA P K, JAGGI A S. TRPV1 and TRPV4 channels: potential therapeutic targets for ischemic conditioning-induced cardioprotection[J]. European Journal of Pharmacology, 2015, 746: 180-185. DOI:10.1016/j.ejphar.2014.11.010.
[53] QIAO L, JIAO L, PANG G C, et al. A novel pungency biosensor prepared with fixing taste-bud tissue of rats[J]. Biosensor and Bioelectronics, 2015, 68: 454-461. DOI:10.1016/ j.bios.2015.01.032.
[54] ARAI T, OHKURI T, YASUMATSU K, et al. The role of transient receptor potential vanilloid-1 on neural responses to acids by the chorda tympani, glossopharyngeal and superior laryngeal nerves in mice[J]. Neuroscience, 2010, 165(4): 1476-1489. DOI:10.1016/ j.neuroscience.2009.11.051.
[55] MORALES-LÁZARO S L, ROSENBAUM T. A painful link between the TRPV1 channel and lysophosphatidic acid[J]. Life Sciences, 2015, 125: 15-24. DOI:10.1016/j.lfs.2014.10.004.
[56] HECK G L, MIERSON S, de SIMONE J A. Salt taste transduction occurs through an amiloride-sensitive sodium transport pathway[J]. Science, 1984, 223: 403-405. DOI:10.1126/science.6691151.
[57] KRETZ O, BARBRY P, BOCK R. Differential expression of RNA and protein of the three pore-forming subunits of the amiloridesensitive epithelial sodium channel in taste buds of the rat[J]. Journal of Histochemistry & Cytochemistry, 1999, 47(1): 51-64. DOI:10.1093/ chemse/bji046.
[58] CHANDRASHEKAR J, KUHN C, OKA Y, et al. The cells and peripheral representation of sodium taste in mice[J]. Nature, 2010, 464: 297-301. DOI:10.1038/nature08783.
[59] BREZA J M, CONTRERAS R J. Anion size modulates salt taste in rats[J]. Journal of Neurophysiology, 2012, 107: 1632-1648. DOI:10.1152/jn.00621.2011.
[60] LYALL V, ALAM R I, PHAN D Q, et al. Decrease in rat taste receptor cell intracellular pH is the proximate stimulus in sour taste transduction[J]. American Journal of Physiology-Cell Physiology, 2001, 281: C1005-C1013.
[61] OKA Y, BUTNARU M, von BUCHHOLTZ L, et al. High salt recruits aversive taste pathways[J]. Nature, 2013, 494: 472-475. DOI:10.1038/ nature11905.
[62] LIMAN E R, ZHANG Y L V, CRAIG M. Peripheral coding of taste[J]. Neuron, 2014, 81: 984-1000. DOI:10.1016/j.neuron.2014.02.022.
[63] HUANG A L, CHEN X, HOON M A, et al. The cells and logic for mammalian sour taste detection[J]. Nature, 2006, 442: 934-938. DOI:10.1038/nature05084.
[64] ROPER S D. Signal transduction and information processing in mammalian taste buds[J]. Pflügers Archiv-European Journal of Physiology, 2007, 454: 759-776. DOI:10.1007/s00424-007-0247-x.
[65] HORIO N, YOSHIDA R, YASUMATSU K, et al. Sour taste responses in mice lacking PKD channels[J]. PLoS ONE, 2011, 6(5): e20007. DOI:10.1371/journal.pone.0020007.
[66] CHANG R B, WATERS H, LIMAN E R. A proton current drives action potentials in genetically identified sour taste cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107: 22320-22325. DOI:10.1073/pnas.1013664107.
[67] RICHTER T A, DVORYANCHIKOV G A, CHAUDHARI N, et al. Acid-sensitive two-pore domain potassium (K2P) channels in mouse taste buds[J]. Journal of Neurophysiology, 2004, 92(3): 1928-1936. DOI:10.1152/jn.00273.2004.
[68] WANG Y Y, CHANG R B, LIMAN E R. TRPA1 is a component of the nociceptive response to CO2[J]. Journal of Neuroscience, 2010, 30(39): 12958-12963. DOI:10.1523/JNEUROSCI.2715-10.2010.
[69] SHOICHET B K, KOBILKA B K. Structure-based drug screening for G-protein-coupled receptors[J]. Trends in Pharmacological Sciences, 2012, 33(5): 268-272. DOI:10.1016/j.tips.2012.03.007.
[70] WHORTON M R, MACKINNON R. X-ray structure of the mammalian GIRK2–bc G-protein complex[J]. Nature, 2013, 498: 190-196. DOI:10.1038/nature12241.
[71] SU C Y, MENUZ K, REISERT J, et al. Non-synaptic inhibition between grouped neurons in an olfactory circuit[J]. Nature, 2012, 492: 66-71. DOI:10.1038/nature11712.
[72] NAVRATILOVA I, BESNARD J, HOPKINS A L. Screening for GPCR ligands using surface plasmon resonance[J]. ACS Medicinal Chemistry Letters, 2011, 2(7): 549-554. DOI:10.1021/ml2000017.
[73] MARTINS S A, TRABUCO J R, MONTEIRO G A, et al. Towards the miniaturization of GPCR-based live-cell screening assays[J]. Trends in Biotechnology, 2012, 30(11): 566-574. DOI:10.1016/ j.tibtech.2012.07.004.
[74] MÉJARD R, GRIESSER H J, THIERRY B. Optical biosensing for label-free cellular studies[J]. Trends in Analytical Chemistry, 2014, 53: 178-186. DOI:10.1016/j.trac.2013.08.012.
[75] WU C S, DU L P, WANG D, et al. A novel surface acoustic wavebased biosensor for highly sensitive functional assays of olfactory receptors[J]. Biochemical and Biophysical Research Communications, 2011, 407: 18-22. DOI:10.1016/j.bbrc.2011.02.073.
[76] LEE S H, JIN H J, SONG H S, et al. Bioelectronic nose with high sensitivity and selectivity using chemically functionalized carbon nanotube combined with human olfactory receptor[J]. Journal of Biotechnology, 2012, 157(4): 467-472. DOI:10.1016/ j.jbiotec.2011.09.011.
[77] ROSS P, WEIHOFEN W, SIU F, et al. Isothermal chemical denaturation to determine binding affinity of small molecules to G-protein coupled receptors[J]. Analytical Biochemistry, 2015, 473: 41-45. DOI:10.1016/j.ab.2014.11.019.
[78] KOVACIC P, SOMANATHAN R. Mechanism of taste; electrochemistry, receptors and signal transduction[J]. Journal of Electrostatics, 2012, 70(1): 7-14. DOI:10.1016/j.elstat.2011.09.004.
[79] DUAN X X, LI Y, RAJAN N K. Quantification of the affinities and kinetics of protein interactions using silicon nanowire biosensors[J]. Nature Nanotechnology, 2012, 7(6): 401-407. DOI:10.1038/nnano.2012.82.
[80] CHEN P H, LIU X D, WANG B Q, et al. A biomimetic taste receptor cell-based biosensor for electrophysiology recording and acidic sensation[J]. Sensors and Actuators B, 2009, 139: 576-583. DOI:10.1016/j.snb.2009.02.067.
[81] KANG X B, PANG G C, LIANG X Y, et al. Study on a hydrogen peroxide biosensor based on horseradish peroxidase/GNPs-thionine/ chitosan[J]. Electrochimica Acta, 2012, 62(1): 327-334. DOI:10.1016/ j.electacta.2011.12.034.
[82] 康晓斌, 庞广昌, 梁新义. 牛IgG电化学纳米免疫传感器的研制[J].食品科学, 2011, 32(16): 379-383.
[83] LU D Q, LU F P, PANG G C. A novel glutathione-S transferase immunosensor based on horseradish peroxidase and double-layer gold nanoparticles[J]. Biomedical Microdevices, 2016, 18(3): 50. DOI:10.1007/s10544-016-0075-x.
[84] KANG X B, PANG G C, CHEN Q, et al. Fabrication of Bacillus cereus electrochemical immunosensor based on double-layer gold nanoparticles and chitosan[J]. Sensors and Actuators B, 2013, 177(1): 1010-1016. DOI:10.1016/j.snb.2012.12.018.
[85] WANG X Y, PANG G C Amplification systems of weak interaction biosensors: applications and prospects[J]. Sensor Review, 2015, 35(1): 30-42. DOI:10.1108/SR-03-2014-629.
Advances in Research on Taste Receptors and Application Prospects of Taste Sensors
PANG Guangchang, CHEN Qingsen, HU Zhihe, XIE Junbo
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
The color, smell and taste with perfect blend of the fi ve basic fl avors namely sourness, sweetness, bitterness, spice and saltiness as core criterion are three aspects to describe traditional Chinese diet and food cooking and processing. The internationally recognized fi ve tastes are identical to the Chinese ones except for the replacement of spice by umami. It is suggested that the taste of fat be def i ned as “aroma”, but the Chinese “aroma” belongs to the sense of smell, rather than the sense of taste. Accumulated evidences have demonstrated that the majority of taste receptors as a nutrient sensing system, such as bitterness, sweetness and umami, which have been used as the target for drug screening, belong to the super family of G protein coupled receptor, and its distribution is not restricted to the taste buds, intestinal tract and other tissues. Although a lot of achievements have made in the study of taste receptors, but so far, the instrumental determination of taste still depends on electronic nose and electronic tongue. Taste receptor-based biosensors and related technologies are still under exploration and research. The major reason is due to the effects of all receptors including taste receptors with weak interaction with their ligands. How to transform the weak interaction into signals such as light, sound, electric, magnetism and heat, which can be handled and amplif i ed by sensors to realize quantitative measurement, is a critical problem. Because of the great prospects for the development and application of taste receptors in medical screening, functional evaluation of foods and additives, and the prevention of metabolic syndromes, developing detection methods based on using taste receptors is always one of the research focuses. This article aims to provide a systematic review of recent advances in our knowledge about taste receptors and in the development of taste receptor-based biosensors. The prospects for their future application are discussed as well.
G-protein-coupled receptors (GPCRs); biosensor; taste receptors; electronic tongue
10.7506/spkx1002-6630-201705047
R151.41
A
1002-6630(2017)05-0288-11
庞广昌, 陈庆森, 胡志和, 等. 味觉受体及其传感器研究与应用[J]. 食品科学, 2017, 38(5): 288-298. DOI:10.7506/ spkx1002-6630-201705047. http://www.spkx.net.cn
PANG Guangchang, CHEN Qingsen, HU Zhihe, et al. Advances in research on taste receptors and application prospects of taste sensors[J]. Food Science, 2017, 38(5): 288-298. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705047. http://www.spkx.net.cn
2016-06-26
国家自然科学基金面上项目(31371773)
庞广昌(1956—),男,教授,博士,研究方向为食品生物技术和生物传感器。E-mail:pgc@tjcu.edu.cn
——以“收”为主 多酸少辛

