空间微重力环境对骨代谢影响的研究进展
苗治平,仇伍霞,马小莉,骞爱荣
(西北工业大学生命学院空间生物实验模拟技术国防重点学科实验室骨代谢研究室,西安710072)
空间微重力环境对骨代谢影响的研究进展
苗治平,仇伍霞,马小莉,骞爱荣
(西北工业大学生命学院空间生物实验模拟技术国防重点学科实验室骨代谢研究室,西安710072)
详细介绍了空间微重力环境对航天员骨代谢影响的国内外研究现状,并总结实验动物和骨组织细胞的太空飞行实验结果以及失重性骨丢失发生的可能机制。介绍了利用新型抗磁悬浮模拟失重技术平台获得的部分细胞实验结果。提出了尚需研发更多新型地基微重力模拟平台来开展骨代谢研究,同时需要更多真实空间飞行机会的进一步验证,为我国空间生物医学的发展建设提供参考。
微重力;空间飞行;骨丢失;骨代谢;骨组织细胞
0 引 言
随着载人航天事业的迅速发展,空间飞行环境对航天员健康的影响引起越来越多的关注。对于航天员来说,首先面临的一个问题是重力场环境的改变,包括在轨航行或远程星际航行中的低重力环境(特别是失重环境),以及在其他天体上与地面环境截然不同的重力环境。因此,自1961年人类飞上太空以来,空间微重力环境对人体生理及心理的影响就成为科学研究关注的热点。
骨是一种动态更新的组织,对力学刺激的变化非常敏感。因此,重力或机械力刺激对骨骼系统的生长、发育及功能维持非常重要。目前研究表明,空间失重环境引起骨代谢紊乱,导致骨丢失。失重性骨丢失位列影响航天员身体健康的各种风险因素之首,直接影响中长期载人航天任务的顺利执行。因此空间失重性骨丢失一直是航天医学领域的重要课题。
基于以上研究背景及分析,本文首先综述空间微重力对航天员骨代谢的影响,由于航天员的数量极为有限,因此结合空间动物和细胞搭载试验,详细分析了空间飞行对实验动物骨代谢的影响及细胞学机制。为我国未来空间生物医学的发展建设提供参考。
1 空间微重力条件对航天员骨代谢的影响
地球上的生命在地球重力环境(1g)下生长与发育,因此重力在维持人类正常生理功能中发挥重要作用。骨骼作为人体的力学支撑结构,其结构与功能已适应地球重力环境且受到重力环境影响。骨组织持续不断地进行着吸收和形成的平衡,这一代谢过程称为骨重建[1]。骨重建过程对力学刺激的变化非常敏感,因此,重力或机械力刺激对骨骼系统的生长、发育及功能维持非常重要。目前研究表明,空间失重环境主要引起承重骨骨质流失,且这种骨质流失是难以逆转的,即使返回地面也难以完全恢复。
1.1 航天员骨矿密度的变化
早在20世纪60年代,美国第二个载人航天飞行计划“双子座”就采用了X-射线光密度分析法对航天员飞行前、后的手骨、脚骨的变化进行了分析。此后的载人航天飞行计划均对空间飞行对骨代谢的影响开展了实验研究,研究历史及方法如图1所示[2]。美国高校空间研究协会的LeBlanc等[3],NASA约翰逊航天中心的Nagaraja等[4]、Smith等[5]对这些研究进行了详细的文献分析与综述。研究表明,长期空间飞行(>30天)引起航天员严重的骨质流失,骨质流失具有一定的部位选择性,且在返回地面后恢复缓慢。
(1)长期空间飞行引起航天员严重的骨质流失
在60位参与了和平号(Mir)空间站和国际空间站(ISS)长期空间飞行任务(平均176±45天)的美、俄航天员中,约92%的人至少有一处骨骼部位发生最少5%的骨质流失,40%的人至少有一处骨骼部位遭受10%或更多的骨质流失,如图2所示[3]。
苏联航天员在75~184天空间飞行后,跟骨的骨矿密度(Bone mineral density,BMD)下降0.9% ~19.8%,在礼炮号空间站停留5~7个月的航天员的脊椎骨BMD约丢失0.3%~10.8%[6-8]。在和平号空间站执行任务的航天员中,一个月内,一名航天员的跟骨骨量减少了7.74%,胫骨骨小梁骨量减少2.27%;经过6个月后,另一名航天员的胫骨骨量与其飞行前相比,小梁骨和皮质骨分别丢失4.5%和2.9%[9]。对18名俄罗斯航天员在和平号空间站4~14.4个月空间飞行前后BMD的研究如表1所示。航天员的总体BMD平均每月减少0.3%,髋骨BMD每月减少1.0%~1.5%,腰椎骨BMD每月减少1%,相当于一个妇女绝经后一年的骨质流失量[3,6,8 ]。
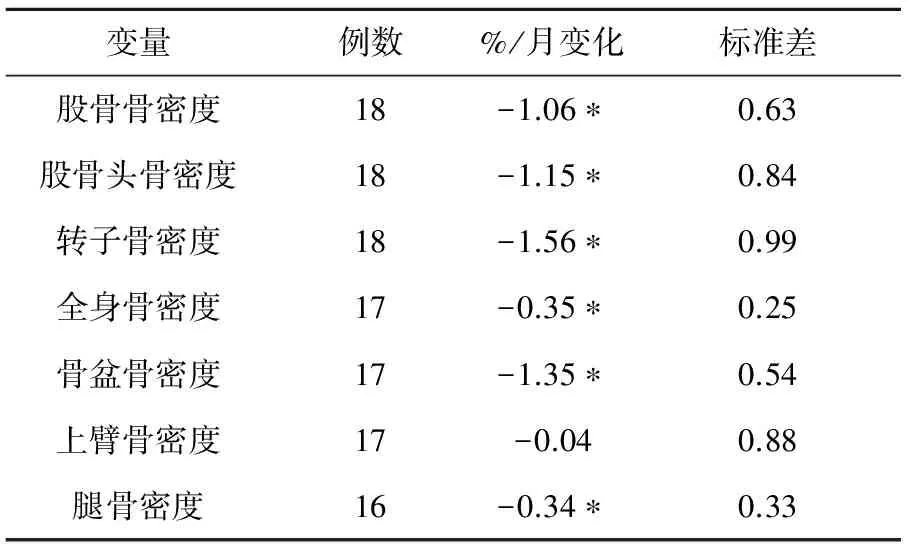
表1 和平号空间站4~14.4个月空间飞行任务航天员骨密度变化
注:*P<0.01, 有显著差异
对国际空间站(ISS)上执行任务的8名航天员BMD研究结果显示,7名航天员腰椎骨密度下降2.5%~10.6%,4名航天员股骨颈处骨密度减少1.7%~10%,而全部航天员股骨部分骨密度均减少3%~10%[10]。通过对14名航天员在国际空间站完成4~6个月空间飞行任务前后的骨质流失研究,得到的结果与和平号空间站类似,如表2所示。航天员髋骨BMD平均每月减少1.2%~1.5%。腰椎骨BMD每月减少0.8%~0.9%[3, 11-12]。
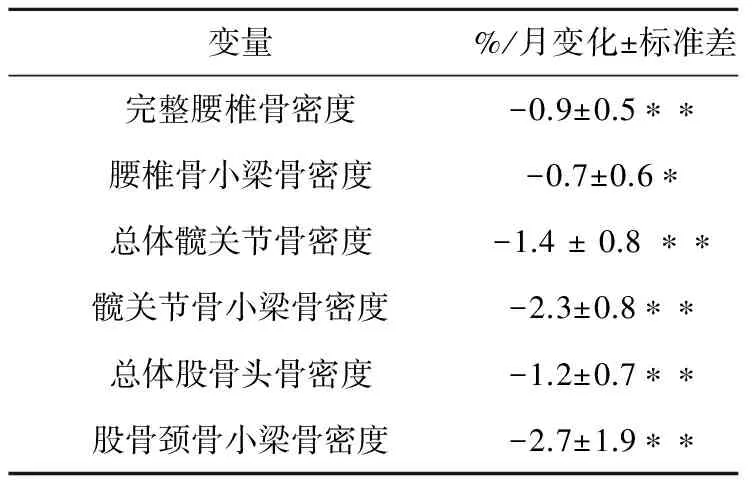
表2 国际空间站4~6个月空间飞行任务航天员骨密度变化
注:*P<0.01; **P<0.001, 有显著差异
对2000-2009年在国际空间站执行过长期飞行任务(平均任务长度170~175天)的20名男航天员与5名女航天员的骨质流失对照实验还表明,在微重力环境下,男航天员髋骨BMD平均每月减少1.3%,远远超过女航天员的0.55%[13]。为了尽量减少微重力环境下的骨质流失,目前采取的对抗措施一是通过先进的机械进行适当的体育锻炼和对抗性训练,如跑步机、间歇阻抗训练装置(Interim resistive exercise device,IRED)和先进阻抗训练装置(Advanced resistive exercise device,ARED);二是进行药物干预,如双膦酸盐类药物等。但这些方法的效果并不是很明显,如图3所示[14-15]。
(2)微重力环境下骨质流失具有一定的部位选择性
微重力环境下骨质流失存在着一定的部位选择性,主要发生在承重骨(跟骨、胫骨、股骨、椎骨),而非承重骨(桡骨、尺骨)则不明显。Ruggiu等对当前长期空间飞行后航天员不同部位骨质流失研究结果进行了总结,如图4所示[16]。通过对空间飞行前后不同骨部位的CT扫描,利用统计参数图(Statistical parametric mapping,SPM)或超阈值聚类分析(Suprathreshold cluster analysis,STCA)等方法对扫描图像进行分析,可以检测空间飞行后骨质流失区域,判断哪些部位遭受了最大骨质流失[17]。从百分比来看,骨质流失在小梁骨比皮质骨更为严重,特别是在腿部;从骨量来看,腿部骨量的丢失,特别是皮质骨的丢失最大[18]。
(3)经历骨质流失的航天员恢复缓慢
由于空间微重力环境下骨质丢失主要发生在承重骨,当航天员回到地面正常重力环境后,在一段时间内骨质流失的情况并不会得到显著改善,骨密度在较长时间内难以恢复到飞行前的水平。16名在在国际空间站飞行了4~6个月的航天员在返回地球一年后,股骨近端的骨量基本恢复正常,但骨密度与骨强度均只有部分恢复[19]。NASA格林研究中心采用骨折风险分析模型(Bone fracture risk model, BFRM)对长期空间飞行的航天员骨质流失数据进行分析,与飞行前相比,航天员抗骨折能力平均下降12%,恢复一年后仍下降5%,未能恢复到飞行前水平[20-21]。对和平号空间站和国际空间站平均飞行时间达179天的15名男性航天员骨质恢复研究表明,一年后这些航天员大多数骨骼部位的BMD偏低,三年后髋骨BMD仍然低于预期值,如表3所示[22-24]。NASA约翰逊航天中心对45名在和平号空间站和国际空间站飞行了4~6个月的航天员骨密度恢复进行跟踪研究,大多数航天员骨密度在三年后才恢复到飞行前水平,即骨密度恢复时间是飞行任务时间的6倍[25-27]。加拿大麦克马斯特大学Williams等对大量研究空间飞行对人体生理机能影响的NASA技术报告与医学文献进行了综述,研究表明尽管在返回地球后大多数生理影响会在短期内消失,但骨矿质流失可能产生永久后果。大部分经历长期空间飞行的航天员骨密度在三年后恢复,但有些航天员永远恢复不到飞行前水平[28]。
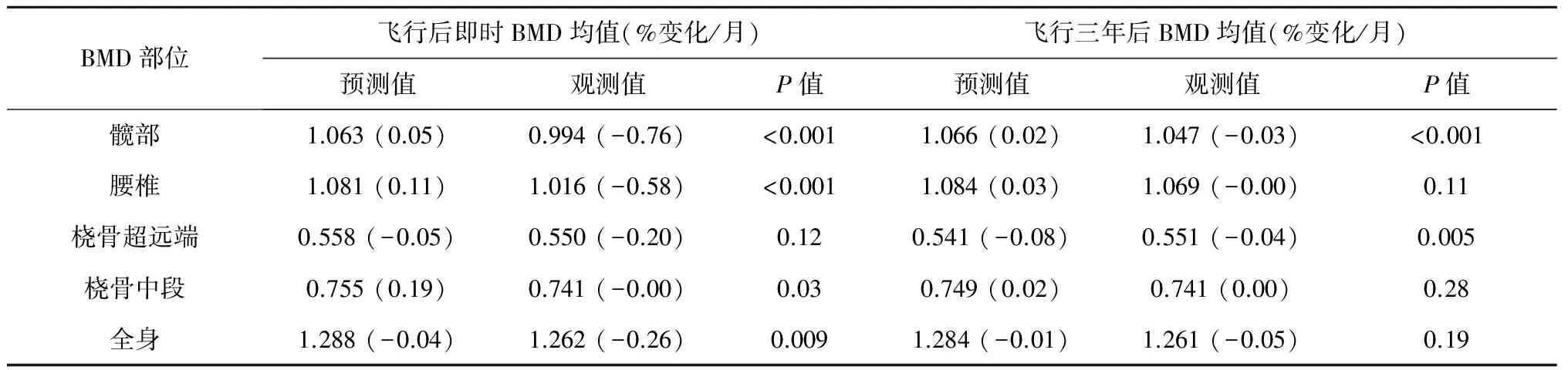
表3 长期空间飞行后航天员骨密度恢复结果
1.2 空间飞行引起骨重建生化标志物的变化
正常的骨重建过程依赖于骨吸收和骨形成过程的动态平衡,微重力环境则打破了这一平衡。对天空实验室(Skylab)、和平号空间站和国际空间站执行长期空间飞行任务的航天员骨重建生化标志物的研究表明,在空间飞行中,航天员的骨形成生化标志物减少或不变,骨吸收生化标志物增加,从而导致骨质流失。大部分研究认为,骨形成受到抑制是骨质流失的主要原因[5, 29]。Smith等总结了空间飞行对骨代谢与骨生化的影响,如图5所示[5]。
对在和平号空间站执行180天空间飞行任务的航天员骨重建研究发现,在飞行过程中,航天员的骨形成生化标志物,包括骨碱性磷酸酶(Bone alkaline phosphatase,BALP)、血清完整骨钙素(Intact osteocalcin,IBGP)和 Ι型胶原羧基前体肽(Procollagen type i c-terminal propeptide,PICP)分别下降了27%、38%和28%。航天员的骨吸收生化标志物,包括游离脱氧吡啶啉(Free deoxypyridinoline,F D-Pyr)和I型胶原 C 端肽(C-telopeptide,简称CTX)在飞行过程中增加了54%和78%。研究证实,微重力对骨形成有较强的抑制作用[30]。另一项对和平号空间站飞行115天的航天员的研究显示,在长期飞行过程中骨形成生化标志物BALP下降了36%,骨钙素(Osteocalcin,OCN)下降了7%,骨吸收生化标志物则增加了50%。骨质流失可能是由于钙摄入减少,钙排出增加与骨吸收增加的综合结果[31]。美、俄联合对在和平号空间站执行4~6个月空间飞行任务的13名航天员开展骨重建研究,骨吸收生化标志物在飞行中增加了75%~125%,在飞行后也增加50%~75%。骨吸收生化标志物BSALP和OCN在飞行中没有发生变化,但在飞行后显著增加。研究认为,在微重力环境下,骨吸收增加和钙吸收减少导致了骨质流失[32]。对35名在1994-2010年间在和平号空间站和国际空间站执行任务120~180天的NASA航天员进行的骨重建研究表明,骨吸收生化标志物NTX在飞行期间显著增加,骨形成生化标志物BALP在飞行初期降低,后来则保持不变,如图6所示。骨吸收大于骨形成,从而导致了航天员髋骨与腰椎骨BMD平均每月减少1.0%~1.5%[33]。
为了计算长期空间飞行任务后骨重建变化,为骨质流失恢复提供科学依据,美国国家空间生物医药研究院与NASA格林研究中心将定量CT(QCT)方法与骨重建计算模型相结合,对骨强度进行分析预测。NASA未来计划将航天员送上火星,完成长达三年的空间任务,这一计算模型将可用于预测在微重力环境下工作1000天的骨质流失情况,为超长期空间飞行任务骨质流失研究奠定良好基础[34]。
2 空间微重力条件对实验动物骨代谢影响
因航天员的数量极为有限,空间动物搭载试验成为空间微重力环境对骨代谢影响研究的重要途径。在航天飞机上的搭载实验发现,56天大的雄鼠在空间飞行14天,股骨末端BMD下降,肱骨与胫骨未发现骨质流失。骨吸收生化标志物显著增加,骨形成生化标志物则没有变化。在飞行结束后14天(与飞行时间相当)对雄鼠进行观察,虽然矿化和骨形成参数提示骨质已开始增加,但有些部位仍未能逆转[35]。
另一项航天飞机15天的动物搭载试验表明,小鼠的骨盆与股骨区域骨质流失极为严重,大致相当于BMD平均每月减少12%~24%,远远超过航天员平均每月1%~2%的流失水平[36-37]。日本科学家最新研究发现[38],空间微重力条件促进青鳉鱼成骨细胞和破骨细胞中特异性基因转录水平急性上调。意大利航天局开发了“小鼠抽屉系统”(Mice drawer system,MDS),将野生型与多效生长因子(Pleiotrophin,PTN)转基因型小鼠放置其中,在国际空间站进行了为期91天的动物搭载试验。野生型与转基因型小鼠均发生承重骨骨质流失,小梁骨厚度未见变化但骨量减少[39]。观察发现,PTN转基因型小鼠受到微重力的负面影响少于野生型小鼠,表明PTN促进了成骨细胞骨形成活动,产生了一定的保护作用。
还有一项在航天飞机上进行的12天雌鼠搭载试验表明,骨保护素-Fc(Osteoprotegerin,OPG)能持续抑制破骨细胞引发的骨吸收,从而有效减轻骨质流失[40]。Blaber等对近期开展的两项长期空间动物搭载试验进行了对比分析,一项是为期30天的BionM1生物实验卫星上的雄鼠试验,另一项则是37天的国际空间站“啮齿动物研究计划-1”(Rodent research 1,RR1)的雌鼠试验。两个试验中的小鼠股骨头均发生严重的骨质流失,BionM1项目中的小鼠还出现了明显的老化与骨质疏松迹象,如图7所示[41-42]。这些空间动物搭载实验也表明,微重力条件可导致严重的骨质流失,并影响骨重建过程。
3 空间微重力条件对骨组织细胞的影响
骨组织细胞主要包括骨髓间充质干细胞、成骨细胞、骨细胞、破骨细胞等。当骨组织损伤或所承受的机械应力改变时,破骨细胞首先被激活释放能够分解骨基质的氢离子和水解酶,从而在骨组织表面形成骨吸收陷窝,同时,骨髓间充质干细胞被募集并分化为成骨细胞[43]。成骨细胞分泌类骨质,与钙和磷等矿物质一起通过矿化过程沉积至骨陷窝中,同时,成骨细胞成熟为骨细胞,将自身包埋进新的骨基质中,并通过其树突状的结构连接起来(图8)。空间飞行研究表明,微重力通过影响骨组织细胞作用而抑制骨形成,促进骨吸收,从而使骨重建失衡(图9)。
3.1 骨髓间充质干细胞
骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)是成年人骨髓中的多能干细胞,具有多向分化潜能。微重力所引起骨髓间充质干细胞的功能紊乱会影响骨形成。研究表明,微重力直接影响骨髓间充质干细胞增殖、细胞周期、细胞骨架、基因和蛋白表达和细胞凋亡等。目前,对真实微重力环境对BMSCs影响的研究较少,多数为模拟微重力环境下的研究,不在本文讨论范围内。Monticone 等[45]研究发现微重力对骨髓间充质干细胞最显著的影响就是对其定向分化的改变。8天的空间飞行抑制了骨髓间充质干细胞的细胞增殖,促进小鼠股骨和胫骨BMSCs细胞中神经发育相关基因表达,但抑制细胞周期相关基因表达。发现号航天飞机15天的雌鼠搭载试验表明,微重力环境使得骨髓腔增大,骨髓细胞增殖与分化标志物下降,巨核细胞减少,红细胞滞留,BMSCs分化能力明显下降[46]。2016年4月,我国首颗微重力科学实验卫星“实践十号”返回式科学实验卫星成功发射,顺利完成了12天的空间飞行。“实践十号”进行的19项科学实验包括浙江大学承担的“微重力条件下骨髓间充质干细胞的成骨细胞定向分化效应及分子机制研究”项目,目的是研究空间微重力环境BMSCs分化为成骨细胞潜能的变化,以及微重力影响BMSCs成骨分化的细胞信号通路[47]。
3.2 成骨细胞
成骨细胞作为骨形成的主要功能细胞,负责骨基质的合成、分泌与矿化,在维持骨重建平衡中发挥重要作用。微重力会改变成骨细胞形态,抑制成骨细胞增殖、分化,使其凋亡增加,微观上表现为细胞增殖相关基因表达下调,分化相关基因表达下调,胶原Ⅰ蛋白、骨钙蛋白和骨骼生长因子含量减少[48-49]。通过观察在国际空间站短暂飞行10天后的成骨细胞,可以发现成骨细胞形态发生明显改变,如细胞变圆变大、形态不规则、细胞质变大、细胞骨架变细等。研究认为,微重力条件下微管蛋白体积密度显著降低,很难组装形成有序的微管结构,导致细胞骨架损伤,使成骨细胞表面形态变得不规则[50]。Landis等[51]将从不同年龄鸡胚胎颅骨分离的原代成骨细胞搭载于奋进号航天飞机(STS-59)上,空间飞行5 d后,I型胶原(Type I collagen,Col I)和OCN的表达显著下降,表明,空间飞行减慢了成骨细胞分化的进程。Carmeliet等[52]使用MG-63成骨样细胞系得到了相似的结论。目前研究表明,失重环境下成熟成骨细胞数量减少,成骨细胞活性下降,分化能力下降导致骨形成减少是引起失重性骨质流失的重要原因之一[53-54]。
3.3 骨细胞
骨细胞是成熟骨组织中含量最丰富的细胞类型,占骨组织细胞的90~95%。研究表明骨细胞是骨组织感知与响应力学刺激的细胞学基础[55]。骨细胞对力学刺激很敏感,是骨组织最重要的力学感受器之一[56-57],可能会在感知与响应微重力中起重要作用。返回式卫星Bion-11空间搭载飞行 14天后,猴子髂骨中一些年轻的骨细胞激活了适应性骨重建过程中胶原蛋白的生物合成[58]。大鼠经过12.5天的空间飞行后,与地面对照组相比,皮质骨骨膜中的骨细胞功能退化[59];经过两周的SLS-2空间飞行后,在骨矿物质吸收增强区域,成骨细胞和骨细胞发生破坏[60]。近年来,中、美联合开发了基于骨细胞生存能力的小梁骨重建(Osteocyte-viability-based trabecular bone remodeling,OVBR)模型,为定量分析微重力环境下的航天员或长期卧床试验人员的小梁骨骨质流失与显微结构退化提供了有效的工具[61]。
3.4 破骨细胞
在骨重建过程中,骨形成和骨吸收紧密联系,破骨细胞负责骨吸收[62]。一般认为,短期曝露于微重力环境中,破骨细胞的功能没有较大的改变,即骨吸收功能未受失重的影响。经过17天的空间飞行,大鼠盆骨和胸椎骨中,成骨细胞数量减少,而破骨细胞的数量没有变化[63]。搭载于生物实验卫星“Cosmos-1129”上的Wistar大鼠经过18.5天的轨道飞行后,体内的破骨细胞数量未发生变化。但也有报道称微重力环境影响破骨细胞形成及其骨吸收能力。蝾螈在生物试验卫星“Cosmos-2229”上飞行20天后,长骨骨内膜表面的骨吸收活动被激活[64]。在航天飞机上进行的15天飞行试验研究表明,微重力下破骨细胞成倍增长,成熟多核破骨细胞数量增加53.8%,骨吸收生化标志物TRAP-5b血浆抗酒石酸酸性磷酸酶(Tartrate resistant acid phosphatase,TRAP)增加9.35%[36, 42]。由破骨前体细胞Raw264.7细胞诱导而来的破骨细胞搭载于Foton M3卫星飞行后,与地面对照组相比,离散的骨吸收陷窝总数增加[65]。在Fonton M3卫星上开展的三项破骨细胞试验表明,微重力环境下破骨成熟与活性相关基因成倍增长[66]。中国航天员科研训练中心等多家单位共同研究发现,在微重力环境下,破骨细胞分泌富含microRNA的外泌体,其中小核酸分子(microRNA-214)会转移至成骨细胞,抑制成骨细胞的功能,并且通过两种蛋白ephrinA2和EphA2之间的相互作用,外泌体特异性地识别成骨细胞,抑制成骨细胞活性,导致骨质疏松的发生,如图10所示[67]。
4 “空间生物实验模拟技术国防重点学科实验室”
开展的微重力对骨代谢影响的研究进展
由于空间飞行实验机会少、费用高、条件难控制。因此,研制地基模拟失重条件平台,并利用地基平台开展预先研究是非常必要的。依托西北工业大学的“空间生物实验模拟技术国防重点学科实验室”,建立了国内唯一的长时间新型模拟失重技术平台——抗磁悬浮模拟失重平台[68-69](图11)。作者所在研究团队利用该平台开展了骨组织细胞相关研究,结果表明:抗磁悬浮模拟失重影响了成骨细胞形态、细胞骨架、增殖及粘附功能和细胞骨架相关基因的变化[70-72],影响了骨细胞形态、细胞骨架以及能量代谢相关基因表达[73-74](图12),促进了破骨细胞的分化[75]。部分结果与真实空间飞行结果一致,提示该平台可以用于地面模拟失重条件的研究,为空间飞行研究提供很好的前期实验基础。
5 结论与展望
随着载人航天事业的迅速发展,空间飞行中所面对的空间环境对人体健康的影响引起越来越多的关注。其中空间微重力环境引起的骨质流失,位列影响航天员身体健康的各种风险因素之首,制约着人类进行深空探索。骨是一种动态更新的组织,它持续不断地进行着骨吸收和骨形成的骨重建平衡,骨重建过程对力学刺激的变化非常敏感。空间飞行实验表明:微重力环境引起航天员承重骨骨密度下降、骨形成标志物下降而骨吸收标志物上升;微重力条件影响实验动物承重骨骨量及骨重建过程,导致严重的骨质流失。此外,微重力条件影响了骨组织细胞结构和功能,主要表现为:微重力条件抑制骨髓间充质干细胞及成骨细胞分化能力,抑制骨细胞功能,增强破骨细胞分化及骨吸收能力,并促使破骨细胞分泌富含microRNA的外泌体,抑制成骨细胞的功能。尽管目前已有部分研究阐明微重力对骨组织细胞功能的影响及作用机制,但由于空间飞行机会少、费用高、条件难控制,此外由于骨组织细胞的多样性及细胞间相互作用的复杂性,其作用机制仍需要深入细致的研究。尚需研发更多新型地面模拟平台并开展相应的研究,同时需要更多真实空间飞行机会的进一步验证。
[1] Pivonka P, Zimak J, Smith D W, et al. Theoretical investigation of the role of the RANK- RANKL- OPG system in bone remodeling [J]. J Theor Biol, 2010, 262(2): 306-316.
[2] Sibonga J D. Effect of microgravity on bones: challenges to addressing risks to human health and performance [C]. Endocrine Grand Rounds, McGuire Veterans Affairs, 2014, Richmond, VA, United States.
[3] LeBlanc A D, Spector E R, Evans H J, et al. Skeletal responses to space flight and the bed rest analog:a review [J]. J Musculoskelet Neuronal Interact, 2007, 7(1): 33-47.
[4] Nagaraja M P, Risin D. The current state of bone loss research: data from spaceflight and microgravity simulators [J]. J Cell Biochem, 2013, 114(5): 1001-1008.
[5] Smith S M, Abrams S A, Davis-Street J E, et al. Fifty years of human space travel: implications for bone and calcium research [J]. Annu Rev Nutr, 2014, 34:377-400.
[6] LeBlanc A, Schneider V, Shackelford L, et al. Bone mineral and lean tissue loss after long duration space flight [J]. J Musculoskelet Neuronal Interact, 2000, 1(2): 157- 160.
[7] Sibonga J. Spaceflight- induced bone loss: is there a risk for accelerated osteoporosis after return? [C]. Space Physiology, Galveston, TX, United States, 2008.
[8] Cavanagh P R, Licata A A, Rice A J. Bone loss in long-duration spaceflight: measurements and countermeasures [J]. Gravit Space Biol Bull, 2005, 18(2):39-58.
[9] Collet P, Uebelhart D, Vico L, et al. Effects of 1-and 6-month spaceflight on bone mass and biochemistry in two humans [J]. Bone, 1997, 20(6): 547-551.
[10] Kozlovskaya I B, Grigoriev A I. Russian system of countermeasures on board of the International Space Station (ISS): the first results [J]. Acta Astronautica, 2004, 55(3): 233-237.
[11] Lang T, Leblanc A, Evans H, et al. Cortical and trabecular bone mineral loss from the spine and hip in long-duration spaceflight [J]. J Bone Miner Res, 2004, 19(6):1006-1012.
[12] Alleyne C W. International space station and the science of microgravity [C]. National Institute of Higher Education Public Lecture, Trinidad and Tobago, 2011.
[13] Ellman R, Sibonga J, Bouxsein M. Male astronauts have greater bone loss and risk of hip fracture following long duration spaceflights than females [C]. American Society of Bone Mineral Research, Toronto, Canada, 2010.
[14] LeBlanc A, Matsumoto T, Jones J A, et al. Bisphosphonates as a countermeasure to space flight induced bone loss [C]. Aerospace Medicine, Technical Report.
[15] Sibonga J D. Spaceflight-induced changes to bone [C]. Space Life Sciences Summer Institute, Houston, TX, United States, 2015.
[16] Ruggiu A, Cancedda R. Bone mechanobiology, gravity and tissue engineering: effects and insights [J]. J Tissue Eng Regen Med, 2015, 9(12): 1339-1351.
[17] Zhao Q, Li W, Li C, et al. A statistical method (cross-validation) for bone loss region detection after spaceflight [J]. Australas Phys Eng Sci Med, 2010, 33(2): 163-169.
[18] Sibonga J D, Cavanagh P R. Adaptation of the skeletal system during long-duration spaceflight [J]. Clin Rev Bone Miner Metab, 2007, 5(4): 249- 261.
[19] Lang T F, Leblanc A D, Evans H J, et al. Adaptation of the proximal femur to skeletal reloading after long-duration spaceflight [J]. J Bone Miner Res, 2006, 21(8):1224-1230.
[20] Lewandowski B E, Myers J G, Nelson E S, et al. Risk assessment of bone fracture during space exploration missions to the moon and mars [J]. Clin Orthop Relat Res, 2007, 466(1):81-89.
[21] Lewandowski B, Myers J, Licata A. Probabilistic risk assessment for astronaut post flight bone fracture [C]. NASA Human Research Program Investigators' Workshop Integrated Pathways to Mars, Galveston, TX, United States, 2015.
[22] Sibonga J, Amin S. Epidemiologic analyses of risk factors for bone loss and recovery related to long-duration space flight [C]. 2010 NASA Human Research Program Investigators' Workshop, Houston, TX, United States, 2010.
[23] Amin S, Achenbach S, Atkinson E, et al. Bone density following long duration space flight and recovery [J]. J Bone Miner Res, 25: S193-S193, 2010.
[24] Amin S, Achenbach S J, Atkinson E J, et al. Bone density following three years of recovery from long-duration space flight [C]. 18th Humans in Space Symposium, Houston, TX, United States, 2011.
[25] Sibonga J D, Evans H J, Sung H G, et al. Recovery of spaceflight- induced bone loss: bone mineral density after long-duration missions as fitted with an exponential function [J]. Bone, 2008, 41(6): 973-978.
[26] Amin S. Mechanical factors and bone health: effects of weightlessness and neurologic injury [J]. Current Rheumatology Reports, 2010, 12(3): 170- 176.
[27] Sibonga J D. Space: the final frontier of bone density [C]. ISCD (International Society for Clinical Densitometry) 17th Annual Meeting, Miami, FL, United States, 2011.
[28] Williams D, Kuipers A, Mukai C, et al. Acclimation during space flight: effects on human physiology [J]. Canadian Medical Association Journal, 2009, 180(13):1317-1323.
[29] Smith S M, Heer M. Calcium and bone metabolism during spaceflight[J]. nutrition, 2002, 18(10): 849-852.
[30] Caillot-Augusseau A, Lafage-Proust M H, Soler C, et al. Bone formation and desorption biological markers in cosmonauts during and after a 180-day space flight (Euromir 95) [J]. Clinical Chemistry, 1998, 44(3): 578-585.
[31] Smith S M, Wastney M E, Morukov B V, et al. Calcium metabolism before, during, and after a 3-mo spaceflight: kinetic and biochemical changes[J]. Am J Physiol, 1999, 277(1Pt2): R1- 10.
[32] Smith S M, Wastney M E, O'Brien K O, et al. Bone markers, calcium metabolism, and calcium kinetics during extended-duration space flight on the mir space station[J]. J Bone Miner Res, 2005, 20(2): 208-218.
[33] Orwoll E S, Adler R A, Amin S, et al. Skeletal health in long-duration astronauts:nature, assessment, and management recommendations from the NASA bone summit [J]. J Bone Miner Res, 2013, 28(6): 1243-1255.
[34] Chang K L, Pennline J A. Predicting bone mechanical state during recovery after long- duration skeletal unloading using QCT and finite element modeling [M]. NASA/TM-2013-217842.
[35] Lafage-Proust M H, Collet P, Dubost J M, et al. Space-related bone mineral redistribution and lack of bone mass recovery after reambulation in young rats [J]. Am J Physiol, 1998, 274(2Pt 2):R324-334.
[36] Blaber E A, Dvorochkin N, Lee C, et al. Microgravity induces pelvic bone loss through osteoclastic activity, osteocytic osteolysis, and osteoblastic cell cycle inhibition by CDKN1a/p21 [J]. PLoS One, 2013, 8(4):e61372.
[37] Grimm D, Grosse J, Wehland M, et al. The impact of microgravity on bone in humans [J]. Bone, 2016, 87:44-56.
[38] Chatani M, Morimoto H, Takeyama K, et al. Acute transcriptional up-regulation specific to osteoblasts/osteoclasts in medaka fish immediately after exposure to microgravity [J]. Sci Rep, 2016, 6:39545.
[39] Tavella S, Ruggiu A, Giuliani A, et al. Bone turnover in wild type and pleiotrophin- transgenic mice housed for three months in the International Space Station (ISS) [J]. PLoS one, 2012, 7(3): e33179.
[40] Lloyd S A, Morony S E, Ferguson V L, et al. Osteoprotegerin is an effective countermeasure for spaceflight-induced bone loss in mice [J]. Bone, 2015, 81: 562-572.
[41] Blaber E A, Cheng-Campbell, M A, Almeida E A C. Femoral head bone loss following short and long-duration spaceflight [C]. Annual Meeting of the American Society for Gravitational and Space Research (ASGSR) Cleveland, United States, Oct 26-29. 2016.
[42] Cheng-Campbell M A, Blaber E A, Almeida E A C. Change in mouse bone turnover in response to microgravity on RR-1 [C]. Annual Meeting of the American Society for Gravitational and Space Research (ASGSR) Cleveland, United States, Oct 26-29. 2016.
[43] Hadjidakis D J, Androulakis I I. Bone remodeling [J]. Ann N Y Acad Sci, 2006, 1092(1): 385-396.
[44] Shang P, Zhang J, Qian A R, et al. Bone cells under microgravity [J]. J Mech Med Biol, 2013, 13(5): 1340006.
[45] Monticone M, Liu Y, Pujic N, et al. Activation of nervous system development genes in bone marrow derived mesenchymal stem cells following spaceflight exposure [J]. J Cell Biochem, 2010, 111(2): 442-452.
[46] Blaber E A, Dvorochkin N, Torres ML, et al. Mechanical unloading of bone in microgravity reduces mesenchymal and hematopoietic stem cellmediated tissue regeneration [J]. Stem Cell Res, 2014, 13(2):181-201.
[47] 厚美瑛,张文俊,张海,等.SJ-10卫星空间科学实验项目其他实验任务简介[J]. 力学与实践, 2016, 38(2): 225-227.[Hou Mei-ying, Zhang Wen-jun, Zhang Hai, et al. Brief introduction of space scientific experiments and other task on SJ-10 satellite [J]. Mechanics and Engineering, 2016, 38(2): 225-227.]
[48] Hughes-Fulford M. Physiological effects of microgravity on osteoblast morphology and cell biology [J]. Adv Space Biol & Med, 2002, 8(3): 129- 157.
[49] 徐沁, 张丽君, 王永春, 等.失重或模拟失重对骨形成影响的研究进展[J].解放军医学院学报, 2015,36(3):291-293. Xu Qin, Zhang Li-jun, Wang Yong-chun, et al. Advances in effects of weightlessness or simulated weightlessness on bone formation [J]. Academic Journal of Pla Postgraduate Medical School, 2015, 36(3):291-293.
[50] Kapitonova M Y, Salim N, Othman S, et al. Alteration of cell cytoskeleton and functions of cell recovery of normal human osteoblast cells caused by factors associated with real space flight [J]. Malays J Pathol, 2013, 35(2): 153-163.
[51] Landis W J, Hodgens K J, Block D, et al. Spaceflight effects on cultured embryonic chick bone cells [J]. J Bone Miner Res, 2000, 15(6): 1099-1112.
[52] Carmeliet G, Nys G, Bouillon R. Microgravity reduces the differentiation of human osteoblastic MG‐63 cells [J]. J Bone Miner Res, 1997, 12(5): 786-794.
[53] Vico L, Collet P, Guignandon A, et al. Effects of long-term microgravity exposure on cancellous and cortical weight-bearing bones of cosmonauts [J]. The Lancet, 2000, 355(9215): 1607-1611.
[54] Zheng Q, Huang G, Yang J, et al. Could the effect of modeled microgravity on osteogenic differentiation of human mesenchymal stem cells be reversed by regulation of signaling pathways? [J]. Biological chemistry, 2007, 388(7): 755-763.
[55] Bonewald L F. Mechanosensation and transduction in osteocytes [J]. Bonekey Osteovision, 2006, 3(10): 7-15.
[56] Burger E H, Klein-Nulend J. Mechanotransduction in bone-role of the lacuno- canalicular network [J]. FASEB J, 1999, 13(9001): S101-S112.
[57] Bonewald L F. Osteocytes as dynamic multifunctional cells [J]. Ann N Y Acad Sci, 2007, 1116(1): 281-290.
[58] Rodionova N, Oganov V, Zolotova N. Ultrastructural changes in osteocytes in microgravity conditions [J]. Adv Space Res, 2002, 30(4): 765-770.
[59] Doty S B, Morey-Holton E R, Durnova G N, et al. Cosmos 1887: morphology, histochemistry, and vasculature of the growing rat tibia [J]. FASEB J, 1990, 4(1): 16-23.
[60] Rodionova N, Polkovenko O, Oganov V. Interactions of cells in zones of bone resorption under microgravity and hypokinesia [J]. J Gravit Physiol, 2004, 11(2): 147-151.
[61] Wang H, Ji B , Liu X S. Osteocyte-viability-based simulations of trabecular bone loss and recovery in disuse and reloading [J]. Biomech Model Mechanobiol, 2014, 13(1): 153-166.
[62] Li Z, Kong K, Qi W, Osteoclast and its roles in calcium metabolism and bone development and remodeling [J]. Biochem Biophys Res Commun, 2006, 343(2): 345-350.
[63] Zerath E, Holy X, Roberts S G, et al. Spaceflight inhibits bone formation independent of corticosteroid status in growing rats [J]. J Bone Miner Res, 2000, 15(7): 1310-1320.
[64] Berezovska O P, Rodionova N V, Grigoryan E N, et al. Changes in the numbers of osteoclasts in newts under conditions of microgravity [J]. Adv Space Res, 1998, 21(8): 1059-1063.
[65] Nabavi N, Khandani A, Camirand A, et al. Effects of microgravity on osteoclast bone resorption and osteoblast cytoskeletal organization and adhesion [J]. Bone, 2011, 49(5): 965-974.
[66] Tamma R, Colaianni G, Camerino C, et al. Microgravity during spaceflight directly affects in vitro osteoclastogenesis and bone resorption [J]. FASEB J, 2009, 23(8): 2549-2554.
[67] Sun W, Zhao C, Li Y, et al. Osteoclast-derived microRNA-containing exosomes selectively inhibit osteoblast activity [J]. Cell Discov, 2016, 2(4),16015.
[68] Qian A R, Ying D C, Yang P F, et al, Development of a ground-based simulated experimental platform for gravitational biology [J]. IEEE T Appl Supercon, 2009, 19(2): 42-46.
[69] Qian A R, Yin D C, Yang P F, et al. Application of diamagnetic levitation technology in biological sciences research[J]. IEEE T Appl Supercon, 2013, 23(1): 3600305.
[70] Qian A R, Zhang W, Weng Y, et al. Gravitational environment produced by a superconducting magnet affects osteoblast morphology and functions [J]. Acta Astronaut, 2008, 63(7-10): 929-946.
[71] Qian A R, Yang P F, Hu L F, et al. High magnetic gradient environment causes alterations of cytoskeleton and cytoskeleton- associated genes in human osteoblasts cultured in vitro [J]. Adv. Space Res, 2010, 46(6): 687-700.
[72] Qian A R, Di S M, Gao X, et al. CDNA microarray reveals the alterations of cytoskeleton- related genes in osteoblast under high magneto- gravitational environment [J]. Acta Biochim Biophys Sin (Shanghai), 2009, 41(7):561-577.
[73] Qian A R, Wang L, Gao X, et al. Diamagnetic levitation causes changes in the morphology, cytoskeleton, and focal adhesion proteins expression in osteocytes [J]. IEEE Trans Biomed Eng, 2012, 59(1): 68-77.
[74] Wang Y, Chen Z H, Yin C, et al. Genechip expression profiling reveals the alterations of energy metabolism related genes in osteocytes under large gradient high magnetic fields [J]. Plos One, 2015, 10 (1): e0116359.
[75] Sun Y L, Chen Z H, Chen X H, et al. Diamagnetic levitation promotes osteoclast differentiation from RAW264.7 cells [J]. IEEE Trans Biomed Eng, 2015, 62(3): 900-908.
通信地址:陕西省西安市友谊西路127号(710072)
电话:(029)88491840
E-mail:maiozp@nwpu.edu.cn
骞爱荣(1972-),女,博士,教授,博士生导师,主要从事空间生物学、航天医学以及航空航天系统工程研究。本文通信作者。
通信地址:陕西省西安市友谊西路127号(710072)
电话:(029)88491840
E-mail:qianair@nwpu.edu.cn
(编辑:张宇平)
Advances in Research on Effects of Space Microgravity on Bone Metabolism
MIAO Zhi-ping, QIU Wu-xia, MA Xiao-li, QIAN Ai-rong
(Bone Metabolism Lab, Key Lab for Space Bioscience and Biotechnology, School of Life Science,Northwestern Polytechnical University, Xi’an 710072,China)
This article not only describes the research on the effects of the space microgravity environment on astronauts’ bone metabolism at home and abroad, but also summarizes the space flight experiment results from the lab animals and bone cells as well as the possible mechanism of the microgravity-induced bone loss. Moreover, this paper introduces some bone metabolism results using a novel simulated microgravity model, a diamagnetic levitation platform, and proposes to develop much more novel microgravity simulated platforms to further carry out bone metabolism research as well as much more space flight chances to verify the results from the simulated models in future, which provides a reference for space biomedical study in China.
Microgravity; Space flight; Bone loss; Bone metabolism; Bone cells
2017-01-23;
2017-02-13
国家自然科学基金(31570940);教育部新世纪人才支持计划(NCET-12-0469)
V7
A
1000-1328(2017)03-0219-11
10.3873/j.issn.1000-1328.2017.03.001
苗治平(1963-),女,学士,副主任医师,主要从事特殊环境医学效应,航空航天系统工程。

