拮抗放线菌ZZ-9菌株发酵液的抑菌谱及稳定性测定
范万泽,薛应钰,张树武,徐秉良
(甘肃农业大学 植物保护学院/甘肃省农作物病虫害生物防治工程实验室,兰州 730070)
拮抗放线菌ZZ-9菌株发酵液的抑菌谱及稳定性测定
范万泽,薛应钰,张树武,徐秉良
(甘肃农业大学 植物保护学院/甘肃省农作物病虫害生物防治工程实验室,兰州 730070)
为探究拮抗放线菌ZZ-9 (Streptomycesrochei)菌株发酵液的抑菌谱,并明确传代培养、温度、光照、pH及紫外线等理化因素对发酵液稳定性的影响。以15种植物病原真菌为供试菌,采用菌丝生长速率法测定发酵液的抑菌谱,并以苹果树腐烂病菌(Cytosporasp.)为指示菌,测定不同条件下发酵液的稳定性。抑菌谱结果表明:ZZ-9菌株发酵液对供试的15种病原真菌均具有不同程度的抑制作用,其中对苹果树腐烂病菌和立枯丝核菌抑制效果最好,生长抑制率可达96%以上,且效果持久;而对苹果轮纹病菌、蚕豆褐斑病菌、月季叶霉病菌等抑制效果较差,抑制率在27%以下。稳定性试验结果表明:菌株传接6代时,活性稳定,从第7代开始菌株活性下降显著;发酵液耐高温,对强酸强碱处理、可见光及紫外线照射均有较好的稳定性;且在4 ℃及室温(20~25 ℃)下可贮藏至少30 d而保持其抑菌活性几乎不变。因此,拮抗放线菌ZZ-9菌株次生代谢产物具有较广谱的抑菌活性和较强的稳定性,具有开发成微生物农药的潜力。
拮抗放线菌;发酵液;抑菌谱;稳定性
中国是世界上农药和化肥污染最严重的国家之一,化学农药的滥用不仅对生态环境、人类健康产生影响,而且易造成病虫害抗性等问题。开发新型生物农药、减少和替代高毒高残化学农药是发展绿色、安全农产品的必要条件[1]。微生物农药因污染小、广谱性,与环境相容等特点符合绿色农业的发展要求而被深入研究[2]。放线菌作为一种重要的微生物农药资源而倍受关注,其次生代谢产物在低浓度时被用来防治病、虫、草害或调节植物生长发育[3]。目前,已有多个商品化的产品被应用于生产。例如,被用来杀虫的有阿维菌素、多杀菌素和南昌霉素;被用来杀菌的有放线菌酮、春雷霉素、万隆霉素、多效霉素 、井冈霉素、农抗120以及多抗霉素、中生菌素、宁南霉素等;被用来除草的有双丙氨膦等[4-7]。因此,从放线菌及其次生代谢产物中筛选广谱、稳定及低毒的农用抗生素具有十分广阔的前景。
由于放线菌产生的活性物质在自然环境中大多不稳定,从而影响放线菌的开发与应用。农用抗生素在施用到作物表面,或者进入到土壤中,都要受到光照、温度、土壤酸碱性等的影响。因此,农用抗生素在各种环境条件下的稳定性是评价其是否具有开发价值的一个重要指标[8]。甘肃农业大学植物病原实验室从甘肃陇东地区采集的土壤中分离获得一株拮抗放线菌,菌株编号ZZ-9,前期研究结果表明,放线菌ZZ-9对苹果树腐烂病菌(Cytosporasp.)具有较高抑菌活性,不同稀释倍数的ZZ-9发酵滤液对腐烂病菌分生孢子萌发及菌丝生长均有明显的抑制作用,其中50倍发酵滤液对孢子萌发抑制率和菌丝生长抑制率均达80%以上,且受抑制菌丝颜色加深,分支增多,末端膨大、畸形,出现原生质浓缩与释放现象。通过形态学和分子生物学特征初步鉴定该菌为娄彻氏链霉菌(Streptomycesrochei)。关于娄彻氏链霉菌防治植物病害的例子已有相关报道[9-10],但关于其发酵液的抑菌谱及稳定性的研究鲜见报道。本研究通过菌丝生长速率法测定菌株ZZ-9发酵液的抑菌谱范围及不同条件下抑菌活性物质的稳定性,以期为该拮抗菌的进一步开发利用提供参考依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 放线菌ZZ-9(Streptomycesrochei)分离自甘肃省平凉市庄浪县朱店镇(N35°07′28.88″,E105°57′44.10″) 苹果树根际土壤,接种于高氏一号试管斜面,于4 ℃保存。
1.1.2 供试病原菌 苹果树腐烂病菌(Cytosporasp.)及14种供试植物病原真菌:立枯丝核病菌(Rhizoctoniasolani)、番茄灰霉病菌(Botrytiscinerea)、荷兰豆枯萎病菌(Fusariumoxysporum)、黄瓜枯萎病菌 (Fusariumoxysporum)、辣椒叶斑病菌(Phaeoramulariacapsicicol)、油菜根腐病菌(Fusariumsemitectum)、苹果霉心病菌(Trichotheciumroseum)、菜豆炭疽病菌(Colletotrichumlindemuthianum)、景天叶斑病菌(Alternariaalternata)、月季叶霉病菌(Cladosporiumcladosporioides)、苹果轮纹病菌(Botryosphaeriapiricola)、甘蓝黄叶病菌(Fusariumsp.)、杨树溃疡病菌(Dothiorellagregaria)、蚕豆褐斑病菌(Ascochytafabae),由甘肃农业大学植物病原实验室提供。
1.1.3 供试培养基 固体培养基:PDA培养基、高氏一号合成培养基。液体培养基:①种子发酵培养基为高氏一号液体培养基;②基础发酵培养基为小米浸汁培养基[11](小米10.0 g,葡萄糖10.0 g,蛋白胨3.0 g,氯化钠2.5 g,碳酸钙2.0 g,蒸馏水1 000 mL,pH 7.2~7.4)。
1.2 发酵液的制备
首先将筛选纯化的ZZ-9菌株[12]接种于高氏一号平板上,28 ℃培养7 d。挑取已活化好的ZZ-9菌株到装有60 mL种子发酵培养基的150 mL三角瓶中,28 ℃、180 r/min振荡培养72 h,制成种子液;然后再按10% 的接种量接入到装液量为80 mL的基础发酵培养基中(150 mL三角瓶),28 ℃、180 r/min,振荡培养4 d后,在4 ℃、10 000 r/min 条件下离心20 min,用0.22 μm微孔滤器过滤其上清液,既得无菌发酵滤液,存于4 ℃冰箱,备用。
1.3 菌株ZZ-9发酵液的抑菌谱测定
采用菌丝生长速率法[13],取2 mL无菌发酵液与18 mL冷至45 ℃左右的PDA培养基混匀,倒入无菌培养皿内制成带药平板,冷却后在平板中央接入倒置的供试植物病原真菌菌饼(d=5 mm),每处理3次重复。28 ℃恒温培养,以加入无菌水的处理作对照,用十字交叉法测量菌落生长直径,计算生长抑制率[14]。计算公式为:
生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-5)×100%
1.4 菌株ZZ-9发酵液的稳定性测定
以苹果树腐烂病菌为指示菌,用菌丝生长速率法测定菌株ZZ-9无菌发酵液在不同条件处理后的抑菌活性。以无菌水和未经处理的发酵液原液为对照,每处理3次重复。
1.4.1 ZZ-9的传代稳定性 将放线菌ZZ-9菌株在高氏一号试管斜面上每隔1 d转管1次,连续转管10次,将每次转管后的菌株再转接到高氏平板上扩大培养,同时观察各代菌株的培养特征,并测定其发酵液的抑菌活性。
1.4.2 热稳定性 将25 mL无菌发酵液于20、40、60、80、100、121 ℃分别处理30和60 min,测定活性,根据抑菌活性的变化确定其发酵液的稳定性。
1.4.3 酸碱稳定性 将25 mL无菌发酵液用1 mol/L HCl和1 mol/L NaOH 分别调整pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0后,再分别做2个试验[15]。试验(1):将上述调节好pH的样品在室温下静止放置12 h后,分别将其调至原发酵液pH(pH 7.6),测定活性;试验(2):将上述调节好pH的样品在100 ℃水浴中分别加热30和60 min后,测定抑菌活性,根据抑菌活性的变化确定其发酵液的稳定性。
1.4.4 可见光、紫外光稳定性 将25 mL无菌发酵液置于无菌培养皿中,在4 000 lx 的光照箱中和波长为254 nm的紫外灯下25 cm处,分别照射1、2、4、8、16 h后再加蒸馏水还原至初始体积[16],分别测定活性,根据抑菌活性的变化确定其发酵液的稳定性。
1.4.5 贮藏稳定性 取无菌发酵液各25 mL分别装入已灭菌的50 mL三角瓶中,密封后,分别在室温下和4 ℃冰箱中避光保存,在保存5、10、15、20、25、30 d时分别测定活性,根据抑菌活性的变化确定其发酵液的稳定性。
2 结果与分析
2.1 菌株ZZ-9发酵液的抑菌谱
由图1可知,菌株ZZ-9发酵液对供试的15种植物病原真菌均具有不同程度的抑制作用。其中对苹果树腐烂病菌和立枯丝核菌的抑制效果最好,菌丝生长抑制率分别可达96.67%和98.75%;对黄瓜枯萎病菌、荷兰豆枯萎病菌、番茄灰霉病菌、辣椒叶斑病菌这4种病原真菌的抑制率均在50%以上;对苹果霉心病菌、菜豆炭疽病菌、油菜根腐病菌的抑菌率也在40%左右;而对苹果轮纹病菌、蚕豆褐斑病菌、月季叶霉病菌等抑制效果较差,其中对蚕豆褐斑病菌的抑制率仅为15.27%(表1)。
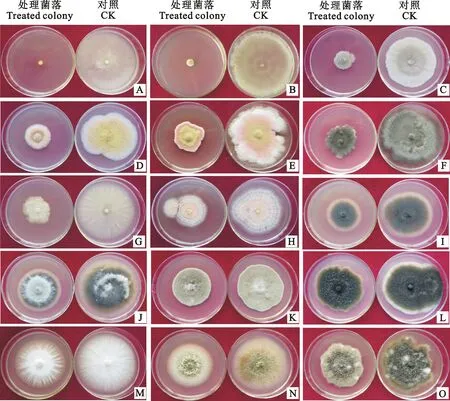
图中字母分别代表的病原菌种类见表1 Upper letters in Fig 1 reprent pathogens

表1 放线菌ZZ-9菌株发酵液抑菌谱Table 1 Testing of fermentation broth of actinomycete strain ZZ-9 against pathogenic fungus
注:供试样品浓度为发酵液稀释10倍,数据为3次重复的平均值。
Note:Concentrations of samples was fermentation broth diluted by 10 times;the data were average of three repetitions.
2.2 菌株ZZ-9发酵液的稳定性
2.2.1 菌株ZZ-9传代多次后稳定性 将菌株ZZ-9连续转管10次,然后将各代菌株在高氏一号平板上扩大培养后,其培养特征与初始菌株具有相同的性状表现,气生菌丝丰富,呈鼠灰色,基内菌丝呈灰白色或浅黄色,且均无色素产生。说明菌株在传代的过程中培养特征较稳定;从抑菌活性方面,菌株ZZ-9连续转接6代后,其发酵液对苹果树腐烂病菌的抑制率几乎不变,第6代时抑制率仍为96.37%,各代菌株间在P=0.05水平上差异不显著。第7代菌株抑制率为86.71%,与前6代菌株相比,其抑制率下降约10%,存在极显著差异。从第7代开始到第10代,菌株活性略有下降但不明显(图2)。由此可知,该拮抗菌株前6代有较好的传代稳定性,从第7代后抑菌活性下降明显,菌株活性相对稳定。

不同小写英文字母表示在0.05 水平差异显著。下同 Bars with different letters mean significant differences at 0.05 level. The same as following
2.2.2 菌株ZZ-9发酵液的热稳定性 由图3可知,菌株ZZ-9发酵液,在不同温度下分别处理30和60 min后,对苹果树腐烂病的抑制率仍然可达96%左右,与对照相比差异不显著。121 ℃下分别处理30和60 min后,菌丝生长抑制率较对照分别仅下降1.5% 和2.0% 左右,较20 ℃处理下降不超过2.5%。试验结果还表明,在同一处理温度下,随着处理时间的延长而抑制率有所下降,但对其抑菌活性影响并不大,说明该菌株发酵液有较好的热稳定性。
2.2.3 菌株ZZ-9发酵液的可见光、紫外光稳定性 由图4可见,ZZ-9发酵液对可见光具有较好的稳定性,在连续可见光照射8 h后,抑菌活性较对照没有显著差异。紫外照射较可见光照射,活性有所下降。在紫外光处理2 h后,发酵液活性仍然较高,可达94.38%,另外随紫外照射时间的加长而发酵液活性也呈下降趋势,但下降幅度不大。如紫外照射16 h 较紫外光照射8 h处理,其活性仅下降约1.5%左右,较对照也仅下降约3%,说明ZZ-9发酵液对可见光、紫外光都较好稳定性。

图3 温度对发酵液抑菌活性的影响Fig.3 Effect of temperature on inhibitory activity of fermentation broth

图4 光照对发酵液抑菌活性的影响Fig.4 Effect of illumination time on inhibitory activity of fermentation broth
2.2.4 菌株ZZ-9发酵液酸碱稳定性 由图5可见,发酵液在酸性环境中和在碱性环境中抑菌活性都较稳定,其中在pH 2.0的较强酸性条件下,活性下降较为明显,但仍然保持在94.15%;在pH 12.0的较强碱条件下,活性较对照差异不大,为96.14%,说明ZZ-9发酵液有较宽的酸碱适应范围。然而经水浴加热处理过的发酵液较未经水浴处理过的发酵液,其活性有所下降。如,pH 3.0 时,100 ℃水浴加热处理60 min后,其抑制率下降约2%,而较对照下降约3%;pH 12.0时,100 ℃水浴加热处理60 min后,抑制率下降仅1.5%。总体而言,发酵液不论在偏酸性的环境或偏碱性的环境下时,水浴加热处理后发酵液活性略有降低,但变化不大,说明其活性稳定性较好(表2)。
2.2.5 菌株ZZ-9发酵液贮藏稳定性 由图6可见,菌株ZZ-9发酵液在4 ℃和室温(20~25 ℃)下贮藏30 d后,生物活性测定结果显示抑菌活性几乎没变,其抑制率仍保持在96%以上,且各处理间差异无同统计学意义(P=0.05)。表明菌株ZZ-9产生的抑菌活性物质有很好的耐贮藏性,其贮藏时间至少1个月以上。

图5 不同pH对发酵液抑菌活性的影响Fig.5 Effect of different pH on inhibitory activity of fermentation broth
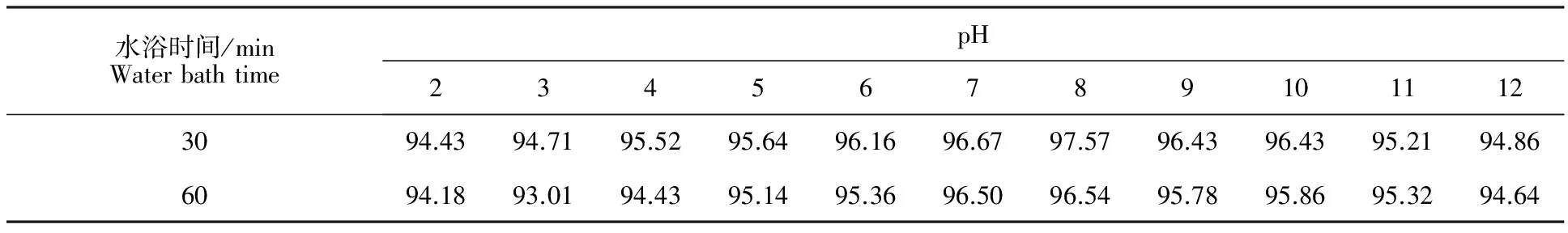
表2 不同pH的发酵液在100 ℃水浴处理后抑菌率Table 2 Inhibition rate of different pH fermentation broth under the treatment of water bath by 100 ℃ %

图6 贮藏时间对发酵液抑菌活性的影响Fig.6 Effect of storage time on inhibitory activity of fermentation broth
3 结论与讨论
生物农药因具有许多化学农药不具备的优点,符合发展绿色农业的要求而被不断创新与利用,特别是微生物源农药(也称农用抗生素)由于高效、安全、与环境友好等特点而被广泛开发与应用[7,17]。放线菌在自然界中分布最为广泛,同时也是最早被用于植物病害防治的一类微生物[18]。据报道,目前至少有11 000多种生物活性物质来自于放线菌[19],但放线菌产生的主要活性物质为大环内酯类抗生素,而大环内酯类抗生素在生产应用中很不稳定[20-21]。邵彦坡等[22]从海洋分离到的一株放线菌B5经室内杀菌活性测定发现具有较广谱的抗真菌与细菌活性,发酵液经80 ℃处理6 h,活性下降不到20%。在酸性条件下活性基本不变,但在碱性条件下活性极易丧失。
本研究通过菌丝生长速率法测定菌株ZZ-9的抑菌谱,试验结果表明,菌株ZZ-9发酵液对15种植物病原真菌均具有不同程度的抑菌作用,抑菌谱较广,尤其对立枯丝核菌(Rhizoctoniasolani)的抑制作用最为强烈,抑制率达98.75%。另外对荷兰豆枯萎病菌(Fusariumoxysporum)和番茄灰霉病菌(Botrytiscinerea)的抑制率也达到60%以上。由于供试的植物病原真菌数量较少,故还不能确定其发酵液对未测试病原菌有无抑菌活性,且关于它的抑菌机制有待进一步研究。另外,本试验只对病原真菌在室内条件下进行离体生测,而对其在大田试验中防效是否理想也需进一步验证。
本研究以苹果树腐烂病菌为靶标菌,对娄彻氏链霉菌ZZ-9发酵液稳定性进行测定。结果表明,发酵液耐高温、在强酸碱条件下较稳定、可见光及紫外光处理后,生长抑制率无明显下降,依然具有显著抑菌活性,说明该菌产生的次生代谢产物有很好的稳定性。张丽等[23]研究娄彻氏链霉菌YL-2代谢产物的稳定性,其粗提物随着温度的升高,抑菌活性明显下降,在弱酸性条件下抑菌活性比较稳定,但对日光的稳定性较差。这一结果与本研究的结果有所不同,这可能是因为菌株生长环境不同其发酵代谢产物活性、稳定性也会不同。代鹏等[24]测定抗生素产生菌Streptomycesalbogriseus的传代稳定性,结果表明JFA-001菌株传接6代时,活性稳定,从第7代开始其活性缓慢降低,这一结果与本研究结果相似。综上所述,该菌株发酵液稳定性良好,有望分离到新结构或新种类的抗生素,为该菌活性物质分离纯化及产品的加工与应用提供一定的理论依据。
另外,放线菌产生的次生代谢产物种类繁多,性质各异,其活性、稳定性等特征与其结构相关[25]。因此,对该菌株活性物质的种类、性质及结构有待深入研究。
Reference:
[1] 邱德文.新型生物农药绿色环保产业[J].中国创业投资与高科技,2005(10):28-30.
QIU D W.The new environmental and protection industry on biological pesticide[J].TheVentureInvestmentandHigh-TechinChina,2005(10):28-30(in Chinese).
[2] 朱玉坤,尹衍才.微生物农药研究进展[J].生物灾害科学,2012,35(4):431-434.
ZHU Y K,YIN Y C.Research advances on microbial pesticides[J].BiologicalDisasterScience,2012,35(4):431-434(in Chinese with English abstract).
[3] 李增波,薛泉宏,梁军峰,等.一株生防放线菌AL-04的防病促生作用[J].农 药,2009,4(1):74-76.
LI Z B,XUE Q H,LIANG J F,etal.An actinomycete on antidisease and growth-promoting effect[J].Agrochemicals,2009,4(1):74-76(in Chinese with English abstract).
[4] 招 衡.生物农药及其未来研究和应用[J].世界农药,2010,32(2):16-23.
ZHAO H.Biopestieides,its future researeh and application[J].WorldPesticides,2010,32(2):16-23(in Chinese with English abstract).
[5] DESHPANDE B S,AMBEDKAR S S,SHEWALE J G.Biologically active secondary metabolites fromStreptomyces[J].EnzymeandMicrobial,1998,10(8):455-473.
[6] 王敬伟,曾鑫年,林壁润.农用放线菌代谢产物研究概况[C].北京:中国农业出版社,2007:739-742.
WANG J W,ZENG X N,LIN B R.The research of actinomycetes metabolites on agricultural[C].Beijing:China Agriculture Press,2007:739-742(in Chinese).
[7] 邱德文.生物农药研究进展与未来展望[J].植物保护,2013,39(5):81-89.
QIU D W.Research progress an prospect of bio-pesticides[J].PlantProtection,2013,39(5):81-89(in Chinese with English abstract).
[8] 朱昌雄.新农用抗生素-中生菌素[J].精细与专用化学品,2002(16):14-17.
ZHU CH X .Zhongshengmycin,a new agro-antibiotics[J].FineandSpecialtyChemicals,2002(16):14-17(in Chinese with English abstract).
[9] 刘 琴,徐 健,刘怀阿,等.黄瓜内生放线菌SR-1102分离及对枯萎病菌拮抗活性[J].扬州大学学报(农业与生命科学版),2015,36(2):83-88.
LIU Q,XU J,LIU H E,etal.Isolation and antagonistic activity of endophytic actinomycete SR-1102 toFusariumoxysporumf.sp.cucumebriumof cucumber[J].JournalofYangzhouUniversity(AgriculturalandLifeScienceEdition),2015,36(2):83-88(in Chinese with English abstract).
[10] 柳成宾,万传星,贾晓宇,等.新疆盐环境棉花黄萎菌拮抗放线菌的筛选及菌株TRM42561的防效测和鉴定[J].中国生物防治学报,2014,30(3):408-413.
LIU CH B,WAN CH X,JIA X Y,etal.Screening of antagonistic actionomycetes againstVerticilliumdahliaefrom saline environments in Xinjiang as well as the antagonistic activities and identification of strain TRM42561[J].ChineseJournalofBiologicalControl,2014,30(3):408-413(in Chinese with English abstract).
[11] 张 波,吴文君,宗兆峰.放线菌Z139菌株的分离、鉴定及其生物活性[J].西北农林科技大学学报(自然科学版),2005,33(8):69-72.
ZHANG B,WU W J,ZONG ZH F.Studies on isolation,identification and fungicidal activity of antagonistic actinomycete Z139[J].JournalofNorthwestSci-TechUniversityofAgriculturalandForest(NationScienceEdition),2005,33(8):69-72(in Chinese with English abstract).
[12] RAJAGOPAL R,SURYANARAYANAN T S.Isolation of endophytic fungi from leaves of neem (Azadirachtaindica)[J].CurrentScience,2000,78:1375-1378.
[13] 方中达.植病研究方法[M].北京:中国农业出版社,1998.
FANG ZH D.Research Methods of Plant Pathology[M].Beijing:China Agriculture Press,1998(in Chinese).
[14] ERRAKHI R,LEBRIHI A,BARAKATE M.In vitro and in vivo antagonism of actinomycetes isolated from Moroccan rhizospherical soils againstSclerotiumrolfsii:a causal agent of root rot on sugar beet(BetavulgarisL.)[J].JournalofAppliedMicrobiology,2009,107(2):672-681.
[15] 吴庆菊,曾会才,弓淑芬.放线菌WZ162菌株发酵液抗香蕉枯萎病菌稳定性研究[J].广西农业科学,2009,40(4):366-369.
WU Q J,ZENG H C,GONG SH F.Stability of fermentation broth of actinomycete strain WZ162 resistance toFusariumoxysporumf.sp.cubenseof banana[J].GuangxiAgriculturalSciences,2009,40(4):366-369(in Chinese with English abstract).
[16] 张建华,徐秉良,郑宇宇,等.长枝木霉 T6 发酵液稳定性及粗提物抑菌活性[J].农 药,2015,54(5):330-333.
ZHANG J H,XU B L,ZHENG Y Y,etal.Stability and antimicrobial activity of the extract of fermentation liquor fromTrichodermalongibrachiatumT6[J].Agrochemicals,2015,54(5):330-333(in Chinese with English abstract).
[17] 周 启,王道本.农用抗生素和微生物杀虫剂[M].北京:农业出版社,1995.
ZHOU Q,WANG D B.Agricultural Antibiotics and Microbial Pesticides[M].Beijing:Agricultural Press,1995(in Chinese).
[18] 刘清术,刘前刚,陈海荣,等.生物农药的研究动态、趋势及前景展望[J].农药研究与应用,2007,11(1):17-25.
LIU Q SH,LIU Q G,CHEN H R,etal.Advance,development trend and perspective of studies on bio-pesticides[J].AgrochemicalsResearchandApplication,2007,11(1):17-25(in Chinese with English abstract).
[19] BERDY J.Bioactive microbial metabolites,a personal view [J].TheJournalofAntibiotics,2005,58(1):1-26.
[20] 冯俊涛,张锦恬,韩立荣,等.放线菌HJ1-2菌株发酵液抑菌谱及稳定性的研究[J].西北农业学报,2009,18(6):280-284.
FENG J T,ZHANG J T,HAN L R,etal.Study of antimicrobial sectrum and stability of the fermentation broths produced by actinomycete strain HJ1-2[J].ActaAgriculturueBoreali-occidentalisSinica,2009,18(6):280-284(in Chinese with English abstract).
[21] 陈文群,吴剑波,金启光,等.农用抗生素11371各组分的分离、纯化和鉴别[J].中国抗生素杂志,1990,15(1):42-48.
CHEN W Q,WU J B,JIN Q G,etal.Isolation,purification and identification of agricultural antibiotic 11371 components [J].ChineseJournalofAntibiotics,1990,15(1):42-48(in Chinese with English abstract).
[22] 邵彦坡,方丽萍,魏少鹏,等.海洋放线菌B5菌株发酵液抗菌谱及稳定性研究[J].西北农业学报,2007,16(3):248-251.
SHAO Y P,FANG L P,WEI SH P,etal.Studies on antagonistic spectrum and stability of actinomyete B5- strain from marine[J].ActaAgriculturueBoreali-occidentalisSinica,2007,16(3):248-251(in Chinese with English abstract).
[23] 张 丽,纪明山,于志国.娄彻氏链霉菌 YL-2代谢产物对稻瘟病菌的抑制活性及其稳定性[J].沈阳农业大学学报,2014,45(2):143-146.
ZHANG L,JI M SH,YU ZH G.Antifungal activities and stability of metabolites fromStreptomycesrocheiYL-2 againstPyriculariaoryzae[J].JournalofShenyangAgriculturalUniversity,2014,45(2):143-146(in Chinese with English abstract).
[24] 代 鹏,张 霞,杨腊英,等.抗生素产生菌Streptomycesalbogriseus发酵液的抗菌谱及稳定性测定[J].热带作物学报,2009,30(1):86-89.
DAI P,ZHANG X,YANG L Y,etal.Antagonistic spectrum and stability of fermented solution of JFA-001 strain producing antibiotics[J].ChineseJournalofTropicalCrops,2009,30(1):86-89(in Chinese with English abstract).
[25] JOO G J.Production of antifungal substance for biological control ofPhytophthoracapsicicausing phytophthora blight in red-peppers byStreptomyceshalstedii[J].BiotechnologyLetters,2005,27 (3) :201-205.
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Antimicrobial Spectrum and Stability of Fermentation Broth Produced by Antagonistic Actinomycetes Strain ZZ-9
FAN Wanze,XUE Yingyu,ZHANG Shuwu,XU Bingliang
(College of Plant Protection,Gansu Agricultural University/Biocontrol Engineering Laboratory of Crop Diseases and Pests of Gansu Province,Lanzhou 730070,China)
To study bacteriostatic spectrum of fermentation broth from actinomycetes strain ZZ-9 identified asStreptomycesrochei,and to verify the effect of it on stability of fermentation broth under biochemical and physical factors such as subculture,temperature,illumination,pH and ultraviolet conditions.As the tested phytopathogen,method of growth rate was used to determine antimicrobial spectrum of fermentation broth with 15 kinds of plant pathogenic fungus.WithCytosporasp.as indicator phytopathogen,the stability of fermentation broth under different conditions was measured .The bacteriostatic spectrum results showed that the fermentation broth of ZZ-9 strain had inhibitory effects at different degres on 15 kinds of pathogenic fungus.With growth inhibition rate of more than 96% and the lasting effect,the fermentation broth of ZZ-9 strain had the best effect onCytosporasp.andRhizoctoniasolani,and it had worse effect onBotryosphaeriapiricola,Cladosporiumcladosporioidesv andAscochytafabae,the inhibition rate was under 27%.The stability test showed that the activity of strain was stable until the 6th generation,it decreased significantly from the 7th generation,and the fermentation broth had high temperature resistance,good stability under strong acid and alkali,visible light and ultraviolet irradiation treatments.Moreover,the fermentation broth could be stored for at least 30 days at 4 ℃ and room temperature (20-25 ℃), the activity remained nearly unchanged.Therefore,the secondary metabolites of antagonistic actinomycetes ZZ-9 strain had broad-spectrum antibacterial activity and strong stability,and the potential could be developed into the microbial pesticide.
Antagonistic actinomycetes; Fermentation broth; Antimicrobial spectrum; Stability
FAN Wanze,male,master student.Research area: comprehensive management of plant diseases.E-mail fanwanze@foxmail,com
XUE Yingyu,male,associate professor,master supervisor.Research area: comprehensive management of plant diseases.E-mail:xueyy@gsau.edu.cn

SI词头
日期:2017-03-03
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170303.0832.048.html
2016-02-02
2016-05-11
甘肃省农牧厅农业生物技术研究与应用开发项目(GNSW-2012-27);国家重点研发计划(2016YFD0201112)。
范万泽,男,硕士研究生,研究方向为植物病害综合治理。E-mail:fanwanze@foxmail.com
薛应钰,男,副教授,硕士生导师,研究方向为植物病害综合治理。E-mail:xueyy@gsau.edu.cn
S482.2+92
A
1004-1389(2017)03-0463-08
Received 2016-02-02 Returned 2016-05-11
Foundation item Bio-tech Project of Department of Agriculture and Animal Husbandry of Gansu Province (No.GNSW-2012-27);The National Key Research and Development Plant Projects(2016YFD0201112).

