基于高通量测序技术的堆肥对兰州百合根际微生物多样性的影响
郝海婷,王若愚,赵 霞,王 筠,郭志鸿,张玉宝,谢忠奎
(1.中国科学院 寒区旱区环境与工程研究所 生态与农业研究室(皋兰生态与农业综合研究站),兰州 730000;2.甘肃省寒区旱区逆境生理与生态重点实验室,兰州 730000;3.中国科学院大学,北京 100049;4.中国科学院 寒区旱区环境与工程研究所 沙漠与沙漠化研究室,兰州 730000)
基于高通量测序技术的堆肥对兰州百合根际微生物多样性的影响
郝海婷1,2,3,王若愚1,2,3,赵 霞1,2,3,王 筠3,4,郭志鸿1,2,3,张玉宝1,2,3,谢忠奎1,2,3
(1.中国科学院 寒区旱区环境与工程研究所 生态与农业研究室(皋兰生态与农业综合研究站),兰州 730000;2.甘肃省寒区旱区逆境生理与生态重点实验室,兰州 730000;3.中国科学院大学,北京 100049;4.中国科学院 寒区旱区环境与工程研究所 沙漠与沙漠化研究室,兰州 730000)
以兰州百合为试材,基于llumina MiSeq测序平台,探讨施用堆肥与化肥对兰州百合鳞茎鲜质量及根际土壤细菌和真菌微生物群落的影响。结果表明,有机堆肥对增加百合鳞茎鲜质量作用显著,相比化肥增产76.6%。物种注释结果显示,细菌的门、纲、目、科、属的数量在施用堆肥的土壤中都大于施用化肥的土壤,而经施用化肥处理的土壤中的真菌各个分类水平的数量大于施用有机肥的。从丰富度指数(Chao1)和多样性指数(Shannon)分析,细菌群落整体变化小于真菌群落的变化。施用有机肥或化肥的样品,一些细菌属的相对丰度变化不明显,这些细菌属包含的大多数菌是有益菌。此外,在有机堆肥组的样品中出现一些有益特有菌属,例如野野村菌属(Nonomuraea),而化肥组的样品中发现致病特有菌属(Aquicella)。在真菌属中,镰刀菌属(Fusarium)、曲霉属(Aspergillus)、青霉菌属(Penicillium)和支顶孢属(Acremonium)的丰度在有机肥处理下显著降低,这些属分布有很多潜在或机会致病真菌,这在一定程度上说明施用有机肥能有效改善百合根际土壤微生物群落。
兰州百合;有机堆肥;根际微生物;llumina MiSeq测序
土壤微生物是土壤生态系统中极其重要的组分[1],是土壤生态系统养分循环和能量流动的动力,在维持系统的稳定性和可持续性中占主导地位[2]。现代农业生产中,土壤耕作方式、施肥和农药是影响大田土壤微生物群落的结构组成和多样性的三大主要因素。尤其是化肥的施用直接影响土壤理化性质,进而引起土壤微生物活性和群落多样性的改变。研究发现长期施入氮肥明显降低土壤微生物的活性[3], 而向土壤中添加粪肥、植物残体等有机肥可有效维持土壤肥力和微生物系统的稳定[4]。因此,不同的施肥处理对土壤微生物量、微生物活性、群落功能的影响也不相同。
兰州百合是中国百合中的上品,具有很高的食用、药用、保健和观赏价值。然而,兰州百合是多年生鳞茎草本植物,通常在籽球栽植后2~3 a才能生长成为成熟的商品球茎,生长发育过程中往往需要大量营养供给。当前兰州百合种植中,普遍以施用化肥为主,有时少量施用农家肥。化肥的连续施用常常导致土质变差、营养元素失衡、土壤微生物多样性降低,从而病原微生物大量滋生,土传病害加重,因而易产生连作障碍,严重影响百合的生长发育、品质和产量[5]。
近年来,兰州百合消费市场的不断扩大,百合产业发展方向已开始从追求高产转变到保证产品品质下的稳定生产。由于有机种植的兰州百合鳞茎个头硕大、肉质甜美,具有更高的经济价值和市场欢迎度,部分生产者已开始投入资金增大农家肥用量,并通过综合管理控制化肥及农药的使用。当前有机肥的主要来源有2种:①畜禽粪便。由于存在腐熟周期长、制作成本高、劳动力投入较多等限制因素,将畜粪、秸秆等物质经过彻底的高温有氧发酵,完全无害化处理措施以后施用的并不多。这类有机肥未经彻底腐熟,容易造成烧苗,并且在施用过程中难以杀灭杂草种子和病虫害、寄生虫的虫卵,最终容易导致土壤中虫害的发生,或商品种球遭到虫卵污染。 ②商品有机肥。生产企业利用畜禽粪便、秸秆等,通过一定工艺制成有机肥颗粒,但商品有机肥由于生产成本的问题,依旧存在未完全腐熟的问题,依然在施用中不能发挥最大作用。目前,在日本、美国、埃及等有机种植产业中大规模采用机械化的完全腐熟的堆肥,并取得良好的经济和社会生态效益[6-9]。
传统的土壤微生物研究方法有微生物平板培养法、DNA指纹图谱技术、Biolog鉴定系统法、生物标记法等[10-11],但这些方法往往低估土壤微生物的群落组成,更无法详细描述土壤微生物的群落结构组成方面的信息及不同群体之间的生理差异。随着科学技术的迅速发展,高通量测序技术也随之诞生。不同于传统的测序方法,高通量测序技术的优势在于不但极大地降低基因测序成本,实现大规模的土壤微生物基因的直接测序[12],而且提高测序通量,极大地丰富试验研究的信息量,使土壤微生物研究更为深入。
因此,本研究采用完全腐熟有氧发酵的方法制备堆肥施用于兰州百合,以普通化肥作为对照组,采用高通量测序方法分析农田土壤微生物多样性在施肥前后的变化,以及百合产量等,阐明完全腐熟发酵堆肥施用后的农田土壤微生态特征,从而为建立大规模百合有机堆肥完全腐熟发酵体系进行条件摸索和数据积累。
1 材料与方法
1.1 研究区概况
研究地点位于宁夏回族自治区银川市平吉堡中国科学院西北农业生物技术中心试验田。该地区属大陆性季风气候,日照充足,干旱少雨,年均气温9.1 ℃,年降水量203 mm。土质多为灌淤土,熟化土层深厚,土质条件好,灌排通畅。
1.2 材料与取样方法
百合品种采用甘肃地方食用品种‘兰州百合’。百合苗龄1 a左右,行距20 cm,株距15 cm。试验区面积0.133 hm2。
为促进堆肥完全腐熟,堆肥试验中添加商品EM菌粉以增加发酵活力(广州微元生物科技有限公司)。
供试堆肥材料:有机肥原料因地制宜,选用当地的鸡粪和玉米秸秆。
堆肥:首先,将粉碎成约1 cm左右小段的玉米秸秆铺20 cm厚,上面铺1层鸡粪(约5 cm),鸡粪上面撒1层EM菌粉,在适当的洒水。玉米秸秆和鸡粪的质量比是2∶1。玉米秸秆加鸡粪加EM菌一共重复叠加14层,高度约2.3 m。在堆制过程中,堆心温度在刚开始的30 ℃左右开始升温,10多天后,平均达到45 ℃左右,进行第1次翻料;且温度持续增涨,温度最高达到67 ℃。期间每10 d左右陆续进行3~4次翻料后堆体温度不再上升,逐渐冷却至30 ℃以下,视为完全腐熟。整个发酵过程持续2个月左右至完全腐熟,发酵结束。
田间设计:设化肥(lilyW)和EM菌发酵有机肥(lilyY)2个处理。化肥(lilyW)作为对照,主要包括氮肥和磷肥(美国产磷酸氢二铵)。在1 a生百合苗的2块试验地中分别施用化肥和有机肥,其他农田管理措施相同。堆肥 2 000 kg/667m2,化肥为磷酸氢二铵20 kg/667m2。2014年3月下旬作为基肥施用。
采样:分别在化肥和有机肥处理的百合试验田,随机选取3个百合根际土样。迅速将土样保存于带有冰袋的保温箱中,带回实验室,冻存于-20 ℃冰箱保存,备用。另外,在对化肥和有机肥处理的百合根际土壤进行采样时,将对应的百合种球也一并取回,称鲜质量。
1.3 土壤微生物 DNA的提取
土壤总DNA的提取:土壤总DNA的提取采用美国OMEGA公司生产的E.Z.N.A.Rhizosphere soil DNA Kit试剂盒。将提取的土壤总DNA电泳和NanoDrop 2000TM分光光度计(Thermo Scientific,Waltham,MA,USA)检测合格后,取自同一肥料处理的3个根际土壤样品DNA等量混合作为1个测序样本。将混合好的化肥处理的根际土样(lilyW)和有机肥处理的土样(lilyY),再次进行质量检测,密封,然后用冰袋寄送到北京诺禾致源生物信息科技有限公司(www.novogene.com)进行测序。
1.4 试验上机流程
整个上机流程包括PCR的扩增、PCR产物的混样、纯化,文库的构建和上机测序流程由北京诺禾致源生物信息科技有限公司提供。高通量测序技术具有测序深度高、利于鉴定低丰度群落物种以及费用低的特点,已成为研究微生物群落多样性的首选之策[13-14]。因此,在本试验中,基于Illumina MiSeq测序平台,利用双末端测序(Paired-End)的方法对16S rDNA高变区V3~V5区和ITS1区域进行测序。
1.5 测序数据分析
为了研究样品的物种组成多样性信息,用 Uparse 软件(Uparse v7.0.1001,http://drive5.com/uparse/)[15]对所有样品的全部 Effective Tags 序列聚类,默认提供以97%的一致性(Identity)将序列聚类成为OTUs( Operational Taxonomic Units )结果。
同一OTUs中的序列被视为是来源于某1个相同分类单元的序列,作为1个假定的分类单元。Uparse 构建 OTUs 时会选取代表性序列(依据其算法原则,筛选的是OTUs中出现频数最高的序列),将这些代表性序列集合用RDP Classifier(Version 2.2,http:// sourceforge.net/ projects/ rdp-classifier/)[16]与GreenGene数据库(http:// greengenes.lbl.gov/ cgi-bin/ nph-index.cgi)[17]进行物种注释分析。根据物种注释,统计每个样品在各分类水平(Kingdom,Phylum,Class,Order,Family,Genus,Species)上的数目。根据物种注释结果,选取在门(Phylum)分类水平上最大相对丰度排名前10的门,生成的物种相对丰度分布柱。
对不同样品在不同一致性(Identity)阈值水平(默认提供97%的阈值)下的Alpha Diversity 分析的指数进行统计。其中,97%水平下聚类成为1个OTU的序列被认为可能是源自于同1个种的(Species Boundary)的序列。主要考察2个指标:Species Richness Estimators和Community Diversity Indices。Species Richness Estimators 是用来估计群落样品中包含的物种总数,Chao1 指数[18]是广泛使用的指数之一。Community Diversity Indices 是包含样品中的物种组成的丰富度(Richness)和均匀度(Evenness)2个因素的评估指标,广泛采用的计算参考是 Shannon指数(Shannon’s diversity index)。此外,稀释曲线(Rarefaction Curve),是从样品中随机抽取一定测序量的数据,统计它们所代表物种数目(即OTUs数目),以数据量与物种数来构建曲线。
本研究其他的数据分析与图形制作采用Origin 8和SPSS 16软件完成。
2 结果与分析
2.1 不同肥料处理对百合种球鲜质量的影响
将分别施用有机肥和化肥1 a的百合种球称取鲜质量。由图1 可看出,EM菌发酵有机肥对增加百合鳞茎鲜质量作用显著,相比化肥可增产76.6%。

图中不同字母表示在P≤0.05水平上的差异显著性 Different letters represent significant difference at the 0.05 level
2.2 不同肥料处理对百合根际土壤细菌和真菌组成及丰度的影响
从图2-A、2-B稀释曲线可以看出,随着测序数据的增加,细菌和真菌稀释曲线均基本趋于平缓,说明取样基本合理。
Chao1指数和Shannon 指数代表了微生物群落结构的变化。由表1可以看出,百合根际土壤 Chao1指数和Shannon 指数的变化幅度真菌更为显著,表明肥料对根际土壤真菌群落丰富度和多样性的影响大于细菌的。其中,百合细菌和真菌Chao1指数都是lilyW大于lilyY,这说明施用化肥的土壤(lilyW)中物种丰富度大于施用有机肥的(lilyY)。Shannon指数显示细菌的lilyY指数大于lilyW的指数,而真菌的lilyW的指数大于lilyY的指数,这说明施用有机肥(lilyY)使土壤中的细菌群落多样性升高,真菌多样性降低。
2.3 不同肥料处理对百合根际土壤细菌类群的影响
对测序得到的OTU结果进行分析可知(图3),lilyY和lilyW 2个样品中检测到细菌门数分别为15、14,细菌纲数分别为57、54,细菌数目分别为99、98,细菌科数分别为155、152,细菌属数分别为175、167。在门、纲、目、科、属水平均表现为施用有机肥处理(lilyY)大于施用化肥处理(lilyW)。
由图4-A可以看出,在2个百合土壤处理中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)所占比例较高,平均都大于10%。此外,绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)在2个处理中平均所占比例大于1%。其中,芽单胞菌门(Gemmatimonadetes)和拟杆菌门(Bacteroidetes)在不同肥料处理中丰度变化差异较大,芽单胞菌门(Gemmatimonadetes)在施用有机肥和无机肥处理下所占比例分别为10.6%和14.0%;而拟杆菌门(Bacteroidetes)在施用有机肥和无机肥所占比例分别为7.9%和3.9%。
对2个处理中含量最高的变形菌门(Proteobacteria)进行纲水平分析,其中α-变形菌纲(Alphaproteobacteria)在2个处理中含量最高,变化较小,平均占10.45%。δ-变形菌纲(Deltaproteobacteria)在2个处理中变化较大,其中,在有机肥中只占3.9%,而在化肥占5.3%。
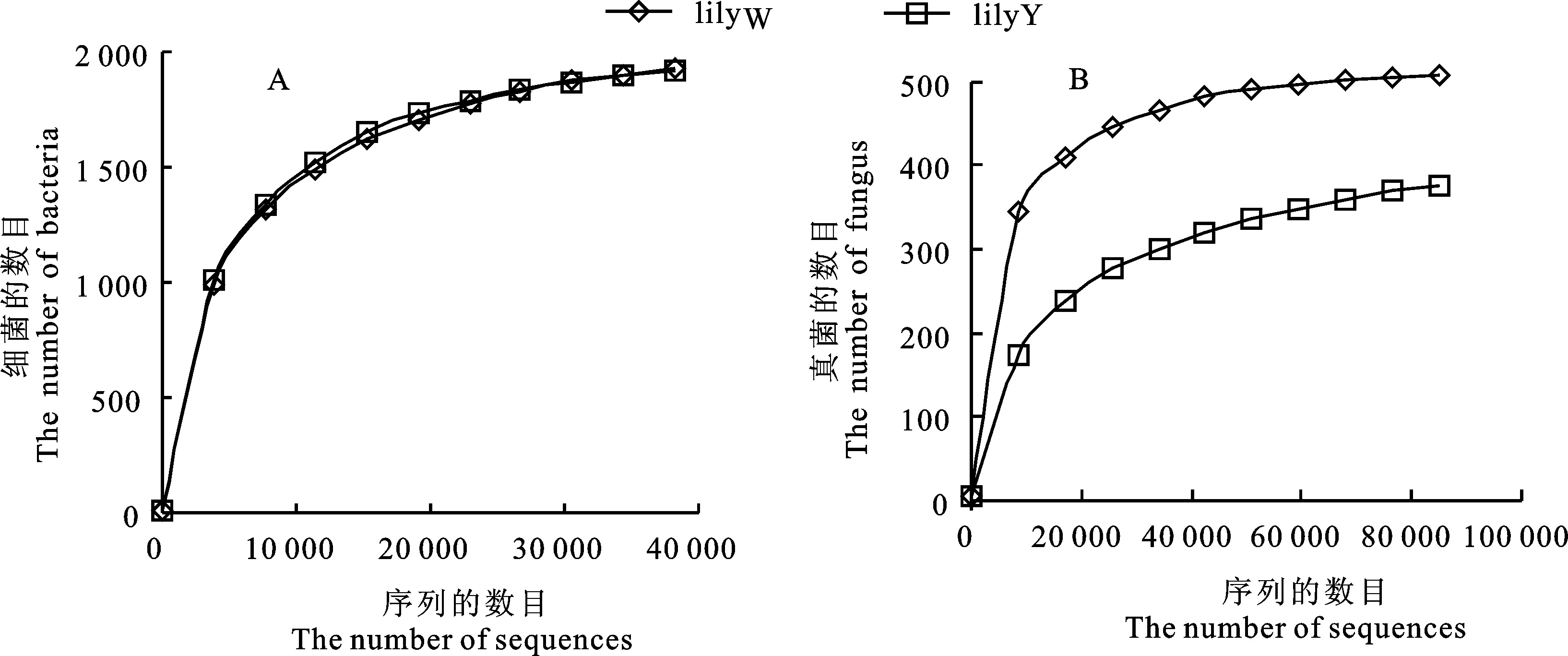
图2 相似度为0.97条件下各土壤细菌(A)和真菌(B)的稀释曲线Fig.2 Rare faction curves of bacteria(A) and fungus(B) in each rhizosphere soil sample at cutoff level of 3%
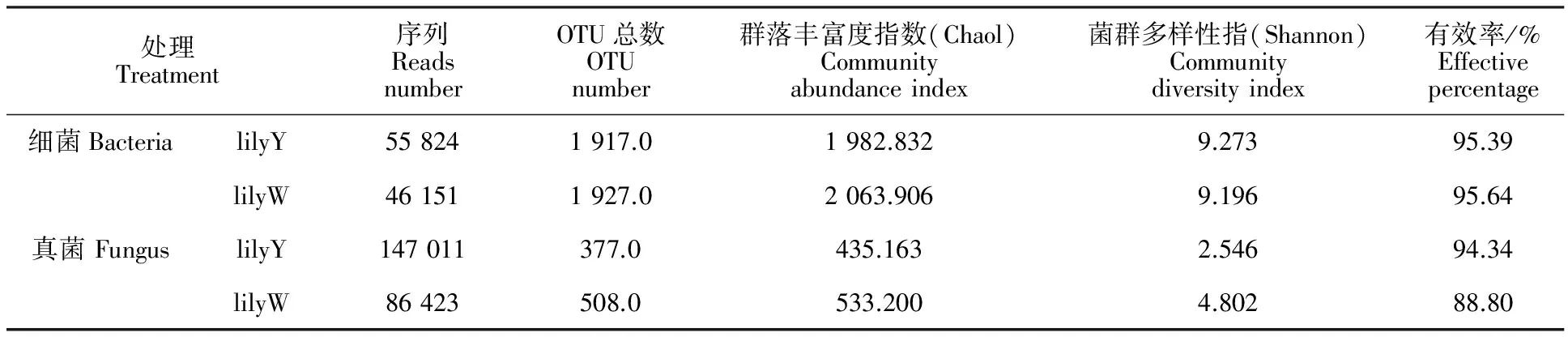
表1 不同肥料处理百合根际土壤细菌、真菌群落多样性指数Table 1 Bacteria and fungus diversity index in rhizosphere soil of lily in fertilizer and compost
对比施用有机肥和化肥的根际土壤细菌组成可发现,有机肥和化肥处理过的样品中各含有一些特有属(表2),其中,施用有机肥的土壤(lilyY)中出现的特有属有12个,包括盐细菌属(Salinibacterium)、野野村菌属(Nonomuraea)、副球菌属(Paracoccus)、红长命菌属(Rubrivivax)、索氏菌属(Thauera)、异常球菌属(Deinococcus)、海居菌属(Phycicoccus)、Salinimicrobium、Wautersiella、Faecalibacterium、Akkermansia和Luteolibacter; 施用化肥的土壤(lilyW)中特有属只有4个,包括苍白杆菌属(Ochrobactrum),无色杆菌属(Achromobacter),德沃斯氏菌属(Devosia)和Aquicella。
不同肥料的处理还会使一些细菌属的丰度发生不同变化(图5-A),其中,施用有机肥的样品(lilyY)中有8个属的丰度出现上调,包括不动杆菌属(Acinetobacter)、溶杆菌属(Lysobacter)、浮霉状菌属(Planctomyces)、鞘脂单胞菌属(Sphingomonas)、芽孢八叠球菌属(Sporosarcina)、固氮弓菌属(Azoarcus)、热单胞菌属(Thermomonas)和Pontibacter;而施用化肥的样品(lilyW)中有5个属出现丰度上调,包括出芽菌属(Gemmata),小梨形菌属(Pirellula)、Kaistobacter、Steroidobacter和Candidatussolibacter。此外,从表3可知,不同肥料处理对硝化螺菌属(Nitrospira)、短根瘤菌属(Bradyrhizobium)、芽孢杆菌属(Bacillus)、红游动菌属(Rhodoplanes)、Niastella、链霉菌属(Streptomyces)、生丝微菌属(Hyphomicrobium)、类芽孢杆菌属(Paenibacillus)、苯基杆菌属(Phenylobacterium)、假诺卡氏菌属(Pseudonocardia)等10个细菌属的相对丰度没有影响。
2.4 不同肥料对百合根际土壤真菌类群的影响
对于真菌分类(图3),lilyY和lilyW 2个样品中检测到真菌门数均为4;真菌纲数分别为7、10;真菌目数分别为12、20;真菌科数分别为15、28;真菌属数分别为23、37。在门、纲、目、科、属水平均表现出施化肥的样品(lilyW)大于施有机肥样品(lilyY)。
其中,在门水平如图4-B所示,子囊菌门(Ascomycota)所占比例最大,lilyY占32.1%,而lilyW达到80.7%,此外所占比例较多的是不能鉴定的真菌(Unidentified),lilyY和lilyW分别占67.0%和15.0%。
对比施用有机肥和化肥的根际土壤真菌组成可发现,有机肥和化肥处理过的样品中各含有一些特有属(表4),其中,施用化肥的土壤中特有属有16个,包括平脐蠕孢属(Bipolaris)、光黑壳属(Preussia)、外瓶霉属(Exophiala)、曲霉属(Aspergillus)、翘孢霉属(Emericella)、金孢子菌属(Chrysosporium)、Tetracladium、Leuconeurospora、地丝霉属(Geomyces)、念珠菌属(Candida)、Clonostachys、 翅孢壳属(Emericellopsis)、Wardomyces、丝盖伞属(Inocybe)、红菇属(Russula)和Geminibasidium;施用有机肥的特有属只有2个,包括鬼伞属(Coprinellus)和黑团孢属(Periconia)。
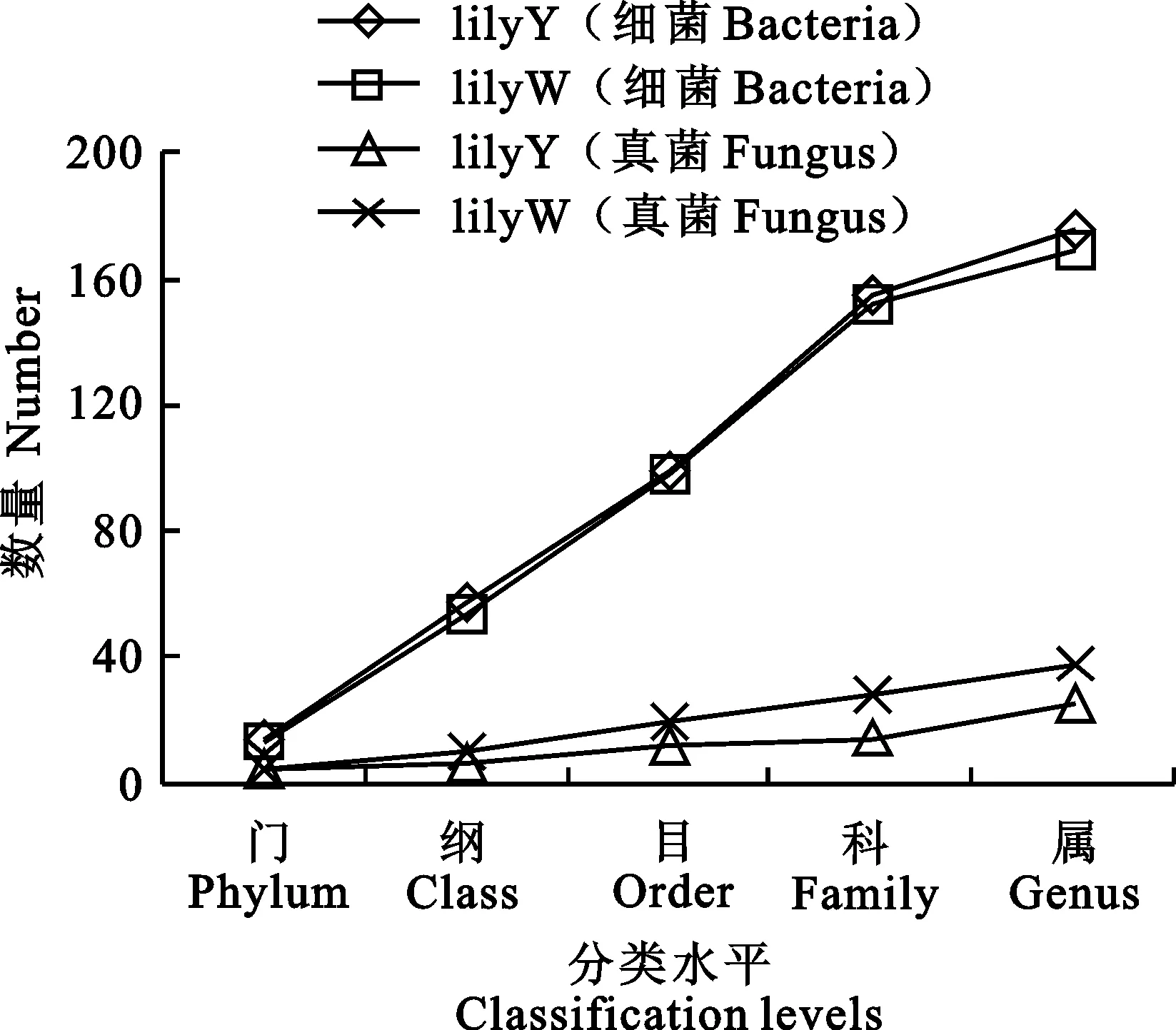
图3 不同肥料处理根际土壤细菌、真菌在各分类水平上的数量Fig.3 The number of each taxonomic levels for rhizosphere soil of fertilizer and compost
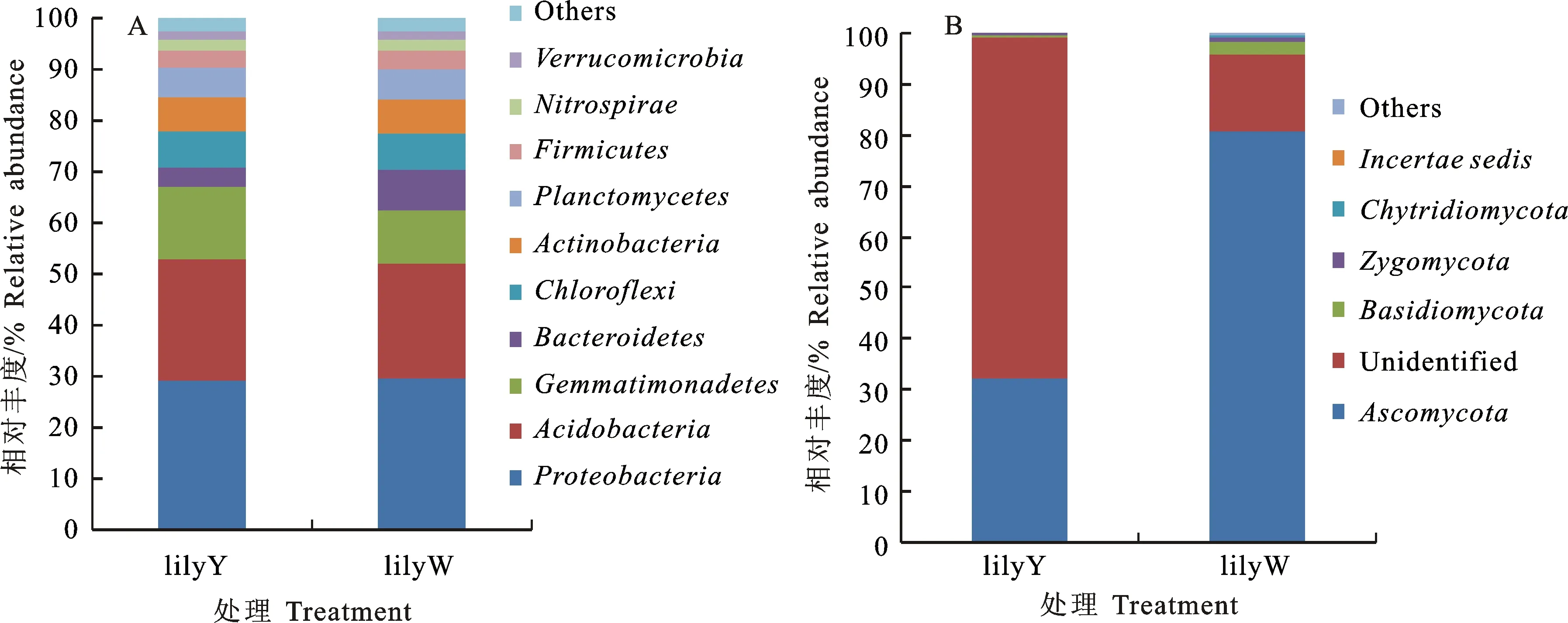
相对丰度算法:A/B×0.01,A代表在这个样本中某个属的克隆序列,B代表在这个样本中所有属的克隆序列 The clone abundance was calculated as: A/B×0.01,where A is the number of related clones detected in the genera for the library and B is the total number of all genera in the same library
不同肥料的施用还会使一些真菌属的丰度发生不同变化(图5-B),其中,施用化肥的样品(lilyW)中有15个属出现丰度上调,包括镰刀菌属(Fusarium)、赤霉菌属(Gibberella)、轮枝孢属(Verticillium)、青霉菌属(Penicillium)、油瓶霉属(Lecythophora)、支顶孢属(Acremonium)、漆斑菌属(Myrothecium)、葡萄穗霉属(Stachybotrys)、毛壳菌属(Chaetomium)、腐质霉属(Humicola)、短梗蠕孢属(Trichocladium)、柄孢壳菌属(Podospora)、被孢霉属(Mortierella)、假裸囊菌属(Pseudogymnoascus)和Plectosphaerella;而施用有机肥的样品(lilyY)中有2个属的丰度出现上调,包括Lectera和链格孢属(Alternaria)。
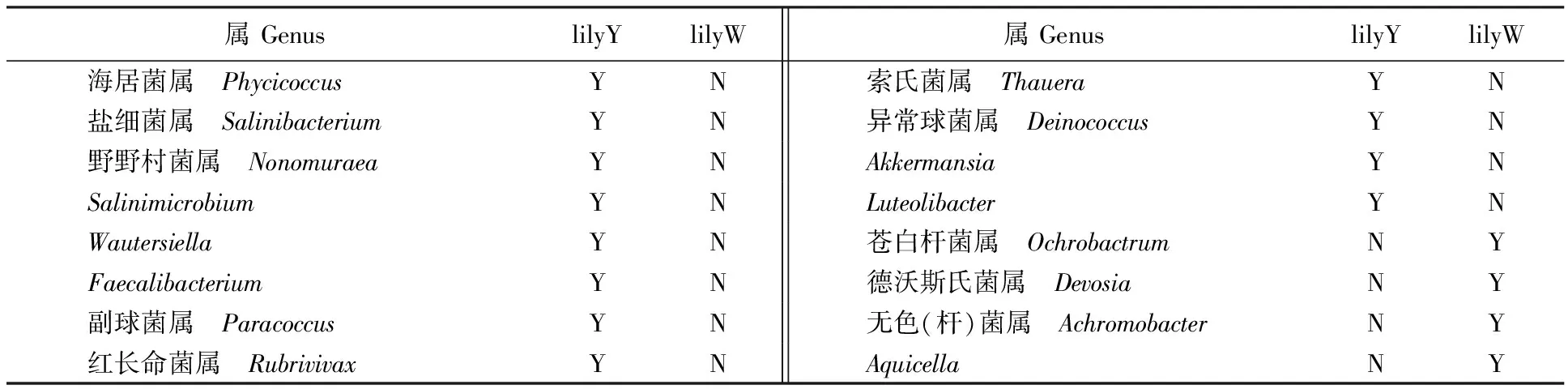
表2 不同肥料处理百合根际土壤细菌差异属比较Table 2 Comparison on bacterial genera of the lily rhizosphere soil under the treatment of fertilizer and compost,respectively
注:Y表示该属在此根际中存在;N表示该属在此根际中不存在。表4同。Note:Y represent presence of the genus in the rhizosphere soil; N represent absence of the genus in the rhizosphere soil.The same as table 4.

表3 不同肥料处理百合根际土壤细菌丰度不变的属Table 3 No change of bacteria relative abundance at genera level under fertilizer and compost treatments,respectively
注:各菌属功能的描述参照汪其同等[19]的研究成果。
Note:The function description of each genus were reported by WANG Qitongetal[19],2015.

表4 不同肥料处理百合根际土壤真菌差异属比较Table 4 Comparison of fungus genera in the lily rhizosphere soil under the treatment of fertilizer and compost treatments,respectively
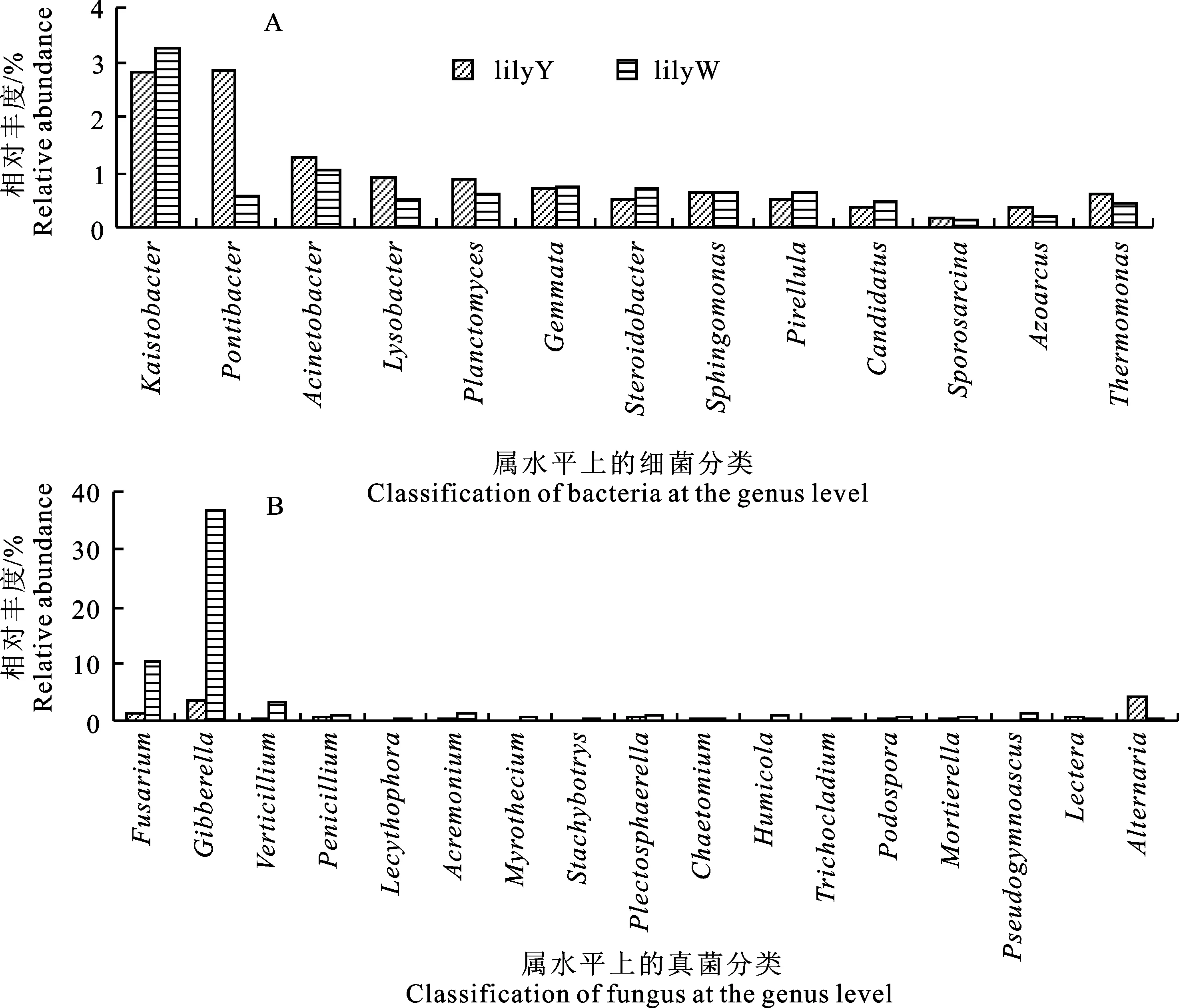
相对丰度算法同图4 The relative abundance was calculated as Fig.4
3 讨 论
3.1 不同肥料处理对兰州百合产量的影响
众多研究表明,增施有机肥可以促进作物生长,改善品质,提高产量。EM菌是由功能各异的80余种微生物组成的一种活菌制剂。在堆肥发酵过程中加入EM菌剂,有利于微生物的迅速繁殖及粪便和秸秆的快速分解,抑制或杀死病菌、虫卵等有害生物,并且有利于释放出氮磷钾和微量元素等有效养分。然而,EM有机菌肥在兰州百合种植上鲜有使用。为验证EM有机菌肥和常规化肥2种肥料对兰州百合产量的影响,测定兰州百合鳞茎的鲜质量,结果表明施用有机肥对兰州百合增产显著。这与之前在黄瓜[20]、番茄[21]等作物的堆肥试验结果相似。
土壤微生物在土壤有机质和养分转化、循环中起着极重要的作用[22]。同时,土壤微生物是土壤质量变化的敏感指标,能够迅速对周围环境的变化做出反应[23]。因此,不同施肥处理对微生物影响效果不同。本研究有机肥的施用提高土壤细菌的多样性,降低土壤真菌的多样性和丰度,尤其是降低致病真菌的多样性和丰度,这与以前的研究结果相同[24-26]。不仅如此,研究还发现土壤中大多数微生物的数量与土壤养分、作物产量呈正相关[27]。因此,合理施用有机肥有利于维持土壤有益微生物的多样性及活性,进而影响土壤肥力、植物的营养吸收和产量。
3.2 施用有机肥对兰州百合根际土壤细菌群落结构的影响
土壤微生物群落受很多因素影响。土壤类型、植物类型和田间管理都是影响土壤微生物群落的主要因子[28-30]。为减少其他因素的干扰,在本试验中,除了施用肥料不同外,其他条件(如田间管理、土壤类型、植物种类)控制都一样。本研究发现施用EM发酵有机肥和化肥对土壤细菌群落结构影响不同,这与之前的研究结果相同[31-32]。笔者发现在施用有机肥的土壤中芽单胞菌门(Gemmatimonadetes)的相对丰度有所降低。有研究报道芽单胞菌门(Gemmatimonadetes)相比湿润土壤环境更适合在干燥土壤环境中生存[33]。这在一定程度上说明施用有机肥可以提高百合根际土壤的保水能力。相反,拟杆菌门(Bacteroidetes)在有机肥中的丰度显著上升。Fierer等[34]和Goldfarb等[35]研究发现拟杆菌门(Bacteroidetes)是富营养性土壤细菌。经有机肥处理的兰州百合根际土壤中的拟杆菌门(Bacteroidetes)的丰度明显上升,表明经有机肥处理的土壤中可利用的物质增多。不仅在门水平,还发现属水平施用有机肥相对丰度上调幅度高于施用化肥的,这表明有机肥对土壤细菌有积极的作用。
研究发现EM有机菌肥对兰州百合土壤细菌的选择是有一定范围的。如硝化螺菌属(Nitrospira)、短根瘤菌属(Bradyrhizobium)、芽孢杆菌(Bacillus)、红游动菌属(Rhodoplanes)、Niastella、链霉菌属(Streptomyces)、生丝微菌属(Hyphomicrobium)、类芽孢杆菌属(Paenibacillus)、苯基杆菌属(Phenylobacterium)、假诺卡氏菌属(Pseudonocardia)等一些在土壤中有一定生态功能的菌群相对丰度并没有因施用不同肥料而发生变化。虽然这些属的丰度值没有进一步的验证,但是这些结果与Piromyou等[36]的研究结果一致。
此外,研究还发现经有机肥处理的兰州百合根际特有细菌多为有益菌,如野野村氏菌属(Nonomuraea)有积极的生态功能(抗菌)[37-38]。而化肥处理的根际特有细菌属如Aquicella是包含了已报道的致病菌。这表明有机肥增加有益细菌的多样性,也印证EM菌有机肥一定程度上能够改善土壤的理化性质,调节土壤微生物种群。
3.3 施用有机肥对百合根际土壤真菌群落结构的影响
相对细菌来说,施用有机肥和化肥对根际真菌群落的影响不同。各个分类水平(如门、纲、目、科、属等)上的数量在施用化肥的样本中都高于施用有机肥的样本。在门水平,除了不能鉴定到具体的门水平以外,所有能鉴定到门水平的相对丰度施用有机肥处理(lilyY)低于施用化肥处理(lilyW)。例如,子囊菌门(Ascomycota)的相对丰度,lilyY只占32.1%,而lilyW占80.7%,施用化肥的土壤子囊菌门(Ascomycota)的丰度是施用有机肥的2倍多。说明施用有机肥显著影响土壤的真菌群落。
镰刀菌属(Fusarium)是引起植物根腐的主要病原菌。而假单胞菌属(Pseudomonas)是主要的根际细菌,有潜在控制植物病原菌的能力[39-40],尤其对镰刀菌属有一定的拮抗能力[41-43]。本研究发现,在施用2种肥料的土壤中并没有检测到假单胞菌属的存在,但是在施用有机肥的土壤中镰刀菌属的丰度却显著降低。这就说明有机肥不是简单的增加拮抗菌的丰度去抑制病原菌这种一对一的常规模式,可能存在更复杂的调节机制。
另外,施用有机肥的土壤中镰刀菌属(Fusarium)、曲霉属(Aspergillus)、青霉菌属(Penicillium)和支顶孢属(Acremonium)等真菌属的丰度小于施用化肥的。这与之前的研究结果相同,有机肥能够使土壤中真菌数量减少[44]。据报道[39,45-49]这些属包含的菌株多数为致病菌,这从另一方面说明施用有机肥对百合的生长是有利的。
致谢:感谢张宝贵博士对本研究的帮助。
Reference:
[1] PANKHURST C E,OPHEL-KELLER K,DOUBE B M,etal.Biodiversity of soil microbial communities in agricultural systems[J].Biodiversity&Conservation,1996,5(2):197-209.
[2] SCHLOTER M,DILLY O,MUNCH J C.Indicators for evaluating soil quality[J].Agriculture,Ecosystems&Environment,2003,98(1):255-262.
[3] FAUCI M F,DICK R P.Soil microbial dynamics:short-and long-term effects of inorganic and organic nitrogen[J].SoilScienceSocietyofAmericaJournal,1994,58(3):801-806.
[4] MARSCHNER P,KANDELER E,MARSCHNER B.Structure and function of the soil microbial community in a long-term fertilizer experiment[J].SoilBiologyandBiochemistry,2003,35(3):453-461.
[5] 黄 鹏.施肥对兰州百合植株生长及鳞茎产量的影响[J].植物营养与肥料学报,2007,13(4):753-756.
HUANG P.Effect of fertilization on growth ofLiliumdavidiivar.unicolor and the yield of bulb [J].PlantNutritionandFertilizerScience,2007,13(4):753-756(in Chinese with English abstract).
[6] IMAI S,HIGA T.Kyusei nature farming in Japan.Effect of EM on growth and yield of spinach[C]//Proceedings of 2nd International Conference on Kyusei Nature Farming,Brazil.1991:92-96.
[7] KUMAZAWA K.Beneficial effects of organic matter on rice growth and yield in Japan[M].Organic Matter and Rice.IRRI,Philippines,1984:431-443.
[8] ATIYEH R M,ARANCON N,EDWARDS C A,etal.Influence of earthworm-processed pig manure on the growth and yield of greenhouse tomatoes[J].BioresourceTechnology,2000,75(3):175-180.
[9] ATIYEH R M,EDWARDS C A,SUBLER S,etal.Pig manure vermicompost as a component of a horticultural bedding plant medium:effects on physicochemical properties and plant growth[J].BioresourceTechnology,2001,78(1):11-20.
[10] KIRK J L,BEAUDETTE L A,HART M,etal.Methods of studying soil microbial diversity[J].JournalofMicrobiologicalMethods,2004,58(2):169-188.
[11] BING-RU L I U,GUO-MEI J I A,JIAN C,etal.A review of methods for studying microbial diversity in soils[J].Pedosphere,2006,16(1):18-24.
[12] GOMEZ-ALVAREZ V,TEAL T K,SCHMIDT T M.Systematic artifacts in metagenomes from complex microbial communities[J].TheISMEJournal,2009,3(11):1314-1317.
[13] DEGNAN P H,OCHMAN H.Illumina-based analysis of microbial community diversity[J].TheISMEJournal,2012,6(1):183-194.
[14] CAPORASO J G,LAUBER C L,WALTERS W A,etal.Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J].TheISMEJournal,2012,6(8):1621-1624.
[15] EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].NatureMethods,2013,10(10):996-998.
[16] WANG Q,GARRITY G M,TIEDJE J M,etal.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].AppliedandEnvironmentalMicrobiology,2007,73(16):5261-5267.
[17] DESANTIS T Z,HUGENHOLTZ P,LARSEN N,etal.Greengenes,a chimera-checked 16S rRNA gene database and workbench compatible with ARB[M].AppliedandEnvironmentalMicrobiology,2006,72(7):5069-5072.
[18] CHAO A.Estimating the population size for capture-recapture data with unequal catchability[J].Biometrics,1987,43(4):783-791.
[19] 汪其同,朱婉芮,刘梦玲,等.基于高通量测序的杨树人工林根际和非根际细菌群落结构比较[J].应用与环境生物学报,2015(5):29.
WANG Q T,ZHU W R,LIU M L,etal.Comparison on bacterial community of rhizosphere and bulk soil of poplar plantation based on pyrosequencing[J].ChineseJournalofAppliedandEnvironmentalBiology,2015(5):29(in Chinese with English abstract).
[20] 杨 猛,姚 静,王瑞良.EM 菌堆肥对大棚黄瓜生长发育产量和品质的影响[J].中国蔬菜,2011(8):60-64.
YANG M,YAO J,WANG R L.Effects of EM microbe compost on yield and nutritional quality of cucumber in greenhouse[J].ChinaVegetables,2011(8):60-64(in Chinese with English abstract).
[21] 张 磊,陈 军.EM 菌堆肥对番茄生长发育的影响[J].南方农业,2014,8(10):158-158.
ZHANG L,CHEN J.Effects of EM microbe compost on the growth and development of tomato[J].SouthChinaAgriculture,2014,8(10):158-158(in Chinese).
[22] 李阜棣.土壤微生物学[M].北京:中国农业出版社,1996.
LI F L.Soil Microbiology [M].Beijing:China Agricultural Press,1996(in Chinese).
[23] AVIDANO L,GAMALERO E,COSSA G P,etal.Characterization of soil health in an Italian polluted site by using microorganisms as bioindicators[J].AppliedSoilEcology,2005,30(1):21-33.
[24] 蔡燕飞,廖宗文,章家恩,等.生态有机肥对番茄青枯病及土壤微生物多样性的影响[J].应用生态学报,2003,14(3):349-353.
CAI Y F,LIAO Z W,ZHANG J E,etal.Effect of ecological organic fertilizer on tomato bacterial wilt and soil microbial diversities[J].ChineseJournalofAppliedEcology,2003,14(3):349-353(in Chinese with English abstract).
[25] 曹 群,丁文娟,赵兰凤,等.生物有机肥对冬瓜枯萎病及土壤微生物和酶活性的影响[J].华南农业大学学报,2015,36(2):36-42.
CAO Q,DING W J,ZHAO L F,etal.Effects of biological organic fertilizer on wax gourd wilt disease,microorganism and enzyme activities in soil[J].JournalofSouthChinaAgriculturalUniversity,2015,36(2):36-42(in Chinese with English abstract).
[26] 袁英英,李敏清,胡 伟,等.生物有机肥对番茄青枯病的防效及对土壤微生物的影响[J].农业环境科学学报,2011,30(7):1344-1350.
AN Y Y,LI M Q,HU W,etal.Effect of biological organic fertilizer on tomato bacterial wilt and soil microorganism[J].JournalofAgro-EnvironmentScience,2011,30(7):1344-1350(in Chinese with English abstract).
[27] 李秀英,赵秉强,李絮花,等.不同施肥制度对土壤微生物的影响及其与土壤肥力的关系[J].中国农业科学,2005,38(8):1591-1599.
LI X Y,ZHAO B Q,LI X H,etal.Effects of different fertilization systems on soil microbe and its relation to soil fertility[J].ScientiaAgriculutraSinica,2005,38(8):1591-1599(in Chinese with English abstract).
[28] GARBEVA P,VAN VEEN J A,VAN ELSAS J D.Microbial diversity in soil:selection of microbial populations by plant and soil type and implications for disease suppressiveness[J].AnnualReviewofPhytopathology,2004,42:243-270.
[29] WIELAND G,NEUMANN R,BACKHAUS H.Variation of microbial communities in soil,rhizosphere,and rhizoplane in response to crop species,soil type,and crop development[J].AppliedandEnvironmentalMicrobiology,2001,67(12):5849-5854.
[30] SUDINI H,LILES M R,ARIAS C R,etal.Exploring soil bacterial communities in different peanut-cropping sequences using multiple molecular approaches[J].Phytopathology,2011,101(7):819-827.
[31] 徐阳春,沈其荣,冉 炜.长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J].土壤学报,2002,39(1):89-96.
XU Y CH,SHEN Q R,RAN W.Effects of zero-tillage and application of manure on soil microbial biomass C,N and P after sixteen years of cropping[J].ActaPedologicaSinica,2002,39(1):89-96(in Chinese with English abstract).
[32] 韩晓日,郑国砥,刘晓燕,等.有机肥与化肥配合施用土壤微生物量氮动态、来源和供氮特征[J].中国农业科学,2007,40(4):765-772.
HAN X R,ZHENG G D,LIU X Y,etal.Dynamics,sources and supply charecteristic of microbial biomass nitrogen in soil applied with manure and fertilizer[J].ScientiaAgriculturaSinica,2007,40(4):765-772(in Chinese with English abstract).
[33] DEBRUYN J M,NIXON L T,FAWAZ M N,etal.Global biogeography and quantitative seasonal dynamics of Gemmatimonadetes in rhizosphere soil[J].AppliedandEnvironmentalMicrobiology,2011,77(17):6295-6300.
[34] FIERER N,BRADFORD M A,JACKSON R B.Toward an ecological classification of rhizosphere soil bacteria[J].Ecology,2007,88(6):1354-1364.
[35] GOLDFARB K C,KARAOZ U,HANSON C A,etal.Differential growth responses of rhizosphere soil bacterial taxa to carbon substrates of varying chemical recalcitrance[J].FrontiersinMicrobiology,2001,2:1-10.
[36] PIROMYOU P,BURANABANYAT B,TANTASAWAT P,etal.Effect of plant growth promoting rhizobacteria(PGPR) inoculation on microbial community structure in rhizosphere of forage corn cultivated in Thailand[J].EuropeanJournalofSoilBiology,2011,47(1):44-54.
[37] 陈玉英.海洋放线菌次级代谢产物的研究[D].福州:福建医科大学,2014.
CHEN Y Y.Studies on the secondary metabolites of marine actinomycetes[D].Fuzhou:Fujian Medical University,2014(in Chinese with English abstract).
[38] 秦 盛,赵立兴,陈 云,等.药用植物内生放线菌的分离,筛选及活性菌株 YIM 61470 鉴定[J].微生物学通报,2009,36(11):693-1699.
QIN SH,ZHAO L X,CHEN Y,etal.Endophytic actinomycetes associated with medicinal plants:isolation,antimicribial activity and identification[J].MicrobiologyChina,2009,36(11):1693-1699(in Chinese with English abstract).
[39] PLIEGO C,RAMOS C,DE VICENTE A,etal.Screening for candidate bacterial biocontrol agents against rhizosphere soilborne fungal plant pathogens[J].PlantandRhizosphereSoil,2011,340(1/2):505-520.
[40] SAHARAN B S.Plant growth promoting rhizobacteria:a critical review[J].LifeSciencesandMedicineResearch,2011.
[41] ALMARIO J,MONNE-LOCCOZ Y,MULLER D.Monitoring of the relation between 2,4-diacetylphloroglucinol-producingPseudomonasandThielaviopsisbasicolapopulations by real-time PCR in tobacco black root-rot suppressive and conducive rhizosphere soils[J].RhizosphereSoilBiologyandBiochemistry,2013,57:144-155.
[42] ELMER W H,PIGNATELLO J J.Effect of biochar amendments on mycorrhizal associations andFusariumcrown and root rot of asparagus in replant rhizosphere soils[J].PlantDisease,2011,95(8):960-966.
[43] LI Y G,MA F M.Antagonistic mechanism ofFusariumoxysporumof soybean root rot byBacillussubtilis[J].AppliedMechanicsandMaterials,2011,108:127-131.
[44] 张 慧,杨兴明,冉 炜,等.土传棉花黄萎病拮抗菌的筛选及其生物效应[J].土壤学报,2008,45(6):1095-1101.
ZHANG H,YANG X M,RAN W,etal.Screening of bacteria antagonistic against soil-borne cotton verticillium wilt and their biological effects on the soil-cotton system[J].ActaPedologicaSinica,2008,45(6):1095-1101(in Chinese with English abstract).
[45] ANAISSIE E J,STRATTON S L,DIGNANI M C,etal.PathogenicAspergillusspecies recovered from a hospital water system:a 3-year prospective study[J].ClinicalInfectiousDiseases,2002,34(6):780-789.
[46] BENHAMOU N.Potential of the mycoparasite,Verticilliumlecanii,to protect citrus fruit againstPenicilliumdigitatum,the causal agent of green mold:A comparison with the effect of chitosan[J].Phytopathology,2004,94(7):693-705.
[47] D'SOUZA C A,ALSPAUGH J A,YUE C,etal.Cyclic AMP-dependent protein kinase controls virulence of the fungal pathogenCryptococcusneoformans[J].MolecularandCellularBiology,2001,21(9):3179-3191.
[49] GARBEVA P.Microbial diversity in rhizosphere soil:selection of microbial populations by plant and rhizosphere soil type and improvement for disease suppr[J].AnnualReviewofPhytopathology,2004,42:1-464.
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)
Effect of Compost on Rhizosphere Microbial Community of Lanzhou-lily Based on High Throughput Sequencing
HAO Haiting1,2,3,WANG Ruoyu1,2,3,ZHAO Xia1,2,3,WANG Yun3,4,GUO Zhihong1,2,3,ZHANG Yubao1,2,3and XIE Zhongkui1,2,3
(1.Gaolan Station of Agricultural and Ecological Experiment,Cold and Arid Regions Environmental and Engineering Research Institute,Chinese Academy of Sciences,Lanzhou 730000,China;2.Key Laboratory of Stress Physiology and Ecology in Cold and Arid Regions of Gansu Province,Lanzhou 730000,China;3.University of Chinese Academy of Sciences,Beijing 100049,China;4.Key Laboratory of Desert and Desertification,Cold and Arid Regions Environmental and Engineering Research Institute,Chinese Academy of Sciences,Lanzhou 730000,China)
In this study,we investigated the rhizosphere bacteria and fungi community which fertilized by compost and chemical fertilizer respectively by the llumina Miseq platform.The result showed that compared with chemical fertilizer,the fresh production of bulbs in the first year of planting increased 76.6% when compost was used.The species annotation of the high throughput sequencing experiment showed that the diversity of bacteria on each taxonomic level in rhizosphere soil with compost was all larger than that with chemical fertilizer.However,the number at each taxonomic level of fungi with compost was less than that with chemical fertilizer.The indices of Chao1 and Shannon showed that the change of bacteria community was less than the change of fungi community.The relative abundance of some bacterial genus had no change between rhizosphere soil with compost or chemical fertilizer and most of them belong to the beneficial group.Besides,we found that some beneficial bacteria,such asNonomuraea,were present only in compost-used rhizosphere soil,but some pathogenic bacteria appeared only in the inorganic-fertilized soil,such asAquicella.The abundance of fungi genus likeFusarium,Aspergillus,PenicilliumandAcremoniumdecreased in rhizosphere soil used compost,most of which were potential pathogenic or opportunistic fungi.In conclusion,the results showed that compost could effectively affect the diversity and distribution of microorganism community in lily rhizosphere.
Lanzhou-lily;Organic compost;Rhizosphere microorganisms;llumina MiSeq sequencing
HAO Haiting,female,doctoral student.Research area:molecular microbiology.E-mail: m18919046163@163.com
WANG Ruoyu,male,Ph.D,research fellow.Research area:molecular ecology.E-mail: wangruoyu@lzb.ac.cn
日期:2017-03-03
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170303.0833.052.html
2016-04-01
2016-05-15
国家自然科学基金(31370447);中国科学院“百人计划”项目(27Y127L41002)。
郝海婷,女,博士研究生,研究方向为分子微生物。 E-mail:m18919046163@163.com
王若愚,男,博士,研究员,研究方向为分子生态 。E-mail: wangruoyu@lzb.ac.cn
S-3
A
1004-1389(2017)03-0437-11
Received 2016-04-01 Returned 2016-05-15
Foundation item The National Natural Science Foundation of China(No.31370447); the Chinese Academy of Sciences under the “One Hundred Talents” Program(No.27Y127L41002).

