干扰素诱导的跨膜蛋白研究初探
李东富,覃 岭,张永宏
干扰素诱导的跨膜蛋白研究初探
李东富,覃 岭,张永宏
生物机体存在多种方式减缓甚至阻止病毒复制。其机制主要通过抗病毒蛋白来介导,可因干扰素诱导而扩大。在这些干扰素刺激蛋白中,干扰素诱导的跨膜(interferon-induced transmembrane, IFITM)蛋白家族独树一帜,其通过阻止病毒透过细胞脂质双分子层而防止病毒感染。目前已知,至少有3种IFITM具有抗病毒活性:IFITM1、IFITM2以及IFITM3。这些跨膜蛋白已被证实在体外细胞培养中能阻止多种RNA病毒感染,包括登革热病毒、埃博拉病毒、甲型流感病毒、SARS冠状病毒和西尼罗病毒等。人ifitm3基因多态性与季节性流感/高致病性禽流感病情严重程度相关,但介导其抗病毒作用的具体分子机制仍不完全清楚。本文主要讨论ifitm基因、IFITM蛋白及其抗病毒作用和可能的作用机制,从而在研究病毒感染和肿瘤治疗中另辟蹊径,寻找最佳治疗方案。
ifitm基因; IFITM蛋白;作用;机制
1 IFITM家族分子
1.1 IFITM家族分子基因 干扰素诱导的跨膜(interferon-induced transmembrane, IFITM)蛋白是最早被发现的一批干扰素诱导蛋白[1],被命名为9-27(IFITM1)、1-8D(IFITM2)、1-8U(IFITM3),而在小鼠中依次命名为fragilis2,fragilis3,fragilis。IFITM蛋白属于跨膜蛋白家族,根据基因相似性和推定功能,IFITM蛋白还可进一步分为3种[2]。第一种为所有具有抗病毒活性的人类蛋白,即免疫相关IFITM蛋白,命名为IFITM1、IFITM2、IFITM3。IFITM2与IFITM3高度同源,IFITM1略有不同。此种蛋白还包括以上鼠源性同源基因编码的IFITM蛋白和鼠源性IFITM6、IFITM7。IFITM7由IFITM1来源的无内含子的反转基因编码。在诸如恒河猴等其他物种中,尚不能认为其ifitm2/3基因与人类的ifitm2/3等位基因相同[2-5]。人类ifitm基因位于11号染色体,鼠位于7号染色体,鸡位于5号染色体,鼠ifitm7位于16号染色体,可能由ifitm1逆转录而来。除了ifitm7,人类及鼠类编码ifitm的基因都含有1个内含子以分隔2段外显子,而这些基因多数附加1个前驱非编码的外显子。如图1所示。
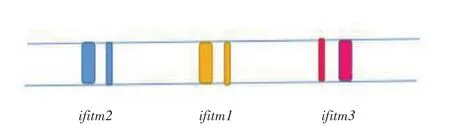
图1 ifitm 基因模式图[3]免疫相关基因(ifitm1,ifitm2,ifitm3)在人类形成1个基因簇,在小鼠和禽类中同样存在(带颜色的表示外显子,其中较小部分即为前驱非编码外显子)Figure1 Schematic diagram of ifitm
IFITM家族的多态性、异质性提示其进化过程经历了强烈的正向选择,与其制约病毒因子的功能相符[2]。第二种和第三种IFITM分别是IFITM5及IFITM10。虽然ifitm10基因临近人类ifitm基因位点,而ifitm5基因位于ifitm基因位点之中,但这两种蛋白都非干扰素可诱导,也不具备抗病毒活性[2],反映了基因的纯化过程,而非横向选择过程,且两者在大多数脊椎动物中都有明确的等位基因。
研究发现,ifitm基因存在剂量效应。Smith等[4]分别用鼠源化相对低毒的H3N2(A/X-31)和2009年疫情H1N1感染ifitm3-/-小鼠及野生型小鼠,发现ifitm3-/-小鼠在第6 d时体质量下降大于25%者死亡,野生型小鼠第6 d时体质量下降小于25%者康复。Bailey等[6]以H1N1(A/PR/8/34)分别感染ifitm3-/-和ifitmDel-/-的小鼠,发现其相较于野生型小鼠,体质量减轻更快,在第6 d时体质量下降均大于20%者死亡,约60%野生型小鼠在7~8 d时体质量下降大于20%,其余均康复。实验组和野生型小鼠杂交后代表现出介于两者之间的抗病毒反应,提示了ifitm3基因的剂量效应。而ifitm3-/-、ifitmDel-/-和ifitm3+/-、ifitmDel+/-杂交小鼠之间抗病毒活性无明显区别,提示鼠源性ifitm3在抗甲型流感病毒(inf l uenza A virus, IAV)感染中的重要作用,ifitm基因尚待进一步研究。
1.2 IFITM家族分子的表达 IFITM蛋白普遍存在于真核和原核生物中[7],并广泛表达于多种组织。对IFITM蛋白多向胚胎细胞研究发现,在小鼠胚胎中,ifitm3特异的表达于原始生殖细胞(primordial germ cells, PGCs),而不表达于临近体细胞,因此IFITM3可作为代表小鼠生殖细胞活力的标志物。IFITM1介导PGCs由中胚层迁移至内胚层。Lange等[8]建立小鼠模型以研究IFITM蛋白在原始生殖细胞中的演变过程。ifitmDel-/-小鼠敲除位于7号染色体上120 kb的整个ifitm区域,ifitm1、ifitm2、ifitm3、ifitm5、ifitm6基因不表达,而由逆转录而来的位于16号染色体的ifitm7、ifitm10基因保持完整。这些小鼠正常生存,无任何发育缺陷,与野生型相比生育能力也无区别。
虽然IFITM在干扰素刺激后表达广泛,但Bailey等[6]在研究IFITM的表达情况时发现,IFITM主要表达于肺泡Ⅱ型上皮细胞、气管和支气管上皮细胞等流感病毒的靶组织中。例如,IFITM3在野生型小鼠的肺组织,尤其是呼吸道上皮、脏胸膜、内皮细胞上都有固定表达,这些组织均构成体内外环境解剖屏障或分隔不同体腔,提示IFITM3能阻止感染扩散。值得一提的是,Bailey在ifitmDel-/-小鼠脾脏中发现了病毒RNA,但未见到任何组织学改变。
IFITM5主要表达于成骨细胞[9],其变异与成骨不全症V型相关[10-11]。研究显示,敲除ifitm5的小鼠,在胚胎发育期骨形成发生细微改变[9],而IFITM10的表达方式及功能尚不完全清楚。
1.3 IFITM分子结构研究 初期发现,ifitm基因编码LEU-13抗原(现名CD225),提示至少存在部分IFITM1蛋白暴露于质膜。其与B细胞受体组成部分CD19、CD21、CD81/TAPA-1(最直接)相关。抗体交联IFITM1可促进白血病B细胞与T细胞粘附,抑制B细胞增殖,下调L-选择蛋白。IFITM的拓扑结构提示其可能不存在天然配体,因此IFITM1抗体应该是通过与IFITM1相关蛋白交联而发挥作用。故考虑IFITM1为跨膜蛋白。
利用去污剂微粒对IFITM3进行系统性定点自旋标记和电子顺磁共振,确定了C-末端单一的长跨膜螺旋和在N-末端疏水区的膜内段,并且确定了野生型IFITM3蛋白单体状态[12]。
目前,已提出针对IFITM3蛋白的3种膜拓扑结构模型[13](图2)。①基于流式细胞术实验和细胞表面免疫染色实验的结果,第一种IFITM3模型是1个双跨膜蛋白,N-和C-末端暴露于内质网腔或细胞外空间;②基于该N-和C-末端区域内所插入的N-联糖基化位不能被修改,第二种IFITM3模型为膜内拓扑结构,其N-和C-末端同时朝向细胞质;③而最新实验,基于电子顺磁共振和液态核磁共振研究结果,又提出第三种IFITM3模型,即II型跨膜蛋白,此模型结构与其发挥抗病毒机制可能的结构相符,但从IFITM3功能考虑又可以推导出其他与此相悖的膜拓扑模型[14]。由此推测:IFITM3可能在病毒感染不同的阶段或在不同类型的宿主细胞中存在多种拓扑结构。进一步深入研究IFITM3在不同的细胞类型中结构和功能的相关性将有利于揭示其抗病毒机制。
2 IFITM蛋白分子功能
2.1 IFITM蛋白抗病毒作用 通过不同蛋白质进行细胞融合的病毒或逆转录病毒假病毒都可以被一种或多种IFITM蛋白制约。IFITM抗病毒活性最早发现于1996年,该研究表明过表达IFITM1可抑制水泡性口炎病毒(vesicular stomatitis virus, VSV)复制。虽然程度不及干扰素诱导蛋白抗粘液病毒蛋白A,但是过表达人类IFITM1蛋白的小鼠细胞比对照组小鼠细胞抗VSV能力更强[15],而抗IAV的能力相对较弱。尽管近期有研究指出其抗IAV能力较VSV更强,但此研究仍是第一篇关于IFITM蛋白抗病毒活性的报道。2009年,Brass[16]及Shapira[17]发现了IFITM3可能是IAV的制约因子。之后Brass进一步证实了抗IFITM3的siRNA能明显促进H1N1(A/PR/8/34)在U2OS细胞中的复制,IFITM3特异性siRNA可对抗γ-干扰素介导的病毒抑制。在A549、U2OS、MDCK细胞系及鸡胚成纤维细胞中,过表达人类IFITM1、IFITM2、IFITM3均能抑制H1N1(A/ PR/8/34)、H3N2(A/Udorn/72),但不能抑制鼠白血病病毒(murine leukemia virus, MLV)。敲除ifitm基因(ifitmDel-/-)的小鼠胚胎成纤维细胞(mouse embryonic fi broblasts, MEFs)相较于其他野生型的MEFs,对IAV更易感;I/II型干扰素对于ifitmDel-/-的MEFs所起到的抗IAV能力也更弱。与此同时,IFITM1、IFITM2、IFITM3能有效抑制携带H1、H3、H5、H7红细胞凝集素但不携带马丘波病毒或MLV的感染,提示其对病毒的制约作用可能主要通过干扰某种红细胞凝集素从而参与病毒融合。颗粒病毒,如登革热病毒及西尼罗病毒,同样易受IFITM制约。IFITM介导的病毒易感性随细胞类型、病毒滴度、IFITM蛋白种类及其表达水平而改变。以下是IFITM相关病毒制约作用的研究。
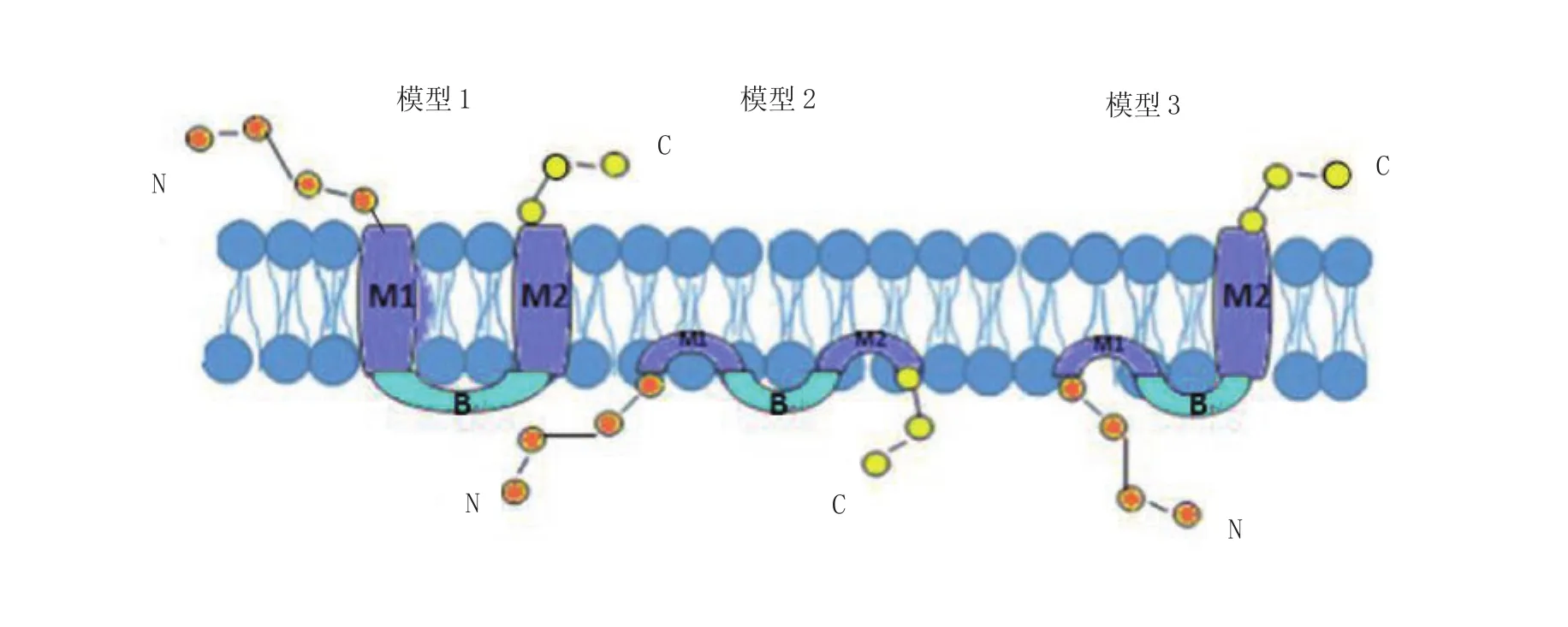
图2 IFITM 结构模型IFITM蛋白由2个外显子编码而成,具有N端、跨膜区1、保守的胞内环、跨膜区2和C端5个结构域组成(图中N代表N端,B代表保守的胞内环,C代表C端,M1代表跨膜区1,M2代表跨膜区2)Figure 2 Structural models of IFITM
2.1.1 IAV 体内外实验都已证实IFITM对IAV具有抑制作用。IFITM3对IAV的制约作用显著强于IFITM1和IFITM2。人或鼠的IFITM都能在人细胞上制约IAV,惟一例外的是鼠IFITM6,其仅在鼠细胞中起作用,能成功制约埃博拉病毒(Ebola virus, EBOV)假病毒[18]。小鼠实验中,IFITM3在制约IAV中起关键作用,而IFITM1、IFITM2作用有限甚至无显著作用[6]。同时各型IAV,如H1N1、H3N2、H5N1、H7N1、H7N9,都能被IFITM制约,至今无IAV免疫逃避IFITM的报道。
2.1.2 黄病毒属 黄病毒属主要包括登革热病毒1型、 2型,日本脑炎病毒和西尼罗病毒[18-19]。内源性IFITM减少会增强病毒复制,而IFITM过表达会明显抑制病毒复制。最新对于寨卡病毒的研究显示:IFITM1和IFITM3均具有抑制病毒作用。实验表明,IFITM1对存在于细胞表面或早期通过内体途径进入细胞的病毒更有效,而IFITM3则对晚期通过内体途径进入细胞的病毒更有效,且过表达的IFITM1抑制程度低于IFITM3,两者均通过直接改变细胞和/或病毒膜的性质,阻断融合孔形成,限制病毒基因组及其相关蛋白进入细胞质来抑制病毒复制[20]。目前认为IFITM抑制作用主要体现在病毒融合过程。黄病毒的结构蛋白不能制作成逆转录病毒假病毒或VSV,所以研究使用的都是感染性病毒体或病毒样颗粒(virus-like particle, VLP)。研究发现感染性病毒体和VLP的融合需要有活性的非结构蛋白辅助,推测:IFITM蛋白很可能通过限制病毒融合从而具有抗病毒作用。然而,IFITM表达不影响电穿孔登革热病毒复制子的效率[19],考虑到黄病毒融合宿主细胞的部位类似IAV,所以有可能这些病毒都通过相同的机制被制约。
2.1.3 丝状病毒与SARS冠状病毒 在传染性病毒和假病毒的消减实验中,通过过表达和发夹RNA结构,证明IFITM蛋白也能有效制约丝状病毒EBOV和马尔堡病毒,以及SARS冠状病毒。尽管这些病毒属于不同种属,但都依赖溶酶体组织蛋白酶以激活其融合蛋白,因此均在内吞后开始融合。IFITM表达不改变在细胞裂解液中组织蛋白酶L活性水平,或细胞表面SARS病毒受体ACE2的水平[21]。IFITM对丝状病毒和SARS冠状病毒的限制模式与对IAV模式不同,比如丝状病毒和SARS冠状病毒对IFITM1更敏感,且人体细胞表面表达的鼠IFITM6能更有效地抑制丝状病毒和SARS冠状病毒。这些研究表明:不同种类IFITM蛋白对病毒具有特异性。
2.1.4 HIV-1 有研究发现干扰素诱导基因如:APOBEC3G、TRIM5a、TETHERIN或BST2、SAMHD1和MXB为有效的HIV限制因子[22]。最新研究表明,IFITM蛋白,特别是IFITM2和IFITM3通过拮抗HIV-1包膜蛋白,使HIV-1加工、组装受损,从而抑制HIV-1感染[23]。IFITM蛋白可促进HIV-1 gp120的脱落,且其C末端对HIV-1在细胞与细胞间的转染和病毒融合具有抑制作用,值得注意的是IFITM蛋白与病毒融合的程度与其抑制病毒作用无严格相关性。
IFITM蛋白除对以上病毒具有抑制作用外,对棒状病毒、布尼亚病毒、呼吸道合胞病毒、呼肠孤病毒等都具有抑制作用。同时,有研究表明IFITM蛋白家族尤其是IFITM3蛋白具有抗HBV复制活性的作用,其跨膜结构域I (56-79AA)可能是IFITM3抑制HBV基因表达的关键结构域。
目前已知IFITM蛋白能广泛抑制多种单链RNA病毒。有研究表明IFITM蛋白对双链DNA病毒——非洲猪瘟病毒,有一定限制作用[24]。同时其对结核杆菌感染也有一定的抑制作用。研究通过对THP-1细胞慢病毒转导过表达IFITM蛋白,在感染24 h后,发现过表达IFITM蛋白的细胞系H37Rv-mCherry信号较空慢病毒载体低,且大大抑制了单核细胞中结核杆菌的生长(IFITM3:38.5%;IFITM1:24.7%;IFITM2:26.7%)[25]。
尽管IFITM蛋白抗病毒作用广泛,但对白血病病毒、拉沙病毒、淋巴细胞脉络丛脑膜炎病毒、马丘波病毒、奇昆古尼亚病毒、辛德比斯病毒、委内瑞拉脑炎病毒、克里米亚-刚果出血热病毒等不具有抑制作用[16,26-28]。
2.2 IFITM蛋白与肿瘤相关性 IFITM蛋白家族参与干扰素调控功能,具有广泛的抗病毒作用。同时,干扰素可以通过调控细胞凋亡、增殖和分化从而在肿瘤的发生中起作用。研究发现IFITM3与肝癌相关,在原发性肝癌中,ifitm3高表达,且与肝癌结节大小相关:结节越大,分化越差,转移程度越高,ifitm3表达越高;同时门脉伴有癌栓形成,TNM分期越靠后,ifitm3基因的表达也越高[29]。有研究表明,IFITM3可能通过对MMP-9的调控从而促进癌细胞的增殖、侵袭和迁移[30]。因此,IFITM3有望成为肝癌研究的新靶点,为肝癌的发生、发展、转移、预后提供新的理论依据,但其具体机制尚待研究。除肝癌外,IFITM家族蛋白在胃癌、肠癌、乳腺癌、卵巢上皮性癌中也呈高表达状态,但在黑色素瘤的某些细胞系基因中,ifitm却呈低表达。有意思的是IFITM蛋白具有抗病毒作用,其高表达有利于病毒的抑制和清除,但在大多数肿瘤组织中高表达却与癌症严重程度呈正相关,其具体机制亟待研究。
3 IFITM蛋白作用机制
目前对IFITM蛋白作用机制研究已取得一些进展,但其具体抗病毒机制仍不明确。IFITM蛋白主要在病毒进入机体早期,通过阻止病毒进入细胞核而限制病毒复制,被认为是抗病毒机制的第一道防线。以pH值或组织蛋白酶依赖方式融合的病毒可以被IFITM蛋白抑制,而像拉萨热病毒利用网格蛋白和小窝蛋白独立机制进入细胞则不能被IFITM蛋白所抑制。在IFITM家族中,IFITM3作用最为广泛,研究也最为深入。对小鼠IFITM3蛋白结构的研究表明,N-末端结构域和CD225结构域是IFITM3功能性结构域。其跨膜区或近跨膜区的3个半胱氨酸被棕榈酰化修饰后可增强IFITM3 跨膜区与脂质双分子层的亲和力,从而稳定跨膜结构。当棕榈酰化位点发生突变时,IFITM3 的抗病毒能力减弱[31-32]。此外,IFITM3也可被泛素化修饰从而降低其抗病毒能力[32]。由此可见,IFITM蛋白的这两种翻译后修饰对抗病毒活性起到了双向调节作用。
最近有研究表明IFITM蛋白还可以通过改变宿主细胞膜的物理性质,如降低细胞膜的流动性,增加膜胆固醇含量,增大膜外小叶的自发曲率限制病毒膜的半融合发挥其抗病毒效应[33]。病毒的复制和扩散主要通过在体内增殖以及膜融合感染临近细胞来实现。Li等[33]研究发现,IFITM主要作用于细胞膜的半融合过程而非完全融合过程,但对囊膜和核内体之间的半融合无抑制作用。
4 结论和展望
作为干扰素诱导的跨膜蛋白,IFITM蛋白可抑制多种单链RNA病毒,其对双链DNA病毒、结核杆菌也具有一定的限制作用,并且与肿瘤的发生、发展、转移及预后相关,但具体机制尚待进一步研究。随着慢病毒载体越来越多地用于治疗遗传性疾病,改善气道慢病毒基因转移效率成为一大研究重点。通过对小鼠肺气管和鼻腔气道上皮细胞慢病毒转导效率的比较发现,肺气管上皮细胞转导效率更低,提示可能与其IFITM蛋白高表达相关。Hornick 等[34]还发现,在人和猪的离体实验中,IFITM蛋白可以部分地限制VSV-GFIV和GP64-FIV的转导,从而限制基于慢病毒载体的基因转移到呼吸道上皮细胞。目前可以确定,IFITM蛋白家族是GP64-介导的慢病毒基因转导的新的限制性因素,这一结论无种属特异性,并具有用于改善基因转导、治疗有关气道上皮遗传疾病的潜在临床意义。
尽管对IFITM蛋白的作用已经有所了解,但对其相关作用机制、变异以及与疾病的相关性尚待进一步探索,从而为疾病的防控和治疗提供理论支撑。
[1] Ling S, Zhang C, Wang W, et al. Combined approaches of EPR and NMR illustrate only one transmembrane helix in the human IFITM3[J]. Sci Rep, 2016, 6:24029.
[2] Zhang Z, Liu J, Li M, et al. Evolutionary dynamics of the interferon-induced transmembrane gene family in vertebrates[J]. PLoS One, 2012, 7(11):e49265.
[3] Bailey CC, Zhong G, Huang IC, et al. IFITM-family proteins: the cell´s first line of antiviral defense[J]. Annu Rev Virol, 2014, 1:261-283.
[4] Smith SE, Gibson MS, Wash RS, et al. Chicken interferoninducible transmembrane protein 3 restricts influenza viruses and lyssaviruses in vitro[J]. J Virol, 2013, 87(23):12957-12966.
[5] Hickford D, Frankenberg S, Shaw G, et al. Evolution of vertebrate interferon inducible transmembrane proteins[J]. BMC Genomics, 2012, 13:155.
[6] Bailey CC, Huang IC, Kam C, et al. IFITM3 limits the severity of acute influenza in mice[J]. PLoS Pathog, 2012, 8(9):e1002909.
[7] Sallman AM, Bringeland N, Fredriksson R, et al. The dispanins: a novel gene family of ancient origin that contains 14 human members[J]. PLoS One, 2012, 7(2):e31961.
[8] Lange UC, Adams DJ, Lee C, et al. Normal germ line establishment in mice carrying a deletion of the ifitm/fragilis gene family cluster[J]. Mol Cell Biol, 2008, 28(15):4688-4696.
[9] Hanagata N, Li X, Morita H, et al. Characterization of the osteoblast-specific transmembrane protein IFITM5 and analysis of IFITM5-deficient mice[J]. J Bone Miner Metab, 2011, 29(3):279-290
[10] Cho TJ, Lee KE, Lee SK, et al. A single recurrent mutation in the 5'-UTR of IFITM5 causes osteogenesis imperfecta type V[J]. Am J Hum Genet, 2012, 91(2):343-348.
[11] Semler O, Garbes L, Keupp K, et al. A mutation in the 5´-UTR of IFITM5 creates an in-frame start codon and causes autosomaldominant osteogenesis imperfecta type V with hyperplastic callus[J]. Am J Hum Genet, 2012, 91(2):349-357.
[12] Ling S, Zhang C, Wang W, et al. Combined approaches of EPR and NMR illustrate only one transmembrane helix in the human IFITM3[J]. Sci Rep, 2016, 6:24029.
[13] 汪安琪,陈舜,汪铭书,等. 抗病毒免疫分子IFITMs的研究进展[J]. 病毒学报,2016,32(4):509-515.
[14] Li K, Markosyan RM, Zheng YM, et al. IFITM proteins restrict viral membrane hemifusion[J]. PLoS Pathog, 2013, 9(1):e1003124.
[15] Alber D, Staeheli P. Partial inhibition of vesicular stomatitis virus by the interferon-induced human 9-27 protein[J]. J Interferon Cytokine Res, 1996, 165:375-380.
[16] Brass AL, Huang IC, Benita Y, et al. The IFITM proteins mediate cellular resistance to influenza A H1N1 virus, West Nile virus, and dengue virus[J]. Cell, 2009, 139(7):1243-1254.
[17] Shapira SD, Gat-Viks I, Shum BO, et al. A physical and regulatory map of host-influenza interactions reveals pathways in H1N1 infection[J]. Cell, 2009, 139(7):1255-1267.
[18] 张云辉,王 姝,陈玉琪,等. 埃博拉出血热研究现状及2014年疫情进展[J]. 传染病信息,2014,27(4):Ⅲ-Ⅷ.
[19] Jiang D, Weidner JM, Qing M, et al. Identification of five interferon-induced cellular proteins that inhibit west nile virus and dengue virus infections[J]. J Virol, 2010, 84(16):8332-8341.
[20] Savidis G,Perreira JM,Portmann JM , et al . The IFITMs inhibit Zika virus replication[J]. Cell Rep, 2016, 15(11):2323-2330.
[21] Huang IC, Bailey CC, Weyer JL, et al. Distinct patterns of IFITM-mediated restriction of filoviruses, SARS coronavirus, and influenza A virus[J]. PLoS Pathog, 2011, 7(1):e1001258.
[22] Goujon C, Moncorge O, Bauby H, et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection[J]. Nature, 2013, 502(7472):559-562.
[23] Yu J, Li M, Wilkins J, et al. IFITM proteins restrict HIV-1 infection by antagonizing the envelope glycoprotein[J]. Cell Rep, 2015, 13(1):145-156.
[24] Muñoz-Moreno R, Cuesta-Geijo Má, Martínez-Romero C, et al. Antiviral role of IFITM proteins in African swine fever virus infection[J]. PLoS One, 2016, 11(4):e154366.
[25] Ranjbar S, Haridas V, Jasenosky LD, et al. A role for IFITM proteins in restriction of mycobacterium tuberculosis infection[J]. Cell Rep, 2015, 13(5):874-883.
[26] Diamond MS, Farzan M. The broad-spectrum antiviral functions of IFIT and IFITM proteins[J]. Nat Rev Immunol, 2013, 13(1):46-57.
[27]. Huang IC, Bailey CC, Weyer JL, et al. Distinct patterns of IFITM-mediated restriction of filoviruses, SARS coronavirus, and influenza A virus[J]. PLoS Pathog, 2011, 7(1):e1001258.
[28] Mudhasani R, Tran JP, Retterer C, et al. IFITM-2 and IFITM-3 but not IFITM-1 restrict Rift Valley fever virus[J]. J Virol, 2013, 87(15):8451-8464.
[29] 裴轩增. ifitm3基因在肝癌组织中的表达及其与临床病理特征的关系研究[D]. 南昌:南昌大学,2014.
[30] 吴荣寿,邬林泉,李科浩,等. IFITM3在原发性肝癌中的表达及其对MMP-9调控效应[J]. 中国普通外科杂志,2016,25(1):68-76.
[31] Yount JS, Moltedo B, Yang YY, et al. Palmitoylome profiling reveals S-palmitoylation-dependent antiviral activity of IFITM3[J]. Nat Chem Biol, 2010, 6(8):610-614.
[32] Yount JS, Karssemeijer RA, Hang HC. S-palmitoylation and ubiquitination differentially regulate interferon-induced transmembrane protein 3 (IFITM3)-mediated resistance to influenza virus[J]. J Biol Chem, 2012, 287(23):19631-19641.
[33] Li K, Markosyan RM, Zheng YM, et al. IFITM proteins restrict viral membrane hemifusion[J]. PLoS Pathog, 2013, 9(1):e1003124.
[34] Hornick AL, Li N, Oakland M, et al. Human, pig, and mouse interferon-induced transmembrane proteins partially restrict rseudotyped lentiviral vectors[J]. Hum Gene Ther, 2016, 27(5):354-362.
(2016-07-19收稿 2016-12-27修回)
(本文编辑 闫晶晶)
Research on the interferon-induced transmembrane protein
LI Dong-fu, QIN Ling, ZHANG Yong-hong*
Biomedical Information Center of Beijing YouAn Hospital, Capital Medical University, 100069, China
*Corresponding author, E-mail: 13810108505@163.com
The living organisms have a variety of ways to slow down or even stop the virus replication. These mechanisms are mainly through mediating antiviral protein, and expanded by interferon inducement. Among these interferon-stimulated proteins, interferon-induced transmembrane (IFITM) family is unique, which prevents virus infection by blocking the virus permeating cell lipid bilayer. Now it is known that, at least 3 IFITMs have antiviral activities: IFITM1, IFITM2, and IFITM3. These transmembrane proteins in vitro cell culture can prevent many RNA virus infections, including dengue virus, Ebola virus, influenza virus, SARS coronavirus, West Nile virus and so on. IFITM3 gene polymorphism is associated with human seasonal influenza/HPAI disease, but the mechanism is still not fully understood. Here we discuss the antiviral functions of ifitm gene, IFITM proteins and the possible mechanisms, then the best regime may be found in the treatment of virus infection and tumor.
ifitm gene; IFITM protein; function; mechanism
R96
A
1007-8134(2017)01-0056-05
10.3969/j.issn.1007-8134.2017.01.017
国家自然科学基金项目(81320108017,81271842);北京市医院管理局临床技术创新项目(XMLX201411)
100069,首都医科大学附属北京佑安医院生物医学信息中心(李东富、覃岭、张永宏)
张永宏,E-mail: 13810108505@163.com

