干扰素诱导蛋白-10在肝源性糖尿病患者体内表达的研究
刘晓燕,吕 勇,王艳丽,朱金照,崔永良,熊 伟,吴旭伟,韩荔芬
干扰素诱导蛋白-10在肝源性糖尿病患者体内表达的研究
刘晓燕,吕 勇,王艳丽,朱金照,崔永良,熊 伟,吴旭伟,韩荔芬
目的探讨干扰素诱导蛋白-10(interferon-inducibe protein 10, IP-10)在肝源性糖尿病患者肝组织及血清中表达水平,进一步探讨其与肝源性糖尿病的关系。方法用ELISA、Real-time PCR以及免疫组织化学法检测60例肝源性糖尿病患者及60例普通肝病患者血清及肝组织中IP-10的表达水平。结果在肝源性糖尿病患者中,ELISA法检测血清中IP-10的表达水平为(239.542±28.603)pg/ml,明显高于对照组的(205.341±26.952) pg/ml(P<0.05);Real-time PCR法检测肝组织中IP-10 mRNA表达水平高于对照组(P<0.05)。用免疫组织化学法检测肝组织IP-10表达阳性率,肝源性糖尿病组为30.0%(18/60),高于普通肝病组的11.7%(7/60)(P<0.05)。结论IP-10在肝源性糖尿病患者血清和肝组织中有着高水平表达。
干扰素诱导蛋白-10;肝源性糖尿病;炎症因子
肝功能损害可造成机体糖原代谢紊乱和糖尿病的发生。有资料证明,约有50%~80%慢性肝病患者糖耐量降低,而其中的20%~30%最终可能会发展为糖尿病[1]。有数据表明,持续高血糖状态会导致肝细胞损害甚至进展为肝衰竭[2]。干扰素诱导蛋白-10(interferon-induced protein 10, IP-10)是由干扰素刺激内皮细胞、单核细胞等诱导产生的能趋化T淋巴细胞的一类分泌性糖蛋白,又称作CXC趋化因子配体10,目前国内外诸多关于IP-10的研究认为IP-10在各种炎症因子介导的疾病中均有重要意义,但在肝源性糖尿病中的表达少有研究。本文通过检测肝源性糖尿病患者血清及肝组织中IP-10的表达水平,探讨其与肝源性糖尿病发生的关系。
1 对象和方法
1.1 对象 所有取材均来自福建医科大学孟超肝胆医院肝组织穿刺标本和外科手术治疗标本(外科手术标本为远离病变组织的肝炎及肝硬化组织标本),按标本来源将患者分为2组:肝源性糖尿病组和普通肝病组,每组均包括普通肝炎患者30例和肝硬化患者30例,2组在性别、年龄、ALT水平、HBsAg定量、 HBV DNA定量方面差异无统计学意义,具有可比性(表1)。
1.2 诊断标准 患者均为HBV感染的慢性乙型肝炎患者和乙型肝炎肝硬化患者,其诊断符合《慢性乙型肝炎防治指南》(2015更新版)[3]的标准。肝源性糖尿病诊断:①有明确的肝病史且在糖尿病发生之前,或同时发生;②无糖尿病史及糖尿病家族史;③肝功能损害临床表现明显,并有客观检查证据支持;④符合糖尿病诊断标准:空腹血糖≥7.0 mmol/L,餐后2 h血糖≥11.1 mmol/L;⑤胰岛素释放试验:空腹胰岛素水平偏高,餐后胰岛素反应延迟或反应不良;血清C肽释放试验可正常或下降,C肽与胰岛素的比值明显减少;⑥肝功能的改变可导致血糖的恶化或好转;⑦可排除其他疾病引起的血糖升高等糖代谢异常,包括无肾上腺、甲状腺、垂体组织器官的疾病,排除药物如降压药、利尿剂、避孕药及糖皮质激素等引起的糖代谢紊乱等。同时排除心、脑、肾及其他器官严重功能不全者及并发其他严重疾病者[4]。
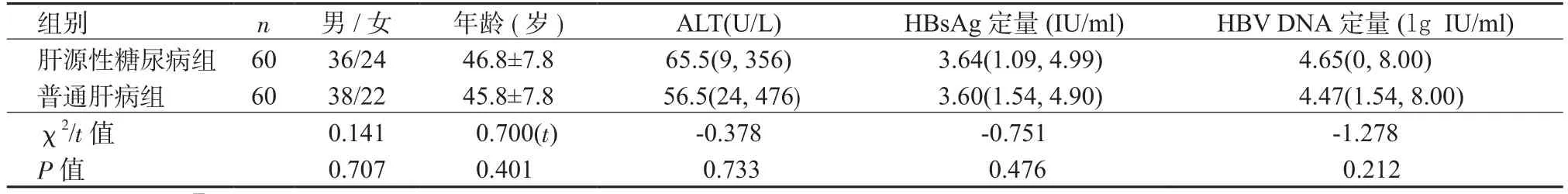
表1 2组基本临床资料Table 1 Basic clinical data of 2 groups
1.2 试剂和仪器
1.2.1 试剂 所用试剂为:血清IP-10 ELISA检测试剂盒(美国Sigma公司),AMV第一链cDNA合成试剂盒(上海生工生物公司),SP超敏试剂盒(福州迈新生物技术开发公司),IP-10单抗(美国GeneTex公司),DAB显色试剂盒(福州迈新生物技术开发公司)。
1.2.2 仪器 所用仪器为:全自动酶标仪EXL808(美国Bio-Tek公司),iCycle Real-time PCR仪iCyele(美国Bio-Rad有限公司),电脑全自动组织脱水机ZMN-9802(常州市华利电子有限责任公司),动组织包埋机ZMN-7803(常州市华利电子有限责任公司),石蜡切片机LEICARM 2128(德国Leica有限公司)。
1.3 检测方法
1.3.1 ELISA法检测血清IP-10水平 采患者空腹静脉血5 ml,分离血清,用ELISA双抗体夹心法检测IP-10浓度。
1.3.2 Real-time PCR法提取总RNA 用RT-PCR及Real-time PCR对IP-10进行定性与定量的测定。IP-10引物序列:上游引物5´-CGA TTCTGA TTTGCTGCCTTA T-3´/下游引物5´-CTTCTCACCCTTCTTTTTCA TTG T-3´。甘油醛-3-磷酸脱氢酶(GAPDH) 可用于RT-PCR反应的内对照。GAPDH引物序列为上游引物:5´-ACCACAGTCCATGCCATCAC-3´/下游引物:5´-TCCACCACCCTGTTGCTGTA-3´。反应条件均为95 ℃ 3 min;93 ℃ 1 min;57 ℃ 1min;74 ℃2 min,循环30次。74 ℃ 延伸10 min。可通过DNA测序证实PCR扩增产物为人IP-10。以肝组织标本中提取RNA反转录的cDNA为模板,在PCR反应体系中同时加入IP-10和GAPDH的特异引物,并进行扩增。lg cDNA/lg GAPDH比值可以代表标本中IP-10 mRNA的水平。
1.3.3 免疫组织化学(免疫组化)SP移动法检测肝组织IP-10表达量 免疫组化SP法具有较高的敏感性,镜下观察有深褐色着色者为阳性,定位于胞膜和胞浆。
1.4 统计学处理 用SPSS 19.0软件对数据进行处理,定量资料呈正态分布,用±s表示,2组比较用成组t检验。2组定性资料比较用χ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 ELISA法检测2组血清中IP-10水平 肝源性糖尿病组血清IP-10水平(239.542±28.603)pg/ml高于普通肝病组(205.341±26.952)pg/ml,差异有统计学意义(t=6.742, P=0.001)。
2.2 Real-time PCR法检测肝组织中IP-10 mRNA的水平 IP-10 mRNA表达量用lg cDNA/lg GAPDH比值表示,肝源性糖尿病组肝组织IP-10 mRNA的水平(0.553±0.924)高于普通肝病组(0.264±0.647),差异有统计学意义(t=2.032,P=0.042)。
2.3 免疫组化法检测肝组织IP-10表达阳性率 肝源性糖尿病组IP-10表达阳性率为30.0%(18/60),高于普通肝病组的11.7%(7/60)(χ2=6.110, P=0.016),见图1。
3 讨 论
目前认为肝源性糖尿病的发生与细胞因子调节有关。慢性肝病患者体内产生的细胞因子、炎性因子可能参与了糖代谢紊乱的发生机制,其中分泌胰岛素的胰岛β细胞在受到自身免疫攻击时部分被破坏凋亡[5-6]。淋巴细胞作为炎症细胞的一种,它在胰岛β细胞的破坏中起着一定的作用,但是淋巴细胞由血液迁移至胰岛炎症部位的机制目前尚无定论。趋化因子是介导淋巴细胞迁移和定位的关键性因子,IP-10能被IFN-γ所诱导,主要与Thl细胞介导的免疫反应有关,并与T细胞膜上的CXCR-3结合,通过三磷酸鸟苷的消耗,使Gβγ 亚基二聚体解离出Gα亚基,使之具有调节活性,从而级联激活多种酶,通过各种细胞通路,发挥吞噬、趋化、呼吸暴发、细胞脱颗粒等作用[7-9]。在肝细胞中产生IP-10,使之与CXCR-3结合,从而趋化单核细胞、活化NK细胞和T淋巴细胞,使NK细胞介导细胞死亡,以及T淋巴细胞附着血管内皮细胞,抑制血管生成等[10-12]。国外研究者曾利用IL-1β、INF-γ和dsRNA刺激体外培养的小鼠和人的胰岛β细胞,检测到高浓度的IP-l0,显示炎症性细胞因子和病毒能够刺激胰岛β细胞产生大量的IP-10[13-14]。因此IP-l0可能作为炎症趋化因子在肝源性糖尿病发生中起一定的作用。在本研究中,应用ELISA、RT-PCR、免疫组化等方法检测了血清及肝组织中IP-10表达水平,表明了肝源性糖尿病患者血清及肝组织中IP-10的表达水平均明显高于普通肝病患者,验证了IP-10通过炎症机制在肝源性糖尿病的发生中可能起着一定的作用,当然,在本研究中还可以对患者病程中及治疗前后IP-10水平进行分析,从而探讨IP-10水平与肝源性糖尿病发展严重程度的关系。今后在进一步的研究中可扩大标本量增加普通肝病组的病种种类,为IP-10的表达水平在肝源性糖尿病发生中的作用寻找更多的循证医学证据。
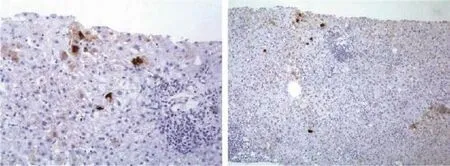
图1 肝源性糖尿病患者肝组织IP-10免疫组化染色左图.×100,右图.×40Figue 1 Mmunohistochemical study of IP-10 in patients with hepatic diabetes
[1] Kuriyama S, Miwa Y, Fukushima H, et al. Prevalence of diabetes and incidence of angiopathy in patients with chronic viral liver disease[J].J Clin Biochem Nutr, 2007, 40(2):116-122.
[2] Marchesini G, Ronchi M, Forlani G, et al. Cardiovascular disease in cirrhosis-a point-prevalence study in relation to glucose tolerance[J]. Am J Gastroenterol, 1999, 94(3):655-662.
[3] 中华医学会肝病学分会,中华医学会感染病学分会. 《慢性乙型肝炎防治指南》(2015更新版)[J]. 传染病信息,2015,27(6):321-340.
[4] 姜丽萍,赵金满. 肝源性糖尿病的诊断与治疗[J]. 世界华人消化杂志,2007,15(6):617-621.
[5] Loetscher M, Gerber B, Loetscher P, et al.Chemokine receptor specific for IP-10 and mIG: structure, function, and expression in activated T lymphocytes[J]. Exp Med, 1996, 184(3):963-969.
[6] Gasperini S, Marchi M, Calzetti F, et al. Gene expression and production of the monokine induced by IFN-gamma(MIG), IFN-inducible T cell alpha chemoattractant(I-TAC), and IFN-gammainducible protein-10(IP-10)chemokines by human neutrophils[J]. J Immunol, 1999, 162(8):4928-4937.
[7] Antonelli A, Ferrari SM. Chemokine (C-X-C motif) ligand (CXCL)10 in autoimmune diseases[J]. Autoimmun Rev, 2014, 13(3):272-280.
[8] Romagnani P, Crescioli C. CXCL10: a candidate biomarker in transplantation[J].Clin Chim Acta, 2012, 413(17-18):1364-1373.
[9] Billottet C, Quemener C, Bikfalvi A. CXCR3, a double-edged sword in tumor progression and angiogenesis[J]. Biochim Biophys Acta, 2013, 1836(2):287-295.
[10] Ishiguro N, Takada A, Yoshioka M, et al. Induction of interferoninducible protein-10 and monokine induced by interferon-gamma from human endothelial cells infected with Influenza A virus[J]. Arch Virol, 2004, 149(1):17-34.
[11] Booth V, Keizer DW, Kamphuis MB, et al.The CXCR3 binding chemokine IP-10/CXCL10: structure and receptor interactions[J]. Biochemistry, 2002, 41(33):10418-10425.
[12] 冷红,张大志.趋化因子IP-10的研究进展[J]. 国际免疫学杂志,2006,29(4):241-244.
[13] Liu D, Cardozo AK, Darville MI, et al. Double-stranded RNA cooperates with interferon-gamma and IL-1 beta to induce both chemokine expression and nuclear factor-kappa B-dependent apoptosis in pancreatic beta-cells: potential mechanisms for viralinduced insulitis and beta-cell death in type 1 diabetes mellitus[J]. Endocrinology, 2002, 143(4):1225-1234.
[14] Cardozo AK, Proost P, Gysemans C, et al. IL-1beta and IFN-gamma induce the expression of diverse chemokines and IL-15 in human and rat pancreatic islet cells, and in islets from pre-diabetic NOD mice[J]. Diabetologia, 2003, 46(2):255-266.
(2016-08-05收稿 2016-12-10修回)
(本文编辑 张云辉)
Research of the expression of interferon inducible protein 10 in patients with hepatogenous diabetes
LIU Xiao-yan, LÜ Yong*, WANG Yan-li, ZHU Jin-zhao, CUI Yong-liang, XIONG Wei, WU Xu-wei, HAN Li-fen
Department of Gastroenterology, Mengchao Hepatobiliary Hospital of Fujian Medical University, Fuzhou 350025, China
*Corresponding author, E-mail: 364299238@qq.com
ObjectiveTo observe the expression of interferon inducible protein 10(IP-10) in serum and liver tissues of patients with hepatogenous diabetes, and the relationship between IP-10 and the occurrence of hepatogenous diabetes.MethodsELISA, Real-time PCR and immunohistochemistry method were used to test the IP-10 level in serum and liver tissues for 60 hepatic diabetes patients and 60 cases with common liver disease.ResultsThe level of IP-10 in serum of patients with hepatogenous diabetes was (239.542±28.603) pg/ml, which was significantly higher than that in control group(205.341±26.952) pg/ml (P<0.05). Tested by the method of Real-time PCR, the level of IP-10 in liver tissue of patients with hepatogenous diabetes was significantly higher than that of control group (P<0.05). Using the method of immunohistochemistry, the IP-10 expression positive rate was 30.0% (18/60) for the hepatogenous diabetes group, which was higher than that of common liver disease group (11.7%, 7/60), (P<0.05).ConclusionsExpression level of IP-10 protein is high in the serum and liver tissue of patients with hepatogenous diabetes.
interferon inducible protein 10; hepatogenous diabetes; inflammatory cytokines
R587.1
A
1007-8134(2017)01-0038-03
10.3969/j.issn.1007-8134.2017.01.012
福州市科技计划项目(2014-S-139-8)
350025 福州,福建医科大学孟超肝胆医院消化科(刘晓燕、吕勇、王艳丽、朱金照、崔永良、熊伟、吴旭伟、韩荔芬)
吕勇,E-mail: 364299238@qq.com

