发光杆菌可湿性粉剂的研制及对荔枝采后贮藏的影响
凡 超,邵雪花,匡石滋,田世尧,赖 多
(广东省农业科学院果树研究所/ 农业部南亚热带果树生物学与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广东 广州 510640)
发光杆菌(Photorhabdus luminescens)是一种昆虫病原线虫肠道内的共生细菌,革兰氏染色为阴性,兼性厌氧[1]。自1990年Ensign等[2]首次报道发光杆菌与苏云金杆菌一样可产生胞外杀虫蛋白,昆虫病原线虫共生细菌引起了国内外学者的兴趣,并进行了大量的研究。研究发现,发光杆菌对烟草天蛾、小菜蛾、菜青虫、斜纹夜蛾、大蜡螟、棉铃虫等鳞翅目多种害虫有较高的生物活性[2-6]。此外,发光杆菌还能够产生蒽醌类、羟化二苯乙烯类、细菌素和几丁质酶类等多种抑菌物质[7-8],抑制其他微生物的生长,尤其对荔枝霜疫霉病菌、苹果灰霉病菌、拟茎点霉病菌、冬瓜枯萎病菌、番茄菌核病菌、萝卜褐腐病菌、黄瓜灰霉病菌、马铃薯环腐病菌、烟草青枯病菌等多种植物病原具有广泛的抑制作用[9-12]。也有研究报道,发光杆菌对植物病原线虫具有致死或抑制活性[13-14]。在发展可持续性农业呼声越来越高的今天,发光杆菌作为一类新型的具有开发潜力和应用前景的生物资源,在植物病虫害生物防治中具有越来越重要的作用[15]。
开发活体微生物可湿性粉剂在现代农药制剂中具有广泛的适用范围,许多微生物杀菌剂往往加工成可湿性粉剂。但是,目前对发光杆菌的研究主要集中在分离、活性筛选和代谢物鉴定等方面,尚没有关于其剂型加工的报道。而加工成活体农药时,不同种类的助剂(如载体、润湿剂和分散剂等)对发光杆菌的存活和活性影响有着非常大的差异。因此,本研究通过对载体、润湿剂和分散剂的种类和用量进行考察优化,研制发光杆菌可湿性粉剂,以提高其制剂的生防效果,为工业化生产提供理论依据;同时测定其对荔枝采后贮藏性能的影响,这对丰富荔枝果实采后保鲜生物材料具有重要意义。
1 材料与方法
1.1 试验材料
菌株:发光杆菌(P. luminescens)Hb1029,由农业部南亚热带果树生物学与遗传资源利用重点实验室分离保藏;培养条件参考孙东磊等[12]的方法。
果实:荔枝品种为桂味,2017年7月20日采摘于广州市增城区荔枝种植园,采后立刻运回实验室,试验中选择无病虫害、无机械损伤、成熟度及大小一致的果实。
农药助剂载体:硅藻土、碳酸钙、高岭土;分散剂:羧甲基纤维素钠、木质素磺酸钠、亚甲基双荼磺酸钠;润湿剂:十二烷基苯磺酸钠、拉开粉(丁基萘磺酸钠)、茶枯粉;保护剂:糊精、海藻酸钠、可溶性淀粉。
1.2 试验方法
1.2.1 生物相容性测定 采用稀释平板计数法,将50 mg/mL载体、0.25 mg/mL润湿剂、1.5 mg/mL分散剂、50μg/mL保护剂分别与融化的营养琼脂(NA)培养基混合,灭菌后制成平板。取 100μL 稀释至不同倍数(103、104、105…109)的发光杆菌稀释液,均匀涂布于混合培养基平板上,以不添加助剂的NA培养基作为对照,每个处理3次重复,置于28℃下培养,24 h后计算各平板的发光杆菌菌落数。
1.2.2 助剂的筛选与最佳配比的确定 载体筛选:选择对发光杆菌菌落生长没有影响或者影响很小的载体,结合其对制剂理化性质、成本等方面的因素确定最佳载体。
润湿剂与分散剂的筛选:参照王剑等[16]的方法略作修改,在菌粉中分别添加一定量的润湿剂与分散剂,混合均匀,即制得不同助剂的制剂。按照GB/T 5451-2001标准[17]测定各制剂的润湿时间,比较润湿性能的好坏,润湿时间越短,润湿性越好。按照GB/T 14825-2006标准[18]测定各制剂的悬浮率,比较各种分散剂的分散效果,悬浮率越高,分散性越好。同时测定各润湿剂、分散剂与发光杆菌的生物相容性。综合考虑润湿时间、悬浮率以及生物相容性确定最佳的分散剂、润湿剂。
保护剂筛选:将菌体稀释液涂布在含保护剂的平板上,以不含保护剂的平板作对照。用254 nm UV紫外灯(20 W)照射1 min后,置于28℃恒温培养箱中培养24 h,计算菌落数。
以筛选出的最佳载体、润湿剂、分散剂和保护剂为变量因素,采用四因素三水平L9(34)正交设计进行试验。将各种助剂分别过38 mm筛,按正交设计的比例加入菌粉,搅拌均匀加工成可湿性粉剂,然后测定各制剂的润湿性和悬浮率,确定配方各组分的最佳比例。
1.2.3 粉剂性能的测定 粉剂中发光杆菌活菌数的检测通过稀释涂布NA平板,于28℃培养箱中培养24 h,镜检计数。润湿时间按GB/T 5451-2001标准[17]测定。悬浮率按GB/T 14825-2006标准[18]测定。pH值按GB/T 1600-1993标准[19]测定。细度通过45 mm标准筛大于 95% 测定[20]。
1.2.4 对荔枝采后贮藏影响的测定 贮藏保鲜试验于2017年7月20日在恒温房进行,将制备的发光杆菌可湿性粉剂用无菌水稀释成1×108CFU/mL的悬浮液,对荔枝进行表面喷施处理,以喷施无菌水的荔枝作为对照。每个处理3次重复,每个重复30个果实。待荔枝自然晾干后,装入塑料袋,封口,置于25℃、相对湿度90%~95%条件下贮藏,7 d后观察记录荔枝的腐烂指数和商品率。
腐烂指数及商品率的测定参照Wu等[21]方法并略作修改。根据果实腐烂面积大小,将腐烂指数分为5级:0级,无腐烂、无病斑;1级,腐烂面积占果实面积的比例小于10%;2级,腐烂面积占果实面积10%~25%;3级,腐烂面积占果实面积25%~50%;4级,腐烂面积大于总果实面积50%。计算腐烂指数和荔枝商品率:

采用GraphPad Prism 5.0统计软件对试验数据进行方差分析,采用Duncan's或Tukey's多重比较分析处理间的差异显著性。
2 结果与分析
2.1 载体的筛选
试验结果(表1)表明:碳酸钙对发光杆菌菌落生长有明显抑制作用,与对照差异显著;而高岭土和硅藻土与对照差异不显著,表明两者均对发光杆菌菌落的生长没有影响。将高岭土和硅藻土分别与菌粉加工成粗制剂后,两种制剂的润湿时间差异不显著,但是以硅藻土作为载体时,制剂的悬浮率达到51.33%,明显高于高岭土和碳酸钙。因此,硅藻土可作为发光杆菌可湿性粉剂的理想载体。
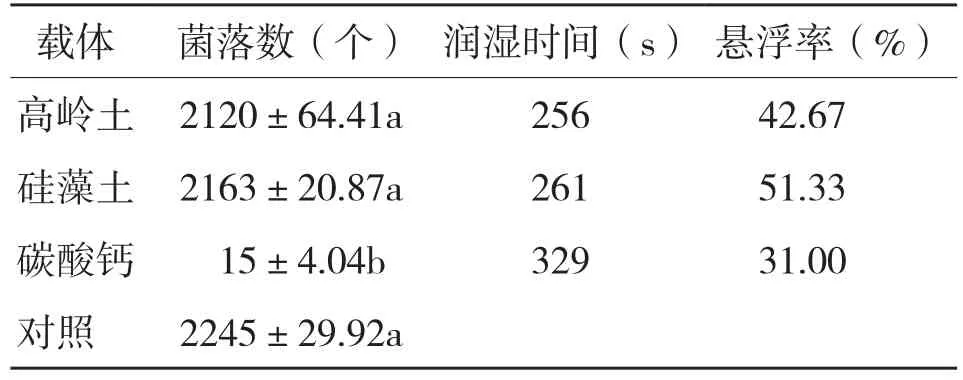
表1 载体对发光杆菌菌落及制剂理化性质的影响
2.2 润湿剂和分散剂的筛选
由表2可知,以茶枯粉为润湿剂,制剂的润湿时间和悬浮率均最优,并且菌落数高达187个,明显高于以十二烷基苯磺酸钠和拉开粉为润湿剂的制剂,表明茶枯粉对发光杆菌菌落生长影响最小,而十二烷基苯磺酸钠和拉开粉显著地抑制发光杆菌的生长,因此选择茶枯粉为润湿剂。以木质素磺酸钠为分散剂,制剂的润湿性能最好,润湿时间仅为53 s,但是木质素磺酸钠和亚甲基双荼磺酸钠菌对发光杆菌菌落生长具有明显的抑制作用,与对照差异显著;羧甲基纤维素钠尽管润湿时间较长,但其分散状况最优,悬浮率高达84.67%,并且对发光杆菌菌落生长没有抑制作用,故选择羧甲基纤维素钠作为分散剂。

表2 不同润湿剂和分散剂对发光杆菌菌落及制剂理化性质的影响
2.3 保护剂的筛选
由表3可知,紫外线照射1 min后,以糊精为保护剂,对发光杆菌菌落生长保护效果最好,存活率最高,达到55.37%;而海藻酸钠和可溶性淀粉的保护作用不明显。因此,选择糊精作为制剂的保护剂。
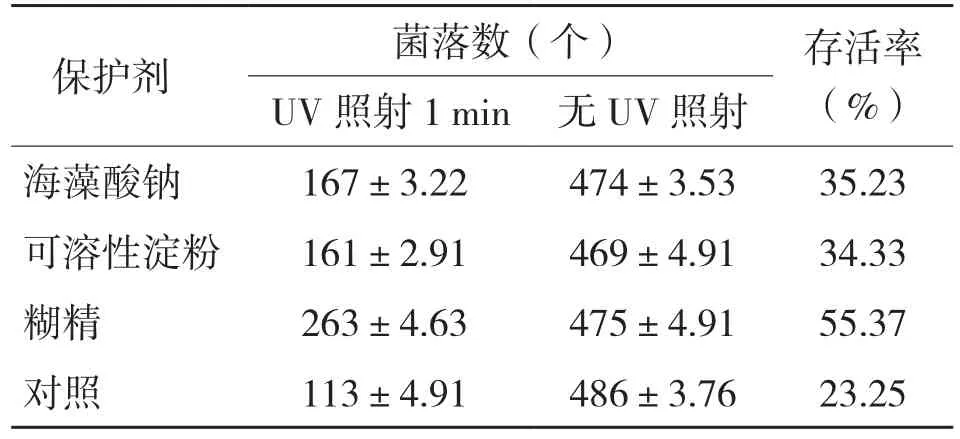
表3 保护剂对发光杆菌菌落生长的保护效果
2.4 可湿性粉剂最佳配比的确定
通过上述单因素的筛选,可以确定硅藻土、茶枯粉、羧甲基纤维素钠和糊精为发光杆菌可湿性粉剂的最佳助剂,进一步以这4种助剂为筛选因素,以3个质量分数水平进行正交试验(表4),结果见表5。以悬浮率为指标,由极差大小判断,各因素对制剂悬浮率影响次序为:B(茶枯粉)>C(羧甲基纤维素钠)>A(硅藻土)>D(糊精);从平均值分析,A1B2C2D2为最佳组合,即硅藻土40%、茶枯粉4%、羧甲基纤维素钠6%、糊精0.2%。

表4 助剂筛选的因素和水平
2.5 发光杆菌可湿性粉剂质量指标测定
可湿性粉剂各项指标测定结果表明,发光杆菌活菌数大于5.0×108CFU/g,pH值6.8,润湿时间51 s,悬浮率74.83%,水分含量2.87%,细度通过率98.52%,各项检测结果均符合国家标准。
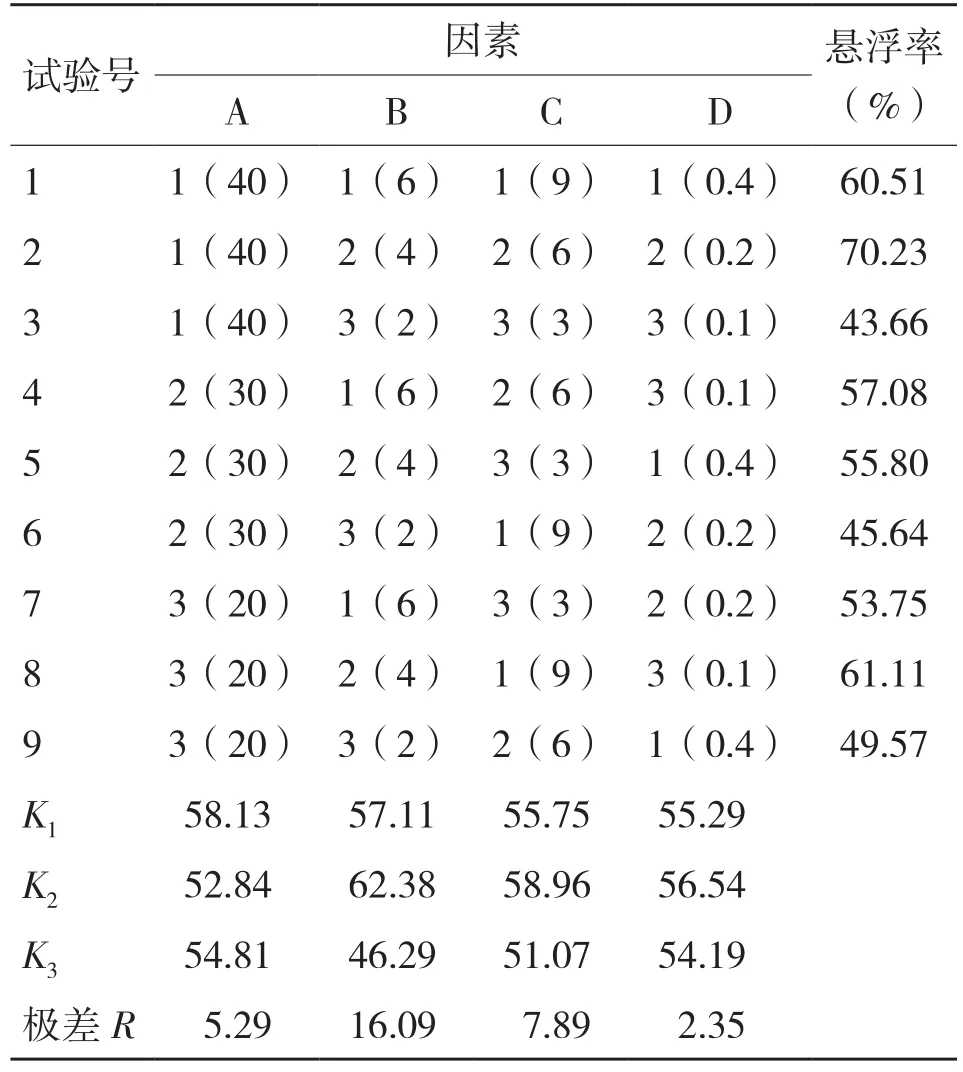
表5 助剂正交试验结果
2.6 发光杆菌可湿性粉剂对荔枝采后贮藏的影响
从图1(彩插四)可以看出,贮藏7 d后,未经菌剂处理的对照荔枝果实大部分出现腐烂、褐变现象,部分果实表面布满了白色菌丝;而经发光杆菌可湿性粉剂处理的荔枝果实保持鲜艳和完整,仅少量果实表面发生小面积褐变。调查结果显示,菌剂处理果实的腐烂指数仅为0.13,极显著低于对照0.89。室温贮藏7 d后,对照的果实商品率仅为6.67%,而菌剂处理的商品率高达90%。表明喷施发光杆菌可湿性粉剂对荔枝果实具有良好的保鲜作用,能有效降低果实的腐烂指数,提高果实的商品率。

图1 发光杆菌可湿性粉剂对荔枝果实采后贮藏的影响
3 结论与讨论
农药中可湿性粉剂不使用溶剂和乳化剂,对植物较为安全,既提高了经济效应,又保护生态环境,是当前发展绿色环保农业的重要方式。但是,微生物可湿性粉剂中的助剂,不仅对制剂的理化性质影响很大,而且对微生物本身活性也有着密切关系,因此必须考虑助剂与微生物两者的相容性。通过菌落计算法研究了可湿性粉剂中硅藻土、茶枯粉、羧甲基纤维素钠等常用助剂与发光杆菌的生物相容性,通过正交试验对载体、润湿剂、分散剂和保护剂的筛选,确定了发光杆菌可湿性粉剂的最佳配方为:硅藻土40%、茶枯粉4%、羧甲基纤维素钠6%、糊精0.2%,且制备的制剂各项指标符合质量要求,为发光杆菌可湿性粉剂的研制提供了技术参考。
微生物可湿性粉剂中的载体尽管作为一种惰性填料,但是不同种类的载体对活体微生物影响差异很大。张敏等[22]报道了载体硅藻土不影响木霉菌分生孢子萌发及菌丝生长,可作为其可湿性粉剂载体,而凹凸棒土显著抑制木霉菌的分生孢子萌发及菌丝生长,相容性较差。王志英等[23]则研究发现硅藻土与苏云金杆菌、白僵菌的相容性较差,而凹凸棒土对苏云金杆菌芽孢萌发以及白僵菌分生孢子萌发、菌落生长基本没有影响,可作为两者可湿性粉剂的载体。本研究结果显示硅藻土与发光杆菌有较好的相容性,但碳酸钙和高岭土会抑制其菌落生长。由此可见,不同种类的载体、润湿剂和分散剂对微生物的存活和活性影响有着非常大的差异,即使同一载体,对不同种类的微生物也会产生不一样的效果。因此,在研制不同微生物可湿性粉剂时,必须针对所涉及的菌株,对载体、润湿剂和分散剂的种类进行筛选,以提高其生防效果。
荔枝霜疫霉菌是荔枝果实上的一种重要病害,不仅会造成大量落果和烂果,还严重影响荔枝鲜果的贮藏。以往研究表明,发光杆菌对荔枝霜疫霉菌具有良好的抑菌活性[24]。因此,本文对研制的发光杆菌可湿性粉剂在荔枝果实采后贮藏上应用进行了探索,结果表明喷施发光杆菌可湿性粉剂能有效降低荔枝果实的腐烂指数,提高果实的商品率,这可能与发光杆菌抑制荔枝果实表面的霜疫霉菌生长有关。本研究为发光杆菌可湿性粉剂在荔枝采收贮藏保鲜上提供了新思路,但是对于发光杆菌是否影响荔枝果实采后贮藏品质还有待进一步探讨。
[1]Jallouli W,Boukedi H,Sellami S,et al.Combinatorial effect of Photorhabdus luminescens TT01 and Bacillus thuringiensis Vip3Aa16 toxin against Agrotis segetum[J]. Toxicon,2018,142:52-58.
[2]Ensign J C,Bowen D J,Bintrim S B. Crystalline inclusion proteins and an insecticidal toxin of Xenorhabdus luminescens strain NC-19[C].International Colloquium on and. 1990.
[3]田世尧,李素春,王晓容,等. 仲恺1号毒素对三种鳞翅目害虫的生物活性初报[J]. 仲恺农业技术学院学报,1993,6(2):74-75.
[4]Kwak Y,Shin J H. Complete genome sequence of Photorhabdus temperata subsp. thracensis 39-8(T),an entomopathogenic bacterium for the improved commercial bioinsecticide[J]. J Biotechnol,2015,214:115-116.
[5]Ullah I,Jang E K,Kim M S,et al. Identification and characterization of the insecticidal toxin“makes caterpillars floppy”in Photorhabdus temperata M1021 using a cosmid library[J].Toxins,2014,6(7):2024-2040.
[6]Meusch D,Gatsogiannis C,Efremov RG et al. Mechanism of Tc toxin action revealed in molecular detail[J]. Nature,2014,508(7494):61-65.
[7]Park H B,Crawford J M. Lumiquinone A,an α-aminomalonate-derived aminobenzoquinone from Photorhabdus luminescens[J]. J Nat Prod,2015,78(6):1437-1441.
[8]Ullah I,Khan A L,Ali L,et al. Benzaldehyde as an insecticidal,antimicrobial,and antioxidant compound produced by Photorhabdus temperata M1021[J]. J Microbiol,2015,53(2):127-133.
[9]Chen G,Zhang Y,Li J,et al. Chitinase activity of Xenorhabdus and Photorhabdus species,bacterial associates of entomopathogenic nematodes[J]. J Invertebr Pathol,1996,68(2):101-108.
[10]陆秀君,王勤英,赵光耀,等. 发光杆菌Photorhabdus sp. HB-gyl3菌株对4 种蔬菜病原菌的抑菌活性[J]. 河北农业大学学报,2003,26(4):18-20.
[11]文旭,南宫自艳,张园,等. 2种昆虫病原线虫共生茵的代谢产物对苹果病原茵真菌的抑茵作用[J]. 中国植保导刊,2012,32(1):13-16.
[12]孙东磊,杨裕兵,匡石滋,等. 发光杆菌Photorhabdus sp. 1029发酵液抑菌活性研究[J]. 广东农业科学,2013,40(15):104-106.
[13]Hu K J,Li J X,Webster J M. Nematicidal metabolites produced by Photorhabdus luminescens(Enterobacteriaceae),bacterial symbiont of entomopathogenic nematodes[J]. Nematology,1999,1:457-469.
[14]马丽丽. 发光杆菌NJ菌株发酵条件及对大豆胞囊线虫的作用研究[D]. 哈尔滨:黑龙江八一农垦大学,2008.
[15]肖尧,杨秀芬,杨怀文. 致病杆菌和发光杆菌抗菌代谢产物研究进展[J]. 中国生物防治学报,2011,27(4):553-558.
[16]王剑,王楠,高观朋,等. 200亿芽孢/g枯草芽孢杆菌可湿性粉剂的研制[J]. 农药,2010,49(7):486-489.
[17]GB/T 5451-2001,农药可湿性粉剂润湿性测定方法[S]. 北京:中国标准出版社,2001.
[18]GB/T 14825-2006 ,农药悬浮率测定方法[S].北京:中国标准出版社,2006.
[19]GB/T 1600-1993,农药pH值测定方法[S].北京:中国标准出版社,1993.
[20]凌世海. 固体制[M]. 北京:化学工业出版社,2003.
[21]Wu Y,Lin H,Lin Y,et al. Effects of biocontrol bacteria Bacillus amyloliquefaciens LY-1 culture broth on quality attributes and storability of harvested litchi fruit[J]. Postharvest Biol Tec,2017,132:81-87.
[22]张敏,彭化贤,邓新平,等. 5亿活孢子/克木霉菌可湿性粉剂的研制[J]. 西南农业学报,2008,21(3):675-679.
[23]王志英,孙丽丽,张健,等. 苏云金杆菌和白僵菌可湿性粉剂研制及杀虫毒力测定[J]. 北京林业大学学报,2014,36(3):34-41.
[24]孙东磊,管楚雄,曾杨,等. 发光杆菌1029发酵液和乙膦铝混配对荔枝霜疫霉病菌的抑制作用[J]. 广东农业科学,2009,36(9):105-107.

