棉纤维细胞色素单加氧酶基因GhCYP714A1促进活性氧的累积
辛珊,李榕,谢全亮,寇伟,李鸿彬,2*
(1石河子大学生命科学学院,新疆 石河子,832003;2石河子大学农业生物技术重点实验室,新疆 石河子 832003)
棉纤维细胞色素单加氧酶基因GhCYP714A1促进活性氧的累积
辛珊1,李榕1,谢全亮1,寇伟1,李鸿彬1,2*
(1石河子大学生命科学学院,新疆 石河子,832003;2石河子大学农业生物技术重点实验室,新疆 石河子 832003)
本研究利用RT-PCR技术从陆地棉纤维组织中克隆得到了1个棉花细胞色素P450基因(Cytochrome P450 714A1)的全长cDNA序列,将该基因命名为GhCYP714A1。序列分析发现,该cDNA包含1563 bp的完整开放读码框,编码521个氨基酸的蛋白质,理论分子质量为57.31 kDa;氨基酸序列生物信息学分析显示,GhCYP714A1蛋白具有跨膜结构域和多个蛋白结合位点;进化树分析结果表明,棉花GhCYP714A1与禾草SiCYP714B1在进化上亲缘关系上较近;半定量RT-PCR的组织表达特异性分析表明GhCYP714A1基因与纤维突起形成发育有关。本研究构建了 pET28a-GhCYP714A1原核表达载体并进行体外诱导表达,获得分子质量约为 57.31 kDa的重组蛋白。将GhCYP714A1基因转化烟草验证其参与活性氧产生的功能,与非转基因的野生型烟草相比,转基因烟草叶片中具有较高的H2O2累积。本实验结果为深入研究该基因在棉纤维发育中的作用奠定了基础。
棉花纤维发育;细胞色素P450基因;细胞伸长;活性氧
棉花是世界上最重要的经济作物。棉纤维作为优良的天然纤维,是重要的纺织工业原料[1]。由于传统遗传育种基础狭窄、产量和品质存在负相关等原因,细胞的伸长或膨大发育与纤维的品质密切相关[2]。因此,利用基因工程技术改良棉花纤维产量和品质成为目前研究的新策略和热点。
激素显著影响植物组织器官发育和细胞的极性生长[3-5]。细胞色素P450基因(CYP450)是细胞色素单加氧酶的家族成员,与植物活性氧(ROS)的产生密切相关,ROS的水平对纤维的发育影响重大[6]。赤霉素GA是一类广泛存在于植物等生物中的二萜类化合物,GA能够通过影响细胞内活性氧(Reactive oxygen species,ROS)促进纤维的发育[7],通过超量或抑制GA代谢酶基因的表达可调节植物内源GA活性,进而控制植物的生长和发育[8]。CYP450是GA失活酶类的一种,能够通过抑制细胞内GA含量而影响细胞发育。水稻中的细胞色素P450单加氧酶EUI (CYP714D1)是GA失活酶类的一种,可以催化非-13-羟基赤霉素(GA12,GA9和 GA4)的氧化[9];水稻中P450基因的过表达会造成GA缺失而使植株严重矮化[9]。拟南芥中有2个CYP714成员,CYP714A1和CYP714A2,已有报道研究表明CYP714A1或者CYP714A2过表达植株的拟南芥会表现出严重的矮化表型[9]。
本研究从棉花纤维组织中克隆得到了细胞色素P450基因GhCYP714A1,并对其编码的蛋白进行序列功能结构域分析,构建原核表达载体并转化大肠杆菌BL21(DE3)进行重组蛋白的诱导表达,研究其在活性氧产生过程中的作用,以期为深入探研究该基因参与棉花纤维发育的重要功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料
植物材料为陆地棉品种徐州142棉花,纤维细胞经液氮速冻后于-80℃保存备用。
1.1.2 菌株与质粒
大肠杆菌菌株Top10及原核表达载体为pET28a由本实验室保存;克隆载体为大连宝生物pGEM-T vector。
1.1.3 酶及生化试剂
RNA反转录试剂盒、TaKaRa LA Taq DNA聚合酶、T4 DNA连接酶、BamHⅠ、XhoⅠ等相关酶购自大连宝生物公司;DNA凝胶回收试剂盒、质粒提取微量试剂盒购自TIANGEN公司;其他相关试剂均为国产分析纯,购自上海生工生物工程公司。
1.2 方法
1.2.1 棉花总RNA的提取
采用改良的CTAB法提取棉花胚珠总RNA[10]。所使用的研钵经高温烘烤数小时,其他器皿均用
DEPC水浸泡后灭菌。
1.2.2 GhCYP714A1基因的克隆
利用 GenBankEST数据库拼接获得的完整cDNA序列,利用Primer Premier 5.0进行引物设计。用Prime-ScriptTM反转录试剂盒以总RNA为模板合成cDNA[11],通过PCR扩增获得GhCYP714A1全长的cDNA基因。设计引物是在上下游引物的两端添加BamHⅠ和XhoⅠ的酶切位点 (下划线)和保护性碱基:正向引物:5'CGCGGATCCATGGACAAG TCCCATATTTTGTC3';反向引物:5'CCGCTCGAGGATGTTTTGAATTAGAATATGTACACC3'。PCR反应条件为95℃预变性5 min,95℃变性45 s,58℃退火45 s,72℃延伸90 s,30个循环,72℃延伸10 min;4℃存放。
1.2.3 蛋白质序列比对和结构域分析
蛋白质序列比对利用Clustalx1.81软件和Predict Protein网站在线完成,采用MEGA软件构建进化树。
1.2.4 pET28a-GhCYP714A1原核表达载体的构建与鉴定
将克隆得到GhCYP714A1基因cDNA的PCR产物经过回收后连接到pGEM-T19载体上,将连接产物转入大肠杆菌Top10感受态细胞,菌落PCR鉴定后挑取阳性单克隆,摇菌做穿刺管后送至华大基因公司测序。将经测序正确的重组质粒pGEM-T-Gh-CYP714A1和pET28a原核表达载体同时用BamHⅠ和XhoⅠ进行双酶切,回收目的基因小片段和原核表达载体大片段,并将回收好的大小片段按一定体系用T4-DNA连接酶4℃过夜连接,将连接产物转化大肠杆菌Top10感受态细胞,涂布于50 mg/L卡那霉素抗性固体LB培养基37℃恒温箱中培养12 h,挑取单克隆进行PCR和双酶切鉴定。
1.2.5 GhCYP714A1重组蛋白的诱导表达及SDS-PAGE鉴定
将构建成功的重组质粒pET28a-GhCYP714A1和空质粒pET28a转化大肠杆菌BL21(DE3)感受态细胞,经PCR鉴定后挑取阳性单克隆菌落接种于10 mL含50 mg/L卡那霉素的LB液体培养基中37℃培养过夜。各取上述过夜菌1ml转接入50 mL含50 mg/L卡那霉素的LB中,37℃振荡培养至OD600为0.4-0.6时,各取10 mL菌液记为0 h(作为对照),加入IPTG至终浓度为2 mmol/L,继续振荡培养,分别取加入 IPTG后 2、4及 6 h菌液 10 mL,4℃,6000 r/min离心10 min收集菌体,然后加入冰预冷PBS磷酸缓冲液悬浮菌体后再加入5×SDS,100℃水浴5 min,凉至室温后12000 r/min离心5 min,吸取上清液进行SDS-PAGE电泳(5%浓缩胶,12%分离胶),凝胶用考马斯亮蓝染色。
1.2.6 H2O2组织化学分析
用打空器钻取约30个叶圆片,放入小烧杯中,加入适量1 mg/mL的DAB溶液,真空渗入10 min左右,黑暗条件放置8 h以上,期间要经常振荡,叶圆片要分散开。拿出培养皿光照约1h,至红棕色斑点出现(自然光即可),用蒸馏水冲洗叶圆片。加入适量脱色液(75%乙醇+5%甘油),在80℃水浴中进行脱色,至叶片不含叶绿素后进行观察或保存。
1.2.7 H2O2定量测定
H2O2含量测定参考Bellincampi等[11]的方法。1 mL细胞培养物10000 g离心20 s,收集上清液测定H2O2的含量。上清液中加入反应试剂至总体积500 μL(反应试剂包括:500 μmol/L硫酸亚铁铵、50 mmol/L H2SO4、200 μmol/L的二甲酚橙和200 mmol/L山梨醇),H2O2介导的氧化反应将Fe2+氧化成Fe3+,温育45 min后在560 nm处测定的Fe3+-二甲酚橙复合物吸光值。
2 结果与分析
2.1 棉花GhCYP714基因克隆
采用改良的CTAB法提取棉花纤维组织的总量RNA(图1A)并反转录为cDNA,以反转录获得的棉花纤维cDNA作为模板,经过PCR扩增得到特异性条带(图1B),经测序正确后获得GhCYP714A1基因的全长cDNA,包含1563个碱基对的核苷酸,编码含有521个氨基酸残基的多肽。
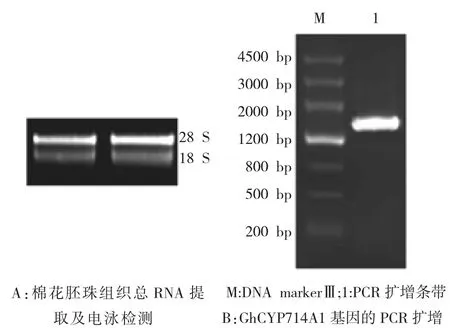
图1 GhCYP714A1基因的克隆Fig.1 Cloning of GhCYP714A1 cDNA
2.2 序列比对与进化树构建
将GhCYP714A1基因的cDNA序列翻译为氨基酸序列,将该序列与拟南芥和可可树CYP714基因的氨基酸序列进行对比,结果(图2)显示:植物中GhCYP714蛋白质在序列相似性较高。GhCYP714A1蛋白是1个疏水性蛋白,定位于核外,具有跨膜结构域(图2A,线框表示)、β-折叠结构(图2A,虚线表示)、VHP、WSC结构域(图2A,实线表示)。进化树分析的结果表明:棉花GhCYP714A1与可可树TcCYP714A1在进化上亲缘关系较近(图2B)。

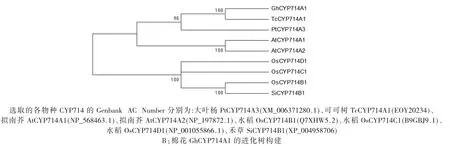
图2 GhCYP714A1的氨基酸序列比对与进化树分析Fig.2 Amino acid sequence alignment and phylogenetic tree construction of GhCYP714A1 genes
2.3 重组GhCYP714A1蛋白的诱导表达
将构建的pET28a-GhCYP714A1重组子转入表达菌株BL21(DE3)中,经PCR筛选鉴定后,进行扩大培养,IPTG诱导后提取蛋白质进行SDS-PAGE电泳分析,获得了大小约为57.13 kDa的重组GhCYP714A1蛋白(图3,箭头所示)。
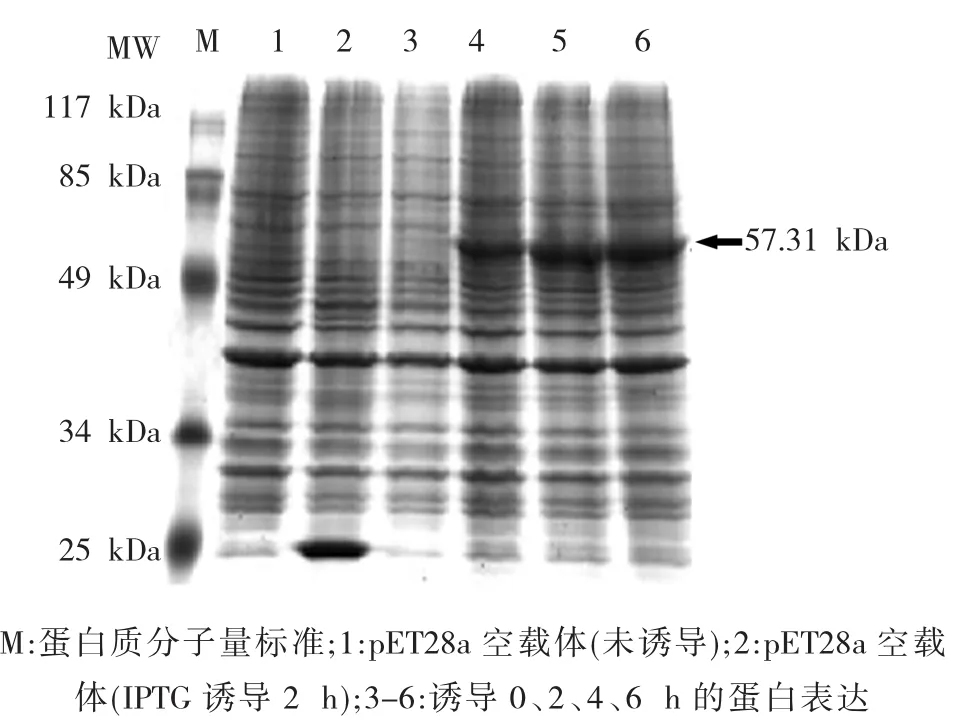
图3 GhCYP714A1重组蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of GhCYP714A1 recombinant protein
2.4 GhCYP714A1基因参与纤维发育的表达分析
以棉花的Ubiquitin7(UBQ7)为内参,通过半定量RT-PCR分析GhCYP714A1基因在棉花开花前-3、0 d和开花后3、5、10 d胚珠和纤维组织中的表达特征。由图4可见,GhCYP714A1基因在野生型棉花-3、0、3 dpa的胚珠和纤维组织中的表达较高,在相应时期的突变体组织中表达量较低,表明GhCYP714A1基因的表达可能与棉花纤维起始发育相关。
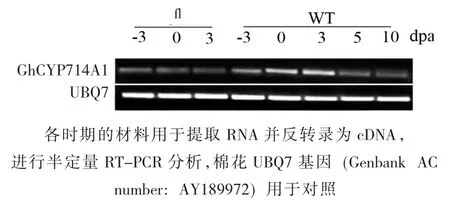
图4 GhCYP714A1参与纤维发育的表达分析Fig.4 Expression pattern analysis of GhCYP714A1 during cotton fiber development
2.5 转GhCYP 714A1基因烟草H2O2含量分析
为分析GhCYP714A1基因参与活性氧产生的功能,利用农杆菌介导的叶盘法将GhCYP714A1基因转化烟草,定性和定量检测转基因烟草叶片中的H2O2含量。由图5可见,与野生型相比,转GhCYP714A1基因烟草叶片细胞具有较高的H2O2积累。

图5 转GhCYP714A1基因烟草叶片中H2O2测定Fig.5 Detection of H2O2in GhCYP714A1 tobacco transgenic leaves and wild type
3 讨论
GA调控的ROS产生对于在植物的生长发育如根的伸长、叶的延伸等过程发挥重要作用[8-12]。水稻和拟南芥中细胞色素P450可以介导GA信号参与植物发育[9]。本研究从棉花纤维材料中克隆得到棉花GhCYP714A1基因,为首次在棉花中的报道。GhCYP714A1蛋白属于细胞色素单加氧酶家族,是1个疏水性蛋白,定位于核外,具跨膜结构域和蛋白结合位点,暗示了GhCYP714A1可能在细胞信息传递过程发挥功能。本研究获得了重组GhCYP714A1蛋白,为进一步验证其功能奠定基础。
ROS在棉花纤维发育的整个过程中的作用十分重要。在纤维发育起始期ROS含量急剧升高并在整个发育过程中一直维持在较高水平,抑制ROS的产生对纤维伸长具有显著的阻遏作用。本研究发现GhCYP714A1基因在野生型棉花开花前-3 d至开花后3 d的胚珠和纤维组织中表达量较高,这一段时期是棉纤维的发育起始时期,暗示GhCYP714A1基因可能与纤维的起始发育有关。ROS与细胞伸长发育紧密相关,可以通过诱导expansin基因的表达以及对细胞壁多糖的切割使细胞壁膨胀疏松,还参与许多的信号通路如:MAPK、Ca2+及乙烯等激素信号调控细胞的伸长发育[13-15]。本研究发现转GhCYP 714A1基因烟草叶片中具有较高的H2O2累积,暗示GhCYP714A1可能通过诱导细胞内ROS的产生进一步参与细胞发育调控。
4 结论
本研究从棉花纤维组织中克隆得到GhCYP714A1基因,构建了原核表达载体pET28a-GhCYP714A1,体外诱导表达获得了大小约为57.31 kDa的GhCYP714A1重组蛋白。GhCYP714A1基因在野生型棉花开花前3 d至后3 d的胚珠和纤维组织中表达量较高。转GhCYP714A1基因烟草叶片中活性氧的含量显著增加。这些结果表明GhCYP714A1基因可能通过促进活性氧的累积进一步参与棉花纤维起始发育。
[1]刘进元,赵广荣,李骥.棉花纤维品质改良的分子工程 [J].植物学报,2000,42(10):991-995 Liu J Y,Zhao G R,Li J.Molecular engineering on quality improvement of cotton fiber[J].Bulletin of Botany,2000,42(10):991-995.
[2]钱雯婕,王斐,李鸿彬,等.棉花单脱氢抗坏血酸还原酶基因的克隆及原核表达 [J].西北农业学报,2012,21(5):118-122. Qian W J,Wang F,Li H B,et al.Cloning and prokaryotic expression of a cotton monodehydroascorbate reductase gene[J].Acta Agriculturae Boreali-occidentalis Sinica,2012,21(5):118-122.
[3]Hartweck L M and Olszewski N E.Rice Gibberellin insensitive dwarf1 is a gibberellin receptor that illuminates and raises questions about Ga signaling[J].The Plant Cell,2006,18(2),278-282.
[4]Fu X and Harberd N P.Auxin promotes Arabidopsis root growth by modulating gibberellin response[J].Nature,2003,421(6924):740-743.
[5]Bennett T,Sieberer T,Willett B,et al.The Arabidopsis MAX pathway controls shoot branching by regulating auxin transport[J].Curr Biol,2006,16(6):553-563.
[6]Qin YM,Hu CY,Zhu YX.The ascorbate peroxidase regulated by H2O2and ethylene is involved in cotton fiber cell elongation by modulating ROS homeostasis[J].Plant Signaling&Behavior,2008,3(3):194-196.
[7]Gialvalis S,Seagull R W.Plant hormones alter fiber initiation in unfertilized,cultured ovules ofGossypium hirsutum [J].The Journal of Cotton Science,2001,5(4):252-258.
[8]Xiao Y H,Meng H Y,Hou L,et al.Direct amplification of introncontaining hairpin RNA construct from genomic DNA [J].Biotechniques,2006,41(2):548,550,552.
[9]Zhang Y Y,Zhang B C,Yan DW,et al.Two Arabidopsis cytochrome P450 monooxygenases,CYP714A1 and CYP714 A2,function redundantly in plant development through Gibberellin deactivation[J].Plant J,2011,67(2):342-353.
[10]蒋建雄,张天真.利用CTAB-酸酚法提取棉花组织总RNA [J].棉花学报,2003,15(3):166-167. Jiang J X,Zhang T Z.Extraction of total RNA in cotton tissues with CTAB-acidic phenolic method[J].Cotton Science,2003,15(3):166-167.
[11]Bellincampi D,Dipierro N,Salvi G,et al.Extracellular H2O2induced by oligogalacturonides is not involved in the inhibition of the auxinregulated rolb gene expression in tobacco leaf explants[J].Plant Physiology,2000,122:1379-1385.
[12]Kende H,Zeevaart J.The five“classical”plant hormones [J].Plant Cell,1997,9(7):1197-1210.
[13]Foreman J,Demidchik V,Bothwell J H,et al.Reactive oxygen species produced by NADPH oxidase regulate plant cell growth[J].Nature,2003,422(6930):442-446.
[14]Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants[J].Trends Plant Sci,2004,9(10):490 -498.
[15]Schopfer,P.Hydroxyl radical-induced cellwall loosening in vitro and in vivo:implications for the control of elongation growth[J].Plant J,2001,28(6):679-688.
Overexpression of a GhCYP714A1 gene encoding cytochrome P450 gene promotes the H2O2accumulation in transgenic tobacco plant
Xin Shan1,Xin Quanliang1,Li Rong1,Kou Wei1,Li Hongbin1,2*
(1 College of life sciences of Shihezi Universtiy,Shihezi,Xinjiang 832003,China; 2 Key laboratory of Agrobiotechnology of Shihezi University,Shihezi,Xinjiang 832003,China)
The full-length cDNA of a cytochrome P450 gene(Cytochrome P450 714A1,GhCYP714A1)was cloned from Upland cotton fiber tissues through RT-PCR method.Sequence analysis showed that the GhCYP714A1 cDNA contains a 1563 bp open reading frame (ORF),which coding a putative protein with theoretical molecular weight of 57.31 kDa and 521 amino acid residues.Bioinformatics analys is demonstrated that GhCYP714A1 protein contains seve ralprotein binding sites and a transmembrane functional domain.Phylogenetic tree analysis showed that GhCYP714A1 has close relationship with SiCYP714B1 protein.Tissue-specific expression patterns assay by semi-quantitative RT-PCR showed that GhCYP714A1 was expressed during the initiation and elongation stages of fiber development. The prokaryotic expression vector pET28a-GhCYP714A1 was constructed and transformed intoE.colito induce expression.As a result,a 57.31 kDa recombinant protein was obtained. GhCYP714A1 gene was transformed into tobacco to explore its function in ROS generation.Compared with wild-type tobacco, the transgenic tobacco plants displayed a higher H2O2accumulation in leaves.These results suggested that GhCYP714A1 may be involved in fiber development by promoting the production of ROS.
cotton fiber development;cytochrome P450 gene;cell elongation;ROS
S562
A
10.13880/j.cnki.65-1174/n.2017.01.011
1007-7383(2017)01-0065-05
2016-05-30
国家自然科学基金项目(31260339),新疆兵团杰青项目(2014CD003),新疆兵团种质资源创新专项(2012BB050),新疆研究生科研创新项目
辛珊(1991-),女,硕士研究生,专业方向为植物分子生物学,e-mail:cynthiaxs@hotmail.com。
*通信作者:李鸿彬(1980-),男,教授,博士生导师,从事植物分子生物学与基因工程研究,e-mail:lihb@shzu.edu.cn。

