石河子烟煤Fenton试剂氧化的研究
莫海燕,朱平,彭文才,李江兵,张建树*
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,新疆 石河子 832003;2巴音郭楞职业技术学院,新疆 库尔勒 841000)
石河子烟煤Fenton试剂氧化的研究
莫海燕1,2*,朱平1,彭文才1,李江兵1,张建树1*
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,新疆 石河子 832003;2巴音郭楞职业技术学院,新疆 库尔勒 841000)
为了增加煤炭产品的附加值,常用过氧化氢作为氧化剂将煤转化为腐殖酸。为了提高煤与过氧化氢氧化的效率,并增强氧化效果,本研究在氧化体系中加入Fe2+形成Fenton试剂,对氧化反应的关键影响因素试剂配比、反应温度、溶液pH值、反应时间进行了探究。通过分析水溶物收率、残渣率及气体体积,探究煤与Fenton试剂氧化的规律及氧化反应最佳条件,为工业化生产提供理论依据与实际指导作用。为了进一步探究氧化过程,分别对石河子烟煤CS2/NMP的萃取物和残渣进行了氧化。实验结果表明:在试剂配比较低时,水溶物收率变化不明显,且随温度的升高先增加后降低;溶液初始pH值较低时有利氧化的进行;水溶物随着反应时间的延长而减少;相比原煤,萃取物和残渣更容易氧化。
烟煤;Fenton试剂;过氧化氢;氧化;腐殖酸
新疆煤炭资源丰富,主要以低变质的长焰煤、不粘结煤和弱粘结煤为主,目前主要用于发电、气化、兰炭、碳基材料等[1-2]。煤经氧化可以转化为羧酸(如芳香多羧酸)或用作肥料的腐殖酸(水或碱的萃取物),而羧酸及其衍生物是重要的有机化工原料,广泛用于生产树脂、塑料、增塑剂及高端材料等。煤的氧化吸引了许多煤炭研究者的兴趣[3-7],其中利用过氧化氢作为氧化剂就有很多的研究。Isoda等[8]在H2O2和Yallourn煤的氧化体系中加入1-丙醇,残渣率为80%且全溶于乙醇。Miura等[9]用H2O2氧化褐煤等低阶煤,发现可以高选择性地得到甲酸、乙酸、乙二酸、丙二酸等脂肪酸。Miura和Mae[10-11]先用30%H2O2在60℃以下对 Beulah Zap和 Morwell煤氧化24 h,再用Fenton试剂对水溶物进行二次氧化,得到的小分子化合物高达60%,尤其是草酸和乙酸等脂肪酸。葛岭梅等[12]用20%H2O2在50℃下分步氧化超细神府煤,原煤的质量损失不超过10%,酸收率可达71%。冯波等[13]用H2O2在NaOH溶液中氧化褐煤,对其氧化产物进行FTIR和GC/MS分析发现产物中除了脂肪羧酸外,还含酚酸。Tian Yujiao等[14]用H2O2对童亭原煤和萃余煤进行氧化,发现萃余煤更容易被氧化,且能得到更多种类的化合物。
目前,煤的过氧化氢氧化研究主要集中在煤的结构分析方面,以优化氧化条件生成腐殖酸的研究较少。为了提高H2O2氧化效率,增加腐殖酸的收率,在氧化体系中加入催化剂Fe2+,形成Fenton试剂,促进氧化反应。根据Fenton试剂氧化机理[15],·OH自由基是氧化反应的有效因子,而Fe2+、H2O2、OH-的浓度决定了·OH自由基的生成。因此,影响Fenton试剂氧化的因素包括试剂配比、反应温度、溶液pH值、反应时间等,本文对这些影响因素分别进行了探究,此外,为了进一步研究煤的氧化过程,分别对石河子烟煤CS2/NMP的萃取物及残渣进行氧化。
1 实验内容
1.1 煤样与试剂
煤样:选用石河子烟煤(SHZ),破碎研磨至 200目以下,105℃干燥2 h,置于干燥器中备用,其中煤样的工业分析和元素分析见表1。
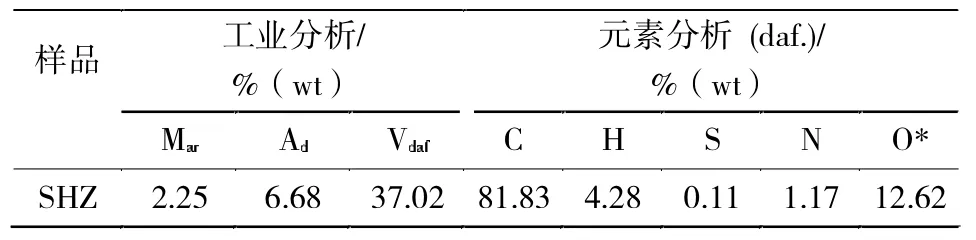
表1 煤样的工业分析和元素分析Tab.1 The proximate and ultimate analysis of coal sample
试剂:30%过氧化氢购于西安化学试剂厂;FeSO4·7H2O、甲基橙购于天津市盛奥化学试剂有限公司;盐酸、丙酮、CS2、N-甲基吡咯烷酮、四氢呋喃购于天津市富宇精细化工有限公司。
以上试剂均为分析纯。
1.2 实验步骤
准确称取干燥后样品(煤与残渣5 g,萃取物4 g),加入500 mL平底烧瓶中,再加入 50 mL的FeSO4溶液(浓度根据样品与Fe2+质量的配比),将烧瓶置于达到预设温度的恒温水浴中;利用恒压滴液漏斗加入30%H2O2,控制其在实验结束前2 h滴完;反应结束后,将烧瓶迅速放入冷水中冷却;反应混合物经离心分离,上清液再进行抽滤,滤液在70℃下旋蒸并干燥,即得水溶物W1,称重并计算收率Y1,再计算单位质量气体V0;反应生成的气体利用气囊收集,并用排水法测体积V1。
氧化残渣中FeSO4的去除。将氧化残渣放到烧杯中,加 4 mol/L HCl溶液,在 50℃下搅拌 40 min。将混合物进行抽滤,即得残渣,干燥称重W2,并计算残渣率Y2。
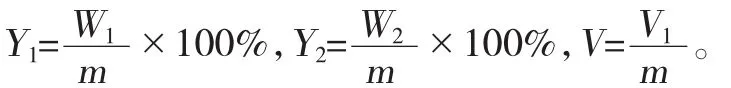
以上各式中:m是煤样质量g;W1是水溶物质量g;W2是氧化残渣质量g;V是气体体积mL。
1.3 煤样萃取
准确称取45 g煤样放入1 L平底烧瓶中并放入磁子,再加入600 mL NMP和 20 mL CS2。在115℃、磁力搅拌下萃取 24 h,移至离心杯,以3800 r/min转速离心10 min,分别移出萃取液和残渣。萃取液在130℃旋蒸干燥。残渣在105℃干燥,后用丙酮进行索式提取,除去残留的 CS2和NMP,最后干燥。
2 结果与讨论
2.1 石河子烟煤与Fenton试剂的氧化
2.1.1 Fenton试剂配比对氧化反应的影响
为了研究Fenton试剂配比对反应的影响,设置反应温度为60℃、反应时间为8 h、溶液初始pH值为3,30%H2O2加入量为50 mL,通过改变Fe2+加入质量调节Fenton试剂配比,试剂质量配比与各收率的关系如图1所示。
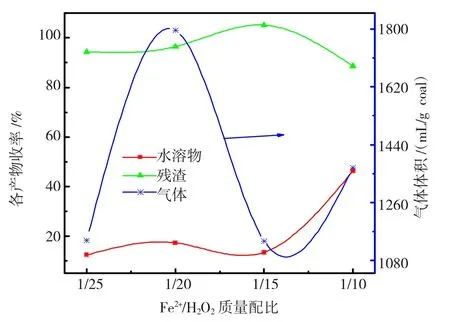
图1 不同Fe2+/H2O2质量配比的各产物收率Fig.1 Yields of products under the different mass ratio of Fe2+to H2O2
由图1可知:
(1)水溶物收率在配比 1/25~1/15时较低,而在1/10时达到46.32%,较1/20时增加2.69倍。
(2)残渣率先增大后减小,1/10时最低为88.60%;气体体积先增加后减小再增加。
根据Featen试剂反应机理[15],究其原因主要是:在Fe2+浓度较低时,转化的·OH自由基较少,主要发生煤与H2O2发生的氧化,氧化程度低,生成的水溶物也容易被多余H2O2氧化分解生成CO2等气体。随着Fe2+的浓度增加,H2O2产生的·OH自由基增多,氧化加剧,生成大量的水溶物,小分子物质也会同时被氧化分解成气体;当Fe2+的浓度过高时,部分H2O2发生无效分解。
2.1.2 反应温度对氧化反应的影响
反应速度与反应温度紧密相关。为探究反应温度对氧化反应的影响,计算分析Fe2+/H2O2配比为1/10、反应时间为8 h、溶液初始pH值为3时,其变化关系,结果见图2。
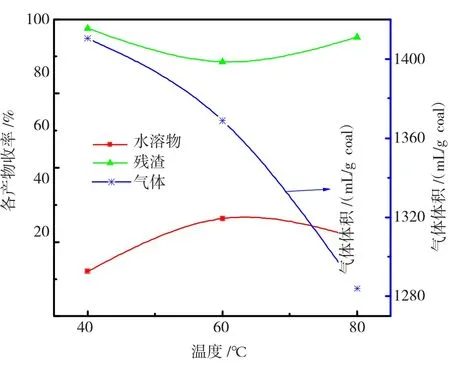
图2 不同温度下的各产物收率Fig.2 Yields of products under the different reaction temperature
由图2可知:水溶物收率随着温度的升高呈先增加后下降趋势,在60℃收率最高为46.32%;残渣率先下降后升高,60℃最低为88.60%;而气体体积逐渐下降,80℃为1284 mL/g coal。
葛岭梅等[12]在不同温度下,用20%H2O2氧化超细神府煤,酸收率随着温度的升高而增加,在60℃下反应6 h后酸收率为18%,残渣率为74.4%;在80℃下反应4 h后,反应混合物中产生大量的气泡。姜雨[16]用30%H2O2氧化呼伦贝尔煤时发现,反应温度在20℃时滤液为浅黄色,40℃时为深褐色,然后转为黑褐色,在80℃时滤液颜色为亮黄色,在40℃时,氧化残渣收率为66.78%。
综上所述可知:温度的升高,使·OH自由基的转化加快、氧化加剧,有利于·OH自由基与煤的反应,可提高氧化效果。在较高温度下,Fe2+催化作用加强了H2O2的分解,H2O2减少致使在80℃下残渣率增加,同时溶液中的水溶物也会随着温度的升高而被氧化分解。
2.1.3 溶液初始pH值对氧化反应的影响
在Fe2+/30%H2O2配比为1/10,反应时间为8 h、反应温度为60℃的条件下,探讨溶液初始pH值对氧化反应的影响,pH值与各收率的变化关系如图3所示。

图3 不同pH值下的各产物收率Fig.3 Yields of products under the different value of pH
从图3可以看出:随着溶液初始pH值的升高,水溶物收率逐渐降低。pH值为 1.5时,收率为52.87%,而pH值为6时,收率仅为26.40%,减少近一倍。残渣率呈先下降后上升趋势,pH值为3时,残渣率最低为88.60%。气体体积先增加后下降再上升,从1083 mL/g coal到1369 mL/g coal,总体变化幅度较小。
根据Fenton试剂反应机理[15],究其原因主要是:溶液pH对Fenton试剂氧化影响很大,当pH值过高时,Fe2+会形成氢氧化物沉淀而失去催化活性,抑制了Fe2+催化作用,氧化效果降低;当pH值过低时,溶液中的H+浓度过高,Fe3+不能被还原为Fe2+。
2.1.4 反应时间对氧化反应的影响
为了研究反应时间对氧化效果的影响,计算分析反应温度60℃、试剂配比为1/10、溶液初始pH值为3时反应,时间与各收率的变化关系见图4。从图4可以看出:水溶物收率随着时间延长呈先增加后减小的的趋势,12 h最高45.53%,之后开始下降;而残渣率呈先下降后增加趋势。
葛岭梅等[12]氧化呼伦贝尔煤时发现,一步氧化最高酸收率为18.6%,经分步优化氧化后,可得71%的腐殖酸。煤与H2O2氧化有三个阶段:形成含氧官能团和水解键;键断裂生成水溶物;水溶物分解[17]。随着时间的增加,残渣逐渐被氧化,随着氧化分解的小分子也和H2O2反应生成为气体,所以其增加较快。同时H2O2浓度降低,一些氧化中间体难以进一步氧化,同时由于含氧官能团的形成,使残渣率超过原煤的质量。

图4 不同反应时间的各产物收率Fig.4 Yields of products under the different reaction time
2.2 石河子烟煤CS2/NMP萃取物及残渣的氧化
2.2.1 反应温度对萃取物氧化的影响
为了探讨Fenton试剂对石河子烟煤CS2/NMP萃取物氧化的影响,设置反应时间12 h、pH值为3、试剂配比为1/10,分别在40℃、60℃、80℃下进行氧化,各收率如图5所示。由图5可知:水溶物收率随着反应温度的升高从68.15%下降到12.40%,残渣率和气体体积都随着温度升高而增加,在80℃时,残渣率为102.04%,气体体积为950 mL/g coal。
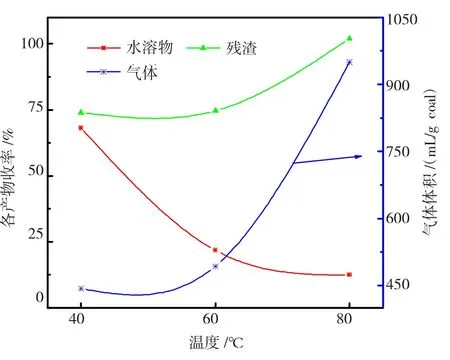
图5 不同温度下萃取物氧化的各产物收率Fig.5 Yields of products of extracts oxidized under the different reaction temperature
萃取物多为多环芳烃和长链脂肪烃,芳烃化合物具有稳定的苯环结构,一般氧化剂很难将其打开,而H2O2被Fe2+催化生成·OH自由基有强氧化性及强的亲电加成性能[18],苯环易受·OH自由基的攻击。田依林等[19]研究发现,Fenton试剂处理芳香化合物是逐步分解的,H2O2不足时氧化反应停留在中间产物。与原煤相比,萃取物有部分易于被氧化的小分子物质,在温度较低时就可以被·OH自由基氧化解聚为水溶物。随着温度的升高,水溶物继续降解而生成H2O和CO2等气体。但其中较难分解的部分被氧化生成中间产物,由于含氧官能团的大量引入,使残渣收率超过初始重量。
2.2.2 反应温度对萃取残渣氧化的影响
为了探讨Fenton试剂对残渣的氧化影响,在反应时间为12 h、试剂配比为1/10、pH值为3,温度40℃、60℃、80℃下进行氧化,结果见图6。
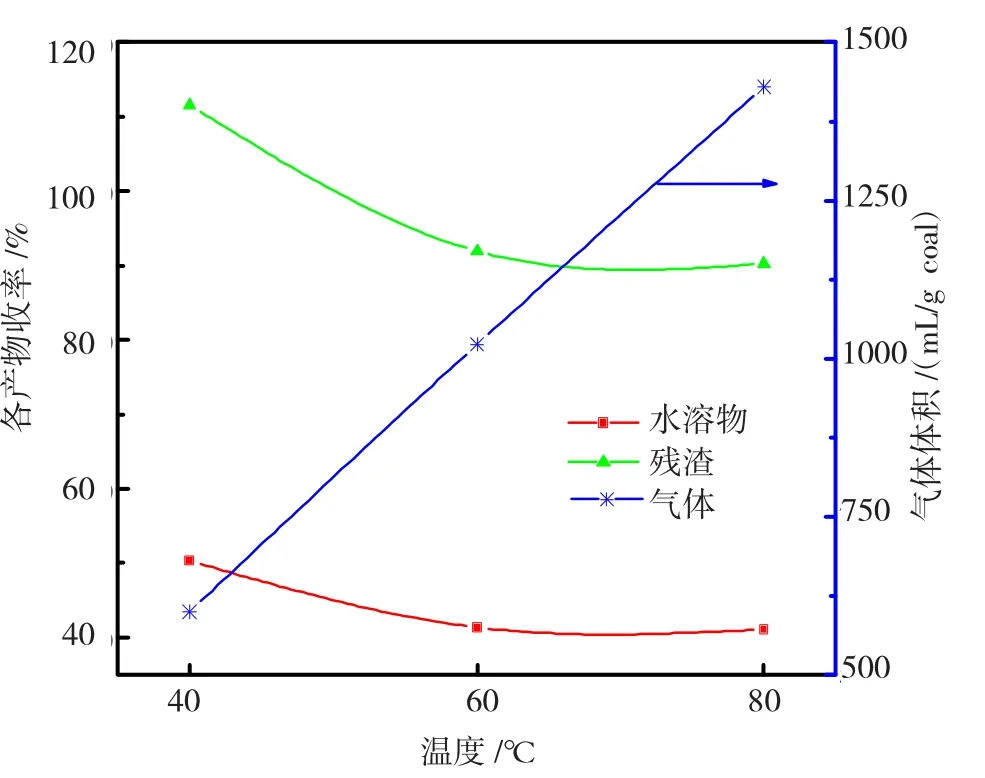
图6 不同温度下残渣氧化的各产物收率Fig.6 Yields of products of residue oxidized under the different reaction temperature
图6 显示:随着温度的升高,氧化生成的水溶物在减少,从50.34%逐渐降至41.13%;同时残渣率在降低,80℃降到最低90.25%;气体体积在增加,80℃时为1430 mL/g coal。
与原煤相比,萃取残渣反应性较高。另外,萃取残渣具有更多孔结构,有利于扩散,·OH自由基夺取残渣分子结构的氢后,使残渣中一些桥键和氢键断裂,转化生成的水溶物相对增多,使残渣率在降低。同时,随着温度的升高,水溶物的分解增多,气体体积在逐渐增加。
3 结论
石河子烟煤经Fenton试剂氧化,可获得较多的水溶物;随着氧化条件的变化,水溶物收率也不相同。
(1)在Fenton试剂配比较低时,水溶物收率较低且变化不明显,且随温度的升高先增加后降低。经优化反应条件后,氧化最佳反应条件为:配比1/10,反应温度60℃,反应8 h,水溶物收率达到最大为46.32%,此时的残渣率最低为88.60%。
(2)溶液pH对Fenton试剂氧化影响很大,水溶物收率随pH值的增大而降低,溶液中H+离子有利于·OH自由基的氧化,可促进反应。在pH值为1.5时,水溶物收率为52.87%。
(3)水溶物收率随着时间的延长先增加后减小,其氧化过程是分步进行。
(4)与原煤相比,萃取后的萃取物和残渣反应性更高,残渣的孔结构增多,更容易被氧化。在溶液初始pH值为3、试剂配比为1/10,反应温度为40℃条件下,萃取物经12 h氧化,水溶物收率达到最大值为68.15%,是原煤最优条件的1.3倍。
[1]姜云辉,杨万志,程遂欣.新疆煤类分布、变质规律及变质作用分析[J].新疆地质,2008,26(3):301-304. Jiang Y H,Yang W Z,Cheng S X.Analysis on distribution,metamorphic regularity and metamorphism of Xinjiang coal [J].Xinjiang Geology,2008,26(3):301-304.
[2]葛欣宇,武占省,闫豫君,等.氨水改性增强煤基活性炭对芘的吸附性能研究[J].石河子大学学报(自然科学版),2016,34 (1):92-99. Ge X Y,Wu Z S,Yan Y J,et al.The ammonia modification of coalbased activated carbon and its pyrene adsorption performance in aqueous solution[J].Journal of Shihezi University(Natural Science),2016,34(1):92-99.
[3]Qi X Y,Wang D M,Zhong X X,et al.Characteristics of oxygen consumption of coal at programmed temperatures [J].Mining Science&Technology,2010,20(3):372-377.
[4]Wang G,Zhou A.Time evolution of coal structure during low temperature air oxidation [J].International Journal of Mining Science and Technology,2012,22(4):517-521.
[5]Wang W,Hou Y,Niu M,et al.Production of benzene polycarboxylic acids from bituminous coal by alkali-oxygen oxidation at high temperatures[J].Fuel processing technology,2013,110:184-189.
[6]潘春秀,刘锦润,张强盛.几种低阶煤的过氧化氢氧化解聚性能研究[J].广州化工,2014(23):51-53. Pan C X,Liu J R,Zhang Q S.Oxidation depolymerization behaviours of several low rank coals by H2O2[J]Guangzhou Chemical Industry,2014(23):51-53.
[7]Yu J,Jiang Y,Tahmasebi A,et al.Coal oxidation under mild conditions:current status and applications[J].Chemical Engineering&Technology,2014,37(10):1635-1644.
[8]Isoda Takaaki,Takagi Hideyuki,Katsuki Kusakabe,et al. Structural Changes of Alcohol-Solubilized Yallourn Coal in the Hydrogenation over a Ru/Al2O3Catalyst[J].Energy& Fuels,1998,12(3):503-511.
[9]MiuraKouichi,MaeKazuhiro,Okutsu Hajime,etal.New Oxidative Degradation Method for Producing Fatty Acids in High Yields and High Selectivity from Low-Rank Coals [J].Energy&Fuels,1996,10(6):1196-1201.
[10]Miura Kouichi.Mild conversion of coal for producing valuable chemicals[J].Fuel Processing Technology,2000,62(2): 119-135.
[11]Mae Kazuhiro,Shindo Hiroyuiki,Miura Kouichi.A New Two-Step Oxidative Degradation Method for Producing Valuable Chemicals from Low Rank Coals under Mild Conditions[J]. Energy&Fuels,2001,15(3):611-617.
[12]葛岭梅.神府超细3-1煤的H2O2氧化研究[J].西安矿业学院学报,1998(A09):80-83. Ge L M.Oxidation behaviours of Shenfu ultrafine 3-1coal by H2O2[J].Journal of Xi’AN Ming Institute,1998(A09): 80-83.
[13]冯波,其鲁,张敬华,等.弱氧化环境下褐煤氧化产物的定性分析[J].冶金分析,2009,29(1):21-24. Feng B,Qi L,Zhang J H,et al.Qualitiative analysis of brown coal oxidation products in mild oxidizing atmosphere [J].Metallurgical Analysis,2009,29(1):21-24.
[14]Tian Y J,Qin Z H,Li B M.Preparation and H2O2oxidation of extract[J].International Journal of Mining Science& Technology,2012,22(5):731-734.
[15]陈胜兵,何少华,娄金生,等.Fenton试剂的氧化作用机理及其应用[J].环境科学与技术,2004,27(3):105-107. Chen S B,He S H,Lou J S.Oxidation mechanism and application of Fenton reagents[J].Environmental Science& Technology,2004,27(3):105-107.
[16]姜雨.褐煤在温和条件下氧化特性和机理的研究[D].沈阳:辽宁科技大学,2014:33-34
[17]埃利奥特 M A.煤利用化学(上册)[M].北京:化学工业出版社,1991:388-389.
[18]胡红伟,李晓燕.Fenton催化氧化反应机理及影响因素研究进展[J].科技通报,2012,28(4):220-222. Hu H W,Li X Y.Analysis the Fenton oxidation reaction mechanism and the influencing factors[J].Bulletin of science and technology,2012,28(4):220-222.
[19]田依林,李明玉,马同森,等.Fenton试剂氧化水中芳香族化合物的机理[J].污染防治技术,2003(1):12-15. Tian Y L,Li M Y,Ma T S,et al.Mechanism of Treatment of Aromatic Compounds-containing Water by Fenton’s Reagent[J].Pollution control technology,2003(1):12-15.
Oxidation behaviours of Shihezi bituminous coal by Fenton reagents
Mo Haiyan1,2,Zhu Ping1,Peng Wencai1,Li Jiangbing1,Zhang Jianshu1*
(1 School of Chemistry and Chemical Engineering/Key Laboratory for Green processing of Chemical Engineering of Xinjiang Bingtuan,Shihezi,Xinjiang 832003,China;2 BaYinGuoLeng Vocational and Technical College,Korle,Xinjiang 841000,China)
Coal resources of Xinjiang are abundant.In order to increase the added value of coal,H2O2was used to oxide coal to produce humic acid.In the interest of increasing the oxidation efficiency of H2O2to coal,Fe2+was added to the oxidation system to form Fenton reagents for enhancing oxidation.In this paper,we investigated the key factors of the oxidation reaction like ratio of Fe2+to H2O2,reaction temperature,pH value and reaction time.The regularities and optimal conditions of reaction between Fenton reagents and coal were also researched by analyzing the water-soluble yield,residue rate and volume of gas, and provide theoretical basis and practical guidance for industrial production.Meanwhile,the CS2/NMP extracts and residue of Shihezi bituminous coal were oxidized to explore the oxidation process of coal and H2O2.The results showed that when the ratio was low,the water-soluble yield increase first slightly and then decrease with the increase of temperature.The experimental results show that the lower pH is favorable for the reaction.With the increasing of oxidation time,the water-soluble is decreased.The extracts and residue are more easily oxidized compared to raw coal.
bituminous coal;fenton reagents;H2O2;oxidation;humic acid
TQ530.2
A
10.13880/j.cnki.65-1174/n.2017.01.004
1007-7383(2017)01-0023-05
2016-08-23
国家自然科学基金项目(21106087,21566033),石河子大学高层次人才启动资金项目(RCZX201013)
莫海燕(1982-),女,硕士研究生,专业方向为煤化工。
*通信作者:张建树(1979-),男,副教授,从事煤化工研究,e-mail:zjschem@163.com。

