黄芪茎叶对断奶仔猪盲肠微生物区系的影响
孔祥杰,姜海龙*,蔡维北,蒙洪娇,惠铄智,相 冬,杨海天
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.中粮加家康(吉林)有限公司,吉林省长春市,132000)
黄芪茎叶对断奶仔猪盲肠微生物区系的影响
孔祥杰1,姜海龙1*,蔡维北2,蒙洪娇1,惠铄智1,相 冬1,杨海天1
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.中粮加家康(吉林)有限公司,吉林省长春市,132000)
本试验旨在探讨日粮中添加不同比例黄芪茎叶对断奶仔猪盲肠微生物区系的影响。选用24头健康的长×大二元杂交仔猪,按体重随机分成对照组、2.5%黄芪茎叶组、5%黄芪茎叶组和7.5%黄芪茎叶组4组,每组3个重复,每个重复2头仔猪,试验期为28 d。试验结束后,采用高通量测序方法对仔猪盲肠内容物进行分析。结果表明:断奶仔猪盲肠微生物的多样性随黄芪茎叶的添加量不同发生改变,其中2.5%组的微生物多样性最高,盲肠内容物中微生物菌群以Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门)为主,占总含量92%以上;在属水平上,2.5%黄芪茎叶组与7.5%黄芪茎叶组的优势菌属数量最高为11种,其中Prevotella菌属的丰度最高。综上所述,在仔猪日粮中添加适量的黄芪茎叶,可降低盲肠pH及提高微生物多样性,有利于断奶仔猪的健康生长。
黄芪茎叶;断奶仔猪;盲肠微生物区系
国内外学者研究发现,断奶仔猪肠道内微生态的稳定性与肠道菌群多样性相关。仔猪肠道内菌群多样性含量越高,肠道微生态平衡就越稳定,仔猪的生长状态就越好。仔猪断奶后由于免疫系统不健全,肠道功能发育不完善,抗病能力比较差[1],会使动物肠道微生态平衡受到破坏,使断奶后的仔猪易患疾病。有研究表明,中草药可以调整动物肠道菌群结构,改善动物的健康状况[2]。我国中草药不但种类繁多、来源广、产量高、价格低廉,长期使用无残留、无毒副作用,并且中草药还具有抗应激、抗氧化、抑菌抗病毒、促消化等功能[3],因此中草药作为绿色添加剂应用于动物饲料中成为近几年的研究热点。但人们关注中草药的同时忽略了中草药的副产品,如黄芪、人参茎叶的利用,造成了资源浪费。中草药副产品中同样含有与中草药相似的成分,如多糖、皂苷等有效物质。在猪的基础饲粮中添加党参的茎叶,可提高仔猪的成活率和日增重,不但降低了饲养成本还提高了仔猪的免疫力和对饲料的转换率[4]。本试验主要利用高通量测序技术,分析断奶仔猪日粮中添加黄芪茎叶对盲肠微生物区系的影响,为黄芪茎叶在仔猪生产中的应用提供理论依据。
1 材料与方法
1.1 试验材料 试验采用的黄芪茎叶来自吉林农业大学中药材学院黄芪种植园,采集到的黄芪茎叶经过风干、粉碎制样。
1.2 试验方法 采用单因子试验设计,根据黄芪茎叶的添加量,将试验用的断奶仔猪分成4组,分别是对照组、2.5%黄芪茎叶组、5%黄芪茎叶组和7.5%黄芪茎叶组。每个处理组3个重复,每个重复2头仔猪。
1.3 试验日粮和饲养管理 试验日粮按照NRC(1998)猪营养需要标准进行配制,每组日粮分别添加0%、2.5%、5%和7.5%的黄芪茎叶。试验日粮组成和营养成分如表1所示。饲养试验于2015年7月9日—2015年8月10日在吉林省长春市梨树县东北养殖繁育基地进行。试验预试期5 d,正试期28 d。试验仔猪在同一猪舍内,同一管理员统一饲喂。试验仔猪采用网床饲养,且通风良好。仔猪自由采食,采用压嘴式饮水器饮水,按猪场免疫程序进行免疫,及时收集槽外废弃饲料,记录采食量,观察仔猪采食和健康情况。预试期结束后,仔猪空腹12 h后称重作为试验初重,采用逐日计算方法计算采食量及平均日增重。

表1 试验日粮组成和营养成分
1.4 样品采集 试验结束后,对每头猪逐个进行称重,结束后每个试验组随机选取3头(即每个重复选取1头猪)仔猪进行屠宰试验。前腔放血后,迅速打开腹腔,找出盲肠后迅速结扎,取出,将盲肠食糜混匀后装入5 mL冻存管中,立即投入液氮内进行速冻,供盲肠食糜中微生物的类别及丰度测定,并迅速用pH计现场测定盲肠内pH。
1.5 样品处理
1.5.1 肠道pH测定 屠宰结束后,用pH测定仪测定盲肠内容物的pH。
1.5.2 盲肠内容物微生物区系测定 采用QIAamp DNA Stool Mini Kit提取仔猪盲肠内容物的总DNA,将干燥好的DNA样品溶于100 μL去离子水中。采用Thermo公司的Scientific NanoDrop 2000C测定DNA的纯度,并以OD260/OD280评价DNA的纯度,要求纯度在1.7~1.9,将提取的DNA送至上海锐意生物公司,利用Qubit2.0 DNA试剂盒对基因组DNA精确定量,以确定再做PCR反应时DNA的加入量。对微生物基因组16S rDNA V3~V4区进行扩增,引物为341F(5′-CCTACACGACGCTCTTCCGATCTN-3′和805R(5′-GACTGGAGTTCCTTGGCACCCGA GAATTCCA-3′)。每个样品引物加barcode序列。PCR结束后,对PCR产物进行琼脂糖电泳,采用琼脂糖回收试剂盒对DNA进行回收。利用Qubit2.0 DNA检测试剂盒对PCR产物精确定量,以确定测序反应加入的PCR产物量,最后采用高通量测序方法对盲肠微生物区系进行分析。
1.5.3 高通量测序 设计16S/ITS特定引物扩增特异区域,得到425/320 bp左右扩增片段。并采用Miseq平台,对2×300 bp的paired-end数据进行拼接,从而进行16S/ITS分析。对原始数据进行QC后,用Usearch软件对数据进行去嵌合体和聚类的操作。对每个样品的tags进行随机抽平处理,并提取对应的OTU序列。然后使用QIIME软件,做Alpha多样性指数的稀释曲线,根据稀释曲线选择合理的抽平参数,利用QIIME软件对得到的抽平后的OTU进行分析,对每个OTU进行物种分类。归类后,根据每个OTU中序列的条数,从而得到OTU丰度表,最后根据该OTU丰度表进行后续分析。
1.5.4 统计分析 试验结果用Excel软件进行整理后,用SPSS20.0软件进行单因素的方差分析,用Duncan′s方法进行多重比较,以P<0.05作为显著判断标准,以P<0.01作为极显著判断标准,试验结果以平均值±标准误表示。
高通量测序采用软件Usearch进行OUT聚类,序列相似性定为0.97;采用RDP方法进行物种分析,利用QIIME计算微生物的Alpha多样性指数的值,并做出相应的稀释曲线,包括OUT数、Chao1指数和Shannon指数。
2 结果与分析
2.1 黄芪茎叶多糖含量 本试验采用国际法对黄芪茎叶中多糖含量进行测定,制得标准曲线为Abs=0.0083c+0.1389 R2=0.9997,将黄芪茎叶所得结果带入X=m1×v1/(m2×v2) ×0.9×10-4,结果显示黄芪茎叶中多糖含量为0.0429 g/g。
2.2 黄芪茎叶对仔猪盲肠微生物pH的影响 如表2所示,随着日粮中黄芪茎叶添加量的提高,仔猪盲肠内pH呈现先低后高的趋势,其中2.5%黄芪茎叶组的pH最低,但与对照组相比差异不显著(P>0.05)。2.3 仔猪盲肠微生物群落在门水平上的组成成分分析 对门水平等级top10的物种丰度进行分析,发现各黄芪茎叶添加组盲肠微生物群落的门水平分类上组成相同,但丰度有所变化。如图1所示,对照组与试验组仔猪盲肠内容物中微生物均由放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、蓝藻菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和螺旋体门(Spirochaetes)这几种菌门组成,其中Bacteroidetes和Firmicutes的所占比例较高,为优势菌群。其中,2.5%组的Bacteroidetes含量最高,5%组Bacteroidetes的含量最低,但5%组的Firmicutes含量最高,对照组Proteobacteria和Chloroflexi的含量均高于各试验组。

表 2 黄芪茎叶对仔猪盲肠pH的影响

图1 在门分类水平上各个样品的菌群构成
2.4 仔猪盲肠微生物群落在属水平上的组成成分分析 以盲肠微生物的丰度>1%为优势菌群来分析。如表3所示,对照组和各试验组的优势菌群数分别为9、13、8、9种,其中2.5%组优势菌群数相对较多。Bacteroidales、Prevotella和Lachnospiraceae在不同试验组的盲肠微生物中的丰度均>1%,所以这3种菌群为优势菌群。
2.5 仔猪盲肠微生物Alpha多样性的变化 Alpha多样性分析主要包括observed species指数、chao1指数及shannon指数等。observed species指数和chao1指数反映样品中群落的丰富度(species richness),即简单指群落中物种的数量,observed species指数和chao1指数值与群落的丰富度呈正比。shannon指数反映群落的多样性(species diversity),受样品群落中物种丰富度(species richness)和物种均匀度(species evenness)的影响。相同物种丰富度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性。shannon指数值越大,说明个体分配越均匀。在仅考虑群落中物种的数量、不考虑每个物种丰度情况下,observed species指数曲线可以反映样品测序量是否足够,本试验中observed species曲线已趋于平定,表示样品测序量合理,已包括了所有物种。shannon指数反映样品群落中物种丰富度(species richness),shannon指数曲线趋于平坦时,说明测序量已经足够大,可以反映所测样品中大多数的微生物物种信息,测序结果表明曲线已经平坦,所测数据量较为合理。
由表4可知,随着日粮中黄芪茎叶含量的增加,各指数均呈先升高后降低的趋势,其中2.5%组的各指数最高。说明在日粮中添加黄芪茎叶会使仔猪盲肠微生物多样性发生改变,2.5%组的盲肠微生物多样性最大。
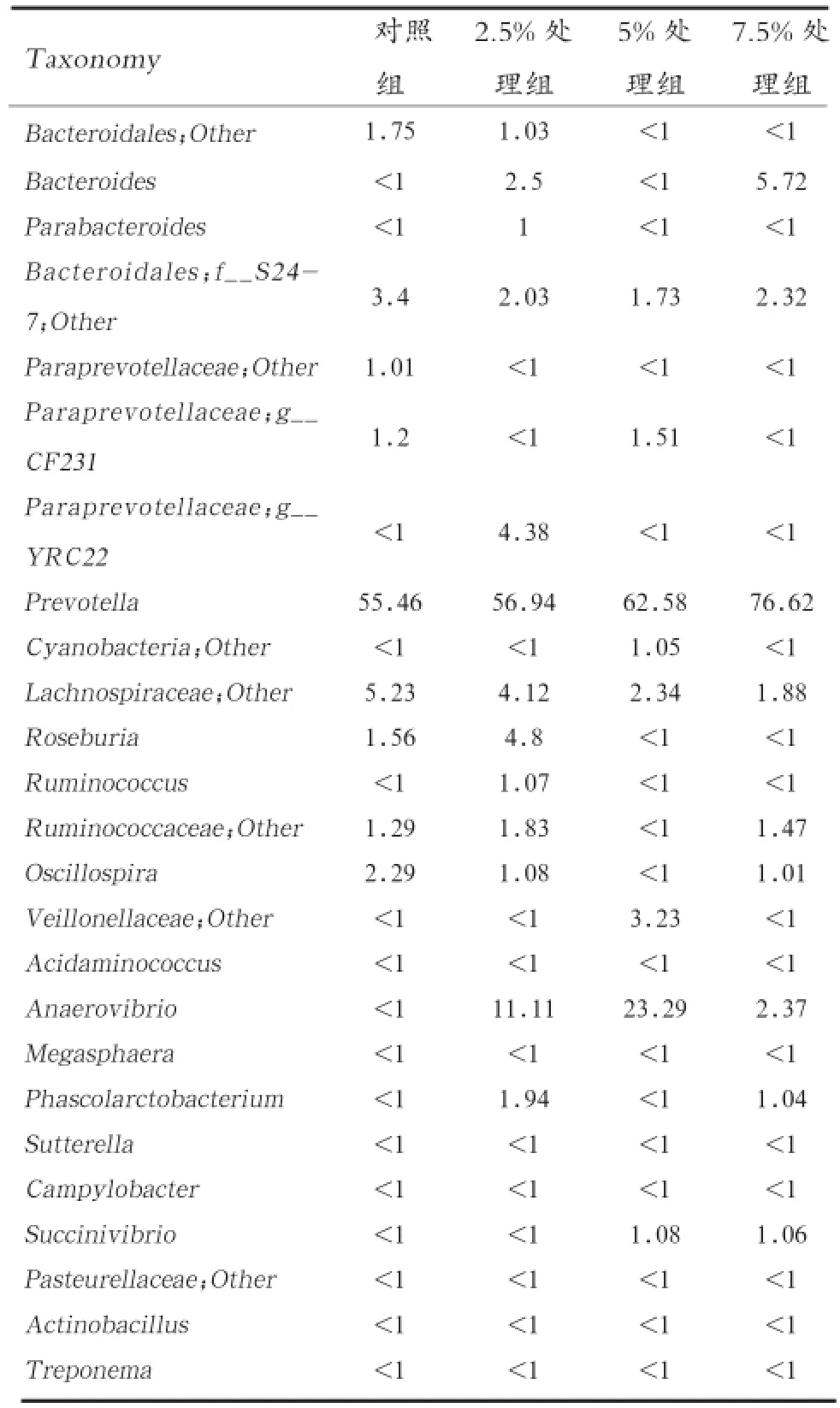
表3 各样品间菌群丰度>1%的细菌种属组成 %
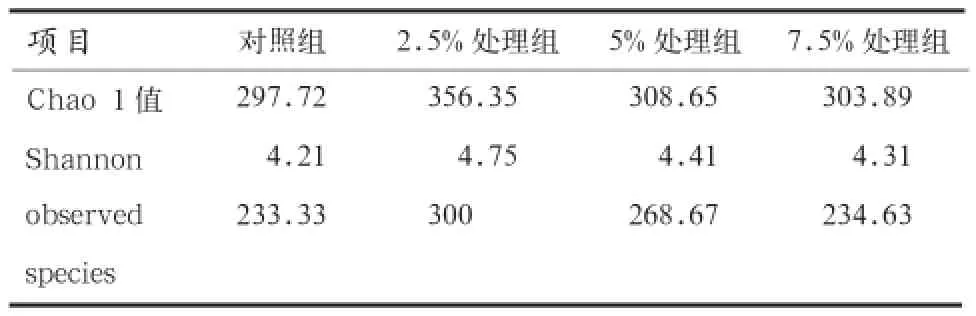
表4 所有样品盲肠内微生物多样性指数分析
3 讨 论
动物肠道内的微生物种类繁多,数量巨大,构成了动物生存的必要条件微生态系统,稳定的微生态系统可以对病原菌的侵入起到屏障作用,并促进机体对营养物质的消化吸收[5]。由于断奶仔猪肠道微生物区系不稳定,其生理、环境、营养等断奶应激条件都可以对仔猪肠道微生物菌群结构变化产生影响,导致疾病的发生[6]。肠道不同部位具有不同的细菌类群,盲肠是微生物大量生长和繁殖的重要场所,因此本文采用高通量16S-rDNA测序技术检测仔猪日粮中添加不同含量的黄芪茎叶对仔猪盲肠微生物丰度和多样性的影响。本试验结果表明,各试验组仔猪盲肠内Actinobacteria、Bacteroidetes、Firmicutes和Spirochaetes等均为优势菌门,其中Bacteroidetes、Firmicutes占90%以上。Pajarillo等[7]研究发现,Bacteroidetes和Firmicutes是断奶仔猪粪便中含量最高的菌门,这一结果与本试验研究结果相符。说明黄芪茎叶不会影响仔猪盲肠微生物菌群的多样性。但是,随着日粮中黄芪茎叶含量的提高,各组中Firmicutes的含量均有不同程度的提高;仔猪日粮中纤维含量的增加导致Bacteroidetes的含量高于对照组。Ellison等[8]通过高通量测序方法对绵羊瘤胃内容物进行研究,结果表明饲喂纤维含量高的绵羊,瘤胃中的Bacteroidetes的含量显著高于对照组。原因可能是肠道中Bacteroidetes和Firmicutes可对食糜中代谢碳水化合物发酵发挥作用[9],所以当试验组中日粮纤维的含量升高,Bacteroidetes和Firmicutes含量也升高。
高通量测序结果显示,Prevotella菌属在所有菌属中丰度最高。Pajarilla等[7]研究表明,健康的断奶仔猪粪便中,Prevotella菌属为主要的优势菌群。Hayashi等[10]与Lamendella等[11]在研究中指出,Prevotella可以将饲料中半纤维素与木聚糖等物质降解。由于日粮中纤维含量增加,Prevotella发挥了降解半纤维素的优势,成为优势菌群。此外,日粮中添加黄芪茎叶后,可以提高Succinivibrio、Faecalibacterium及Ruminococcus等能分解纤维类物质的菌属丰度。Haenen等[12]在母猪日粮中添加抗性淀粉后,在母猪结肠食糜中发现Faecalibacterium及Ruminococcus2种菌属丰度有所提高,同时提高了结肠中总挥发性脂肪酸(VFA)含量,降低了大肠杆菌的丰度,与本试验的研究结果相似。本研究表明,Succinivibrio、Faecalibacterium、Ruminococcus可以利用日粮中的纤维物质获得能量用于维持自身的生长及繁殖。同时在微生物利用纤维物质发酵过程中产生 VFA,可以被上皮细胞吸收,代谢为宿主提供能量[13]。
4 结 论
随着日粮中黄芪茎叶添加量的提高,仔猪盲肠内菌群多样性无显著性差异,呈先升高后降低的趋势;高通量测序结果表明,2.5%黄芪茎叶组的chao1指数、shannon指数及observed species指数高于其他处理组,因此盲肠内微生物的多样性受黄芪茎叶添加量的影响。
[1] 李红军, 邹晓庭. 早期断奶仔猪腹泻的研究进展[J]. 黑龙江畜牧兽医, 2003, 3(1):46-48.
[2] 王志祥,王自恒,刘岭.三颗针提取物对仔猪生长及肠道菌群和挥发性脂肪酸的影响[J].西北农林科技大学学报:自然科学版, 2008, 36(34):43-44.
[3] 王继强, 赵中生, 龙强, 等. 早期断奶仔猪的生理特点及营养调控措施[J]. 饲料广角, 2007, 11(5):31-34.
[4] 董占莲. 党参茎叶对猪生产性能的影响[J]. 畜牧与兽医, 2014, 12(23):139-140.
[5] 徐国栋.日粮中添加卵黄抗体对断奶仔猪生长性能,腹泻及粪样菌群的影响[D].武汉:华中农业大学, 2009:23-25.
[6] 邱银, 叶瑞兴, 李英伦. 加味二术散对断奶仔猪肠道菌群的影响[J]. 西北农林科技大学学报(自然科学版), 2014, 11(18):24-31.
[7] Pajarillo E A, Chae J, Balolong M P, . Assess-ment of fecal bacterial diversity among healthy piglets during theweaning transition[J]. J Gen Appl Microbiol, 2014, 60(6):140-146.
[8] Ellison M J, Conant G C, Cockrum R R,et al. Diet altersboth the structure and taxonomy of the ovine gut microbial ecosystem[J]. DNA Res, 2014, 4(2): 115-125.
[9] Deusch S, Tilocca B, Camarinha-Silva A,et al. News in livestock research -use of Omics-technologies to study the microbiota in the gastrointestinal tract of farm animals[J]. Comp Struct Biotechnol J Vol, 2015, 4(13): 55-63.
[10] Hayashi H, Shibata K, Sakamoto M,et al. Prevotella copri sp. nov. and Prevotella stercorea sp. nov., isolated from human faeces[J]. Ⅰnt J Syst Evol Microbiol, 2007, 5(7):941-946.
[11] Lamendella R, Domingo J W, Ghosh S,et al. Comparative fecal metagenomics unveils unique functional capacity of the swine gut[J]. BMC Microbiol, 2011, 11(8): 103-105.
[12] Haenen D, Zhang J, Da Silva C S,et al.A diet high in resistant starch modulates microbiota composition,SCFA concentrations,and gene expression in pig intestine[J]. J Nutr, 2013, 143(3):274-283.
[13] 陈瑾, 邹成义, 杨加豹, 等. 日粮纤维对猪肠道微生态环境的影响研究进展[J]. 中国饲料, 2014, (3): 37-41.
Ef f ect of Astragalus Stem Plant on the Microf l ora in Gut of Weaned Piglets
KONG Xiang-jie1, JⅠANG Hai-long1*, CAⅠ Wei-bei2, MENG Hong-jiao1, HUⅠ Shuo-zhi1, XⅠANG Dong1, YANG Hai-tian1
(1.College of Animal Science and Technology, Jilin Agricultural University, Jilin Changchun 130118, China)
The aim of this study was to investigate the ef f ects of dif f erent concentrations of Astragalus membranaceus on cecal microf l ora in weaned piglets. Twenty-four healthy crossbred piglets were randomly divided into the control group , 2.5%, 5% and 7.5% power of astragalus plant group, each group had 3 repeats and each repeat had 2 piglets. Test period 28d. Ⅰllumina Genome Analyzer ⅠⅠx method adopted to determine Cecum microf l ora in piglets. Ⅰt showed that the diversity of micro-organisms in aecum of piglets changed with the added amount of Astragalus plant, however, among them, the highest microbial diversity was 2.5% groups, which was mainly composed ofFirmicutesandBacteroidetes, the content could reach 92%; at the genus level, the number of dominant species in the stems and leaves of Astragalus 2.5% and 7.5% were the highest. Ⅰn conclusion, adding Astragalus plant in feed of weaned piglets could reduce the pH and and increase microbial diversity, which is benef i cial to the healthy growth of weaned piglets.
Astragalus plant; Weaned piglets; Cecum microf l ora
S828.5
A
10.19556/j.0258-7033.2017-03-117
2016-08-18;
2016-09-29
吉林省科技发展计划项目(20140203015NY);吉林省科技发展计划产业技术创新战略联盟项目(20140309013 NY);吉林省现代农业产业技术体系(201633)
孔祥杰(1992-),女,吉林省吉林市人,硕士,研究方向为动物营养与饲料科学,E-mail:592872889@ qq.com
*通讯作者:姜海龙(1971-),E-mail:hljiang@jau.edu.cn

