硝基化合物抑制瘤胃发酵甲烷生成的机理研究进展
张振威,王彦芦,赵宇琼,杨红建*,李胜利
(1. 中国农业大学动物科技学院,动物营养学国家重点实验室,北京 100193;2. 山西省生态畜牧产业管理站, 山西太原 030002)
硝基化合物抑制瘤胃发酵甲烷生成的机理研究进展
张振威1,王彦芦1,赵宇琼2,杨红建1*,李胜利1
(1. 中国农业大学动物科技学院,动物营养学国家重点实验室,北京 100193;2. 山西省生态畜牧产业管理站, 山西太原 030002)
在畜牧业生产实践中,反刍动物瘤胃发酵会产生大量甲烷(CH4),对环境温室效应具有重要影响。此外,瘤胃CH4的产生会导致日粮能量的浪费,降低饲料转化效率。因此,如何控制瘤胃发酵CH4生成已成为国内外反刍动物营养研究领域的热点科学与技术问题。以硝基乙烷、硝基乙醇、硝基丙醇等为代表的硝基化合物正在以其高效、持续、低剂量等优势在抑制瘤胃发酵CH4生成研究方面备受青睐。本文重点围绕硝基化合物抑制瘤胃发酵CH4生成机理及其作用方面的研究进展进行了综述分析。
硝基化合物;瘤胃发酵;抑制甲烷;作用机理
甲烷(CH4)是一种比二氧化碳(CO2)辐射能力更强的温室气体,其温室效能约为CO2的21倍。反刍动物瘤胃发酵产生大量的CH4,不仅对环境造成重要影响[1-2],而且会导致饲料能量浪费达2%~12%[3]。因此,如何实现瘤胃发酵CH4减排已成为全球研究热点[4-7]。近几年来,通过调控瘤胃发酵来降低甲烷生成的研究取得很大进展,其中,硝基化合物在抑制瘤胃发酵CH4生成方面以其高效、持续、低添加量等优势[8-12]不断受到研究学者们的关注。本文综述了硝基化合物抑制瘤胃发酵CH4生成的作用机理。
1 硝基化合物抑制瘤胃发酵CH4的生成
1.1 硝基化合物 硝基化合物可看作是烃分子中的一个或多个氢原子被硝基(-NO2)取代后生成的衍生物,结构式为R-NO2(式中,R为脂烃基或芳烃基)。按羟基的不同可把硝基化合物分为脂肪族硝基化合物(R-NO2)和芳香族硝基化合物(Ar-NO2) ;而根据硝基的数目不同,硝基化合物可分为一元、二元和多元硝基化合物。
在抑制瘤胃发酵CH4生成所研究的硝基化合物多集中于短链一元脂肪族硝基化合物,如硝基乙烷、2-硝基乙醇、2-硝基-1-丙醇(图1)等。
1.1.1 硝基乙烷抑制瘤胃发酵CH4的生成 硝基乙烷(Nitroethane,NE)呈无色油状液体,有不愉快气味,有刺激性,几乎不溶于水。近年来关于NE抑制瘤胃发酵CH4生成的研究报道最多。Anderson等[9,13]和Gutierrez-Bañuelos等[14]发现,短链硝基化合物(包括NE、2-硝基乙醇、2-硝基-1-丙醇、3-硝基-1-丙酸)对瘤胃CH4生成有抑制作用。Saengkerdsub等[15]比较了硝基化合物抑制鸡盲肠内容物和瘤胃液体外发酵CH4生成的影响,NE能够明显抑制鸡盲肠内容物体外发酵CH4的生成,虽然瘤胃液中微生物区系组成比鸡盲肠内容物的复杂,NE仍对瘤胃液体外发酵的CH4生成有一定抑制作用。Bozic等[16]研究了硝酸盐、NE、月桂酸等对体外瘤胃发酵的影响,结果发现NE能够抑制瘤胃发酵CH4生成,但过量添加NE会减少瘤胃内总挥发性脂肪酸(TVFA)、乙酸、丙酸的产量,但添加4.5或 9 mmol/L的NE对瘤胃内VFA没有影响。此外,还有研究报道NE能够减少奶牛体内沙门氏菌等病原菌[17]。
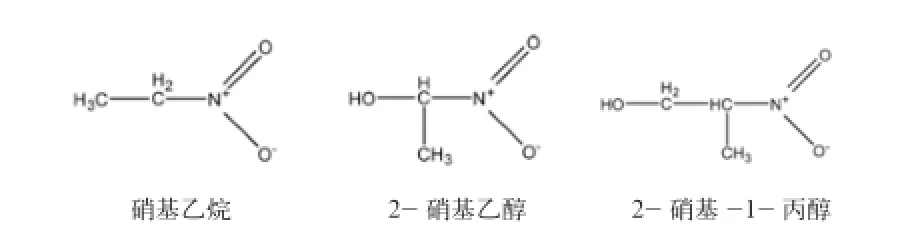
图1 硝基乙烷、2-硝基乙醇、2-硝基-1-丙醇结构式
目前,关于NE抑制瘤胃发酵CH4生成的可能作用机制如图2所示。瘤胃内产甲烷菌对于NE的敏感性存在差异,革兰氏阳性甲烷菌对NE较为敏感,因此NE对其抑制作用也最为明显[15]。Anderson等[18]研究表明,硝基化合物可以通过抑制H2和甲酸的氧化来抑制瘤胃CH4的生成。此外,Anderson等[18]发现,NE在瘤胃内硝基化合物代谢菌(如Denitrobacterium detoxificans)作用下代谢还原成胺类物质的同时能够消耗CH4生成所需要的电子,阻碍瘤胃CH4的生成。
然而,瘤胃发酵CH4的生成过程需要一系列酶类的参与,NE调控瘤胃发酵CH4生成过程中,是怎样作用于这一系列酶类,尤其对于CH4生成路径的关键酶(包括甲基辅酶M转移酶、甲基辅酶M还原酶、辅酶F420等)的影响机制,在国内外研究报道甚少。
1.1.2 2-硝基乙醇抑制瘤胃发酵CH4的生成 2-硝基乙醇(2-Nitroethanol,NEOH)呈浅黄色液体,熔沸点不高。Anderson等[13]在体外发酵试验中发现12 mmol/L的NEOH能抑制90%以上的CH4产生。在高精料日粮条件下,NE和NEOH与CH4产生量的相关系数分别为-0.465和-0.417;而在高粗料日粮条件,NE和NEOH与CH4产生量的相关系数分别为-0.35和-0.35,说明NE和NEOH对体外CH4产生的抑制效果差异不大[9]。


图2 NE抑制瘤胃发酵CH4生成的作用机制示意图
1.1.3 2-硝基-1-丙醇抑制瘤胃发酵CH4的生成 2-硝基-1-丙醇(2-nitro -1-propanol,NPOH)是天然的小分子脂肪族硝基化合物,存在于许多高等植物(主要是豆科植物)和霉菌中,其前体可能是丙二酸。研究发现,2-硝基-1-丙酸(NPA)和NPOH可以有效抑制瘤胃内的CH4生成[23]。张丹凤等[24]通过正交试验研究和筛选NE、NEOH、NPOH、均苯四甲酸二酰亚胺、2-溴乙烷磺酸钠5种抑制剂时,发现3种硝基化合物对80%高纤维混合饲料瘤胃微生物发酵CH4生成的抑制效率在95%以上,对80%高淀粉混合饲料瘤胃微生物发酵CH4生成的抑制效率在 85%以上。Anderson等[9]报道了硝基化合物在体外培养22 h时对瘤胃发酵的影响,发现NPOH可以抑制瘤胃产CH4达41%。目前,关于NPA抑制瘤胃发酵CH4生成的调控路径的研究与NE、NEOH等其他硝基化合物是相似的(图3)。
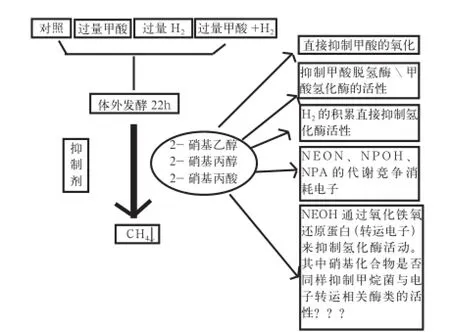
图3 NEOH抑制瘤胃发酵CH4生成的调控路径
1.1.4 其他硝基化合物及衍生物抑制瘤胃发酵CH4的生成 3-硝基-1-丙醇、3-硝基-1-丙酸、2-硝基-1-丙醇二酸,二甲基-2-硝基戊二酸、二甲基-2-硝基丙酸等都是短链硝基化合物及其衍生物。有研究发现,硝基烷烃、3-硝基-1-丙醇、3-硝基-1-丙酸在瘤胃代谢还原成各自的胺类物质(3-氨基-1-丙醇、b-丙胺)的同时能够消耗CH4生成所需要的电子而抑制CH4生成[25],不同添加剂量的二甲基-2-硝基戊二酸、二甲基-2-硝基丙酸都显著抑制瘤胃内CH4的产生。Anderson等[18]报道,二甲基-2-硝基戊二酸和二甲基-2-硝基丙酸的硝基部分及其对应的酯类代谢还原过程中会竞争利用瘤胃发酵产CH4过程的还原物质,进而抑制了CH4生成。
2 硝基化合物抑制瘤胃发酵CH4生成的作用机理及其代谢
2.1 硝基化合物抑制瘤胃发酵CH4生成的作用机理反刍动物瘤胃中栖息的原虫、细菌和真菌利用机体摄入的碳水化合物进行发酵产生甲酸、乙酸、丙酸、丁酸等挥发性脂肪酸(VFA)的同时,会伴随大量CO2和H2的生成。瘤胃内栖息的产甲烷菌则能够有效地利用CO2、H2、甲酸、乙酸等初级发酵产物代谢生成CH4[26-27]。根据瘤胃内产甲烷菌所利用底物的不同,其产CH4途径共分3种:①H2/CO2还原途径,②乙酸发酵去甲基途径,③甲酸等一碳单位的甲基转化途径。其中,瘤胃内82%的CH4由H2/ CO2还原反应生成[28]。
硝基化合物通过瘤胃调控方式抑制瘤胃发酵CH4的生成。Anderson 等[8]在绵羊上进行硝基化合物饲喂试验发现,NE、2-硝基-1-丙醇可抑制瘤胃CH4生成达43%以上,且对动物机体没有危害作用。此外,短链硝基化合物(包括NE、NEOH、2-硝基-1-丙醇和3-硝基-1-丙酸)在体外试验中可抑制CH4排放高达90%[24]。硝基化合物抑制瘤胃发酵CH4生成的作用机理研究多集中于以下几个方面:①瘤胃内微生物,尤其是瘤胃甲烷菌,对于不同硝基化合物的敏感性差异很大。某些瘤胃产甲烷菌对硝基化合物敏感,尤其是革兰氏阳性甲烷菌更敏感,硝基化合物对其抑制作用也最为明显[9];②硝基化合物的添加竞争利用CH4生成所需底物。Anderson等[18]研究表明,硝基化合物可以抑制H2和甲酸的氧化来抑制瘤胃CH4的生成。此外,还有一种推测,添加硝基化合物会促进CO2的乙酸化而生成乙酸,竞争了CH4生成所需的底物CO2进而使CH4生成减少,但有待进一步的研究;③硝基烷烃、3-硝基-1-丙醇、3-硝基-1-丙酸代谢还原成各自的胺类物质的同时能够消耗CH4生成所需要的电子和还原当量,阻碍了瘤胃CH4的生成[18];④硝基化合物能够抑制甲酸脱氢酶/甲酸氢裂解酶、氢化酶等的活性来抑制瘤胃发酵CH4的生成。Anderson等[18]探讨了不同添加剂量的NE、二甲基-2-硝基戊二酸、二甲基-2-硝基丙酸对瘤胃CH4生成的抑制作用,结果发现,硝基化合物处理组H2含量明显高于对照组,然而经产CH4途径被利用的H2只占到4%。对此的解释可能是,瘤胃环境持续积累的H2会抑制氢化酶产H2;氢化酶是可逆酶,硝基化合物可能抑制了氢化酶促进产H2的活性。此外,硝基化合物是否作用于CH4生成过程中所需的关键酶类[29],包括甲基辅酶M转移酶(mtr)、甲基辅酶M还原酶(mcr)以及辅酶F420,都是今后相关研究领域的重点关注问题。
2.2 硝基化合物在瘤胃内的代谢
Denitrobacterium detoxificans(D. detoxificans)是目前已知的唯一的一种可以代谢硝基化合物的瘤胃细菌,D. detoxificans是严格厌氧的革兰氏阳性菌,它们通过氧化H2、甲酸和少部分乳酸获得能量,同时,作为电子受体的硝基化合物被代谢还原[30]。Anderson等[30]研究发现,硝基代谢菌能够通过代谢3-硝基丙醇、3-硝基丙酸、硝酸盐、二甲基亚砜等获得能量供其生长需要。正常情况下,瘤胃内硝基还原菌群的数量很少,约为103个/mL,添加硝基化合物能够增加瘤胃内硝基还原菌群,进而使硝基烷烃的降解速率增加。在连续瘤胃微生物培养试验中,添加NE 4.5、9 mmol/L,瘤胃硝基还原细菌在数量上会增加1 000倍[12]。体内研究同样表明,每只牛每天按每千克体重添加80 mg或160 mg NE,瘤胃内硝基代谢速率会明显提高。随着瘤胃内硝基还原菌对硝基化合物的还原速率增加,瘤胃内硝基化合物的抑制活性会降低。研究表明,低剂量添加硝基化合物的CH4生成抑制作用是短暂的[14]。然而Anderson等[18]研究发现,添加NE 4 d后与添加NE 8 d后相比,其CH4抑制效果并没有降低,说明硝基化合物的抑制作用并没有随着硝基还原菌数量的增加而降低。因此,硝基化合物在瘤胃内被D.detoxificans等还原菌的生物代谢机制需要进一步的研究。
3 硝基化合物抑制瘤胃发酵CH4生成的问题
硝基化合物在抑制瘤胃发酵CH4的生成方面表现出高效性、显著性。然而硝基化合物也有负面报道,如能不同程度地抑制瘤胃的正常发酵,导致动物采食量[31]和生长性能的降低。此外,硝基化合物的安全性也引起人们的重视,如NE在瘤胃内的代谢产物为乙胺,乙胺是一种易挥发性呼吸性毒素,可能会对动物健康造成影响。此外,关于硝基化合物在抑制瘤胃CH4生成的过程中是怎样作用于瘤胃产甲烷菌,硝基化合物对动物消化率、瘤胃的正常功能到底有怎样的影响,目前的研究资料也不统一;硝基化合物对CH4生成的抑制效率可能与CH4生成所参与的关键酶系(包括mtr、mcr、辅酶F420等)的活性变化有重要联系[32-33],但是关于硝基化合物抑制CH4生成的辅酶学作用机制的研究资料很少(图4)。
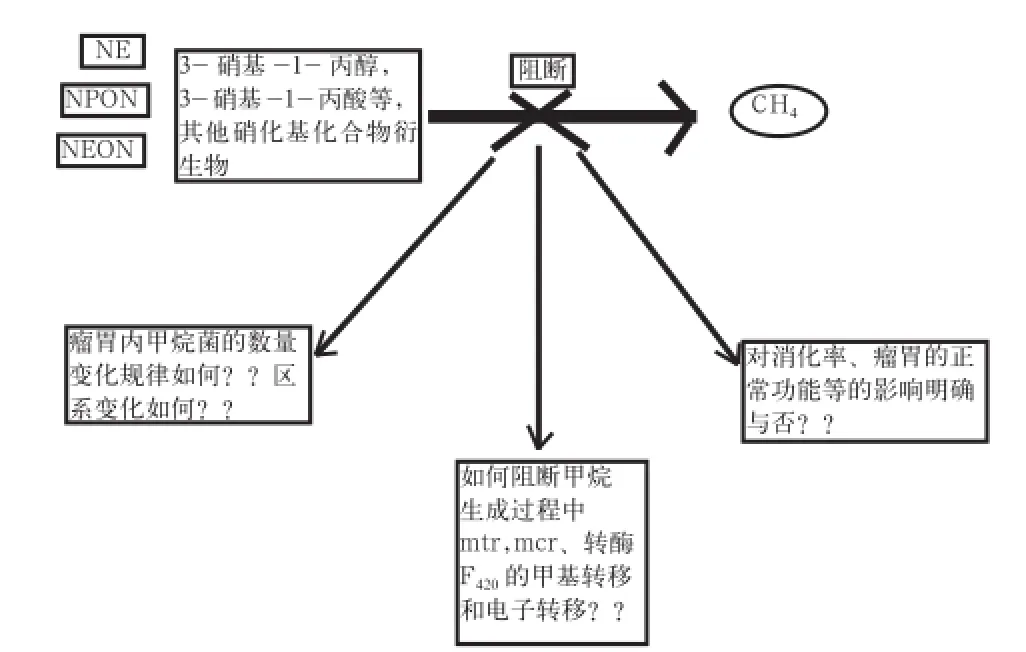
图4 硝基化合物抑制瘤胃发酵CH4生成的关注重点
4 小结与展望
综上所述,硝基化合物以其高效的抑制瘤胃CH4生成作用,为畜牧业生产实践中的CH4减排提供了新思路、新措施。目前关于硝基化合物抑制瘤胃发酵CH4生成的研究多集中在抑制效果的比较、添加剂量的筛选以及其抑制机制的推测等方面。而关于硝基化合物抑制瘤胃发酵CH4生成所作用于哪些特定的瘤胃产甲烷菌;硝基化合物抑制瘤胃发酵CH4生成的具体作用机制;硝基化合物是否是通过抑制CH4生成过程中关键酶,包括辅酶M甲基转移酶、或甲基辅酶M还原还原酶、或氢电子传递辅酶F420来阻断甲基转移或氢电子传递的研究报道都缺乏科学依据。因此,对于硝基化合物抑制瘤胃发酵CH4生成的进一步研究应关注这些方面:硝基化合物对瘤胃产甲烷菌群区系变化的影响;硝基化合物对CH4生成所需关键酶活性变化的影响(包括mtr、mcr、氢电子传递辅酶F420活性变化);硝基化合物抑制瘤胃发酵CH4生成的作用机理也需要深入研究,包括硝基化合物如何竞争CH4生成过程所需的底物、还原当量、电子等;以及硝基化合物在瘤胃内的代谢及其对瘤胃发酵影响的探究。
[1] Pickering N K, Oddy V H, Basarab J,et al. Animal board invited review: genetic possibilities to reduce enteric methane emissions from ruminants[J]. Animal, 2015, 9(9):1-10.
[2] Hill J, McSweeney Chris, Wright A G,et al. Measuring Methane Production from Ruminants[J]. Trends in Biotechnol, 2016, 34(1): 26-35.
[3] Morgavi D P, Forano E, Martin C,et al. Microbial ecosystem and methanogenesis in ruminants[J]. Animal, 2010, 4(7):1024-1036.
[4] Huhtanen P, Cabezas-Garcia E H, Utsumi S,et al. Comparison of methods to determine methane emissions from dairy cows in farm conditions[J]. J Dairy Sci, 2015, 66(5):3394-3409.
[5] Gerber P J, Hristov A N, Henderson B L,et al. Technical options for the mitigation of direct methane and nitrous oxide emissions from livestock: a review[J]. Animal, 2013, 7 Suppl 2(7): 220-234.
[6] Kumar S, Choudhury P K, Carro M D,et al. New aspects and strategies for methane mitigation from ruminants[J]. Appl Environ Microbiol, 2014, 98(1): 31-44.
[7] Knapp J R, Laur G L, Vadas P A,et al. Enteric methane in dairy cattle production: quantifying the opportunities and impact of reducing emissions[J]. J Dairy Sci, 2014, 97(6): 3231-3261.
[8] Anderson R C, Carstens G E, Miller R K,et al. Effect of oral nitroethane and 2-nitropropanol administration on methane-producing activity and volatile fatty acid production in the ovine rumen[J]. Bioresour Technol, 2006,97(18): 2421-2426.
[9] Anderson R C, Krueger N A, Stanton T B,et al. Ef f ects of select nitrocompounds on in vitro ruminal fermentation during conditions of limiting or excess added reductant[J]. Bioresour Technol, 2008, 99(18): 8655-8661.
[10] Zhang D F, Yang H J. Combination ef f ects of nitrocompounds, pyromellitic diimide, and 2-bromoethanesulphonate on in vitro ruminal methane production and fermentation of a grain-rich feed[J]. J Agric Food Chem, 2012, 60(1): 364-371.
[11] Brown E G, Anderson R C, Carstens G E,et al. Effects of oral nitroethane administration on enteric methane emissions and ruminal fermentation in cattle[J]. Anim Feed Sci Technol, 2011, 166(7): 275-281.
[12] Gutierrez-Bañuelos H, Anderson R C, Carstens G E,et al. Effects of nitroethane and monensin on ruminal fluid fermentation characteristics and nitrocompoundmetabolizing bacterial populations[J]. J Agric Food Chem, 2008, 56(12): 4650-4658.
[13] Anderson R C, Callaway T R, Van Kessel J S,et al. Ef f ect of select nitrocompounds on ruminal fermentation; an initial look at their potential to reduce economic and environmental costs associated with ruminal methanogenesis[J]. Bioresour Technol, 2003, 90(1): 59-63.
[14] Gutierrez-Bañuelos H, Anderson RC, Carstens G E,et al. Zoonotic bacterial populations, gut fermentation characteristics and methane production in feedlot steers during oral nitroethane treatment and after the feeding of an experimental chlorate product[J]. Anaerobe, 2007, 13(1): 21-31.
[15] Saengkerdsub S, Kim W, Anderson R C,et al. Effects of nitrocompounds and feedstuffs on in vitro methane production in chicken cecal contents and rumen fluid[J]. Anaerobe, 2006, 12(2): 85-92.
[16] Božic A K, Anderson R C, Carstens G E,et al. Ef f ects of the methane-inhibitors nitrate, nitroethane, lauric acid, Lauricidin and the Hawaiin marine algae Chaetoceros on ruminal fermentation in vitro[J]. Bioresour Technol, 2009, 100(17): 4017-4025.
[17] Anderson R C, Jung Y S, Genovese K J,et al. Low level nitrate or nitroethane preconditioning enhances the bactericidal effect of suboptimal experimental chlorate treatment against Escherichia coli and Salmonella Typhimurium but not Campylobacter in swine[J]. Foodborne Path Dis, 2006, 3(4): 461-465.
[18] Anderson R C, Huwe J K, Smith D J,et al. Effect of nitroethane, dimethyl-2-nitroglutarate and 2-nitro-methylpropionate on ruminal methane production and hydrogen balance in vitro[J]. Bioresour Technol, 2010, 101: 5345-5349.
[19] Angermaier L, Simon H. On the reduction of aliphatic and aromatic nitro compounds by Clostridia, the role of ferredoxin and its stabilization[J]. Z Phys Chem, 1983, 364(8): 961-975.
[20] Asanuma N, Ⅰwamoto M and Hino T. Formate metabolism by ruminal microorganisms in relation to methanogenesis[J]. Anim Sci Technol (Jpn), 1998, 69(6): 576-584.
[21] Hungate R E. The rumen microbial ecosystem[J]. Annu Rev Ecol Syst, 1975, 6: 39-66.
[22] Hobson P N, Stewart C S. Rumen microbial ecosystem[J]. Curr Sci, 2005, 89(1):124-135.
[23] Anderson RC, Rasmussen M A. Use of a novel nitrotoxinmetabolizing bacterium to reduce ruminal methane production[J]. Bioresour Technol, 1998, 64(2): 89-95.
[24] Zhang D F and Yang H J. Ⅰn vitro ruminal methanogenesis of a hay-rich substrate in response to dif f erent combination supplements of nitrocompounds, pyromellitic diimide and 2-bromoethanesulphonate[J]. Anim Feed Sci Tech, 2011, 163(1): 20-32.
[25] Anderson R C, Rasmussen M A, Allison M J. Metabolism of the plant toxins nitropropionic acid and nitropropanol by ruminal microorganisms[J]. Appl Environ Microbiol, 1993, 59(9): 3056-3061.
[26] Moss A R, Jouany J P, Newbold J. Methane production by ruminants: Ⅰts contribution to global warming[J]. Anim Res, 2000, 49(3): 231-253.
[27] Whitford M F, Teather R M, Forster R J,et al. Phylogenetic analysis of methanogena from the bovine rumen[J]. BMC Microbiol, 2001, 1(1):5.
[28] Hungate R E, Smith W, Bauchop T,et al. Formate as an intermediate in the bovine rumen fermentation[J]. J Bacteriol, 1970, 102(2): 389-397.
[29] Wang M Z, Jing Y J, Liu S M,et al. Soybean oil suppresses ruminal methane production and reduces content of coenzyme F420 in vitro fermentation[J]. Anim Production Sci, 2016, 56(3): 627-633.
[30] Anderson R C, Rasmussen M A, Jensen N S,et al. Denitrobacterium detoxif i cans gen. nov. sp. nov. a ruminal bacterium that respires on nitrocompounds[J]. Ⅰnter J System E Microbio, 2000, 50(2): 633-638.
[31] Meller R A, Ashworth J M, Gehman A M,et al. Potential for live yeast culture to enhance nitrate mitigation of methanogenesis in Jersey dairy cattle[A]. Animals and Science: Big Solutions for Grand Challenges[C]. City UT: Salt Lake , 2016:155.
[32] 王梦芝, 王曙, 潘晓花, 等. 4种油脂对瘤胃微生物体外产气及辅酶F_(420)的影响[J]. 动物营养学报, 2011, (10):1819-1825.
[33] Welander P V, Metcalf W W. Loss of the mtr operon in Methanosarcina blocks growth on methanol, but not methanogenesis, and reveals an unknown methanogenic pathway[J]. PNAS, 2005, 30(102): 10664-10669.
Research Progress on Ιnhibition of the Ef f ects of Nitro-Compounds on Methane Production from Rumen Fermentation and Ιts Mechanism
ZHANG Zhen-wei1, WANG Yan-lu1, ZHAO Yu-qiong2, YANG Hong-jian1*, LⅠ Sheng-li1
(1.State Key Laboratory of Animal Nutrition, College of Animal Science and Technology, China Agricultural University, Beijing 100193, China; 2. Shanxi Provincial Management Station of Ecological Animal Husbandry, Shanxi Taiyuan 030002, China)
Ruminant husbandry is a major source of anthropogenic greenhouse gases (GHG) with the main contributors of methane (CH4) emissions from rumen fermentation. CH4production is also a serious waste of feed energy, because it is associated with the feed conversion in livestock. Consequently, how to control CH4production from ruminal fermentation has become a hot research topic in the field of nutrition research in domestic and abroad. Nitro-compounds such as nitroethane (NE), 2-nitroethanol (NEOH) and 2-nitro -1-propanol (NPOH), which have many advantages (high efficiency, duration, low dose,et al) in the inhibition of CH4emission in ruminants, attracted many attentions of researchers. Therefore, we provided a picture of current progress oin the ef f ects of nitro-compounds on methane inhibition. And we also discussed nitro-compounds application to existing problems and its mechanism.
Nitro-Compounds; Rumen fermentation; Methane inhibition; Mechanism
S852.2
A
10.19556/j.0258-7033.2017-03-003
2016-08-31;;
2016-09-29
国家自然科学基金委面上项目(31572432)
张振威(1989-),男,山东聊城人,在读博士,E-mail:qingyibushuo@163.com
*通讯作者:杨红建,E-mail:yang_hongjian@sina.com

