Li2MeO3阴极电化学研究综述
黄振萍,王振伟,李晓伟,徐艳辉,
(1.南通师范高等专科学校,南通;2.山东齐星新材料科技有限公司, 邹平 256200 3.苏州大学物理与光电·能源学部,苏州 215006)
1 前言
和其它化学电源体系相比,锂离子电池体系比较复杂。Ni-MH电池正极只有两种体系,即α-Ni(OH)2/γ-NiOOH体系以及β-Ni(OH)2/β-NiOOH体系,负极是LiNi5系列,电解液则是KOH水溶液。可能作为锂离子电池正极和负极的候选材料体系很多,尤其是正极,包括了橄榄石系列、硫酸盐系列、硫化物系列、硅酸盐系列等等。其中关于Li2MeO3(Me为过渡金属离子)的综述比较少。该系列材料的实用价值并不大,直接作为电极活性材料使用的可能性很小,但是,对该系列材料的研究可以帮助我们从理论上分析相关嵌锂材料的电化学脱嵌锂机理,例如,Li2MnO3的研究有助于对富锂层状锰基系列材料脱嵌锂机理的研究。
因此,本文综述了Li2MeO3的研究现状。
2 结晶结构
Li2MeO3中Me的价态为+4,其结晶结构与Me4+离子半径相关[1],如图1所示,Ru4+的离子半径接近单斜与Rhombohedral结构的边界,Pt和Ir恰好位于边界上,所以可以预料Li2MO3(M=Ru、Ir和Pt)的结构稳定性不是很好,比较难合成出纯相。事实上Li2MeO3结构与LiMeO2的类似,可以写成Li(Li1/3Me2/3)O2,可以看成Me层中1/3的Me被Li取代的结果。

图1 Li2MO3组成的晶格对称性与M4+离子半径的关系
3 Li2IrO3
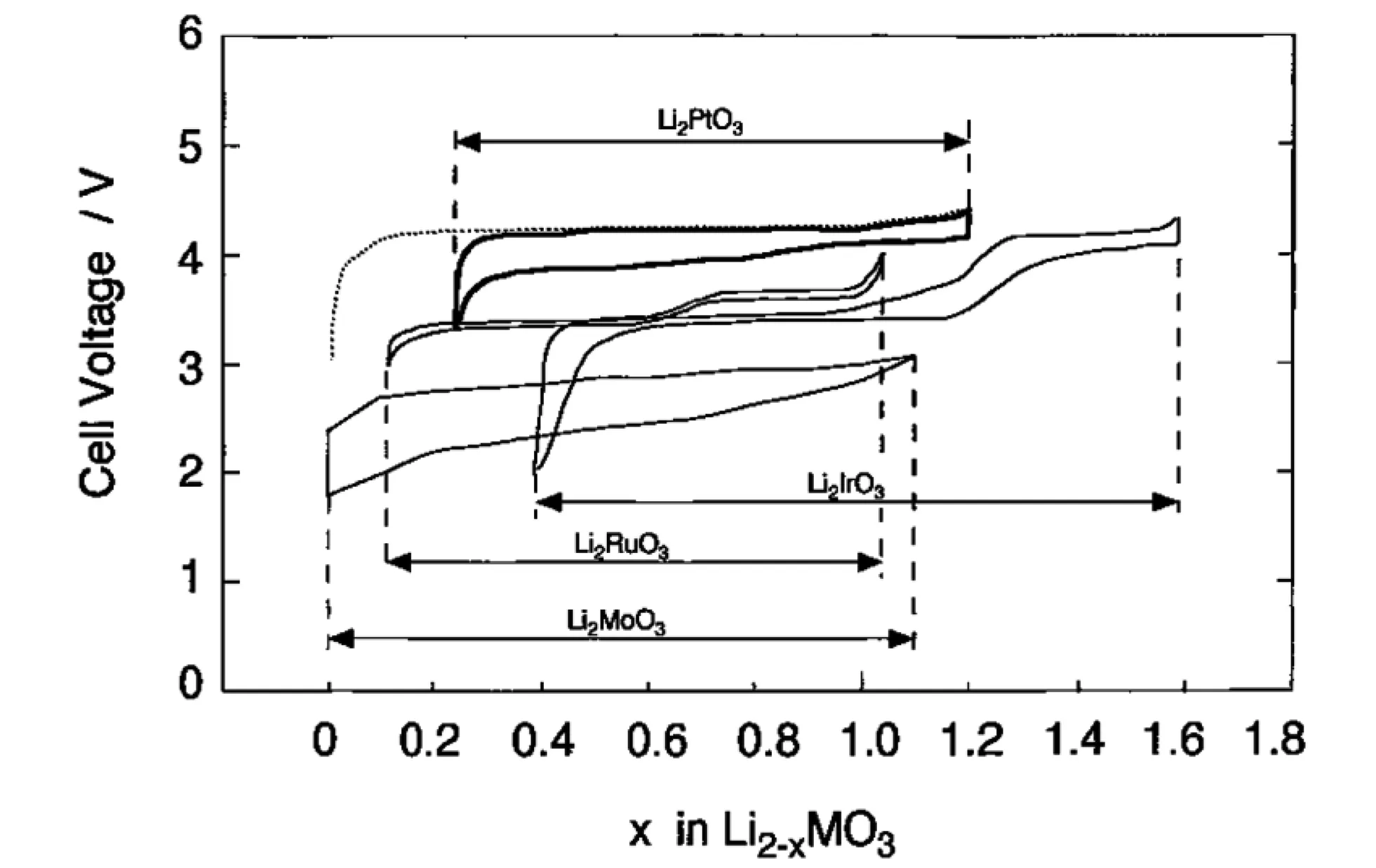
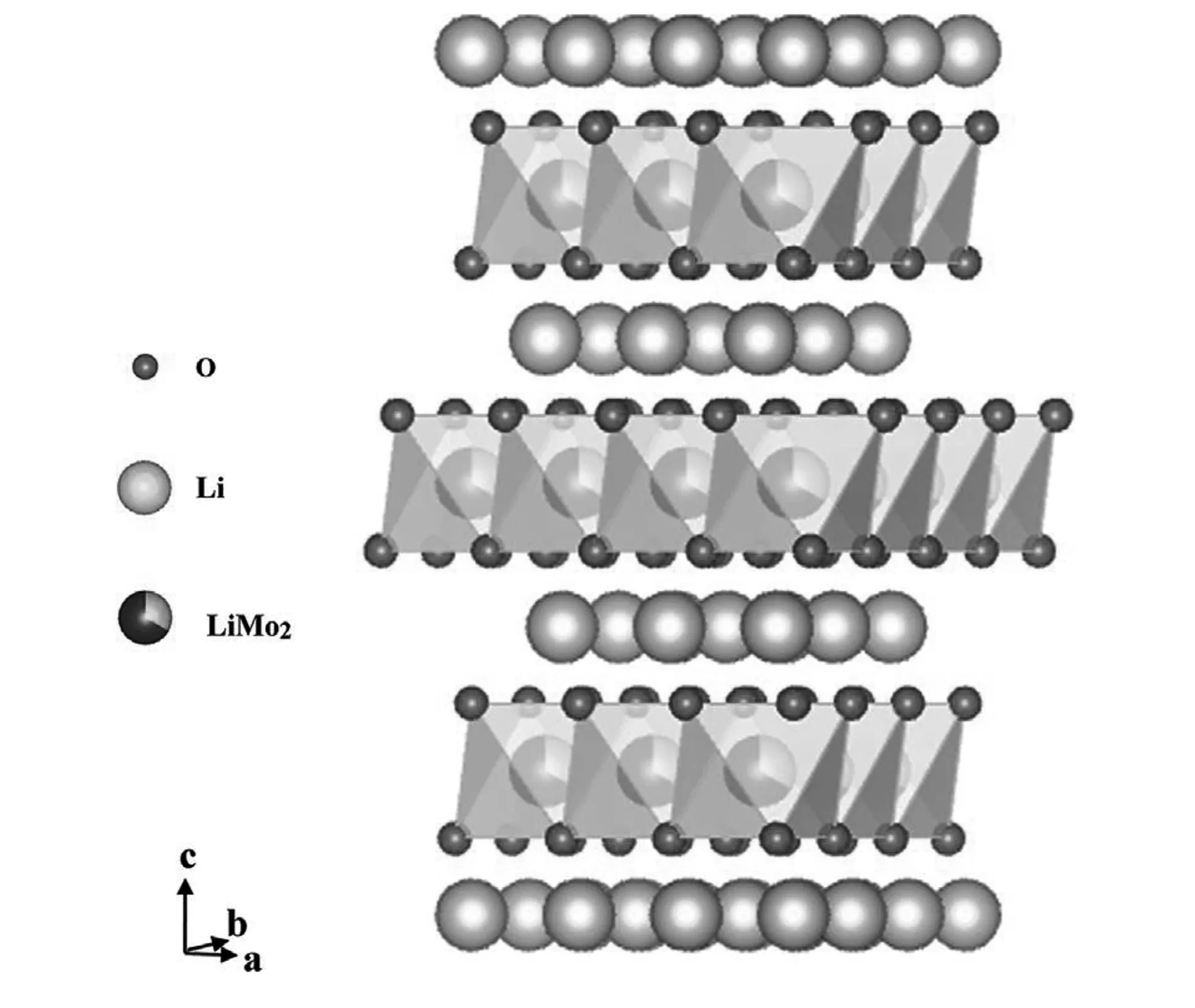
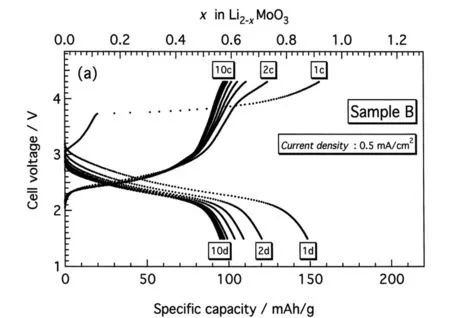
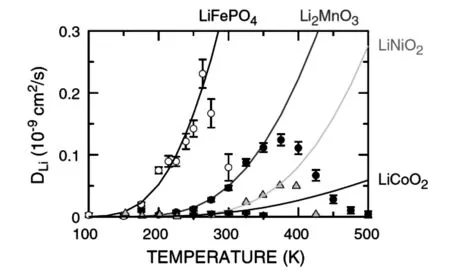
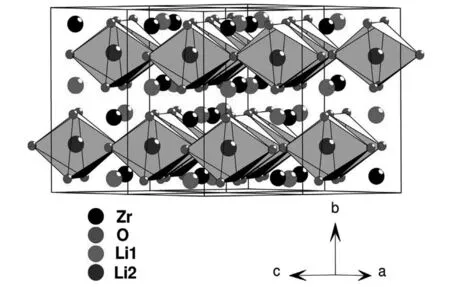
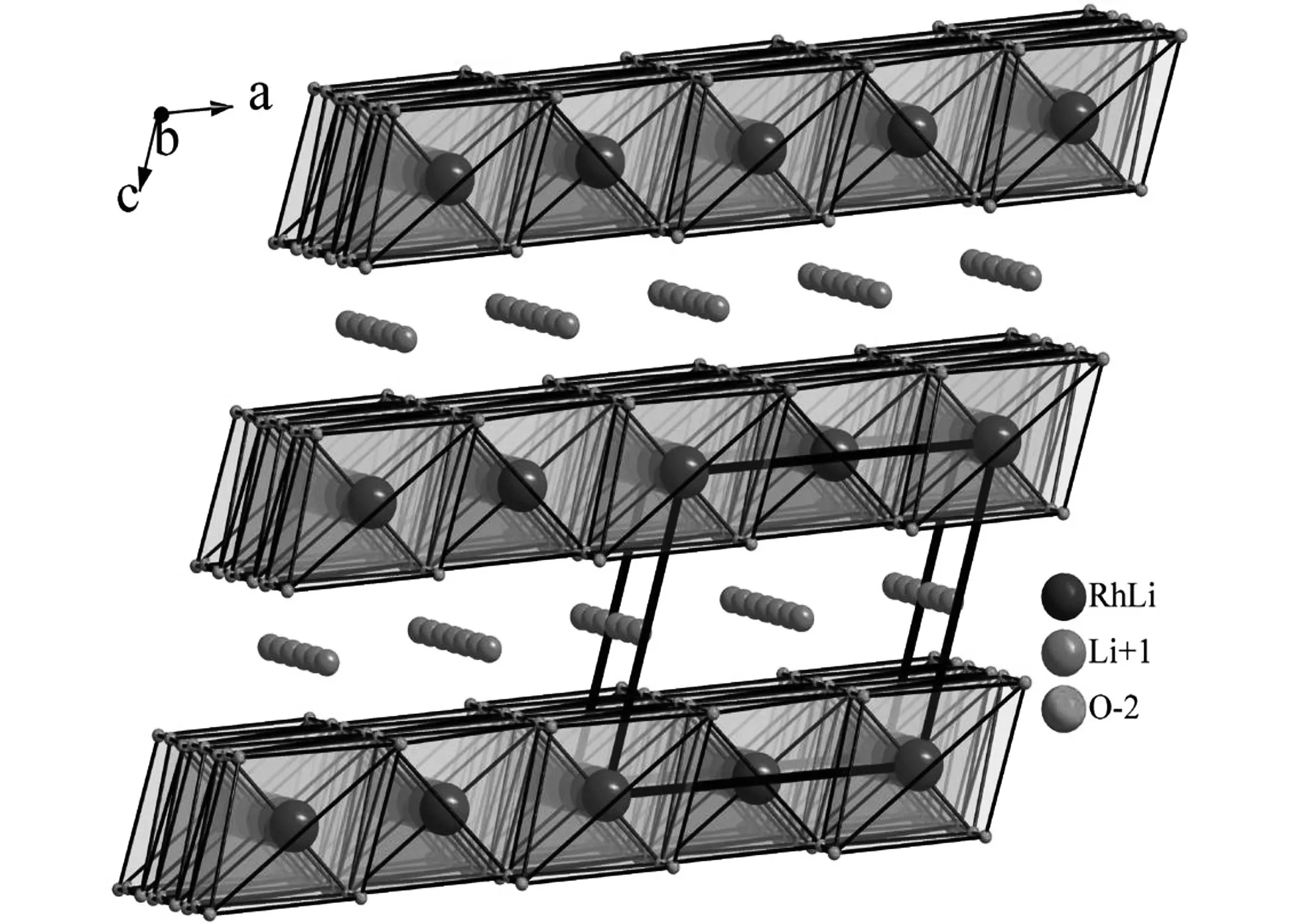
Rhomboheral 结晶结构,理论计算认为Li2IrO3嵌入电位为3.2V~4.1V,纯相带隙大约为1eV,具有半导体特性,锂离子的扩散是三维扩散,迁移能载为0.24eV~0.81eV,3.0V~4.4V范围实际容量有135mAh/g,3.0V~4.2V范围实际容量为100mAh/g;Li2-xIrO3中,0 不同电压上限时的充放电曲线,如图2所示[1, 3],位于3.5V的平台容量接近80mAh/g,电压平台很平,充放电曲线之间的滞后很小,可逆性很高,容量偏小不适合于经典应用领域,但是也许可以用于微电池领域。 图2 Li2IrO3充放电曲线图,2.0V~4.4V(左图)和3.0V~4.2V(右图)[1,3] 关于该材料的精细结构,还存在争论。也有认为[3]是准六方晶系结构, 单胞参数为a=0.5169nm, c=1.1164nm。 Li2PtO3为黄色粉末,六方晶系结构P31空间群,单胞参数为a=0.517nm, c=1.442nm,JCPDS卡片号为29-0820,首次充电Li2-xPtO3的x数值到1.2,为5d金属化合物中第一个4V阴极体系,4V平台的体积比容量可以和LiCoO2媲美,循环中体积变化小于LiCoO2,0.5mA/cm2和3.5V~4.5V条件下50次循环后容量在80mAh/g左右,如果上限提高则衰减明显加速,充放电曲线如图3所示。作为对比,Li2IrO3容量为130mAh/g,Li2RuO3容量为160mAh/g,Li2MoO3为180mAh/g[4]。 图3 Li2PtO3的充放电曲线,Li2RuO3, Li2IrO3, Li2MoO3作对比电流密度0.5mA/cm2, 电压范围3.5V~4.5V Li2MoO3的脱嵌锂(锂化/脱锂)反应电位范围很大[5-10],R-3m空间群,单胞参数为a=0.2874nm, c=1.5038nm, 单晶中存在Mo3簇,结晶结构如图4所示[8]。研究其在0.0V~3.0V范围的锂化/脱锂行为的意义不大;首次充电时脱锂量可以达到x=1.2 (Li2-xMoO3),在1.0V~4.5V范围3C下容量可以达到150mAh/g,滞后比较大[6]。 2.0V~4.5V,10mA/g条件下,20次循环后容量低于100mAh/g,合成好的样品不宜长时间保存,会与空气中的水分等反应。在1.5V~4.3V范围的充放电曲线图,如图5所示[10]。 图4 Li2MoO3的结晶结构示意图[8] 图5 Li2MoO3的充放电曲线示意图[10] Li2MoO3材料,电压偏低,稳定容量在90mAh/g左右,在经典液态锂离子电池领域获得应用的可能性不大。 单斜结构,C2/c空间群Li2-xRuO3大约有x=1的锂离子可以脱嵌,伴随着Ru5+/4+反应,3.6V和3.4V各有一个平台,3.6V对应0.7 伴随着锂离子脱出材料的电导率明显增大,在293K,x=0、x=0.7和x=1.0时比电阻分别为9.99Ω·cm、0.507Ω·cm和0.769Ω·cm。Li1.3~1.4RuO3的结构与Li2RuO3相同,而Li0.9~1.0RuO3的结构演变为R-3 rhombohedral结构,锂层中的锂离子脱出去以后会引起O从立方米堆积向六方密堆积的转变[11-15]。Li3PO4表面改性纳米Li2RuO3表面形成了3.6nm厚非晶Li3PO4层,基底是脉冲激光沉积的25.5nm厚的Li2RuO3,2μA/cm2和2.8V~4.2V条件下首次充电容量296mAh/g,未改性的对比样品为190mAh/g,表面改性可增强结构的稳定性,如图6所示[12, 13]。 图6 Li3PO4表面改性Li2RuO3(左图)的充放电曲线[12] 使用固体电解质体系在0.3mV/s下测量Li2RuO3/Li3PO4的循环伏安曲线,如图7所示,两对氧化还原峰分别对应的平衡电位大约在3.65V和3.45V,对应的还原峰在3.6V和3.3V[14],氧化/还原峰比较明显,表示对应的电位平台比较平;从充放电曲线来看,每个电位平台代表的反应机理是两相平衡机理。 图7 Li2RuO3的循环伏安曲线 首次充电时,结构从C/2C向R-3结构演变,伴随着RuO6变形,进一步充电导致结构失去部分氧,RuO6变形程度降低,形成目前还不能确定的新相;如果放电,伴随着锂离子的重新嵌入形成结晶比较差的原始相,不过组成已经有少许不同,可以表示为Li1.9RuO3-y。 Li-Mn-O系列包括尖晶石结构的LiMn2O4、Li4Mn5O12、Li2Mn4O9,正交或者单斜结构的LiMnO2和单斜结构的Li2MnO3。Li2MnO3中Mn为+4价,一般认为是电化学惰性的。不过实测发现它可以有容量,最初认为可能是Mn被氧化成+5价甚至更高的价态,目前普遍接受了充电时发生脱氧、脱锂并伴随着结构逐步演变的机理。对其电化学感兴趣的另一个原因是认为在富锂层状固溶体材料中存在着Li2MnO3局部结晶域/微区,或者某种类似的结构单元。 高温固相反应合成,利用MnCO3和Li2CO3合成Li2MnO3的过程,可能可以分成4步:200℃~400℃发生MnCO3分解和MnO2的形成,随后MnO2和碳酸锂或者Li2O反应形成Li2MnO3,温度高于790℃以后,Li2MnO3结晶,优先沿着c轴,900℃以上会发生内部阳离子交换,形成尖晶石型结构[16]。 Li2MnO3完全活化对应的理论容量为460mAh/g[17],常温下首次充电时,在4.6V以上的一个比较大的电位范围同时发生脱氧、脱锂过程,对应一个4.6V以上的电位平台,认为反应可能是 Li2MnO3→Li2O+MnO2 伴随着从层状结构向尖晶石型结构的变化,这种变化从4.3V就开始了(也有认为从4.1V就开始了);还有研究者[18]认为同时有四方Li2Mn2O4结构相生成。 首次充电时脱氧电位,在温度升高后有明显降低,如果在60℃下测量,脱氧电位平台要比室温时低180mV~360mV[19];富锂层状固溶体材料首次充电时位于4.6V附近的电位平台,一般就认为和其中的Li2MnO3微相的释放氧过程有关,同时伴随着相变。 有两种结构的Li2MnO3,即α和β相[18],二者的区别仅仅在于Li1/3Mn2/3层内Li和Mn的排布方式,前者是随机排布,后者是有序排布的。Li2MnO3可以看成是LiMn2/3Li1/3O2,属于LiMO2层状化合物[20, 21],为O3结构,层间八面体位置只有锂离子,层内八面体位置被Mn和Li占据,Mn∶Li=2∶1,Mn4+离子半径0.054nm,Li+离子半径为0.074nm,Li和Mn在层内分无序分布和有序分布两种。其中有序分布更稳定的结构。锂离子占据2b(0, 1/2, 0), 2c(0, 0, 1/2)和4h(0, 0.66, 1/2)位置,Mn占据4g(0, 0.167, 0)位置,O占据4i(0.219, 0, 0.227)和8j(0.254, 0.321, 0.223)位置。很难模拟其XRD图谱,实际上,Li1/3Mn2/3层沿着c轴的堆垛或多或少存在一定缺陷,烧结温度越高,沿着c轴堆垛的无序度越低,完美度越高。 锂离子的扩散主要是沿着Li1/3Mn2/3O2层中的c轴扩散,300K时自扩散系数为4.7×10-11cm2/s,活化能为0.156eV。图8是几种典型嵌锂材料的锂离子扩散系数对温度的关系[20],可以看出该材料的锂离子扩散系数对温度的关系与LiFePO4的接近,活化能比较大,换句话说,扩散系数更容易受温度变化的影响,升温会引起电化学性能的明显变化(嵌锂材料的电化学性能主要决定于锂离子的传输能力)。 图8 几种典型嵌锂材料的锂离子扩散系数对温度的关系[20] Li2MnO3微米颗粒,高温下活化以后具有稳定的循环行为,活化过程有氧气释放,还有CO和CO2,可能是氧气和导电剂反应产生的。首次充电时从层状向尖晶石型结构转变,60℃下脱锂过程伴随着脱氧,同时如果电压高于4.5V,可能存在Li+/H+交换过程(取决于电解液特性),含有质子的组成应当是Li2-xHx-yMnO3-0.5y。 研究Li2MnO3的最大难度在于,即使初始材料组成是Li2MnO3,经过循环后,真实的组成已经远远偏离了起始时的组成,并且很难确定偏离到哪里去了,偏离最初的组成以后的最终组成如何,谁也不知道。 Li2MnO3充电时,结构会向尖晶石型结构演变,二者结构具有很大的相似性,对于尖晶石结构的LiMn2O4,沿着111方向,可以认为是层状结构,层板为Mn3/41/4O2和Li1/2Mn1/43/4O2,尖晶石结构层板内阳离子之间是有序化。 Li2MnO3为C2/m空间群,单斜结构,单胞参数大约为a=0.4930nm, b=0.8539nm, c=0.5026nm, β=109.371°,XRD图谱中的20°~23°范围出现的是代表超晶格的衍射峰,源自于过渡金属层中Li和Mn原子的有序排列。超晶格衍射峰宽化代表过渡金属层中堆积的变形,在64°~66°出现双峰,它代表Li2MnO3层状特征[22]。 最初认为其不具有电化学活性。有文献报道在反复强充电的情况下,该材料可以显示出电化学脱嵌锂行为;在富锂锰基层状固溶体材料中存在Li2MnO3相,在对富锂锰基层状固溶体电化学脱嵌锂的研究中,认为其中的Li2MnO3相经过脱出Li和O以后,可以被活化。在2.0V~4.8V范围容量只有30mAh/g左右,滞后较大。纳米Li2MnO3经过球磨首次容量可以达到250mAh/g,不过循环稳定性很差。笔者认为,单独的Li2MnO3相是不具有电化学活性,至于文献报道经过活化或者老化后具有电化学脱嵌锂的活性的原因,实际上源自于组分与结构均发生变化的缘故,体现出脱嵌锂行为的相已经不再是Li2MnO3,而是LixMnOy,其中的Mn也不是+4价,至于x和y的具体数值是多少,以及活化后的相结构如何,恐怕目前还无人能说清。 针对Li2MnO3的改性研究,主要集中在元素取代、纳米材料合成。元素取代包括取代Li、Mn或者O。有认为提高4.5V状态下的锂离子扩散系数对于提高该材料的性能至关重要,通过弱化Li-O键,F取代明显降低首次充电脱锂的活化能,通过引入Mn3+和氧空穴提高电子传输能力。Al取代部分Li的LixAlyMnO3正极,Al同时占据Li和Mn的位置,促使尖晶石相的形成,可适当改进放电容量。 采用自燃烧合成技术得到的20nm~80nm颗粒尺度Li2MnO3, 在60℃下2.0V~4.6V首次充电容量300mAh/g以上,首次放电容量接近200mAh/g,倍率很差,在45℃时10mA/g电流密度下循环100次后容量125mAh/g以上。 Li2MnO3的循环伏安曲线比较复杂,不同作者报道的结果相差比较大;此外,该材料的循环伏安行为随着循环扫描的进行不断的改变,这也暗示了其结构的复杂性。不过,总的一个特点是,该材料CV中背景电流很高,基于一般原理,背景电流与界面双电层电容和相变有关系;对于该材料,背景电流更可能暗示着丰富的相变过程。相应的,充放电曲线平台比较倾斜。如果充放电电压下限比较低,一般在2.0V~3.0V范围会出现一个电位平台,它代表LixMn2O4的形成,x>2。 其它改性方法还包括FePO4表面包覆,引入缺陷例如氧缺陷Li2MnO3-x,Li1+x(Ti0.4Mn0.6)1-xO2, 0 图9 单斜结构Li2ZrO3 结晶结构示意图[23] 750K~1000K温度范围合成的是亚稳态四方结构,在1070K以上合成的是单斜结构的[23]。单斜结构的空间群为C12/c1,Zr原子和Li原子都占据4e位置,部分O占据4d,其它的O占据8f位置,单胞参数a=0.5426nm, b=0.9026nm, c=0.5421nm, β=112.7234°,PDF卡片为75-2157,在ZrO6八面体中Zr近似位于中心,每个ZrO6八面体与相邻的八面体共享两条边,沿着c轴形成边共享ZrO6八面体长链,相邻的两个长链通过角共享ZrO6相互链接,形成空间骨架,锂离子位于骨架中的间隙空间。图9为单斜结构Li2ZrO3结晶结构示意图。 Li2ZrO3中锂离子扩散系数在1.9cm2/s~3.2×10-6cm2/s范围,经常作为其它嵌锂材料的表面包覆材料使用,以改进主相的循环性能。在0.3C下0.1V~2.5V范围内容量只有70mAh/g的稳定容量,脱嵌锂过程中结构变化可逆,不过明显滞后太大,脱嵌锂电压范围太大。 固相法合成,黑色粉末,单斜结构,C2/m空间群,单胞参数为a=0.5120nm, b=0.8850nm, c=0.5103nm, β=109.61°,O原子接近六方密堆积,八面体空位为Li+和Rh4+,部分Li+和Rh4+是无序排布的,结构如图10所示[24]。未见有文献报道其脱嵌锂行为。 图10 Li2RhO3结构示意图[24] Li2MeO3系列材料不具有实用化价值,但是对该系列材料的结构与脱嵌锂机理的研究具有重要理论价值,有利于研究相关层状脱嵌锂材料的反应机理,特别是对于富锂富锰层状材料的反应机理研究更具有重要的参考意义。其中部分材料在薄膜锂离子电池,特别是微型锂离子电池领域可能具有实用价值,例如Li2IrO3材料。 [1] Kobayashi H, Tabuchi M, Shikano M, Kageyama H, Kanno R. Structure, and magnetic and electrochemical properties of layered oxides, Li2IrO3[J]. J. Mater. Chem., 2003, 13: 957-962. [2] Chen Y C, Huo M, Song L J, Sun Z L. Electrical and lithium ion dynamics in Li2IrO3from density functional theory study[J].RSC Adv., 2014, 4, 42462. [3] kobayashi H, kanno R, Tabuchi M, kageyama H, Nakamura O, Takano M. Structure and charge/discharge characteristics of new layered oxides: Li1.8Ru0.6Fe0.6O3and Li2IrO3[J]. J Power Sources, 1997, 68: 686-691. [4] Okada Shigeto, Yamaki J I, Asakura K, Ohtsuka H, Arai H, Tobishima S I, Sakurai Y. Cathode characteristics of layered rocksalt oxide, Li2PtO3[J].Electrochimica Acta ,1999, 45:329-334. [5] Jang J, Kim Y J, Cha O B, Yoon T, Kim S M, Kim H, Park H, Ryu J H, Oh S M. A First-Cycle Coulombic Efficiency Higher than 100% Observed for a Li2MO3(M=Mo or Ru) Electrode.Angew[J]. Chem. Int. Ed. 2014, 53: 10654-10657. [6] Villevieille C, Fjellvåg H, Novak P. Freeze-dryed LixMoO3nanobelts used as cathode materials for lithium-ion batteries: A bulk and interface study[J]. Journal of Power Sources ,2015, 297: 276-282. [7] Takahashi Y, Kijima N, Hayakawa H, Awaka J, Akimoto J. Single-crystal synthesis and structure refinement of Li2MoO3[J]. Journal of Physics and Chemistry of Solids ,2008,69 :1518-1520. [8] Ma J, Gao Y R, Wang Z X, Chen L X. Structural and electrochemical stability of Li-rich layer structured Li2MoO3in air[J]. Journal of Power Sources, 2014, 258:314-320. [9] Hibble S J, Fawcett I D, Hannon A C. Structure of two disordered molybdates, Li2MoO3and Li4MoO8, from total neutron scattering[J]. Acta Cryst. 1997, B 53: 604-612. [10] Kobayashi H, Tabuchi M, Shikano M, Nishimura Y, Kageyama H, Ishida T, Nakamura H, Kurioka Y, Kanno R. Synthesis and electrochemical properties of lithium molybdenum oxides[J]. Journal of Power Sources, 1999, 81-82:524-529. [11] Arnold M S, Swider-Lyons K E. Improved high power Li-ion batteries with Li2RuO3addition: A fast charging and fast cycling study[J]. Journal of Power Sources, 2007 ,165:635-639. [12] Zheng Y M, Taminato S, Xu Y L, Suzuki K, Kim K, Hirayama M, Kanno R. High-capacity phase formation by surface modification of Li3PO4on nanosized Li2RuO3electrode for lithium batteries[J]. Journal of Power Sources, 2012, 208:447-451. [13] Kobayashi H, Kanno R, Kawamoto Y, Tabuchi M, Nakamura O. Physical properties of the de-lithiated Li2RuO3, with the layered structure[J].Solid State Ionics, 1996, 86-88:859-863. [14] Zheng Y M, Hirayama M, Taminato S, Lee S, Oshima Y, Takayanagi K, Suzuki K, Kanno R. Reversible lithium intercalation in a lithium-rich layered rocksalt Li2RuO3cathode through a Li3PO4solid electrolyte[J].Journal of Power Sources ,2015, 300:413-418. [15] Kobayashi H, Kanno R, Kawamoto Y, Tabuchi M, Nakamura O, Takano M, Structure and lithium deintercalation of Li2RuO3[J]. Solid State Ionics, 1995, 82: 25-31. [16] Kan Y C, Hu Y, Croy J, Ren Y, Sun C J, Heald S M, Bareo J, Bloom I, Chen Z H. Formation of Li2MnO3investigated by in situ synchrotron probes[J]. Journal of Power Sources,2014, 266 : 341-346. [17] Lanz P, Villevieille C, Novák P. Electrochemical activation of Li2MnO3at elevated temperature investigated by in situ Raman microscopy[J].Electrochimica Acta , 2013, 109:426-432. [18] Amalraj S F, Burlaka L, Julien C M, Mauger A, Kovacheva D, Talianker M, Markovsky B, Aurbach D. Phase Transitions in Li2MnO3Electrodes at Various States-of-Charge[J].Electrochimica Acta, 2014,123:395-404. [19] Amalraj S F, Sharon D, Talianker M, Julien C M, Burlaka L, Lavi R, Zhecheva E, Markovsky B, Zinigrad E, Kovacheva D, Stoyanova R, Aurbach D. Study of the nanosized Li2MnO3: Electrochemical behavior, structure,magnetic properties, and vibrational modes[J]. Electrochimica Acta.2013, 97:259-270. [20] Sugiyama J, Nozaki H, Mukai K, Harada M, Månsson M, Hillier A. Lithium diffusive behavior in Li2MnO3detected by muon-spin relaxation[J].Solid State Ionics, 2014,262:901-903. [21] Boulineau A, Croguennec L, Delmas C, Weill F. Structure of Li2MnO3with different degrees of defects[J].Solid State Ionics, 2010,180 :1652-1659. [22] Choi A, Palanisamy K, Kim Y, Yoon J, Park J H, Lee S W, Yoon W S, Kim K B. Microwave-assisted hydrothermal synthesis of electrochemically active nano-sized Li2MnO3dispersed on carbon nanotube network for lithium ion batteries[J].Journal of Alloys and Compounds, 2014,591 : 356-361. [23] Baklanova Y V, Arapova I Y, Buzlukov A L, Gerashenko A P, Verkhovskii S V, Mikhalev K N, DenisovaТ А, Shein I R, Maksimov L G. Localization of vacancies and mobility of lithium ions in Li2ZrO3as obtained by Li-6,Li-7 NMR[J]. Journal of Solid State Chemistry, 2013, 208:43-49. [24] Todorova V, Jansen M. Synthesis, Structural Characterization and Physical Properties of a New Member of Ternary Lithium Layered Compounds-Li2RhO3[J]. Z. Anorg. Allg. Chem. 2011, 637: 37-40.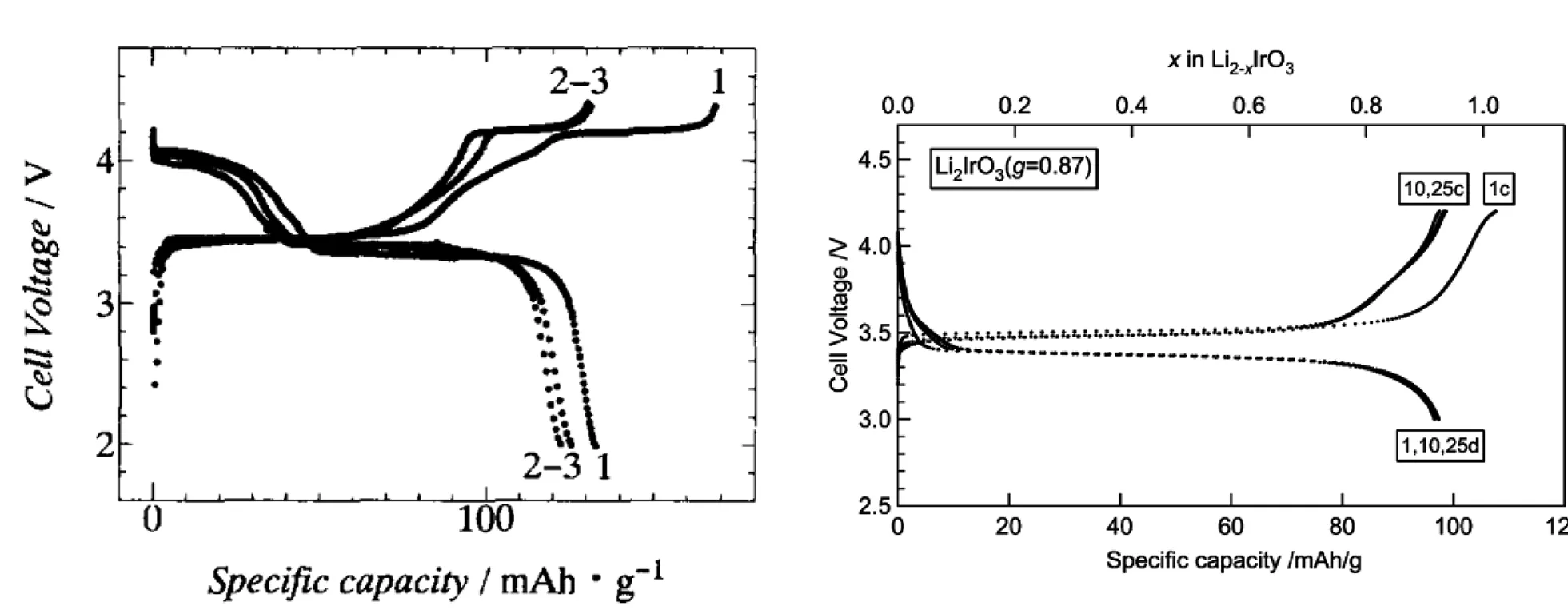
4 Li2PtO3
5 Li2MoO3
6 Li2RuO3


7 Li2MnO3
8 Li2ZrO3
9 Li2RhO3
结论与展望

