锂空气电池正极催化剂的研究进展
王娜,林鸿鹏,方新荣,宋晓娜,刘元刚,武俊伟
( 1.东莞市迈科新能源有限公司,广东 东莞 523800;2.天津科技工作者创新创业服务中心,天津300041;3.哈尔滨工业大学(深圳) 材料科学与工程学院, 深圳 518101)
1 前言
不同于传统的“摇椅式”锂离子电池,基于电化学过程中的氧还原反应(ORR)和氧析出反应(OER),金属空气电池可以实现可逆的充放电过程。由于空气及活性物质(氧气)并不储存在电池内部,而是来自于外界,因而金属空气电池具有极高的理论能量密度,其中锂空气电池是最具潜力成为下一代高能量密度的储能系统。在考虑O2质量的条件下,锂空气电池理论能量密度为5210Wh/kg (不包括氧气条件下能量密度高达11680Wh/kg),比传统锂离子电池能量密度高出5-10倍[1],是目前所有可充电电池体系中理论能量密度最高的。如图1-1所示为不同电池体系实际能量密度及相应电动汽车续航里程和能源单价对比图[2],可见在所有的储能体系中,锂空气电池在理论上可以实现电动汽车接近现有燃油汽车的续航里程数(500km~600km)。基于此,锂空气电池入选了IBM公司“电池500项目”,并由此受到全世界科技工作者的广泛研究。

图1-1 不同电池体系实际能量密度及相应电动汽车续航里程和价格对比[2]Fig.1-1 Comparison of range and price for different battery system energy density and its corresponding electric vehicle[2]
2 锂空气电池概述
2.1 锂空气电池结构与基本原理
最早在1976年有Lockheed的研究人员提出了锂空气电池的概念,整个体系包括金属锂负极、空气(或氧气)正极、以及碱性水溶液电解液。该体系电池的一个严重问题就是金属锂会与水溶液剧烈反应。1996年,有人提出了有机电解液体系的锂空气电池,该体系则包括金属锂负极、复合碳电极的正极、以及胶体电解质,其中酞青钴被用作催化剂材料。此种体系的锂空气电池解决了金属锂负极与水发生剧烈反应的问题,但是又产生了新的问题,这也是当前锂空气电池发展所面临的主要问题之一,即不溶于有机电解液的放电产物Li2O2或Li2O堆积在空气电极上而堵塞材料的物质传输通道,最终导致正极失效,电池放电终止[3]。到2006年,T. Ogasawara等人[4]提出并验证了锂空气电池在有机电解液体系下的可逆性,从此锂空气电池开始逐渐吸引越来越多研究人员的关注。
典型的锂空气电池包含以下几个部分:负极金属锂、空气正极多孔碳、正负极间隔膜以及锂离子传导电解液,其中空气正极一般由碳基体材料和催化剂组成。发展至今,锂空气电池根据所使用电解液种类的不同可以分为以下四种:(a)有机电解液体系;(b)水溶液体系;(c)混合电解液体系;(d)全固态电解液体系,各体系电池结构如图2-1所示[5]。其中有机电解液体系具有最简单的电池结构和相对容易实现的实验条件,同时具有最高的实际能量密度[6-9],因而成为锂空气电池领域的研究热点。
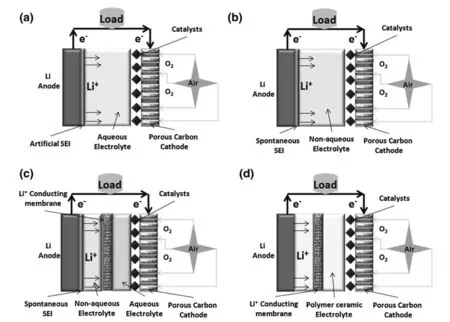
图2-1 四种电池体系结构示意图[5]Fig.2-1 Structure diagram of four battery system[5]
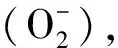
放电过程
阳极反应:
Li - e-→ Li+
(2-1)
阴极反应:
(2-2)
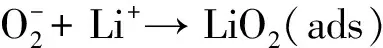
(2-3)
2LiO2→ Li2O2+ O2
(2-4)
LiO2+ Li++ e-→ Li2O2
(2-5)
充电过程
阳极反应:
Li++ e-→ Li
(2-6)
阴极反应:
Li2O2→ 2Li++ 2e-+ O2
(2-7)
在水系锂空气电池中,由于放电产物Li2O2会继续与水发生反应生成LiOH,所以其最终的放电产物为LiOH,并且溶解在电解液中而不会阻碍放电反应的继续进行。
有关锂空气电池充放电反应机理的研究,目前尚不成熟,仍需做大量的工作。可以说锂空气电池的发展仍然处在初级阶段,由于电池各组成部分对电池性能的影响,使得当前锂空气电池所能实现的实际比能量还远远达不到理论水平。
2.2 锂空气电池研究现状
大量研究结果使锂空气电池的基础电化学反应过程以及电极和电解液等材料对电池性能的影响规律越来越明晰。然而时至今日,锂空气电池仍然难以实现商业化,是因为其仍然面临很多问题和挑战,包括实际容量低、倍率性能差、能量效率低(充放电电压差大)以及循环寿命短等,具体原因可以归结为以下几个方面:
(1)有机体系电解液的分解

(2)锂枝晶的生成以及与阳极锂相关的副反应
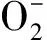
(3)缓慢的氧反应动力学以及正极碳材料的腐蚀失效
目前,锂空气电池除了实际比容量比理论比容量低以外,还存在诸如能量效率低(充放电电压差大)、倍率性能差等不足,这些不足很大程度上是由正极氧的还原反应(ORR)和析出反应(OER)缓慢的反应动力学造成的。此外,锂空气电池充放电过程中LiO2和Li2O2的存在是造成正极碳基材料腐蚀分解的重要原因[13,17]。正极多孔碳基材料的腐蚀分解会加快电池的容量衰减、缩短电池的循环寿命。
综上所述,要实现锂空气电池技术的商业化还有很多的问题需要解决。围绕这些存在的问题和挑战,研究者们已经做了不少基础研究工作,这其中包括对金属锂负极、电解液、空气扩散正极等多方面的研究。其中空气扩散正极作为锂空气电池的核心部分,一直是锂空气电池领域研究的热点。好的正极材料能够为电池充放电过程提供大量的活性位点,并催化电池ORR 和OER过程的快速进行,提高电池的比容量、提高电池的能量效率以及改善电池的倍率性能等。因此,对空气正极催化剂材料的结构和电化学特性进行合理设计及调控对于改善锂空气电池的综合性能具有非常重要的作用。
3 锂空气电池正极催化剂
如上所述,正极材料的好坏影响电池的综合性能,好的正极材料能为电池充放电过程中物质的扩散传输提供通道,为放电产物的沉积提供容纳空间,同时还能催化ORR和OER过程,提高电池的综合性能。目前锂空气电池正极材料一般包括一些碳材料和非碳催化剂材料。
3.1 碳材料
碳材料具有很多特点,如具有良好的电子电导率、容易实现的高比表和高孔隙率、质量轻以及价格低等,此外,碳材料本身也有一定的ORR催化作用,因而其被广泛用作锂空气电池正极材料,其可以单独做正极催化剂使用,也可以作为催化剂载体使用。目前,对锂空气电池正极碳基材料的研究主要集中在两个方向,一是对碳基材料的结构和形貌进行设计和调控,二是通过掺杂等方式对碳材料的电化学特性进行优化改性。这些碳材料包括一些商业碳黑、多孔碳材料[18,19]、碳纳米管和纳米纤维[20,21]以及石墨烯等[22,23]。
Hayashi[24]等人研究发现,电池的放电容量与材料的比表面积有关,大的比表面积更有利于获得高的放电比容量。原因是高比表有利于形成更多的气、液、固三相反应界面,以及更为均匀的催化剂负载,从而有利于更好的发挥材料的性能。而Tran[25]等人同样对比了几种碳作锂空气电池正极材料的性能。结果表明,具有相对最高比表的活性碳(2100m2/g),其放电容量仅为414mAh/g,低于小比表Super P碳的1736mAh/g。分析发现,活性碳具有较小的孔径,而Super P的孔径较大,在碳基体材料中微孔容易被放电产物堵塞,介孔和大孔才可以容纳一定数量的放电产物而不影响物质的扩散。由此可知,锂空气电池的放电容量还与材料的孔径大小有关。
最近,J. B. Park[26]等人采用模板法,通过三元共组装合成一种孔径可控的有序介孔碳,并用作锂空气电池正极材料。与Super P碳正极相比,这种有序介孔碳电极可以在200mA/g的电流密度以及2000mAh/g的比容量限定条件下连续循环25次,表现出优越的循环性能。B. Sun[27]等则利用多孔纳米MnO做硬模板,通过化学气相沉积法(CVD)制备了一种纳米方形介孔碳,这种碳材料具有 492.3m2/g的比表面积,高达3.74cm3/g的孔容积,以及50nm~100nm的孔径分布。与CB碳空气正极首次放电比容量为6240mAh/g相比,该碳材料正极在200mA/g的电流密度下,首次放电容量可以达到26100mAh/g。
另外,一维碳材料如碳纳米管、碳纳米线等也被用于锂空气电池空气正极。Yang[28]等人制备了一种无粘结剂的全碳纤维空气正极,首次放电可以获得高达2500Wh/kg的比能量。分析表明,此高比能量主要来自于碳材料及其孔径结构的高效利用,不添加有机粘结剂,可以使正极有更多的空间来容纳放电产物。Kang[29]研究小组利用有序排列的CNT纤维制备了一种孔结构可控的层状碳空气电极。其放电后电极的SEM图表明,在充放电过程中,碳材料的结构可以很好的保留下来,这对于改善锂空气电池的循环效率和容量衰减都是很有帮助的。
基于计算机模拟技术,Zhang[30]等人称多级孔径结构的碳可以有效提升锂空气电池的放电容量,因为它有利于氧气更快地进入到空气电极的内部。Xia[31]等人合成了一种三维有序介孔/大孔碳球阵列,在限定比容量1000mAh/g的条件下,可以获得很好的循环性能(持续循环30次)和倍率性能[32]。分析结果表明,这种有序介孔/大孔碳材料电化学性能的改善主要是由于孔的有序性更有利于氧气的扩散和固、液、气三相反应区的形成。
Rodrigues[33]等人成功制备了氮掺杂的活性碳材料,制备锂空气电池正极片并进行电化学性能测试。结果显示:N原子的掺入使材料的放电容量和ORR催化活性都有明显的提升。Nie[34]等人则以含氮前驱体三聚氰胺作为碳源,以气相二氧化硅做模板剂,通过控制合成条件,合成了多种孔径的富氮介孔碳材料N-MCS。与商业碳黑BP2000对比,N-MCS碳空气正极放电容量更高,在30mA/g的电流密度下,获得高达4500mAh/g的初始比容量。此外,其他元素(如P、S、B等)掺杂的碳材料对锂空气电池的影响也已有研究[33, 35],结果表明,对空气扩散正极碳基体材料的杂原子掺杂也是提升锂空气电池性能的有效手段。
综合来看,在锂空气电池中,对碳基材料的结构进行设计和调控是改善材料电化学性能,提高电池综合性能的重要手段;同时,对碳材料进行杂原子掺杂是进一步提升材料ORR和OER催化活性的有效方式。
3.2 非碳催化剂
目前有关锂空气电池中催化剂的作用机理尚没有一致的结论,但是很多的研究结论显示,催化剂确实能够减少电池的充放电过电势以及改善电池循环性能,并影响放电产物的结构、形貌等。由于碳材料本身的催化效果有限,因此,研究人员常常在碳材料的基础上通过机械混合或者原位负载的方式引入其他催化剂来进一步提升电池的综合性能,这些催化剂包括过渡金属氧化物、贵金属及其合金、金属氮化物以及导电聚合物等。
3.2.1 过渡金属氧化物
过渡金属氧化物包括单金属氧化物和多金属氧化物,其相对于贵金属催化剂来说具有储量大、价格低、制备简单以及环境友好等优点。
锰氧化物是一种能同时催化ORR和OER过程的具有双功能的电化学催化剂,其具有多种晶体形态,如一维隧道型、二维层状结构以及三维尖晶石结构等,已有的大量研究表明锰氧化物的化学组分、形貌、氧化状态以及晶体结构均会影响材料的电催化性能。Oloniyo[36]等人就合成了α、β、λ-MnO2纳米线以及α-MnO2纳米棒和纳米球,此外通过在碳上负载催化剂合成了α-MnO2纳米线复合材料(α-MnO2/C)。在1M LiTFSI/TEGDME电解液体系中研究各形态氧化锰的电催化性能,发现β-MnO2获得最高2600mAh/g的放电容量,而α-MnO2/C电极则表现出低于1300mAh/g的容量。Song等人[37]则合成了分别具有纳米颗粒、纳米管以及纳米线形貌的α-MnO2催化剂,相应材料的电极显示出相同的放电平台,但是α-MnO2纳米线具有最低的充电平台以及在200mA/g和5000mA/g电流密度下分别高达11000mAh/g和4500mAh/g的容量,而其他形式氧化锰在5000mA/g电流密度下则只有低至1000mAh/g的容量。研究者认为α-MnO2纳米线的优越性能与大量暴露在材料表面的Mn3+有关,表明通过对材料表面的化学特性进行修饰是获得高性能催化剂的有效方式。
结构缺陷对材料电催化性能也有很大影响,Nazar[38]等利用Na0.44MnO2纳米线作为原始材料,通过酸浸渍法获得一种有Na空位缺陷的Na0.44-xHxMnO2纳米线材料,并将其用作锂空气电池正极催化剂。同纯KB碳黑和原始Na0.44MnO2纳米线相比,改性材料催化的锂空气电池表现出更高的可逆容量和更低的OER过电势,其结果如图所示3-1所示。
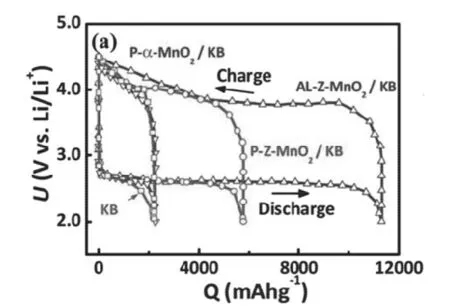
图3-1 原始Na0.44MnO2纳米线催化剂(P-Z-MnO2/KB)、酸浸渍得Na0.44-xHxMnO2纳米线催化剂(AL-Z-MnO2/KB)、α-MnO2催化剂(P-α-MnO2/KB)以及导电碳黑(KB)催化剂正极初始充放电电压容量曲线[38]Fig.3-1 First charge and discharge curve of original Na0.44MnO2 nano line catalytic(P-Z-MnO2/KB,acid solvent Na0.44-xHxMnO2 nano line catalytic(AL-Z-MnO2/KB), α-MnO2 catalytic (P-α-MnO2/KB) and electric conduction carbon (KB) catalytic as cathode[38]
钴的氧化物是另外一种具有高ORR和OER双功能催化活性的氧化物,材料的催化性能也与其相貌和结构等相关。G.Gnana.kumar[39]等人合成了一种rGO/Co3O4复合材料,其中Co3O4为具有面心立方晶体结构的平均直径在220nm左右的纳米片,平均分布在石墨烯片上。用作锂空气电池正极催化剂表现出4150mAh/g的比容量,并具有优越的循环性能。分析表明,该材料的优越性能主要来自石墨烯片的高导电率和Co3O4立法纳米片高电催化活性的协同效应。
Riaz[40]等人制备了三种形貌的Co3O4纳米材料并用作锂空气电池正极材料,分别是纳米片、纳米针以及纳米花,电池测试结果如图3-2所示。在 20mA/g的电流密度下,电池比容量大小为纳米片(1127mAh/g)<纳米花(1930mAh/g)<纳米针(2280mAh/g)。此外,尽管三种正极材料具有相近的高达2.75 V的放电电压和低至3.85 V的充电电压,但是Co3O4纳米针正极具有最佳的循环性能。
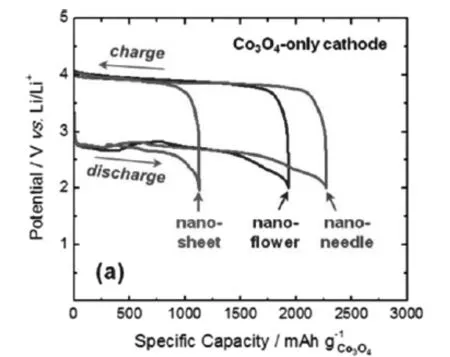
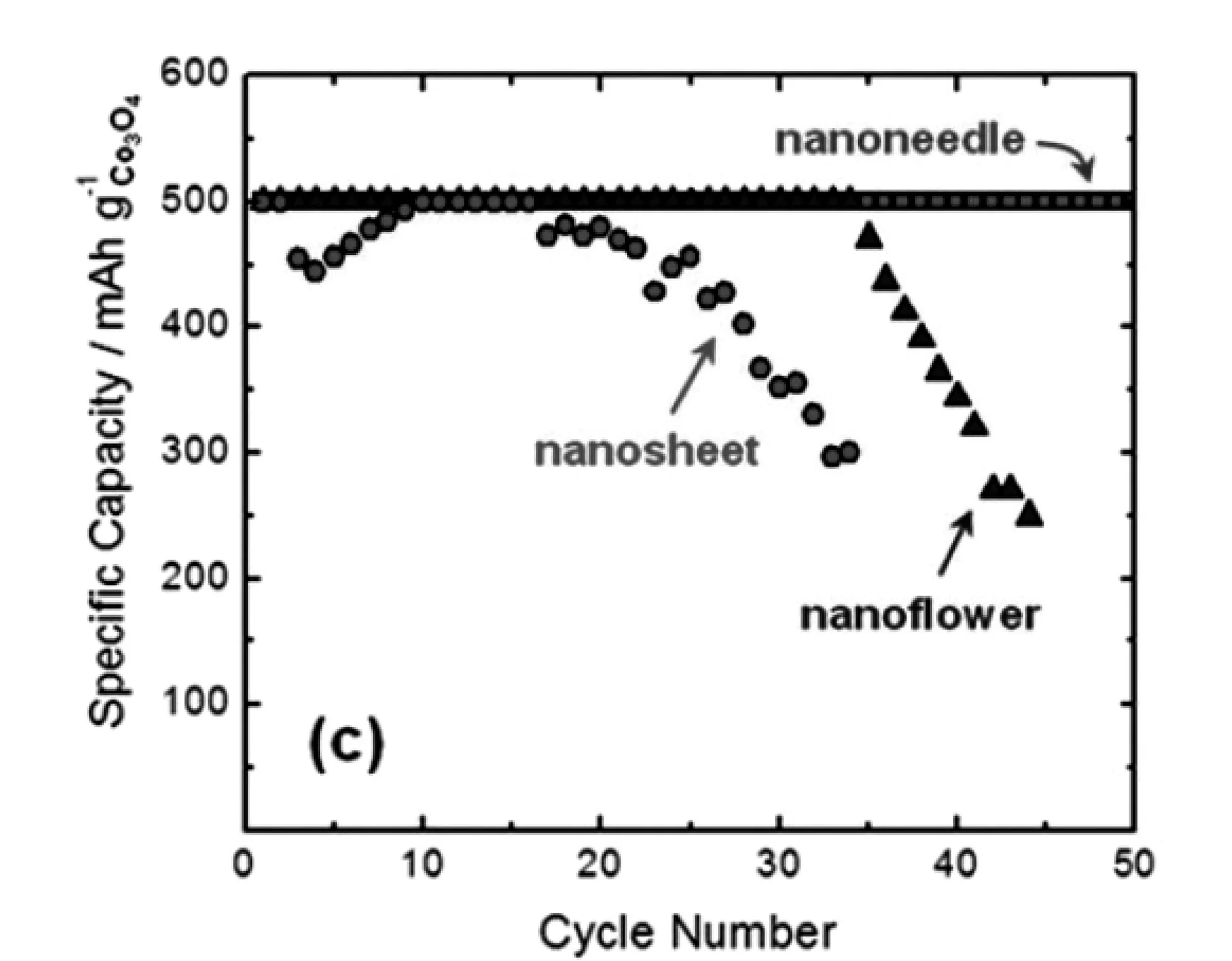
图3-2 20 mA/g的电流密度下 (a)不同形貌Co3O4正极充放电曲线,(b)不同形貌Co3O4正极循环性能比较[40]Fig.3-2 At current density of 20 mA/g (a)charge and discharge curve of cathode Co3O4 for different patterns (b)cycle performance compassion for different patternsof cathode Co3O4[40]
用其他原子取代Co3O4的部分Co原子是一种进一步提升材料性能的有效手段。Anandan[41]等使用Mn原子部分取代Co原子,合成了Mn0.5CO2.5O4、Mn1CO2O4以及Mn1.5Co1.5O4三种材料并用作锂空气电池正极催化剂,结果表明三种材料均表现出比原始Co3O4更低的充电电压,表现出更优的OER催化活性。Li[42]等人则使用硬模板法合成了Ni取代的介孔NiCoO4材料,并研究了正极材料中介孔NiCoO4含量对电池性能的影响。当NiCoO4含量从20%依次增加到45%和70%,充电电压依次从4.0V下降到3.75V,而相应的放电电压则从2.75V增加到2.80V。
除了以上锰、钴的单金属氧化物外,其他过渡金属氧化物用作锂空气电池正极催化剂也有广泛研究。如Thapa[43]等人研究了多种氧化物做正极催化剂的电化学性能,包括Co3O4、NiO、Fe2O3、CuO、V2O5、MoO3和Y2O3。在循环5圈后,所有材料均保持高于首圈的放电容量,其中CuO和V2O5相对具有更高的可逆比容量。而Barile[44]等人有关CuO作正极催化剂的研究则表明,CuO的存在给电池的综合性能带来不利影响,因为它会催化电解液和碳材料的分解。Xiao[45]等人则单独研究了V2O5做正极催化剂的电化学性能,结果显示V2O5是一种高效的锂空气电池催化剂。
钙钛矿以及类钙钛矿型过渡金属氧化物在固体氧化物燃料电池以及超级电容器中已有广泛研究和应用,这种材料通常都具有比较好的ORR和OER双功能催化活性,近年来在锂空气电池正极催化剂领域也吸引了很多研究者的注意,是一类很有潜质的催化剂材料。Fu[46]等人通过溶胶凝胶法和固相法分别合成了s-La0.8Sr0.2MnO3和g-La0.8Sr0.2MnO3两种纳米钙钛矿材料。电化学测试结果显示,在0.1 mA/cm2电流密度下g-La0.8Sr0.2MnO3正极具有1900mAh/gcarbon的初始放电比容量,高于s-La0.8Sr0.2MnO3的1200mAh/gcarbon。并且g-La0.8Sr0.2MnO3正极显示出比s-La0.8Sr0.2MnO3高出0.2 V的放电电压。分析显示,是材料的表面形貌造成了两种催化剂性能的差异。Han[47]等人研究了多孔CaMnO3材料用作正极催化剂材料,同纯碳相比,在50mA/gcarbon的电流密度以及500mAh/gcarbon的放电深度下CaMnO3表现出低至0.98V的充放电电压差,比纯碳低了620mV。在100mA/gcarbon电流密度以及500mAh/gcarbon的放电深度条件下,CaMnO3电极在循环80圈后放电电压仍在2.35V以上,相比之下,纯碳材料只能稳定循环25圈。
除了以上所提到的氧化物外,还有一些材料也表现出不错的性能。如Kalubarme[48]等人合成了一种氧化铈基催化剂Ce1-xZrxO2(x=0~0.5),其中Ce0.8Zr0.2O2正极具有最高达1620mAh/gcarbon的放电比容量。进一步将50%的Ce0.8Zr0.2O2和50%的MnO2混合使用,则电池的比容量还可以再提升12%。 Trahey[49]则合成了含锂的金属氧化物Li5FeO4和Li2MnO3-LiFeO2并用作锂空气电池正极催化剂。研究结果发现,Li5FeO4和Li2MnO3-LiFeO2可以通过酸活化的方式来移除Li2O2,最终,活化后的材料可以获得比较高的放电比容量,显示出较好的ORR催化活性。
3.2.2 贵金属及其氧化物
无论是在工业生产还是电催化试验中,贵金属及其氧化物都是理想的催化材料,在锂空气电池正极催化剂材料的研究中,贵金属也同样是研究热点。目前研究地比较多的贵金属主要有Pt、Au、Pd、Ru和Ir等。
Lu[50,51]课题组系统研究过Pt和Au对锂空气电池ORR和OER的催化行为。结果如图3-3所示,纳米Pt具有优良的OER催化活性,而纳米Au则具有较高的ORR催化活性。因此,同纯碳电极相比,制备的负载在Vulcan XC-72碳上的Pt-Au纳米复合材料电极放电电压高出150mV~360mV,充电电压则低900mV,表现出优良的ORR和OER催化活性。

图3-3 (a)不同材料首圈充放电曲线(电流密度:carbon 85 mA/g,Au/C、Pt/C、和 Pt Au/C 100 mA/g),(b)不同材料第三圈充放电曲线(电流密度:0.04 mA/cmelectrode2)[50,51]Fig.3-3 (a)First charge and discharge curve of different material(current density:carbon 85 mA/g;Au/C、Pt/C and Pt Au/C 100 mA/g),(b) charge and discharge curve for thirdcycle of different material(current density:0.04 mA/cmelectrode2) [50,51]
Su[52]等人通过化学还原法合成了一系列负载在Vulcan XC-72碳上的PtxCoy合金纳米颗粒(包括Pt4Co/C、Pt2Co/C、PtCo/C、和PtCO2/C)。在100mA/g的电流密度下,PtCO2/C基电极具有最高的放电比容量(达3040mAh/g)。类似的,Kim[53]等人则合成了KB碳上负载平均直径为3nm的Pt3Co合金纳米颗粒复合材料(Pt3Co/KB),用作正极催化剂表现出优越的OER催化活性。在100mA/gcarbon 的电流密度下,相比于Pt/KB电极、α-MnO2/KB电极和纯碳KB电极分别为635mv、1150mv以及1085mV的过电势,Pt3Co/KB电极只有135mV的过电势。研究人员认为,Pt3Co/KB材料更优的性能主要与材料表面Pt催化活性位点处对LiO2更小的吸附力有关。此外,合金催化剂可以抑制非晶态Li2O2的形成,从而有利于放电产物在充电过程中的分解。
Sun[54]等人合成了一种金属Ru负载的催化剂,在200mA/gcarbon的电流密度下,表现出优异的综合性能,包括高达9800mAh/gcarbon的放电比容量、低至0.37 V的充放电电压差以及稳定充放电150圈的循环性能。Ke[55]等人则比较了Pt/C、Ir/C以及Pt-Ir/C 的催化性能,同纯碳电极相比,虽然三种催化剂电极的放电比容量稍有下降,但其充电过电势均有所下降,其中Pt-Ir/C电极具有最高的放电电压和最低的充电电压。
Jung[56]等人通过在还原氧化石墨烯上负载催化剂制备了Ru-rGO和RuO2·0.64H2O-rGO材料。在500mA/g electrode电流密度和5000mAh/g electrode放电深度条件下进行充放电实验,同rGO正极4.3V的充电电压相比,Ru-rGO和RuO2·0.64H2O-rGO正极的充电电压分别为3.9V和 3.7 V,显示出更好的OER催化性能。
3.3.3 其他催化剂
传统催化剂材料一般是作为正极材料的一部分,依靠特殊的化学特性催化锂空气电池的ORR和OER过程。因此,在放电过程中,逐渐沉积在正极材料表面的放电产物就会覆盖催化剂活性位点,使其对后续放电过程的催化作用受到影响,使电池的充放电过电势升高。因此,近年来一些可以溶解在电解液中的氧化还原介体(Mred)用作锂空气电池催化剂得到广泛关注。氧化还原介体主要充当电子-空穴传输介质,在充电过程中,介体Mred可以在电极表面直接被氧化形成其氧化态Mox,该氧化态介体随后氧化分解电极表面的放电产物Li2O2,自身则又回到原始的Mred态。
Chen[57]等人研究了四硫富瓦烯(TTF)、二茂铁(FC)和N,N,N,N-四甲基对苯二胺(TMPD)作为锂空气电池氧化还原介体的性能,发现FC和TMPD在电池充电过程中不稳定,而TTF则可以提升电池的充放电速率。同无添加TTF的电池相比,添加TTF的电池表现出更低的充电电压和更好的循环稳定性。Kim[58]等人系统研究了LiI浓度对电池性能影响。结果显示,同单独引入Co3O4催化剂或者LiI介体的电池相比,同时引入Co3O4催化剂和LiI介体的电池具有最好的性能。此外,提高LiI的浓度还可以进一步降低电池的充电电压和改善电池的循环性能。目前,对氧化还原介体(Mred)催化剂的研究仍然较少,但当前的一些研究结果显示其对锂空气电池性能较为明显的提升作用,将成为锂空气电池催化剂研究领域的一个重要方向。
4 总结与展望
锂空气电池极高的理论比容量显示出其在可再生新能源应用以及长续航里程电动汽车领域的广阔应用前景。发展至今,锂空气电池仍然存在许多问题亟待解决,距离其大规模商业化应用仍然有很长的路程要走,在这个过程中,高性能正极催化剂材料的研究和开发是关键。理想催化剂应具有低成本、高活性、高稳定性等特点,对正极催化剂的研究可以从现有材料入手,通过改进材料的制备方法和优化制备条件获得具有不同形貌、结构及成分的材料,最终获得电化学性能优越的正极催化剂材料。
[1] Girishkumar G, Mccloskey B, Luntz A C, et al. Lithium-Air Battery: Promise and Challenges[J]. Journal of Physical Chemistry Letters, 2010, 1(14): 2193-2203.
[2] Bruce P G, Freunberger S A, Hardwick L J, et al. Li-O2and Li-S batteries with high energy storage[J]. Nature Materials, 2012, 11(1): 19-29.
[3] 李慧,吴川,吴锋,等. 超高比能量锂-空气电池最新研究进展[J]. 稀有金属材料与工程,2014,43(6):1525-1530.
[4] Ogasawara T, Debart A, Holzapfel M, et a1. Rechargeable Li2O2Electrode for Lithium Batteries[J]. Journal of the American Chemical Society, 2006, 128(4): 1390-1393.
[5] Rahman M A, Wang X J, Wen C. A Review of High Energy Density Lithium-Air Battery Technology[J]. Journal of Applied Electrochemistry, 2014, 44: 5-22.
[6] Jung H G, Hassoun J, Park J B, et al. An improved high-performance lithium-air battery[J]. Nature Chemistry, 2012, 4(7): 579-585.
[7] Xu J J, Wang Z L, Xu D, et al. Tailoring deposition and morphology of discharge products towards high-rate and long-life lithium-oxygen batteries[J]. Nature Communications, 2013, 4(9): 2438-2438.
[8] Luo Z K, Liang C S, Wang F, et al. Optimizing Main Materials for a Lithium-Air Battery of High Cycle Life[J]. Advanced Functional Materials, 2014, 24(14): 2101-2105.
[9] Johnson L, Li C, Liu Z, et al. The role of LiO2solubility in O2reduction in aprotic solvents and its consequences for Li-O2batteries[J]. Nature Chemistry, 2014, 6(12): 1091-1099.
[10] Freunberger S A, Chen Y, Drewett N E, et al. The lithium-oxygen battery with ether-based electrolytes[J]. Angewandte Chemie International Edition, 2011, 50(37): 8609-8613.
[11] Mccloskey B D, Scheffler R, Speidel A, et al. On the Mechanism of Nonaqueous Li-O2Electrochemistry on C and Its Kinetic Overpotentials: Some Implications for Li-Air Batteries[J]. Journal of Physical Chemistry C, 2012, 116(45): 23897-23905.
[12] Laoire C O, Mukerjee S, Abraham K M, et al. Elucidating the Mechanism of Oxygen Reduction for Lithium-Air Battery Applications[J]. Journal of Physical Chemistry C, 2009, 113(46): 20127-20134.
[13] Freunberger S A,Chen Y,Peng Z,et al. Reactions in the Rechargeable Lithium-O2Battery with Alkyl Carbonate Electrolytes[J]. Journal of the American Chemical Society, 2011, 133(20): 8040-8047.
[14] Herranz J, Garsuch A, Gasteiger H A. Using Rotating Ring Disc Electrode Voltammetry to Quantify the Superoxide Radical Stability of Aprotic Li-Air Battery Electrolytes[J]. J.phys.chem.c, 2012, 116(36): 19084-19094.
[15] Xu W, Wang J, Ding F, et al. Lithium metal anodes for rechargeable batteries[J]. Energy & Environmental Science, 2013, 7(2): 513-537.
[16] Ding F, Xu W, Graff G L, et al. Dendrite-Free Lithium Deposition via Self-Healing Electrostatic Shield Mechanism[J]. Journal of the American Chemical Society, 2013, 135(11): 4450-4456.
[17] Ottakam Thotiyl M M, Freunberger S A, Peng Z, et al. The carbon electrode in nonaqueous Li-O2cells[J]. Journal of the American Chemical Society, 2013, 135(1): 494-500.
[18] Frackowiak E, Béguin F. Carbon materials for the electrochemical storage of energy in capacitors[J]. Carbon, 2001, 39(6): 937-950.
[19] Ming J, Park J B, Kim H S, et al. High surface area, mesoporous carbon for low-polarization, catalyst-free lithium oxygen battery[J]. Solid State Ionics, 2015, 278: 133-137.
[20] Huang S, Fan W, Guo X, et al. Positive Role of Surface Defects on Carbon Nanotube Cathodes in Overpotential and Capacity Retention of Rechargeable Lithium-Oxygen Batteries[J]. Acs Applied Materials & Interfaces, 2014, 6(23): 21567-21575.
[21] Guo Z, Zhou D, Liu H, et al. Synthesis of ruthenium oxide coated ordered mesoporous carbon nanofiber arrays as a catalyst for lithium oxygen battery[J]. Journal of Power Sources, 2015, 276: 181-188.
[22] Sun B, Huang X, Chen S, et al. Porous graphene nanoarchitectures: an efficient catalyst for low charge-overpotential, long life, and high capacity lithium-oxygen batteries[J]. Nano Letters, 2014, 14(6): 3145-3152.
[23] Xiao J, Mei D, Li X, et al. Hierarchically Porous Graphene as a Lithium-Air Battery Electrode[J]. Nano Letters, 2011, 11(11): 5071-5078.
[24] Hayashi M, Minowa H, Takahashi M, et a1. Surface Properties and Electrochemical Performance of Carbon Materials for Air Electrodes of Lithium-Air Batteries[J]. Electrochemistry, 2010, 78(5): 325-328.
[25] Tran C, Yang X Q, Qu D. Investigation of The Gas-Diffusion-Electrode Used as Lithium/Air Cathode in Non-aqueous Electrolyte and The Importance of Carbon Material Porosity[J]. Journal of Power Sources, 2010, 195(7): 2057-2063.
[26] Park J B, Lee J, Yoon C S, et al. Ordered Mesoporous Carbon Electrodes for Li-O2Batteries[J]. ACS Applied Materials & Interfaces, 2013, 5: 13426-13431.
[27] Sun B, Chen S Q, Liu H, et a1. Mesoporous Carbon Nanocube Architecture for High-Performance Lithium-Oxygen Batteries[J]. Advanced Functional Materials, 2015, 25(28): 4436-4444.
[28] Mitchell R R, Gallant B M, Thompson C V, et a1. All-Carbon-Nanofiber Electrodes for High-Energy Rechargeable Li-O2Batteries[J]. Energy & Environmental Science, 2011, 4: 2952-2958.
[29] Lim H D, Park K Y, Song H, et a1. Enhanced Power and Rechargeability of A Li-O2Battery Based on a Hierarchical-Fibril CNT Electrode[J]. Advanced Materials, 2013, 25: 1348-1352.
[30] Williford R E, Zhang J G. Air Electrode Design for Sustained High Power Operation of Li/Air Batteries[J]. Journal of Power Sources, 2009, 194: 1164 -1170.
[31] Yang X H, He P, Xia Y Y. Preparation of Mesocellular Carbon Foam and Its Application for Lithium/Oxygen Battery[J]. Electrochemistry Communications, 2009, 11: 1127-1130.
[32] Guo Z, Zhou D, Dong X, et a1. Ordered Hierarchical Mesoporous /Macroporous Carbon: A High-Performance Catalyst for Rechargeable Li-O2Batteries[J]. Advanced Materials, 2013, 25: 5668-5672.
[33] Kichambare P, Kumar J, Rodrigues S, et a1. Electrochemical Performance of Highly Mesoporous Nitrogen Doped Carbon Cathode in Lithium-Oxygen Batteries[J]. Journal of Power Sources, 201l, 196(6): 3310-3316.
[34] Nie H J, Zhang H M, Zhang Y M, et a1. Nitrogen Enriched Mesoporous Carbon As a High Capacity Cathode in Lithium-Oxygen Batteries[J]. Nanoscale, 2013, 5: 8484-8487.
[35] Wang J, Li Y, Li X, et a1. Nitrogen-Doped Carbon Nanotubes As Cathode for Lithium-Air Batteries[J]. Electrochemistry Communications, 2011, 13(7): 668-672.
[36] Oloniyo O, Kumar S, Scott K. Performance of MnO2Crystallographic Phases in Rechargeable Lithium-Air Oxygen Cathode[J]. Journal of Electronic Materials, 2012, 41(5): 921-927.
[37] Song K, Jung J, Heo Y U, et al. α-MnO2nanowire catalysts with ultra-high capacity and extremely low overpotential in lithium-air batteries through tailored surface arrangement[J]. Physical Chemistry Chemical Physics Pccp, 2013, 15(46): 20075-20079.
[38] Lee J H, Black R, Popov G, et al. The role of vacancies and defects in Na0.44MnO2nanowire catalysts for lithium-oxygen batteries[J]. Energy & Environmental Science, 2012, 5(11): 9558-9565.
[39] Shao Y, Park S, Xiao J, et al. Electrocatalysts for Nonaqueous Lithium-Air Batteries: Status, Challenges, and Perspective[J]. Acs Catalysis, 2012, 2(5): 844-857.
[40] Riaz A, Jung K N, Chang W, et al. Carbon-free cobalt oxide cathodes with tunable nanoarchitectures for rechargeable lithium-oxygen batteries[J]. Chemical Communications, 2013, 49(53): 5984-5986.
[41] Anandan V, Kudla R, Drews A, et al. Mixed Metal Oxide Catalysts for Rechargeable Lithium-Air Batteries[J]. Ecs Transactions, 2012, 41: 167-174.
[42] Li Y, Zou L, Li J, et al. Synthesis of ordered mesoporous NiCO2O4via hard template and its application as bifunctional electrocatalyst for Li-O2batteries[J]. Electrochimica Acta, 2014, 129(10): 14-20.
[43] Thapa A K. Pd/MnO2Air Electrode Catalyst for Rechargeable Lithium/Air Battery[J]. Electrochemical & Solid State Letters, 2010, 13(11): A165-A167.
[44] Barile C J, Gewirth A A. Investigating the Li-O2Battery in an Ether-Based Electrolyte Using Differential Electrochemical Mass Spectrometry[J]. Journal of the Electrochemical Society, 2013, 160(4): A549-A552.
[45] Lee J S, Sun T K, Cao R, et al. Metal-Air Batteries: Metal-Air Batteries with High Energy Density: Li-Air versus Zn-Air (Adv. Energy Mater. 1/2011)[J]. Advanced Energy Materials, 2011, 1(1): 2-2.
[46] Fu Z, Lin X, Huang T, et al. Nano-sized La0.8Sr0.2MnO3, as oxygen reduction catalyst in nonaqueous Li/O2, batteries[J]. Journal of Solid State Electrochemistry, 2012, 16(4): 1447-1452.
[47] Han X, Hu Y, Yang J, et al. Porous perovskite CaMnO3as an electrocatalyst for rechargeable Li-O2batteries[J]. Chemical Communications, 2013, 50(12): 1497-1499.
[48] Kalubarme R S, Cho M S, Kim J K, et al. Ceria based catalyst for cathode in non-aqueous electrolyte based Li/O2batteries[J]. Nanotechnology, 2012, 23(43): 435703-435703.
[49] Trahey L, Johnson C S, Vaughey J T, et al. Activated Lithium-Metal-Oxides as Catalytic Electrodes for Li-O2Cells[J]. Electrochemical Society, 2011, 14(5): A64-A66.
[50] Lu Y C, Gasteiger H A, Parent M C, et al. The Influence of Catalysts on Discharge and Charge Voltages of Rechargeable Li-Oxygen Batteries[J]. Electrochemical and Solid-State Letters, 2010, 13(6): A69-A72.
[51] Lu Y C, Xu Z, Gasteiger H A, et al. Platinum-gold nanoparticles: a highly active bifunctional electrocatalyst for rechargeable lithium-air batteries[J]. Journal of the American Chemical Society, 2010, 132(35): 12170-12171.
[52] Kanasugi H. A study of PtxCoy, alloy nanoparticles as cathode catalysts for lithium-air batteries with improved catalytic activity[J]. Journal of Power Sources, 2013, 244(4): 488-493.
[53] Kim B G, Kim H J, Back S, et al. Improved reversibility in lithium-oxygen battery: understanding elementary reactions and surface charge engineering of metal alloy catalyst[J]. Scientific Reports, 2014, 4(7489): 4225.
[54] Sun B, Munroe P, Wang G. Ruthenium nanocrystals as cathode catalysts for lithium-oxygen batteries with a superior performance[J]. Scientific Reports, 2013, 3(7): 2247.
[55] Ke F S, Solomon B C, Ma S G, et al. Metal-carbon nanocomposites as the oxygen electrode for rechargeable lithium-air batteries[J]. Electrochimica Acta, 2012, 85(4): 444-449.
[56] Jung H G, Jeong Y S, Park J B, et al. Ruthenium-based electrocatalysts supported on reduced graphene oxide for lithium-air batteries[J]. Acs Nano, 2013, 7(4): 3532-3539.
[57] Chen Y, Freunberger S A, Peng Z, et al. Charging a Li-O2battery using a redox mediator[J]. Nature Chemistry, 2013, 5(6): 489-494.
[58] Kim D S, Yong J P. Effect of multi-catalysts on rechargeable Li-air batteries[J]. Journal of Alloys & Compounds, 2014, 591(591): 164-169.

