贮藏时间和贮藏方式对八角茴香油质量及抑菌活性的影响
李萍,舒展,申晓霞,黄治强
(天津农学院 基础科学学院,天津,300384)
·贮运与保鲜·
贮藏时间和贮藏方式对八角茴香油质量及抑菌活性的影响
李萍*,舒展,申晓霞,黄治强
(天津农学院 基础科学学院,天津,300384)
为探讨八角茴香油的最佳贮藏方式,采用称重法和琼脂-孔洞扩散法分别研究了八角茴香油在3种不同贮藏方式下质量和抑菌活性随时间的变化规律。结果表明:水蒸气蒸馏法提取的八角茴香油共有12种组分,主要成分类型是苯基丙烯基类化合物,其中反式茴香脑含量为94.897%。随着时间的延长,八角茴香油质量和抑菌活性均有一定程度下降。光照在短时间内对八角茴香油质量损失影响很小,温度对质量损失有较大影响。在107 d监测期内,八角茴香油对所有供试菌种的抑制活性始终是室温闭口自然光贮藏方式下最好,室温闭口自然光贮藏是八角茴香油的安全贮藏方式。随着浓度的增加,八角茴香油对供试菌种抑制作用加强。八角茴香油对供试微生物的抑制效果随时间延长虽然下降,但107 d后室温闭口自然光贮藏的浓度为333.3 mg/mL的八角茴香油对所有供试细菌和酵母菌抑制率仍然在50%以上,保持了对细菌和酵母菌良好的抑菌活性。在实验浓度内,八角茴香油对大肠杆菌抑制效果始终高于其他菌种,但对两种霉菌的抑制效果难以较长时间保持。
八角茴香油;贮藏时间;贮藏方式;质量;抑菌活性
食物易受病原微生物侵扰,引起食源性疾病。化学保鲜剂由于价格低廉、有效,目前仍然是果蔬贮藏保鲜的主要措施。但是,多数化学保鲜剂残留较高,可能对人类健康造成危害[1-2]。研究发现,多种植物精油具有显著的抑菌效果,是一类安全有效的天然植物源抗菌剂,在食品保鲜领域具有广阔的应用前景[3-5]。其中,八角茴香油是从八角果实、枝、叶等部位提取得到的无色至浅黄色透明油状液体,是八角茴香有效成分之一。关于八角茴香油的组成、抗病毒、抗氧化、杀蚊虫、抗菌等活性已有大量报道[6-10],八角茴香油甚至还可以掺入壳聚糖中制成可食用抗菌膜,延长食品保质期[11]。然而,八角茴香油易挥发、稳定性差,在贮藏过程中易受空气、光照、温度等影响导致质量和生理活性的变化,甚至产生不愉快气味[12]。关于八角茴香油在不同贮藏方式下质量和抑菌活性随时间的变化情况未见文献报道,对八角茴香油的最佳贮藏方式和保质期也未见建议和明确界定。
八角茴香油的提取方法很多,如水蒸气蒸馏法、超临界萃取法和有机溶剂提取法等[13-14]。其中,水蒸气蒸馏法是我国药典推荐的植物精油提取方法,在工业上也得到广泛应用。有文献报道称,水蒸气蒸馏法提取的八角茴香油,其主要成分反式茴香脑含量及抑菌活性比有机溶剂提取法高[15]。因此,本文以水蒸气蒸馏法提取的八角茴香油为试材,研究3种不同贮藏方式下八角茴香油质量和抑菌活性随时间的变化规律,探讨影响八角茴香油贮藏稳定性的一些因素(如光照、温度等),以期寻找八角茴香油的最佳贮藏方式。
1 材料与方法
1.1 材料与试剂
材料:大红八角,产地广西,9~10月采收,购于农贸市场。大红八角整果(带种子)室温下阴干两周,粉碎,过20目筛,取筛下粉末备用。
供试微生物:3种细菌(大肠杆菌、产气肠杆菌、枯草芽孢杆菌);2种酵母菌(啤酒酵母、酿酒酵母);2种霉菌(青霉、黑曲霉),由天津农学院农学与资源环境学院微生物实验室提供,4℃斜面保存,用前活化。培养基:牛肉膏蛋白胨琼脂培养基(细菌用);酵母膏胨葡萄糖琼脂培养基(酵母菌用);马铃薯葡萄糖琼脂培养基(霉菌用)。
试剂:NaCl、石油醚(30~60 ℃),无水Na2SO4、N,N-二甲基甲酰胺(DMF)均为分析纯,正己烷,色谱纯。
1.2 仪器与设备
粉碎机,北京燕山正德机械设备有限公司;移液器,德国Eppendorf公司;DX-35BI型立式压力蒸汽灭菌锅,上海博迅实业有限公司;Thermo Scientific MSC-Advantage Ⅱ级生物安全柜,德国Thermo Fisher Scientific公司; LRH-250-S恒温恒湿培养箱,广东省医疗器械厂; 7890A/5975C型气相色谱-质谱联用仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 水蒸气蒸馏法提取八角茴香油
称取30 g八角茴香果实粉末(准至0.000 1 g)置于圆底烧瓶中,加入600 mL蒸馏水,浸泡24 h。水蒸气蒸馏至馏出液不再混浊为止,收集馏出液,冷至室温,盐析,转入分液漏斗,石油醚萃取2次(每次20 mL),合并上层石油醚层,无水硫酸钠干燥,过滤,水浴回收石油醚,残留物即为八角茴香油,称重,按公式(1)计算提取率[16]。
(1)
1.3.2 气相色谱-质谱(GC-MS)定性分析及定量测定
色谱条件:根据文献9的GC-MS测试条件并做适当修改,HP-5MS色谱柱(30m×0.25mm,0.25μm);载气(He)流速1.0mL/min;进样口温度220 ℃,自动进样,进样量0.5μL,分流比20∶1;升温程序:初始60 ℃,保持1min,5 ℃/min升至160 ℃,保持4min,5 ℃/min升至210 ℃,保持5min,总运行时间40min。
质谱条件:电子轰击离子源:电子能量70eV,接口温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,采集模式:全扫描,质量扫描范围:30~550amu。组分的定性鉴定是采用NIST2008标准谱库进行检索并与相关文献比较,用峰面积归一化法计算各成分相对百分含量。
采用选择离子监测模式[17-18]定量测定107d后不同贮藏方式下八角茴香油中主要成分反式茴香脑的残留情况,特征离子为m/z=105.0、117.0、133.0、148.0,定量离子为m/z=148.0。标准曲线的制作:反式茴香脑用正己烷稀释成0.1、0.2、0.4、0.6、0.8g/mL,按选定的色谱、质谱条件,以反式茴香脑浓度为横坐标,响应值为纵坐标绘制标准曲线,得到回归方程:y=1.480E+06c-84 535,y为响应值,c为反式茴香脑浓度,单位为g/mL,R2=0.998 1(n=5)。
1.3.3 贮藏时间和贮藏方式对八角茴香油质量的影响
八角茴香油分别置于室温敞口自然光、室温闭口自然光、室温闭口避光和冰箱冷藏闭口避光4种方式下贮藏107d,监测时间为2015年6~9月,间隔一定时间取样并称量八角茴香油的质量,每种处理重复3次,取平均值作为测定结果,按公式(2)计算其质量损失率。

(2)
1.3.4 贮藏时间和贮藏方式对八角茴香油抑菌活性的影响
分别将八角茴香油置于室温闭口自然光、室温闭口避光和冰箱冷藏闭口避光3种方式下贮藏107 d,间隔一定时间取样并采用琼脂-孔洞扩散法测定八角茴香油的抑菌活性。
供试样品溶液配制:八角茴香油原液浓度为1 000.0 mg/mL,用DMF作溶剂,采用3倍连续稀释法配制一系列不同浓度的八角茴香油供试样品溶液。
菌悬液制备:活化后的菌种接入液体培养基(不加琼脂),摇床培养。细菌用平板稀释法计算菌落数[19],酵母用血球计数法计算菌落数[19],用无菌生理盐水调节细菌和酵母菌悬液浓度均为107CFU/mL。霉菌培养后用适量无菌生理盐水冲洗并收集孢子,充分振荡,制成孢子数为107个/mL的菌液。
琼脂-孔洞扩散法测定抑菌活性操作步骤:灭菌培养基冷至50 ℃,加入5 mL菌悬液,混匀,倒入直径9 cm培养皿中,每皿20 mL,静置40 min。在固化后的培养基上用无菌打孔器均匀打孔(直径7 mm),记号。每孔加入40 μL不同浓度的八角茴香油供试样品溶液,DMF作空白对照。细菌37 ℃培养24 h,酵母菌28 ℃培养48 h,霉菌25 ℃培养72 h。测量并记录抑菌圈直径(mm),每个浓度重复3次,取平均值作为测定结果,按公式(3)计算八角茴香油对供试菌种抑制率[20-21]。

(3)
2 结果与分析
2.1 水蒸气蒸馏法提取的八角茴香油化学组成分析
水蒸气蒸馏法提取的八角茴香油为浅黄色透明油状液体,具有八角茴香气味,提取率为8.5%。采用GC-MS对八角茴香油的化学组成进行分析,图1显示了总离子流色谱图,表1列出了组分鉴定结果。

表1 八角茴香油化学组成
注:组分是按照它们从HP-5MS柱子上的洗脱顺序列出。
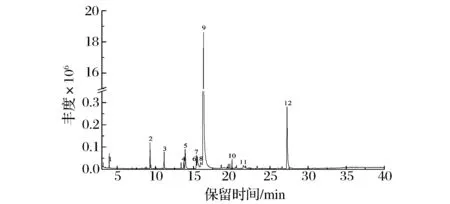
图1 水蒸气蒸馏法提取的八角茴香油总离子流色谱图Fig.1 Total ion chromatogram of the star anise oil extracted by hydro-distillation注:图1中峰号的数字与表1的物质序号对应一致。
可以看出,水蒸气蒸馏法提取的八角茴香油中共鉴定出12种组分,化学成分类型包括:苯基丙烯基类(97.244%)、醛类(1.055%)、苯基烯丙基类(0.706%)、单萜类(0.374%)、单萜醇类(0.349%)、甲苯(0.137%)和单环倍半萜类(0.135%),最主要成分反式茴香脑含量为94.897%,文中的水蒸气蒸馏法提取的八角茴香油中最主要成分反式茴香脑及其含量与HUANG等[22](89.5%)和RITTER等[23](98.1%)的研究结果一致,但精油其他组分和含量略有区别,这可能与八角茴香果实的来源、生长环境、采收时间和提取方法有关。
2.2 贮藏时间和贮藏方式对八角茴香油质量的影响
4种贮藏方式下八角茴香油质量损失率随时间的变化见图2。
可见,随着时间的延长,不同贮藏方式的八角茴香油质量损失均有所增加。其中,室温敞口自然光贮藏的八角茴香油质量损失最严重,第1天就达到41.75%,此后损失趋于平缓,107 d后损失率为64.41%,说明八角茴香油具有很强的挥发性,常温下即可挥发。精油中较低分子质量的萜类(尤其是单萜和倍半萜)和醇类在贮存前半期非常容易挥发[24],反式茴香脑长时间贮存,含量也会有所下降,这些都会导致八角茴香油在贮藏过程中质量的损失。此外,还可以看出,室温闭口自然光与室温闭口避光贮藏的八角茴香油质量损失率非常接近,尤其是贮藏27 d后,曲线几乎重合,说明光照条件在短时间内对八角茴香油的质量损失影响很小。冰箱冷藏闭口避光贮藏的八角茴香油质量损失最小,107 d后损失率为22.48%,比室温闭口避光贮藏的八角茴香油的损失还少16.42%,说明温度对八角茴香油质量损失有较大影响,低温贮藏有利于减弱八角茴香油的挥发损失。
2.3 贮藏时间和贮藏方式对八角茴香油抑菌活性的影响
2.3.1 不同贮藏方式下八角茴香油对同一菌种抑制活性的变化
图3显示了3种贮藏方式下八角茴香油对同一菌种抑制活性随时间的变化情况。

(a)大肠杆菌;(b)产气肠杆菌;(c)枯草芽孢杆菌;(d)啤酒酵母;(e)酿酒酵母;(f)青霉;(g)黑曲霉图3 不同贮藏方式下八角茴香油对同一菌种抑制活性的变化Fig.3 Changes of antimicrobial activities of star anise oil under different storage ways against the same strain(注:八角茴香油质量浓度为333.3 mg/mL)
可见,随着时间的延长,不同贮藏方式的八角茴香油对同一菌种抑制率均呈下降趋势,前7 d内变化最快,此后趋于平缓。107 d内,八角茴香油对大肠杆菌和产气肠杆菌抑制活性始终是室温闭口自然光>冰箱冷藏闭口避光>室温闭口避光,而对枯草芽孢杆菌抑制活性始终是室温闭口自然光>室温闭口避光>冰箱冷藏闭口避光;对供试2种酵母菌和2种霉菌抑制活性始终是室温闭口自然光>室温闭口避光>冰箱冷藏闭口避光。可以看出,在107 d贮藏监测期内,八角茴香油对所有供试菌种抑制活性始终都是室温闭口自然光贮藏方式下最好。
图4是琼脂-孔洞扩散法测定八角茴香油抑菌活性的培养皿照片,可见,抑菌圈形状完整,清晰,此方法测定结果准确可靠。
八角茴香油的抑菌活性与其主要成分反式茴香脑有关,HUANG等[22]研究了八角茴香油及其主要成分反式茴香脑对11种霉菌的抑制作用,发现反式茴香脑是八角茴香油具有抗真菌活性的主要原因;KARAPINAR[25]等证实了茴香脑对3种食源性致病菌的抑制作用;QIU等[26]报道了八角茴香油对金黄色葡萄球菌的抑制作用主要源于高含量的反式茴香脑。GC-MS检测到107 d后,贮藏在室温闭口自然光下八角茴香油中主要成分反式茴香脑的残留浓度为0.62 g/mL,是3种贮藏方式中最高的(表2)。冰箱冷藏闭口避光贮藏的八角茴香油中反式茴香脑浓度降低最多,残留浓度仅为0.38 g/mL,虽然冰箱冷藏闭口避光贮藏的八角茴香油质量损失最小(107 d后损失率为22.48%),但在此条件下贮藏的八角茴香油对供试酵母菌和霉菌的抑制活性难以较长时间保持。相反,室温闭口自然光贮藏有利于八角茴香油对食源性致病菌及酵母菌、霉菌等果蔬腐败性真菌抑制活性的维持,延长果蔬保质期。结合抑菌活性的变化规律及GC-MS定量分析结果可知,室温闭口自然光贮藏有利于八角茴香油对供试菌种抑制活性的较长时间保持,是八角茴香油的安全贮藏方式。

(a)大肠杆菌;(b)产气肠杆菌;(c)枯草芽孢杆菌;(d)啤酒酵母;(e)酿酒酵母;(f)青霉;(g)黑曲霉图4 琼脂-孔洞扩散法测定八角茴香油抑菌活性的培养皿照片Fig.4 Petri dish photos of antibacterial activity of star anise oil determined by agar-hole diffusion assay(注:八角油的浓度分别为:1孔:1 000.0 mg/mL;2孔:333.3 mg/mL;3孔:111.1 mg/mL;4孔:37.0 mg/mL;5孔:12.3 mg/mL)
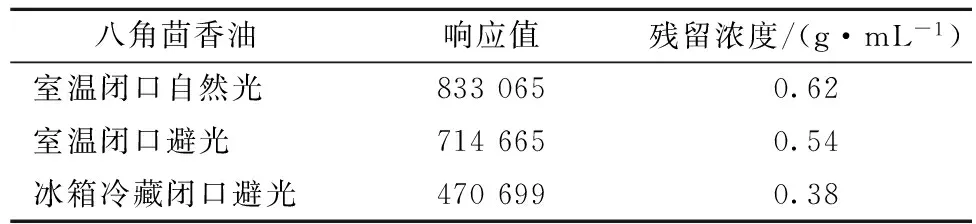
八角茴香油响应值残留浓度/(g·mL-1)室温闭口自然光8330650.62室温闭口避光7146650.54冰箱冷藏闭口避光4706990.38
注:八角茴香油中反式茴香脑的初始浓度为0.95 g/mL。
2.3.2 浓度对八角茴香油抑菌活性的影响
室温闭口自然光贮藏的不同浓度八角茴香油对供试菌种抑制活性随时间的变化情况见图5。
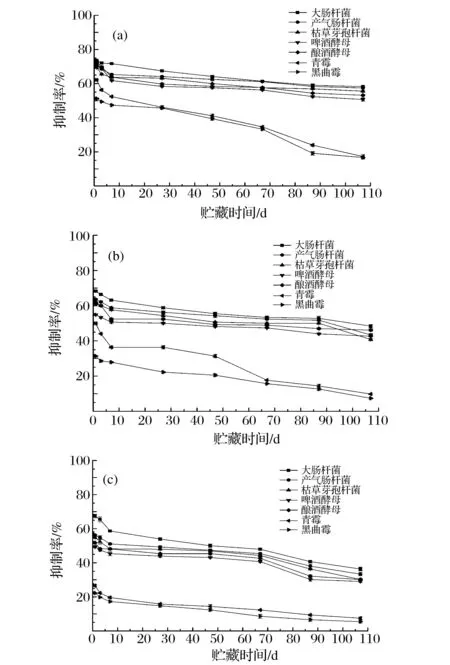
八角茴香油的浓度分别为(a)333.3 mg/mL;(b)111.1 mg/mL;(c)37.0 mg/mL图5 室温闭口自然光贮藏的八角茴香油对供试菌种抑制活性的变化Fig.5 Changes of inhibitory effects of the star anise oil sealed stored under natural light at room temperature against tested strains
可见,随着浓度的增加,八角茴香油对供试菌种抑制作用加强。供试微生物中既有革兰氏阴性菌又有革兰氏阳性菌、酵母菌和霉菌,说明八角茴香油具有广谱抗菌性。贮藏107 d内,不同浓度八角茴香油对大肠杆菌的抑制效果始终高于其他菌种,说明其可以减弱大肠杆菌对果蔬的侵蚀,减少食源性疾病。室温闭口自然光下贮藏107 d后,浓度为333.3、111.1、37.0 mg/mL的八角茴香油对大肠杆菌抑制效果分别下降了15.75%、19.95%、31.47%,对黑曲霉抑制效果分别下降了34.62%、24.18%、16.99%。此外,不同浓度八角茴香油对供试微生物抑制效果随时间的延长虽然下降,但室温闭口自然光下贮藏107 d后,浓度为333.3 mg/mL的八角茴香油对所有供试细菌和酵母菌抑制率仍然在50%以上,保持了对细菌和酵母菌良好的抑菌活性。在实验浓度范围内,八角茴香油对两种霉菌的抑制效果难以较长时间保持。
3 结论
本文研究了水蒸气蒸馏法提取的八角茴香油在3种不同贮藏方式下质量及抑菌活性随时间的变化规律,结论如下:水蒸气蒸馏法提取的八角茴香油共有12种组分,主要成分类型是苯基丙烯基类化合物,反式茴香脑含量为94.897%。随着时间的延长,八角茴香油质量和抑菌活性均有一定程度下降。光照在短时间内对八角茴香油质量损失影响很小,温度对质量损失有较大影响。在107 d监测期内,八角茴香油对所有供试菌种抑制活性始终是室温闭口自然光贮藏方式下最好,室温闭口自然光贮藏是八角茴香油的安全贮藏方式。随着浓度的增加,八角茴香油对供试菌种抑制作用加强。八角茴香油对供试微生物抑制效果随时间的延长虽然下降,但107 d后室温闭口自然光贮藏的浓度为333.3 mg/mL的八角茴香油对所有供试细菌和酵母菌抑制率仍然在50%以上,保持了对细菌和酵母菌良好的抑菌活性。在实验浓度内,八角茴香油对大肠杆菌抑制效果始终高于其他菌种,但对2种霉菌的抑制效果难以较长时间保持。
[1] MARTINEZ G C,GONZALEZ B C A,CABELLERO V A M,et al.Use of herbs and spices for food preservation:advantages and limitations[J].Current Opinion in Food Science, 2015, 6:38-43.
[2] 关文强,李淑芬.天然植物提取物在果蔬保鲜中应用研究进展[J].农业工程学报, 2006,22(7):200-204.
[3] XING Ya-ge,XU Qing-lian,Li Xi-hong,et al.Antifungal activities of clove oil against Rhizopus Nigricans,Aspergillus Flavus and Penicillium Citrinum in vitro and in wounded fruit test[J].Journal of Food Safety, 2012, 32(1):84-93.
[4] XING Ya-ge,Li Xi-hong,XU Qing-lian,et al.Antifungal activities of cinnamon oil againstRhizopusnigricans,Aspergillus flavus andPenicilliumexpansumin vitro and in vivo fruit test[J].International Journal of Food Science and Technology,2010, 45(9):1 837-1 842.
[5] KOCEVSKI D,DU Mu-ying,KAN Jian-quan,et al.Antifungal effect of Allium tuberosum,Cinnamomum cassia,and Pogostemon cablin essential oils and their components against population of Aspergillus Species[J].Journal of Food Science,2013,78(5):M731-737.
[6] CAI Ming,GUO Xiang-yang,LIANG Han-hua,et al.Microwave-assisted extraction and antioxidant activity of star anise oil fromIlliciumverumHook.f.[J].International Journal of Food Science & Technology, 2013, 48(11):2 324-2 330.
[7] DOMICIANO P T,OLIVEIRA DALALIO M M,SLIVA E L,et al.Inhibitory effect of anethole in nonimmune acute inflammation[J]. Naunyn-schmiedeberg′s Archives of Pharmacology,2013, 386(4):331-338.
[8] YANG Cheng-hong,CHANG Fang-rong,CHANG Hsueh-wei,et al.Investigation of the antioxidant activity of Illicium verum extracts[J].Journal of Medicinal Plants Research,2012,6(2):314-324.
[9] KIMBARIS A C, KOLIOPOULOS G,MICHAELAKIS A,et al.Bioactivity of Dianthus caryophyllus,Lepidium sativum,Pimpinella anisum,and Illicium verum essential oils and their major components against the West Nile vector Culex pipiens[J].Parasitol Research,2012,111(6):2 403-2 410.
[10] TAREK N, HASSAN H M, ELGHANI S M M,et al.Comparative chemical and antimicrobial study of nine essential oils obtained from medicinal plants growing in Egypt[J].Beni-Suef University Journal of Basic and Applied Sciences,2014,3(2):149-156.
[11] WANG Li-na,LIU Fei,JIANG Yan-feng,et al.Synergistic antimicrobial activities of natural essential oils with chitosan films[J]. Journal of Agricultural and Food Chemistry,2011,59(23):12 411-12 419.
[12] TUREK C, STINTZING F C.Stability of essential oils:a review[J].Comprehensive Reviews in Food Science and Food Safety,2013,12(1):40-53.
[13] RODRIGUES V M,ROSA P T V,MARQUES M O M,et al.Supercritical extraction of essential oil from aniseed(PimpinellaanisumL)using CO2:solubility,kinetics, and composition data[J].Journal of Agricultural and Food Chemistry,2003, 51(6):1 518-1 523.
[14] VIJAYAKUMAR A,DURAIPANDIYAN V,JEYARAJ B,et al.Phytochemical analysis andinvitroantimicrobial activity ofIlliciumgriffithiiHook.f.&Thoms extracts[J].Asian Pacific Journal of Tropical Disease,2012,2(3):190-199.
[15] SINGH G,MAURYA S,DELAMPASONA MP,et al.Chemical constituents, antimicrobial investigations and antioxidative potential of volatile oil and acetone extract of star anise fruits[J].Journal of the Science of Food and Agriculture,2006,86(1):111-121.
[16] 李瑞红,王宗义,仝其根.不同提取方法制得茴香油的甄别研究[J].中国粮油学报,2012,27(11): 50-53.
[17] 王海凤,刘海学,王俊斌,等.气相色谱-质谱法测定高粱籽粒中11种有机磷农药残留量[J].理化检验-化学分册,2013,49(6): 651-653.
[18] 舒婷,李萍,王英超,等.储藏时间和方式对肉桂油重量及抑菌性的影响[J].食品研究与开发,2016,37(7): 189-193.
[19] 程丽娟,薛泉宏.微生物学实验技术(第二版)[M].北京:食品科学技术出版社, 2012:30,61.
[20] WANG Da-cheng,SUN Su-hua,SHI Li-na,et al.Chemical composition ,antibacterial and antioxidant activity of the essential oils ofMetaplexisjaponicaand their antibacterial components[J].International Journal of Food Science and Technology,2015,50(2):449-457.
[21] ALBAYRAK S and AKSOY A.Evaluation of antioxidant and antimicrobial activities of two endemic anthemis species in turkey[J].Journal of Food Biochemistry,2013,37(6):639-645.
[22] HUANG Yong-fu,ZHAO Jiang-lin,ZHOU Li-gang,et al.Antifungal activity of the essential oil ofIlliciumverumfruit and its main component trans-anethole[J].Molecules,2010,15(11):7 558-7 569.
[23] RITTER A M V,DOMICIANO T P,VERRI JR W A,et al.Antitypernociceptive activity of anethole in experimental inflammatory pain[J].Inflammopharmacology,2013,21(2):187-197.
[24] 罗静,钟永科,李明明,等.小茴香储存过程中挥发性成分的变化[J].中国调味品,2016,41(3): 49-52.
[25] KARAPINAR M,AKTUG S E.Inhibition of foodborne pathogens by thymol, eugenol, menthol and anethole[J].International Journal of Food Microbiology,1987,4(2):161-166.
[26] QIU Jia-zhang,LI Hong-en,SUN Hong-wei,et al.Chemical composition of fennel essential oil and its impact on Staphylococcus aureus exotoxin production[J]. World Journal of Microbiology and Biotechnology,2012, 28(4):1 399-1 405.
Effects of storage time and methods on weight loss and antimicrobial activity of star anise oil
LI Ping*, SHU Zhan, SHEN Xiao-xia, HUANG Zhi-qiang
(College of Basic Science, Tianjin Agricultural University, Tianjin 300384, China)
The changes of weight and antimicrobial activities of star anise oil stored under three different methods were studied. Weighting method and agar-hole diffusion assay were used to investigate the best storage way for star anise oil. Chemical composition of hydro-distillation extracted star anise oil was analyzed by gas chromatography-mass spectrometry(GC-MS). Twelve compounds were identified and main component was phenyl propenyl,andtrans-anethole content was 94.897%. The weight loss and antimicrobial activity of star anise oil all showed a certain degree of declination with time increasing under different storage conditions. Light had little effect on weight loss,while temperature had great impact. Star anise oil sealed stored under natural light at room temperature showed the best bacterial inhibitory activity during 107 day experiment. This indicated that sealed stored under natural light at room temperature was a safe storage. The inhibitory effect on the tested strains increased with oil concentration increasing. Although,the inhibitory effect of star anise oil against tested strains reducing with time increasing, sealed packing under natural light at room temperature with a concentration of 333.3 mg/mL still remained more than 50% of inhibition activity after 107 days. In addition,star anise oil showed higher inhibitory effect onEscherichiacolithan other strains during the storage, but hard to maintain the inhibitory effect on two molds.
star anise oil; storage time ; storage way; weight; antimicrobial activity
10.13995/j.cnki.11-1802/ts.201702040
硕士,讲师(本文通讯作者,E-mail:liping790520@126.com)。
2016-06-20,改回日期:2016-07-19
天津市应用基础与前沿技术研究计划项目(14JCQNJC06300);2016年天津市大学生创新创业训练计划项目(201610061067)

