土壤理化性质与青稞根腐病发生的关系
李雪萍,李建宏,姚 拓,漆永红,刘 丹,郭 炜,李敏权,2
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃省农业科学院,甘肃 兰州 730070)
土壤理化性质与青稞根腐病发生的关系
李雪萍1,李建宏1,姚 拓1,漆永红1,刘 丹1,郭 炜1,李敏权1,2
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃省农业科学院,甘肃 兰州 730070)
调查了甘肃省甘南州成株期青稞根腐病的发生危害,并采集青稞健康植株和根腐病植株根际土壤,测定了土壤理化性质和土壤酶活性,以评价土壤理化性质与青稞根腐病的关系。结果表明,甘肃甘南州青稞发病率在5%~20%,同一样地青稞病健康植株根际土壤黏粒、粉粒、砂粒、有机质、有效磷、速效钾、铵态氮、硝态氮的含量及pH无差异,即与根腐病发病率相关性不显著,但土壤酶活性均存在显著差异,健康植株根际过氧化酶活性大于病株(H>D)的占64%,其中,50%差异显著;健株根际土壤碱性磷酸酶活性大于病株(H>D)的占93%,其中,有79%差异显著;健康植株根际土壤脲酶活性大于病株(H>D)的占71%,且均有显著性差异;健康植株根际土壤纤维素酶活性小于病株(H
青稞;根腐病;土壤酶;土壤理化性质
我国现行的植物病害防治工作的方针是“预防为主,综合防治”[1],在此方针指引下,植物病害发生的预测和预防成为了研究的热点。根腐病是我国青稞的主要病害,其一旦流行,很难治理,及时的预测和预防是防止该病害发生的有效手段。土壤酶在土壤物质循环和能量转化过程中起着重要作用[2],其活性对外界因素的变化敏感[3],极易受到环境条件的影响[4-5]。因此,研究青稞根际土壤酶活性与根腐病发生的关系具有重要的意义。青稞(Hordeumvulgare)是我国的青藏高原地区对多棱裸粒大麦的统称,也叫元麦、淮麦或裸大麦,属禾本科(Gramineae)小麦族(Triticeae)大麦属(Hordeum)大麦变种[6]。其不仅是欧洲马其顿、澳大利亚、加拿大西部和美国北部大平原等地区的饲用作物,也是我国藏区人民的主食。与其他谷物相比,青稞具有蛋白质、纤维素、维生素和矿质元素含量高,总糖和脂肪含量低的特点,符合现代人类“三高两低”(高蛋白、高纤维、高维生素和低脂肪、低糖)的饮食结构需要[7],而根腐病造成了青稞严重减产[8]。根腐病是大麦属作物的主要病害之一,可以造成作物产量降低、品质下降,在加拿大和美国北达科他,由于根腐病造成大麦类作物减产近10%[9]。Amira[10]研究表明,感染根腐病的大麦与健康大麦相比,根和芽的鲜重和干重、每棵植株谷粒数都下降严重,从而导致其总产量下降。有报道土壤理化性质的改善对植物根腐病的发生有防治作用。也有学者研究指出,土壤酶可以作为某些农作物土传病害预测的一个重要指征[11-13]。游春梅等[14]研究显示,土壤中的蔗糖酶、纤维素酶、脲酶、磷酸酶等与三七根腐病害的发生有关联性。目前,对于大麦属作物病害研究主要集中在大麦条纹病[15-16]、黑穗病[17]、锈病等[18-19]方面,对于根腐病的研究较少。研究青稞根腐病的发生规律,探索其预测和预防方法,是一项极为迫切的工作。因此,通过测定青稞根腐病植株和健康植株根际土壤理化性质及酶活性,明确青稞根腐病发生与土壤酶活性的关系及规律,以期为青稞根腐病的预测和预防体系的建立提供理论依据。
1 材料和方法
1.1 调查采样
于2015年8月4日~8月6日赴甘肃青稞主产区甘南州合作市卡加曼乡沟七峡村、当周街道打沙村、多河乡更治地村、那吾乡多河村;临潭县术布乡亦子多村、羊永乡杨升村、长川乡敏家嘴村、古战乡包家寺村;卓尼县完冒乡卡样村、阿子滩乡古战川村和阿子瑭玛纳村对成株期青稞根腐病发生情况进行调查,参考《植病研究法》[20]。并采用多点采样法采集根腐病发病特征典型的青稞植株和同一样地健康植株及其根际土壤,共采得成株期青稞根腐病病株和健株样品各14份,然后将各样品低温运输至实验室备用。
1.2 土壤样品预处理
收集青稞样品根际土壤,风干后过2 mm筛,再将其置于25℃的生化培养箱中培养7 d。
1.3 土壤理化性质测定
测定预处理后的样品的理化性质,包括黏粒、粉粒、沙粒3种物理性质和有效磷、速效钾、铵态氮、硝态氮、有机质和pH等6种化学性质。粘粒、粉粒、砂粒采用马尔文2000型激光粒度仪测定土壤粒度,再根据国标(GBSBYT1995)计算黏粒、粉粒、砂粒的比例。有效磷采用碳酸氢钠浸提法测定,速效钾采用火焰光度测定法,铵态氮采用靛酚蓝比色法,土壤硝态氮采用双波长紫外分光光度法,有机质的测定采用重铬酸钾硫酸外加热法,pH用PHS-3C型pH测定计测定[21-22]。
1.4 土壤酶活性测定
对预处理后的样品进行土壤酶活性测定,包括蔗糖酶活性、脲酶、碱性磷酸酶、过氧化氢酶和纤维素酶5种酶活性。蔗糖酶活性采用改良后的3,5-二硝基水杨酸比色法测定,脲酶采用靛酚比色法测定,碱性磷酸酶采用磷酸苯二钠比色法,过氧化氢酶采用改良后的滴定法来测定,纤维素酶采用滤纸崩溃法[23]。
1.5 数据处理与分析
试验数据整理与处理采用Excel 2007完成,统计分析采用DPS 7.65进行,并采用Duncan新复极差法进行差异显著性分析,Pearson进行相关性分析并检测其显著性。
2 结果与分析
2.1 青稞根腐病的发生
10个乡镇11个村成株期青稞根腐病发病严重,发病率在5%~20%(表1)。

表1 采样地概况及发病率
注:“-”表示此处空白
2.2 青稞病健植株根部土壤的理化性质
2.2.1 各样品根部土壤的物理性质 同一样地青稞样品发病株根际土壤黏粒含量和健康株根际土壤黏粒含量基本相同,而不同样地之间,无论是健康植株还是发病植株,土壤黏粒含量之间多有差异,N1、N2、N3、N9间差异显著(P<0.05);而样品N3,N4和N5之间差异显著(P<0.05),N10,N13和N14之间差异不显著(图1)。同样,同一样地病株和健康植株根际土壤粉粒含量也基本相同,而不同样地样品之间也存在差异,样品N1、N2、N3、N5、N6、N7、N8、N11、N12、N13之间差异显著;但样品N3与N4之间差异不显著,N9和N10、N12和N14之间的差异均不显著(P<0.05)(图2)。
同一样地采集的发病株和健康植株根际土壤砂粒含量基本相同,不存在差异;但不同样地青稞根际土壤样品之间砂粒含量有差异,样品N1、N2、N3、N5、N6、N7、N8、N11之间存在显著差异(P<0.05),而N3、N4、N9、N10、N12、N13、N14之间不存在显著差异(P>0.05)(图3)。

图1 样品土壤黏粒含量Fig.1 Clay content注:图中不同小写字母表示差异显著(P<0.05),下同

图2 样品土壤粉粒含量Fig.2 Silt content

图3 样品的土壤砂粒含量Fig.3 Sand content
2.2.2 各样品根部土壤的化学性质 各样品有效磷含量较高,最高达到99.4 mg/kg。同一样地样品发病株和健康株根际土壤有效磷含量相同;而不同样地之间有效磷含量大多存在显著差异,样品N1、N2、N5、N7、N8、N9、N10、N11、N14之间存在显著差异(P<0.05),但样品N2,N3和N4,N11和N14之间土壤样品有效磷含量差异不存在显著性(P>0.05)(图4)。所有样品的速效钾含量均在120~320 mg/kg,且同一样地样品,发病株和健康株根际土壤速效钾含量大多相同,而样品N10,N11和N13等发病株和健康株根际土壤速效钾含量有所差异,但差异不显著。不同样地健康植株N2、N3、N4、N5、N6样品发病株之间速效钾含量无显著差异,而发病样品N1,N6和N7,样品N9、N10、N11、N12、N14之间也差异不显著;而样品N1、N2、N7之间,样品N3与N8之间等健株根部土壤样品速效钾存在显著差异(P<0.05)(图5)。
同一样地采集的发病株和健康植株根际土壤铵态氮的含量大多相同,只有样品N10和N11健康植株根际土壤铵态氮含量高于发病株,但不存在显著差异,样品N13和N14则是发病株根际土壤铵态氮的含量明显大于健康株,且差异显著(P<0.05);不同样地各样本根际土壤铵态氮的含量多数差异不显著,而 N2,N9和N13存在显著差异(图6)。

图4 各样品土壤有效磷含量Fig.4 Soil available phosphorus content

图5 各样品土壤速效钾含量Fig.5 Soil available potassium content

图6 各样品土壤氨态氮含量Fig.6 Soil ammonium nitrogen content
根际土壤硝态氮含量,同一样地采集的样品除N10和N14发病株含量略高于健康株外,其他各病株和健株根部土壤硝态氮的含量基本相同;不同样地土壤硝态氮含量各不相同,如N1、N5、N6、N14之间存在显著差异(P<0.05),但N2,N4和N5则无显著差异(P>0.05)(图7)。同一样地采集的各发病株和健康株根际土壤有机质的含量相同,但不同样地健康株根际土壤有机质含量各不相同,而 N1、N3、N7、N8、N9、N10、N14之间存在显著差异,N2和N3、N5和N6、N7和N8等差异则均不显著;各发病株根部土壤有机质含量亦如此(图8)。各样地青稞根际土壤pH在8.08~8.14,且发病株和健康株pH不存在差异;各健株根部土壤样品pH之间多数均不存在显著差异,只有N9、N12和N4、N5、N6、N7、N8存在显著差异;各病株根部土壤pH之间也呈现同一规律(图9)。
试验结果表明,同一样地中,青稞病株和健康植株根际土壤理化性质均不存在显著差异(P>0.05)。
2.3 青稞根腐病发生对土壤酶活性影响

图7 各样品土壤硝态氮含量Fig.7 Soil nitrate nitrogen content
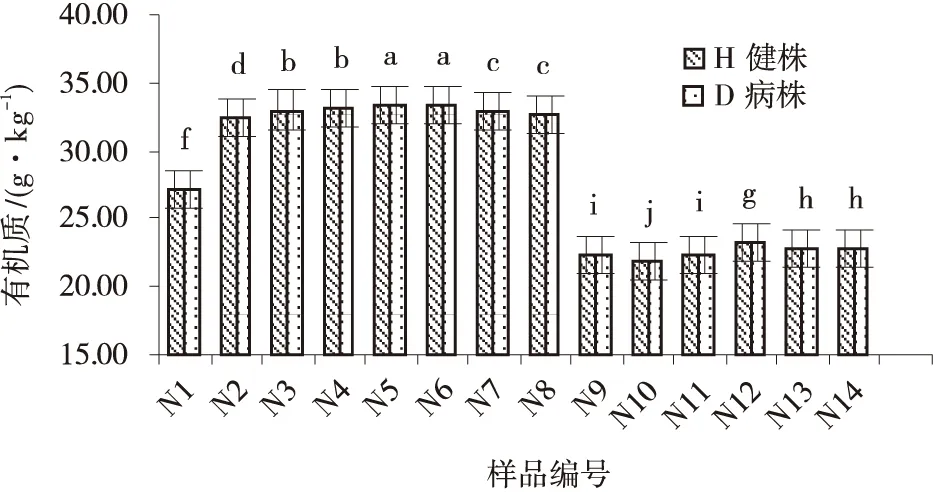
图8 各样品土壤有机质含量Fig.8 Soil organic matter content
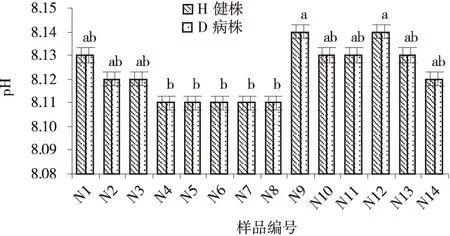
图9 各样品土壤pHFig.9 Soil pH value
不同样地青稞健康植株根际土壤过氧化氢酶活性各不相同,且存在显著差异,病株根部土壤过氧化氢酶活性也是如此;除此之外,同一样地病株和健康植株根部土壤过氧化氢酶活性也有差异(图10)。与过氧化氢酶类似,不同样地青稞健康植株根际土壤碱性磷酸酶活性各不相同,且存在显著差异,发病株根际土壤碱性磷酸酶活性亦如此;同一样地病株和健株根际土壤碱性磷酸酶活性有差异(图11)。试验发现,健康植株和发病株根际土壤脲酶活性都因样地的不同而各不相同,且存在显著差异,且病株和健株根际土壤脲酶活性有差异(图12)。
不同样地青稞健康植株根际土壤纤维素酶活性各不相同,且存在显著差异,病株根际土壤纤维素酶活性与此相似,且病株和健株根际纤维素酶活性有差异。而不同样地各健康植株根际土壤样品蔗糖酶活性各不相同,但除样品N5和其他各样品的蔗糖酶活性存在显著差异外,其他各样品之间均不存在显著性差异;病株根际土壤样品蔗糖酶活性也各不相同,但部分样品之间存在显著差异;且绝大多数样品病株和健株根际土壤蔗糖酶活性有差异。
2.4 病、健康植株根际土壤酶活性差异显著性
青稞根腐病植株和健康植株根际土壤酶活性的比较及差异显著性分析结果如表2所示。

图10 各样品土壤过氧化氢酶活性Fig.10 Soil catalase activities
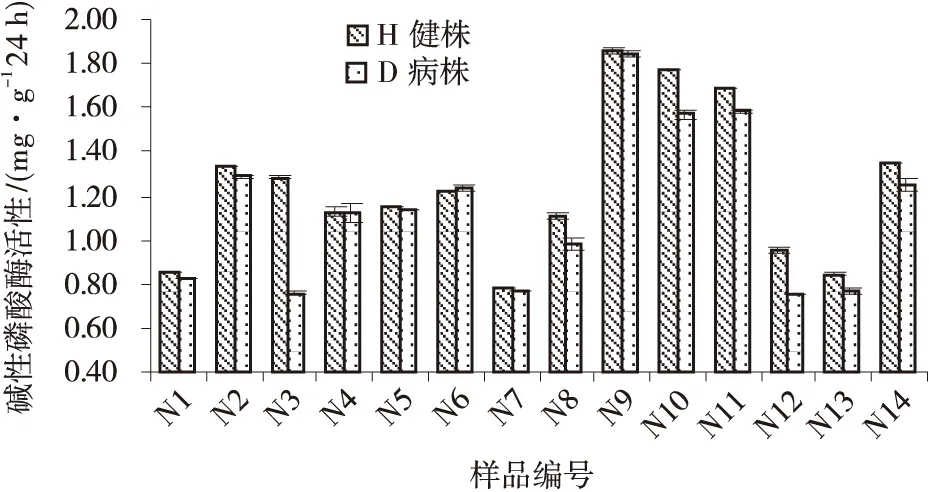
图11 各样品土壤碱性磷酸酶活性Fig.11 Soil alkaline phosphatase activities
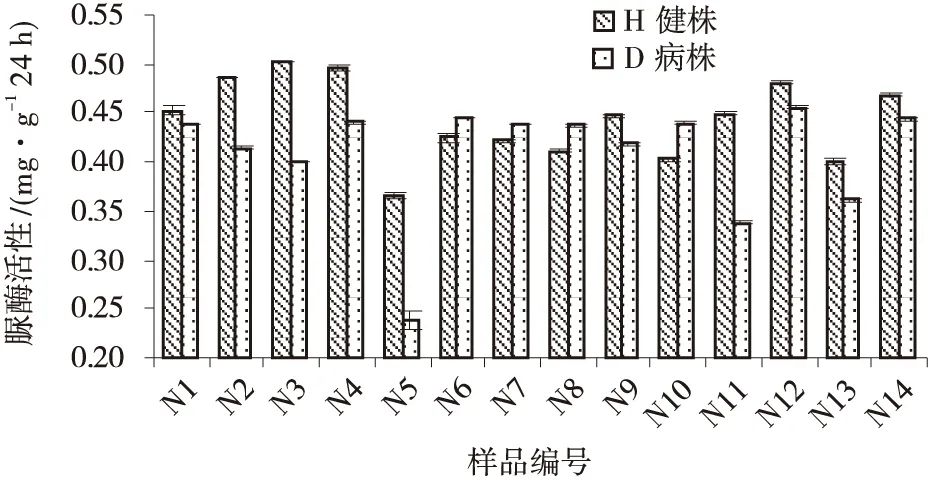
图12 各样品土壤脲酶活性Fig.12 Soil urease activities
同一样地健康植株根际土壤过氧化氢酶、碱性磷酸酶、脲酶及蔗糖酶活性多数均大于病株(H>D),且全部或多数存在显著差异,说明根腐病的发生会导致青稞根际土壤过氧化氢酶、碱性磷酸酶、脲酶、及蔗糖酶活性降低。而健康植株根际土壤纤维素酶活性小于病株根际土壤纤维素酶活性(H 表2 病健植株根际土壤酶活性比较及差异显著性 注:“-”表示此处空白;“H”表示健康植株;“D”表示根腐病植株 2.5 土壤理化性质、土壤酶活性与发病率的关系 2.5.1 土壤理化性质与发病率的相关性 试验发现,黏粒、粉粒、砂粒、有机质、有效磷、速效钾、铵态氮、硝态氮和pH与成株期青稞根腐病发病率的相关系数很小,且不显著(表3),所以在所调查的区域内,青稞根部土壤理化性质与成株期青稞发病率无关,或不是引起青稞根腐病发生的直接或重要因素。 表3 青稞根腐病植株土壤理化性质与发病率的相关性 注:*表示P<0.05,**表示P<0.01,下同 2.5.2 土壤酶活性与青稞根腐病发病率 脲酶与成株期青稞根腐病发病率呈极显著负相关,相关系数是0.64,蔗糖酶与成株期青稞根腐病发病率呈显著负相关,相关系数是0.62,其他3种酶则与成株期青稞发病率没有相关性(表4)。 表4 成株期青稞根腐病植株根部土壤酶活性与发病率的相关性 植物病害的预测和预防是植物保护学的重要内容之一,早在20世纪70年代就确立了“预防为主,综合防治”的植保工作方针,因为植物病害一旦发生和蔓延,就很难治疗,轻则减产,重则绝收,因此,植物病害要做到早发现、早预防,但如何预测病害的发生,一直是植保工作的难点之一,研究者们为此进行了各种研究。土壤理化性质与植物病害的发生之间有一定的关系,如氮、磷、钾等元素含量直接或间接影响植物的抗病性,氮、磷、钾的缺乏或比例失调会显著增加病害发生几率[24-25]。研究结果却显示青稞根腐病的发生与土壤理化性质相关不显著,分析其原因,可能是导致植物病害发生的因素有很多,如气候、降水、连作、虫害等等,如蔡柏岩等[26]研究了连作与大豆根腐病发生的关系,在同一地块试验,理化性质相差不大,但因为连作,土壤中病原菌数量增加,从而使发病率上升。因此,根腐病的发生是多因子综合作用的过程,实际生产中应具体而论,研究结果也说明,导致试验区根腐病发生的主要因素不是青稞根际土壤理化性质失调所致。而根腐病是一种土传病害,土传病害的病原菌生活史的大部分阶段都在土壤中,当条件适宜时,病原物则会侵染植物的根部导致根腐病发生[27]。由此可见,好的土壤环境是防止根腐病发生的重要条件。包括病原物在内的土壤微生物均会产生土壤酶[28],如果植物根际土壤中病原菌含量增加,则会导致土壤酶活性的变化[29]。因此,土壤酶活性是能反应土壤环境质量的灵敏指标[3]。可以通过测定植株根际土壤酶活性的变化来预测或检测根腐病等土传病害的发生。研究结果发现,根际土壤中过氧化氢酶、碱性磷酸酶、脲酶、蔗糖酶的活性会因青稞根腐病的发生而降低,寻路路等[30]、姜飞等[31]、游春梅等[14]、廖梓良等[13]及何川等[32]报道了相似的结论。但纤维素酶活性随根腐病的发生而升高,这与前面4种酶活性的变化趋势相反,也与诸多报道的结果不一致。其原因是不同试验区的土壤状况不同,且不同作物对土壤酶活性的影响也不同所致,具体原因还需要做进一步研究。土壤酶活性与发病率相关性分析表明,蔗糖酶活性和成株期青稞发病率呈显著负相关,脲酶和青稞发病率呈显极著负相关,所以,蔗糖酶和脲酶作为预测和判断成株期青稞根腐病发生指标的潜力,其作用机理也有进一步研究的必要。 青稞根腐病的发生会导致青稞根际土壤过氧化氢酶、碱性磷酸酶、脲酶、蔗糖酶活性降低,纤维素酶活性升高;且发病率与蔗糖酶及脲酶活性呈中度负相关,相关性显著。 [1] 欧阳迪莎.可持续农业中的植物病害管理[D].福州:福建农林大学,2005. [2] 王理德,姚拓,王方琳,等.石羊河下游退耕地土壤微生物变化及土壤酶活性[J].生态学报,2016,36(15):1-11. [3] Badiane N N Y,Chotte J L,Pate E,etal.Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semiarid tropical regions[J].Applied Soil Ecology,2001,18(3):229-238. [4] 曹小玉,李际平,张彩彩,等.不同龄组杉木林土壤有机碳和理化性质的变化特征及其通径分析[J].水土保持学报,2014,28(4):200-205. [5] Garcia C,Hernandez M T.Research and perspectives of soil enzymology in Span[M].Span Murcia:CEBAS-CSIC,2000. [6] 卢良恕.中国大麦学[M].北京:中国农业出版社,1996. [7] 龚凌霄.青稞全谷物及其防治代谢综合征的作用研究[D].杭州:浙江大学,2013. [8] Murray G M,Brennan J P.Estimating disease losses to the Australian barley industry[J].Australasian Plant Pathology,2010,39:85-96. [9] Zhong S,Shaukat A,Leng Y,etal.Brachypodium distachyon-Cochliobolus sativus Pathosystem is a New Model for Studying Plant-fungal Interactions in Cereal Crops[J].Phytopathology,2015,105(4):482-489. [10] Amira H A.Assessment of yield loss caused by root rots in wheat and barley[J].Journal of Food,Agriculture & Environment,2010,8(2):638-641. [11] 李兴龙,李彦忠.土传病害生物防治研究进展[J].草业学报,2015,24(3):204-212. [12] 唐龙翔,李文庆.有机肥对植物土传病害控制的研究[J].北方园艺,2009(7):132-136. [13] 廖梓良,孙世中,刘建香,等.设施栽培香石竹根际土壤酶活与土传病害相关性研究[J].云南师范大学学报,2009,29(3):59-63. [14] 游春梅,陆晓菊,官会林.三七设施栽培根腐病害与土壤酶活性的关联性[J].云南师范大学学报(自然科学版),2014,34(6):25-29. [15] Mueller K J,Valè G,Enneking D.Selection of resistantspring barley accessions after natural infection with leaf stripe (Pyrenophora graminea) under organic farming condition in Germany and by sandwich test[J].Journal of Plant Pathology,2003,85(1):9-14. [16] Bakri Y,Arabi M I E,Jawhar M.Heterogeneity in the ITS of the ribosomal DNA of Pyrenophora graminea isolates differing in xylanase and amylase production[J].Microbiology,2011,80(4):492-495. [17] 陈兆金,倪冬成,鲁帮良,等.防治大麦散黑穗病试验研究[J].大麦与谷类科学,2009(1):47-49. [18] 陈万权,漆小泉,Niks R E.利用AFLP遗传连锁图定位大麦苗期对叶锈病的部分抗性基因[J].遗传学报,1999,26(6):690-694. [19] 刘凤楼,王辉.大麦染色体特异性EST标记在5H短臂成株期叶锈病抗性基因定位中的应用[J].麦类作物学报,2010,30(5):807 -812. [20] 方中达.植病研究法[M].北京:中国农业出版社,1998. [21] 滕爱娣,邓波,王显国,等.沙地苜蓿种植年限对土壤速效钾与碱解氮含量的影响[J].草原与草坪,2015,35(6):22-26. [22] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2008. [23] 李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008. [24] 郑世燕,丁伟,杜根平,等.增施矿质营养对烟草青枯病的控病效果及其作用机理[J].中国农业科学,2014,47(6):1099-1110. [25] 于威,依艳丽,杨蕾.土壤中钙、氮含量对番茄枯萎病抗性的影响[J].中国土壤与肥料,2016,1(1):134-140. [26] 蔡柏岩,王丽阳,胡维,等.连作大豆苗期根际土壤根腐病病原真菌菌群结构分析[J].中国农学通报,2015,31(32):92-98. [27] Li S D,Miao Z Q.Challenges,opportunities and obligations in management of soilborne plant diseases in China[J].Chinese Journal of Biological Control,2011,27(4):433-440. [28] 文都日乐,李刚,张静妮,等.呼伦贝尔不同草地类型土壤微生物量及土壤酶活性研究[J].草业学报,2010,19(5):94-102. [29] 罗文邃,姚政.促进根系健康的土壤微生态研究[J].中国生态农业学报,2002,10(1):44-46. [30] 寻路路,赵宏光,梁宗锁,等.三七根腐病病株和健株根域土壤微生态研究[J].西北农业学报,2013,22(11):146-151. [31] 姜飞,刘业霞,艾希珍,等.嫁接辣椒根际土壤微生物及酶活性与根腐病抗性的关系[J].中国农业科学,2010,43(16):3367-3374. [32] 何川,刘国顺,李祖良,等.连作对植烟土壤有机碳和酶活性的影响及其与土传病害的关系[J].河南农业大学学报,2011,45(6):701-705. Relationships between naked barley root rot and soil physicochemical properties LI Xue-ping1,LI Jian-hong1,YAO Tuo1,QI Yong-hong1,LIU Dan1,GUO Wei1,LI Min-quan1,2 (1.CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2.GansuAcademyofAgriculturalSciences,Lanzhou730070,China) In order to evaluate the relationship between naked barley root rot and soil physicochemical properties,the naked barley root rot in Gannan of Gansu Province was investigated.The rhizosphere soil of healthy and root rot infected plants were collected,and the soil physicochemical properties and soil enzyme activities were measured.The results showed that the naked barley root rot had serious morbidity,incidence rate ranged from 5% to 20%.The difference of physicochemical properties of rhizosphere soil was not significant among diseased and healthy plants.But the soil enzyme activity was significantly different,the catalase activity of healthy plants was greater than diseased plants (H>D) accounted for 64%,in which,50% were significant;healthy plants alkaline phosphatase activity were greater than root rot plants (H>D) accounted for 93%,in which,79% of were significant;healthy plants urease activity were greater than root rot plants (H>D) accounted for 71% and the difference was significant;healthy plants cellulase activity were greater than root rot plants (H>D) accounted for 93%,in which,79% were significant;healthy plants invertase activity were greater than root rot plants (H>D) accounted for 93% and the differenc was significant.Urease and invertase related naked barley root rot incidence showed a moderate negative correlation,and the correlation coefficient was 0.64 and 0.62 respectively. naked barley;root rot;soil enzyme;soil physicochemical properties 2016-04-05; 2016-05-12 国家公益性行业(农业)计划项目(201503112)资助 李雪萍 (1989-),女,甘肃庆阳人,在读博士研究生。 E-mail:lixueping0322@126.com 李敏权为通讯作者。 S 154.4 A 1009-5500(2017)01-0084-08


3 讨论
4 结论

