巧用题链拓展视野 树立观念激发潜能
广东 周曼文
(作者单位:广东省佛山市三水中学)
巧用题链拓展视野 树立观念激发潜能

能力立意的高考试题多数围绕学生的“学习潜能和创新精神”而设置,着重考查考生的“自主学习能力”,而学生自主学习能力的强弱又集中体现为学生能否突破自我认知视野的极限和能否快速的接受、吸收、整合新信息。高考试题的区分度和能力选拔也在于此。高考试题的变化,一是考点的变化,二是同一考点命题视角的变化。尤其是同一考点命题视角的变化则是命题人匠心独运的结晶,不但给人新颖的感觉,也实现了命题的突破。笔者精选了近些年各省高考试题中同一考点试题(如活化能、平衡常数、电解池的放电顺序)组成题链,探究其命题趋势和解题技巧,发现利用题链技术能够拓展学生的认知视野,培养学生树立一些核心学科观来应对这种同一考点不同命题视角变化的趋势,效果颇好,且能激发学生的学习潜能,增强其自主学习能力。
1.活化能
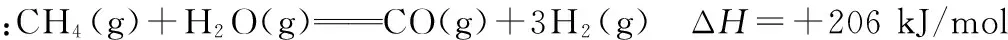
【答案】
题链2 (2014·浙江·27节选)
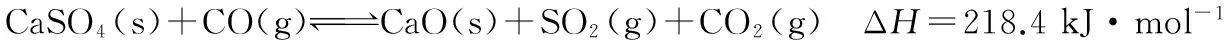
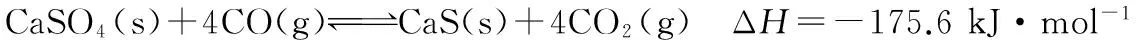
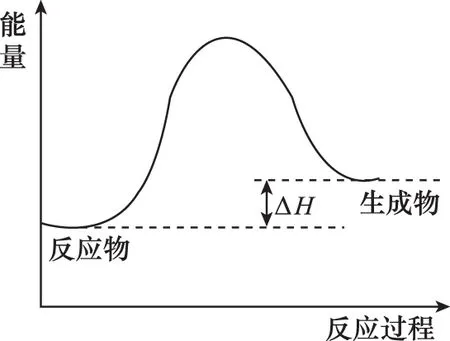
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是___________ 。
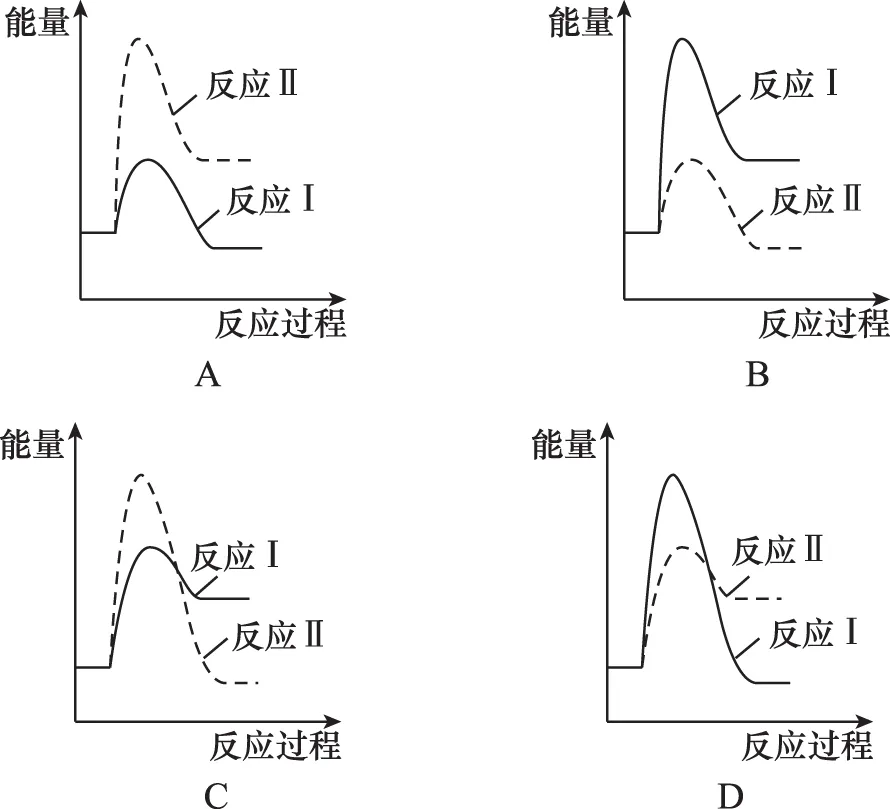
【答案】C
题链3 (2016·浙江·28节选)某实验室控制CO2和H2初始投料比为1∶2.2,在相同压强下,经过相同反应时间测得如下实验数据:
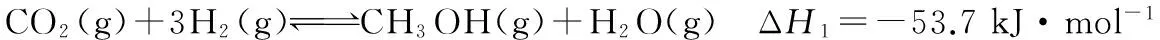

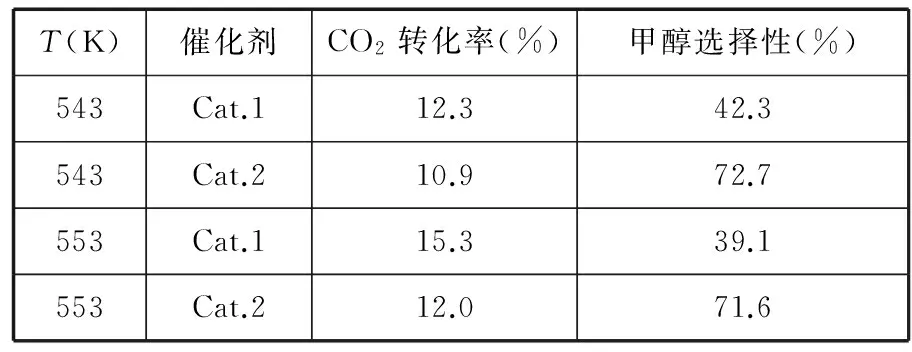
T(K)催化剂CO2转化率(%)甲醇选择性(%)543Cat.112.342.3543Cat.210.972.7553Cat.115.339.1553Cat.212.071.6
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比。
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________。
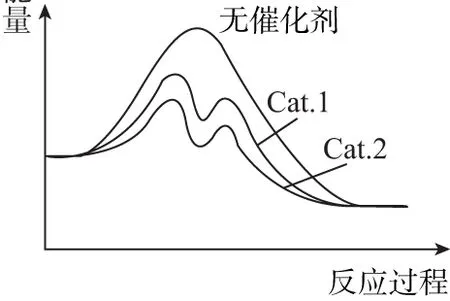
(4)在下图中分别画出反应Ⅰ在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图。

【答案】(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响
(4)
【题链分析】
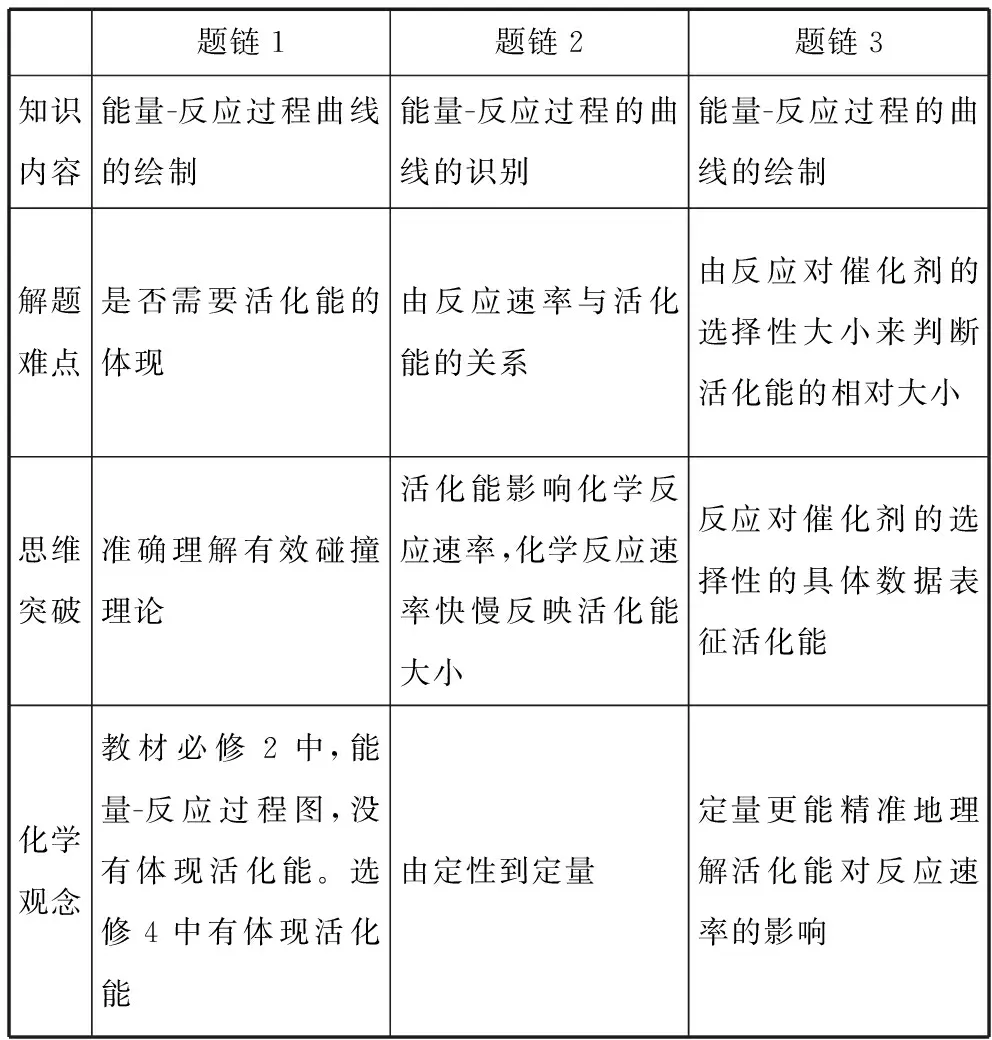
题链1题链2题链3知识内容能量-反应过程曲线的绘制能量-反应过程的曲线的识别能量-反应过程的曲线的绘制解题难点是否需要活化能的体现由反应速率与活化能的关系由反应对催化剂的选择性大小来判断活化能的相对大小思维突破准确理解有效碰撞理论活化能影响化学反应速率,化学反应速率快慢反映活化能大小反应对催化剂的选择性的具体数据表征活化能化学观念教材必修2中,能量-反应过程图,没有体现活化能。选修4中有体现活化能由定性到定量定量更能精准地理解活化能对反应速率的影响
【启示】学生应拓展的认知视野:高中阶段活化能是一个较为抽象的定量概念,教学中一般只是定性地用于分析催化剂对反应速率的影响,从来没有定量地使用过。由速率相对大小来判断活化能的相对大小,可称作“活化能的定量分析”; 题链3由反应对催化剂的选择性的具体数据表征活化能,完全突破了高中学生对活化能的认知局限。
应建构的化学观念——“由定性到定量”是科学研究的必然途径,也是准确掌握某些自然规律的必要手段。
2.平衡常数
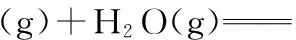
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
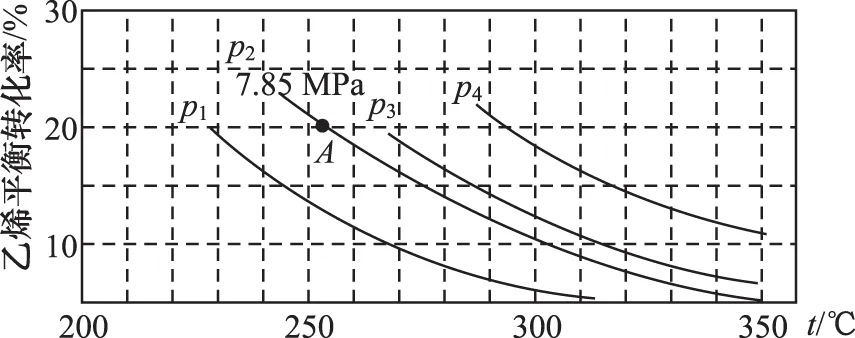
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】①0.07 MPa-1
【解析】(3)①A点乙烯的平衡转化率是20%。根据反应列三段式:
起始___________1 mol___________1 mol___________0
转化___________0.2 mol___________0.2 mol___________0.2 mol
平衡___________0.8 mol___________0.8 mol___________0.2 mol
则平衡时乙烯的分压:p(C2H4)=7.85 MPa×0.8 mol/1.8 mol=3.488 9 MPa
水蒸气的分压:p(H2O)=7.85 MPa×0.8 mol/1.8 mol=3.488 9 MPa
乙醇的分压:p(C2H5OH)=7.85 MPa×0.2 mol/1.8 mol=0.872 2 MPa
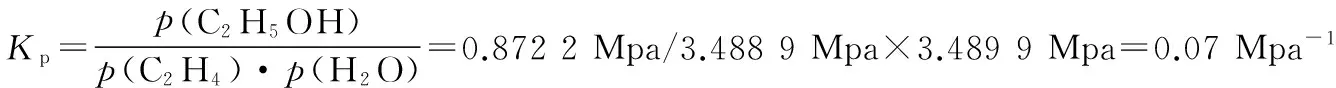
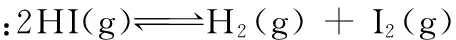
t/min020406080120x(HI)10.910.850.8150.7950.784x(HI)00.600.730.7730.7800.784
①根据上述实验结果,该反应的平衡常数K的计算式为___________。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为___________ (以K和k正表示)。
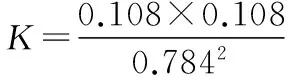
【解析】①注意表格中的两列数据是正向和逆向的两组数据。716 K时,取第一行数据计算:
n(始)(取1 mol)___________1___________0___________0
Δn___________(0.216)___________(0.108)___________(0.108)
n(平)___________0.784___________(0.108)___________(0.108)
②问的要点是:平衡状态下,v正=v逆,故有:k正·x2(HI)=k逆·x(H2)·x(I2)
变形:k正/k逆=x(H2)·x(I2)/x2(HI)=K
故有:k逆=k正/K
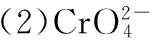
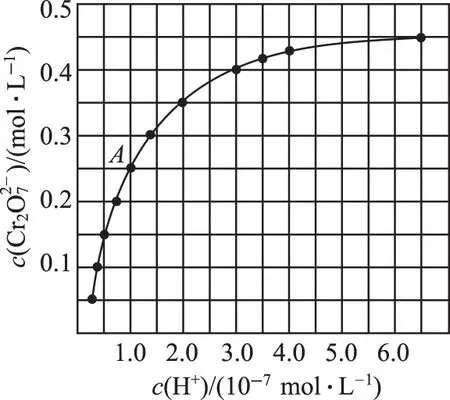
①用离子方程式表示Na2CrO4溶液中的转化反应:___________________________。
②由图A点数据,计算该转化反应的平衡常数为___________ 。
② 1.0×1014
【解析】根据反应并结合A点数据,列三段式:
起始(mol/L)___________1.0___________0
转化(mol/L)___________0.5___________0.25
平衡(mol/L)___________0.5 1.0×10-7___________ 0.25
题链4 (2016·全国Ⅱ·26节选)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
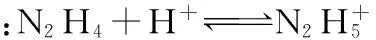
【答案】(4)8.7×10-7
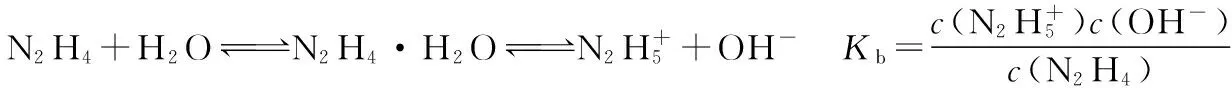
Kb/Kh=KwKb=Kw·Kh=8.7×107×1.0×10-14=8.7×10-7
【题链分析】
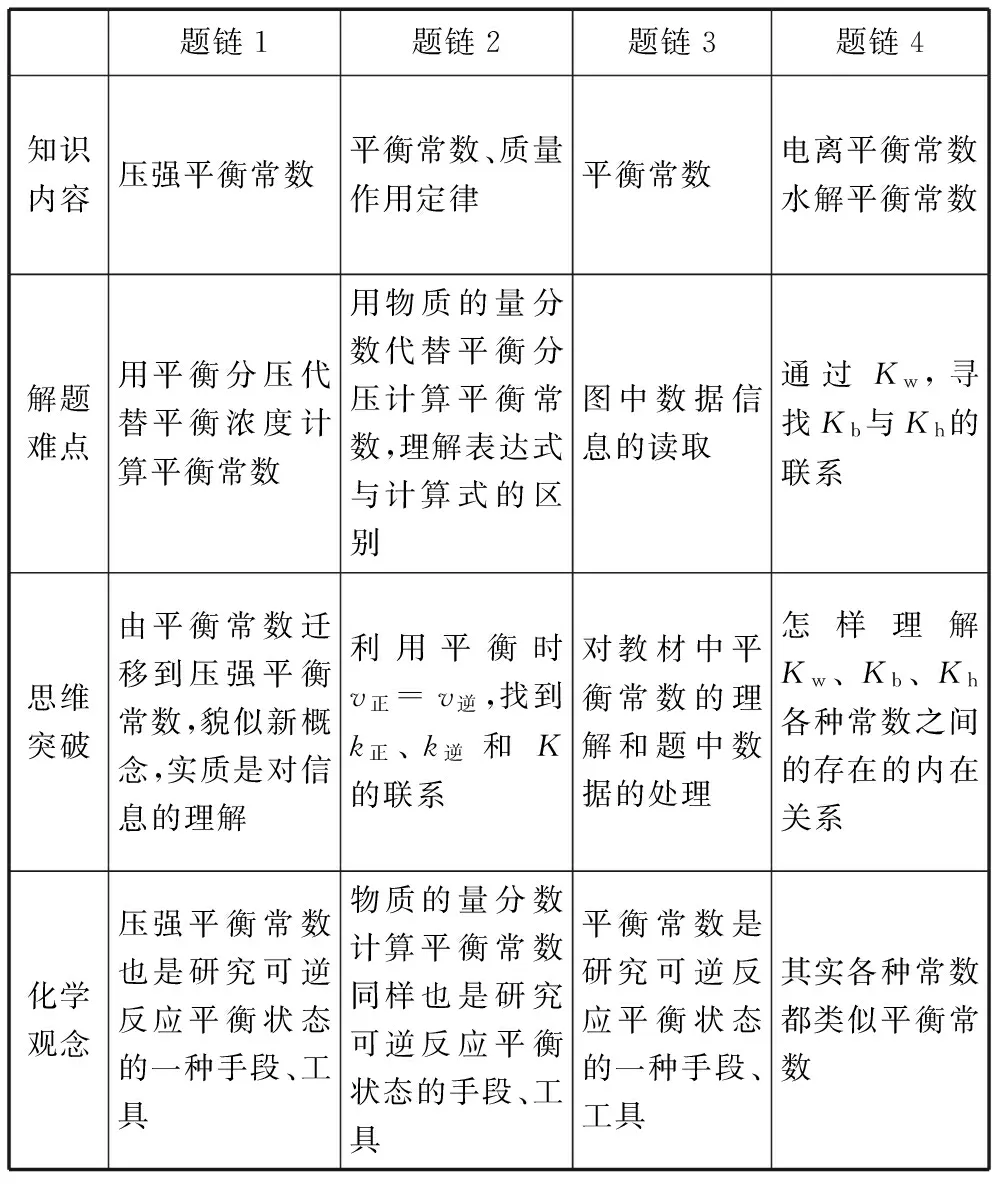
题链1题链2题链3题链4知识内容压强平衡常数平衡常数、质量作用定律平衡常数电离平衡常数水解平衡常数解题难点用平衡分压代替平衡浓度计算平衡常数用物质的量分数代替平衡分压计算平衡常数,理解表达式与计算式的区别图中数据信息的读取通过Kw,寻找Kb与Kh的联系思维突破由平衡常数迁移到压强平衡常数,貌似新概念,实质是对信息的理解利用平衡时v正=v逆,找到k正、k逆和K的联系对教材中平衡常数的理解和题中数据的处理怎样理解Kw、Kb、Kh各种常数之间的存在的内在关系化学观念压强平衡常数也是研究可逆反应平衡状态的一种手段、工具物质的量分数计算平衡常数同样也是研究可逆反应平衡状态的手段、工具平衡常数是研究可逆反应平衡状态的一种手段、工具其实各种常数都类似平衡常数
【启示】学生应拓展的认知视野:平衡常数、压强平衡常数、质量作用定律、物质的量分数计算平衡常数、电离常数、水解常数等。
应建构的化学观念——“万变不离其宗”。各种常数都类似平衡常数,这样的试题向我们展示“教材教的只是其根本”,我们的学习应该达到“举一反三、触类旁通”的境界。
3.电解池的放电顺序
题链1 (2013·天津·9节选)用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
电解池中H+在阴极放电产生H2,阳极的电极反应为________________ 。
题链2 (2014·北京·28节选)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

序号电压/V阳极现象检验阳极产物Ⅰx≥a电极附近出现黄色,有气泡产生有Fe3+、有Cl2Ⅱa>x≥b电极附近出现黄色,无气泡产生有Fe3+、无Cl2Ⅲb>x>0无明显变化无Fe3+、无Cl2
(1)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:___________。
(2)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有___________ 性。
(3)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的0.2 mol/L NaCl溶液做对照实验,记录如下:
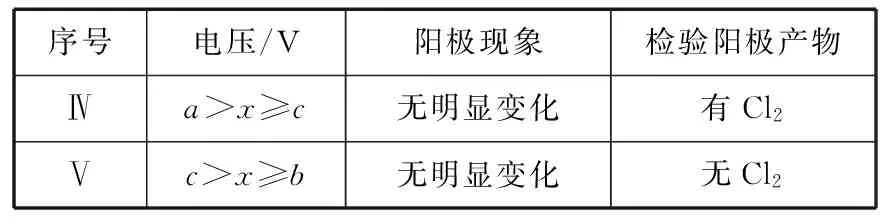
序号电压/V阳极现象检验阳极产物Ⅳa>x≥c无明显变化有Cl2Ⅴc>x≥b无明显变化无Cl2
与Ⅱ对比,得出的结论:_________(写出两点)。
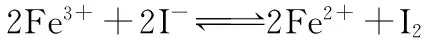
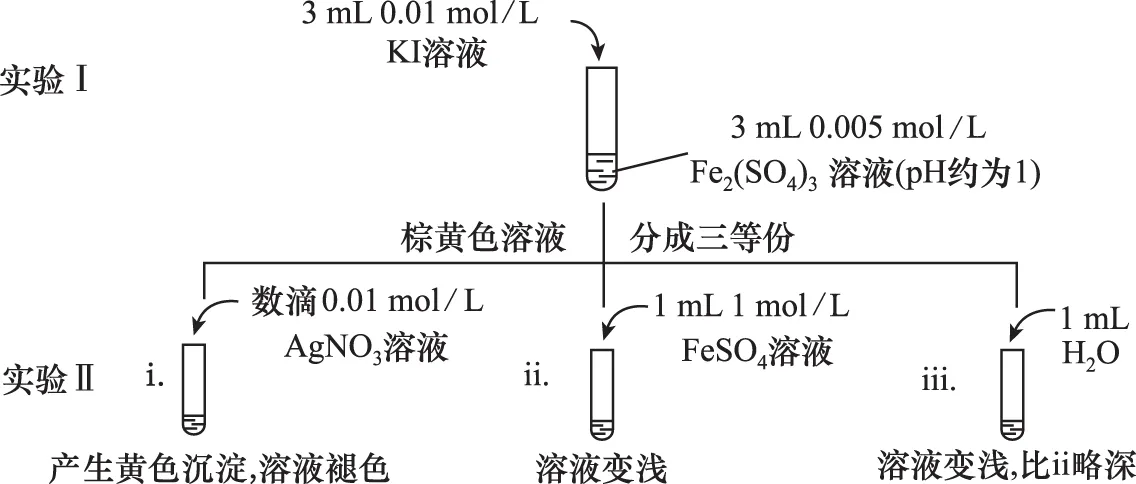
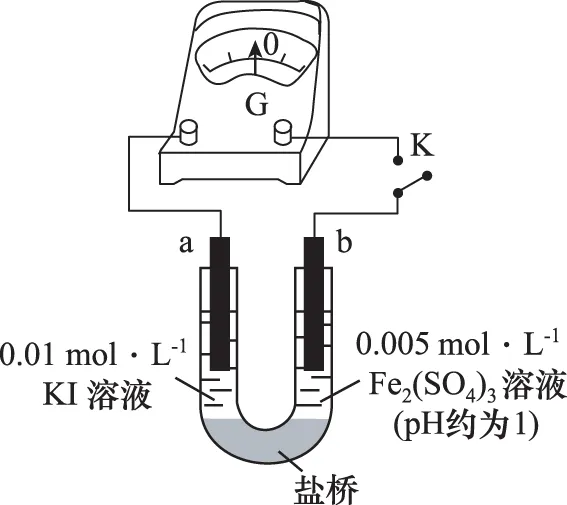
(1)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,且用如图装置(a、b均为石墨电极)进行实验验证。当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是___________。
(2)按照以上原理,该同学用上图装置进行实验,证实了ⅱ中Fe2+向Fe3+转化的原因,①转化原因是________________ 。②与(1)实验对比,不同的操作是___________。
(3)实验Ⅰ中,还原性:I->Fe2+;而实验Ⅱ中,还原性:Fe2+>I-,得出的结论是___________。
【答案】(1)左管产生黄色沉淀,指针向左偏转 (2)①Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I-②向U形管右管中滴加1 mol/L FeSO4溶液 (3)该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向
【题链分析】
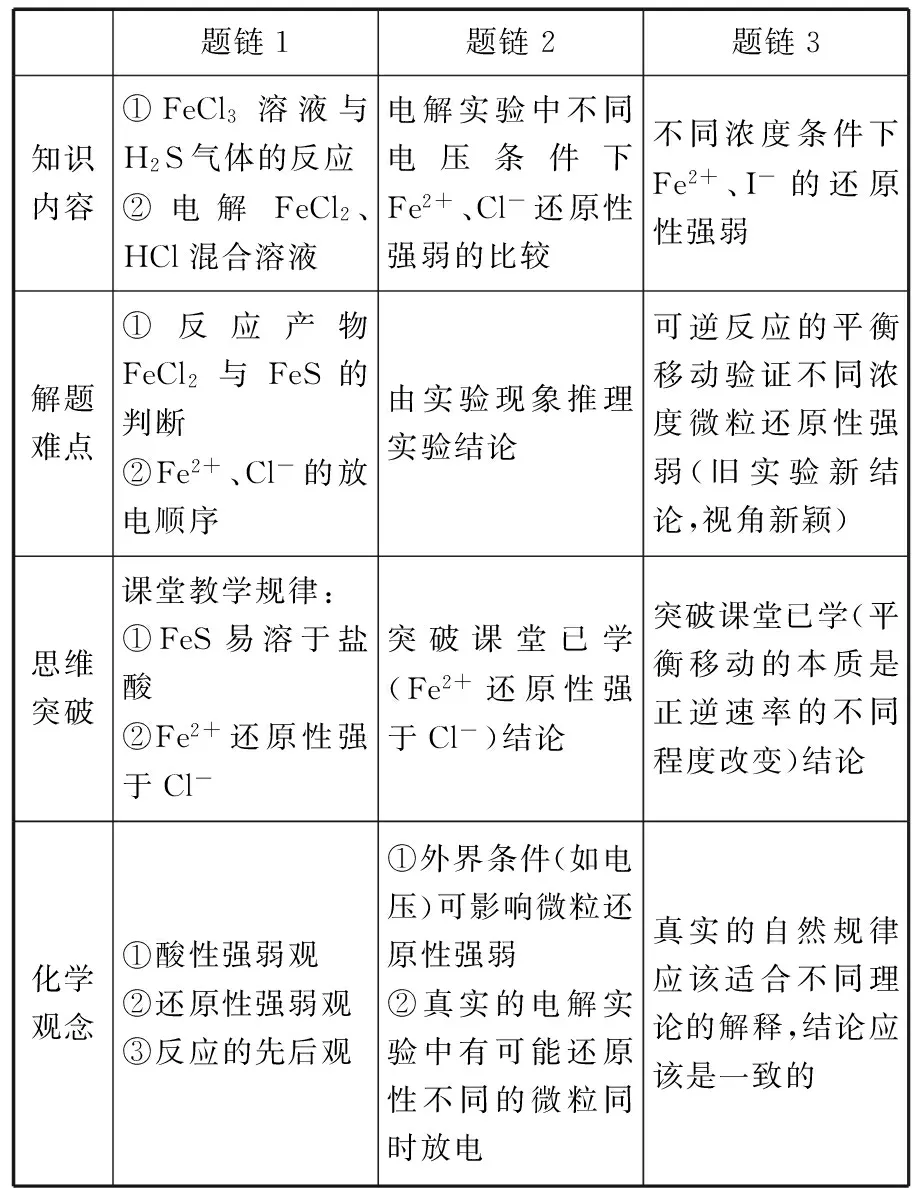
题链1题链2题链3知识内容①FeCl3溶液与H2S气体的反应②电解FeCl2、HCl混合溶液电解实验中不同电压条件下Fe2+、Cl-还原性强弱的比较不同浓度条件下Fe2+、I-的还原性强弱解题难点①反应产物FeCl2与FeS的判断②Fe2+、Cl-的放电顺序由实验现象推理实验结论可逆反应的平衡移动验证不同浓度微粒还原性强弱(旧实验新结论,视角新颖)思维突破课堂教学规律:①FeS易溶于盐酸②Fe2+还原性强于Cl-突破课堂已学(Fe2+还原性强于Cl-)结论突破课堂已学(平衡移动的本质是正逆速率的不同程度改变)结论化学观念①酸性强弱观②还原性强弱观③反应的先后观①外界条件(如电压)可影响微粒还原性强弱②真实的电解实验中有可能还原性不同的微粒同时放电真实的自然规律应该适合不同理论的解释,结论应该是一致的
【启示】学生应拓展的认知视野——“放电观”:活泼电极、阴离子、阳离子、气体分子都可以在阳极失去电子,阳离子、阴离子和中性气体分子也可在阴极得到电子,有时还可能是多种物质同时放电。
应建构的化学观念——学科发展观。化学是研究微观粒子的结构、组成和运动规律的,以实验为基础的科学,囿于可视化仪器限制和不完善的化学理论,化学科学尚不能精确化描述自然规律,当外界条件一旦改变,实验现象和结论可能会发生变化,这导致高中化学存在很多隐喻的、模糊的,甚至错误的知识。

(作者单位:广东省佛山市三水中学)

