基于CT或PET/CT的影像组学信息预测Ⅰ期非小细胞肺癌立体定向消融放疗疗效的初步研究
陈佳艳,王佳舟,张军华,刘 笛,张 静,许新颜,黄 律,樊 旼
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
基于CT或PET/CT的影像组学信息预测Ⅰ期非小细胞肺癌立体定向消融放疗疗效的初步研究
陈佳艳,王佳舟,张军华,刘 笛,张 静,许新颜,黄 律,樊 旼
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:影像组学作为极具潜力的新领域,是指从影像图像中提取有价值的图像特征,并将这些特征数据定量化并转换成可挖掘的数据矿用以指导临床。该回顾性研究应用影像组学的方法初步探索PET/CT对比常规CT在Ⅰ期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者接受立体定向消融放疗(stereotactic ablative radiotherapy,SABR)后疗效预测方面的可行性。方法:回顾性收集经病理证实并在复旦大学附属肿瘤医院行SABR治疗的Ⅰ期NSCLC患者,提取治疗前PET/CT和定位CT图像,由放疗科医师勾画病灶,运用影像组学的方法进行特征值的提取、分析和总结,采用NMF聚类法(non-negative matrix factorization)分析这些特征值是否能够对有无局部进展的患者进行区分,所有统计学算法都在R平台(R Development Core Team)上实现。结果:16例患者纳入最终分析,在PET/CT的影像组学PET特征中发现两个差异有统计学意义的特征值(灰度共生矩阵最大相关系数和灰度游程共生矩阵长行程加重),可以用以区分患者是否出现局部进展,而在所有定位CT图像提取的特征值中并没有类似发现。结论:在经过SABR治疗后的Ⅰ期NSCLC患者中应用基线PET/CT及胸部定位CT提供的信息进行影像组学分析后,PET/CT似乎能够提供更具统计效能的PET特征值用以预测疗效,对比胸部定位CT提供的信息,PET/CT所提取的特征值可能更敏感、更全面甚至更具特征性。
影像组学;PET/CT;肺癌;立体定向消融放疗
医学影像学是现代医学的重要组成部分。一直以来,传统医学影像学所提供的信息都是非定量的,但近年来随着图像采集技术、标准化处理以及图像分析技术的进步,使得更多的影像信息能够被客观提取、精确定量并进一步通过各种算法转化为可深度挖掘的特征数据,经过深入分析这些影像特征数据,即可获得与疾病发生、发展及预后密切相关的各种隐含信息,并将其用于指导疾病治疗和预测疾病的转归。这一过程及由此新兴的领域,被形象的称为影像组学[1]。
立体定向放射治疗(stereotactic body radiation therapy,SBRT)或立体定向消融放疗(stereotactic ablative radiotherapy,SABR)是通过1次至数次分割照射,将至少等同根治剂量的高剂量准确投照于颅外病灶的外照射方法[2]。通过缩小照射区域、严格控制正常组织受量,同时提高放疗剂量[通常生物等效剂量(biologically effective dose,BED)大于等于100 Gy],SABR在Ⅰ期非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗中获得了优于既往常规放射治疗的疗效。多项前瞻性研究显示,其在高龄、合并其他疾病及无法手术的患者中,SABR均能够有效应用,已经成为无法手术患者的标准治疗方案[2-5]。随着SABR的广泛应用,相关的临床重点研究方向正逐渐由治疗实施转为疗效-损伤预测和复发判定。
影像组学中用以分析的图像数据可以通过各种影像方法获得,目前较多的是通过CT提取并分析,通过MRI和PET/CT进行分析的研究已在头颈部肿瘤、大肠癌的预测模型中取得初步成果[6-7],但在Ⅰ期NSCLC的SABR中该类研究国内外还未见发表。在这样的研究背景下,我们进行了一项回顾性分析,收集并整理本中心进行SABR的Ⅰ期NSCLC患者治疗前的PET/CT和CT影像,应用影像组学方法进行分析,结合患者疗效进行了初步的探索,目的是探讨PET/CT相关影像组学特征在预测Ⅰ期NSCLC患者SABR局控方面较传统CT是否能够提供更有价值的信息。
1 资料和方法
1.1 研究对象
本研究回顾性收集2008—2016年复旦大学附属肿瘤医院放疗科收治的Ⅰ期NSCLC患者。纳入标准包括:① 经病理证实的NSCLC患者;② 治疗前在本中心行全身PET/CT扫描,未提示局部晚期或其他部位转移的早期患者;③ 所有患者均在放射治疗中心针对肺部原发病灶行SABR治疗;④ 随访超过3个月。
1.2 PET/CT扫描及SUV计算方法
全身PET/CT检查的18F-FDG由复旦大学附属肿瘤医院核医学科Siemens RDS-ecliopse ST回旋加速器和explora FDG4模块生产获得,放化纯大于等于95%;显像仪器为Siemens Biography16HR PET/CT。患者空腹6 h以上,常规测血糖小于7 mmol/L,按7.4 MBq/kg体质量静脉注射18F-FDG,静卧60 min后行PET/CT扫描。CT扫描层厚5 mm,范围为颅底至股骨上段(6~7个床位,每床位2 min)。PET图像经CT数据衰减校正后用有序子集最大期望值法进行图像重建,融合图像通过Wizard工作站MSV软件显示。依据ROI放射性计数与受试者体质量和注射剂量进行18F-FDG代谢率半定量计算。
1.3 图像勾画
由1名经验丰富的放疗科医师在PET图像及定位CT图像上完成大体肿瘤体积(gross tumor volume,GTV)及双肺的勾画,同时由另1名高年资放疗科医师进行核对(图1)。
1.4 影像特征提取及分析
本研究提取患者定位CT以及治疗前基线PET影像合计503个特征,其中定位CT中提取的影像特征253个,PET影像的特征250个,包括:① 形状特征,包括体积,表面积等特征(3个);② CT像素值和PET SUV值的直方图特征(CT 19个,PET 19个);③ 纹理特征包括GLCM灰度共生矩阵GLRL灰度游程特征(CT 31个,PET 31个);④ 小波滤波后的一系列特征(CT 200个,PET 200个)。灰度特征计算算法采用在每层上计算,再取平均的方法[8],所有计算均在MATLAB上(购自美国MathWorks公司)实现。
1.5 评价标准
患者的局部控制情况按照RECIST 1.1的标准进行定义:完全缓解(complete response,CR)定义为所有靶病灶均消失;部分缓解(partial response,PR)定义为所有靶病灶的直径之和下降至少30%;疾病进展(progressive disease,PD)定义为所有靶病灶的直径之和增加至少20%并且绝对值增加至少5 mm或者出现新的病灶;CR、PR和PD之外则定义为疾病稳定(stable disease,SD)。随访时间定义为自末次治疗开始到末次随访结束。总生存时间(overall survival,OS)定义为自治疗开始至患者死亡的时间。
1.6 统计学处理
影像组学特征结果与患者临床疗效之间的相关性采用t检验的方法进行,具体处理过程为首先采用相关性检验的方法去除影像组学特征之间的冗余[9],再根据患者的疗效进行分组,对不同组别的患者进行t检验,同时我们采用NMF聚类的方法分析影像组学特征是否能够对患者进行区分[10]。所有统计学算法都在R(R Development Core Team)平台上实现。P<0.05为差异有统计学意义。

图1 1例患者治疗前的PET以及定位CT图像Fig. 1 PET image and simulated CT scan image before treatment of one patient
2 结 果
2.1 一般资料
根据排纳标准,共有16例患者符合要求。末次随访时间为2016年11月22日。患者一般情况资料及SABR分割方式见表1。
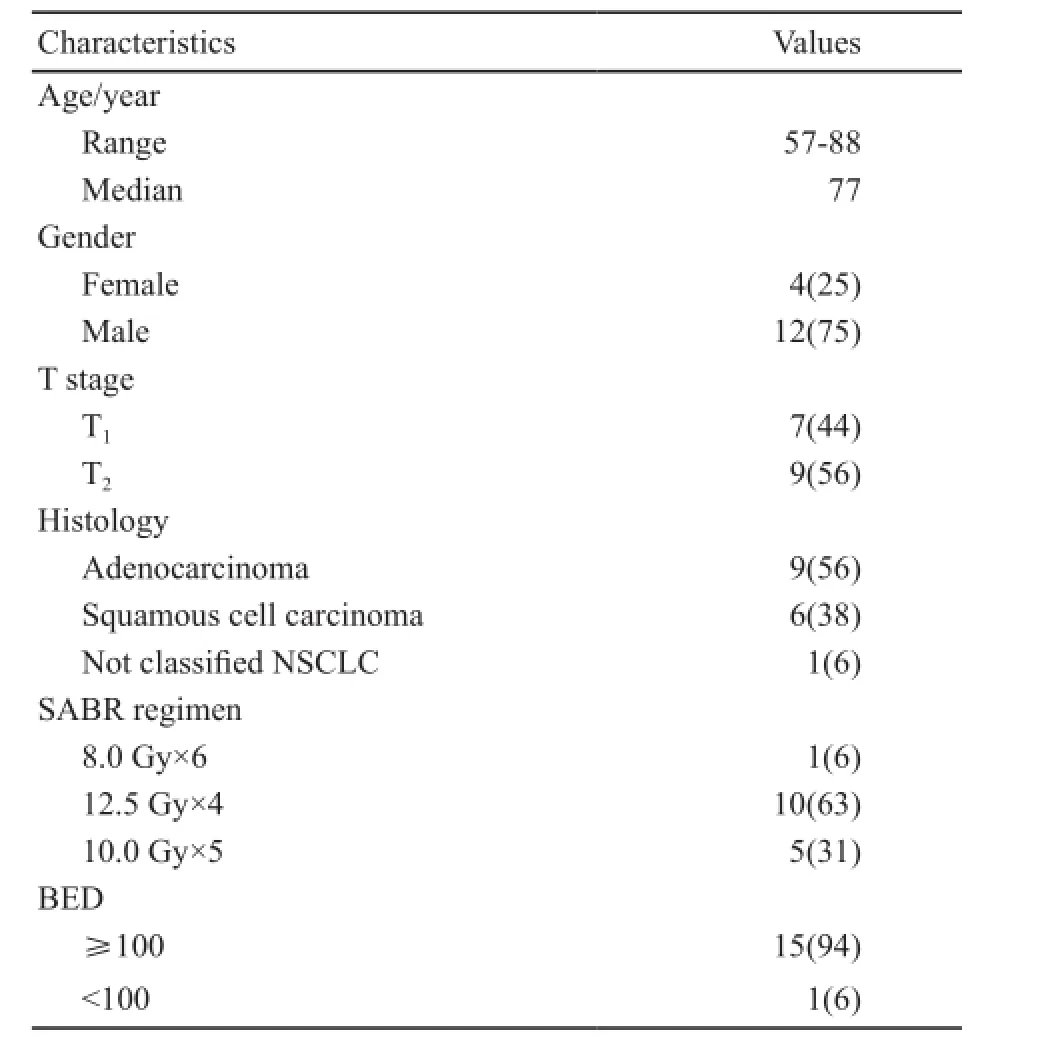
表1 患者一般情况信息(n=16)Tab. 1 Baseline characteristics and SABR regimen of enrolled patients (n=16)[n(%)]
2.2 治疗情况
16例患者均接受肺部原发病灶的SABR治疗,6 MV-X线,3维或调强技术,治疗分割剂量为8.0~12.5 Gy,分割次数为4~6次,总剂量为48~50 Gy,BED为86.4~112.5 Gy。结合肿瘤具体位置(中央型或周围型)、治疗总剂量及分割次数(8.0 Gy×6次、10.0 Gy×5次和12.5 Gy×4次),参考RTOG 0236、RTOG 0618、RTOG 0813以及NCCN指南,对于脊髓、食管、臂丛神经、心脏/心包、气管/支气管、全肺、胸壁和皮肤等正常器官进行限量及保护。
2.3 患者局部控制及生存情况
至末次随访时,随访时间范围为12~46个月,中位随访时间为41个月。16例患者中死亡5例,删失1例,这5例死亡患者中,2例因肺部原发病灶局部进展死亡,另外3例患者中1例死于脑转移,1例死于急性脑梗塞,1例死于药物过敏反应,3年生存率为68%。所有患者中局部病灶进展3例,其中局部进展伴有远处转移2例,转移部位1例为脑转移,1例为肋骨转移,3年局部控制率为79%。
2.4 基于CT和PET/CT的影像组学特征值的提取、分析及比对
经过相关性过滤(0.5),503个特征可以缩减为15个特征,主要包含的都是小波变换以后的特征。对于CT特征而言,主要为包括小波变换后的灰度共生矩阵的6个特征,4个直方图特征;对PET特征而言,主要包含小波变换的3个灰度共生矩阵特征和3个灰度游程特征。在对这15个特征进行NMF聚类分析后发现,这些影像组学特征将是否出现局部复发的患者归为两类(图2),这两类患者对应特征分布如图3所示,仅两个特征值在区分患者的局部进展情况方面差异有统计学意义,且均为PET特征,具体为灰度共生矩阵最大相关系数和灰度游程共生矩阵长行程加重。而在基于CT图像提取的特征值分析结果中,并没有发现如PET类似的差异有统计学意义的特征值(表2)。

图2 NMF聚类结果Fig. 2 Results of non-negative matrix factorization

图3 不同特征对应的分布Fig. 3 The distribution of radiomics features
2.5 影像组学特征值与肿瘤局控的相关性分析
我们在对患者的PET以及定位CT影像数据进行小波滤波并与肿瘤局部控制进行相关性分析后,在是否出现局部进展的两类患者的PET特征值中发现了两个差异有统计学意义的特征(灰度共生矩阵最大相关系数和灰度游程共生矩阵长行程加重),而在定位CT图像特征值的分析中,没有类似发现(表2)。

表2 影像组学特征的t检验的P值Tab. 2 P values of radiomics features
3 讨 论
恶性肿瘤的治疗十分复杂而且疗效难以预测。结合病患及肿瘤本身的共性和异质性,采取针对性强的个体化治疗模式并根据具体情况实时调整,在临床疗效、不良反应及治疗成本间达到长期平衡是最佳选择。为实现这一目标,目前临床实践中更多的是通过应用基因组学和蛋白组学的各项技术在基因、分子、蛋白层面来分析肿瘤的生物学特征,从而指导临床个体化治疗。然而,由于肿瘤本身具有时间和空间的异质性,且这些技术如要达到金标准检测,往往需要穿刺活检或者侵入性的操作,同时每次提取和分析的都是肿瘤的小部分组织,难以达到实时、重复、完整地反映肿瘤全貌的目的,因此在实际应用过程中具有诸多不确定性和限制性。
相比之下,医学影像学本身具有无创、可重复的特点。近年来,随着医学影像成像技术以及信息分析技术的飞速发展,使得高通量提取肿瘤的影像特征信息并进行定量、分析、建模在技术层面得以实现,这促使医学影像在临床中的实际应用发生了质的飞跃,更加凸显其整体性、宏观性、可重复性、无创性、实时性的独特优势。2012年,Lambin等[1]提出影像组学的概念后,许多学者在此领域展开了相关研究,最为著名的是Aerts等[11]的相关报道,研究者在包括1 019例肺癌及头颈部肿瘤患者在内的CT影像大数据集中,通过提取CT密度、强度、形状和纹理等等相关特征,分析得到440个影像特征去定量肿瘤的不同表型,获得4个最为稳定的特征,并第1次将肿瘤分期与肿瘤的基因表型相关联,很好的反应了肿瘤本身的异质性,在肺癌和头颈部肿瘤患者训练集及验证集中建立并验证了具有预测效能的影像组学预后预测模型,同时将其与经典的肿瘤预后因素如TNM分期及人类乳头瘤病毒(human papillomavirus,HPV)状态相比较,证明其强大的预测效能。
放射治疗作为经典的肿瘤局部治疗手段,是肿瘤多学科及个体化治疗的重要组成部分。通过SABR,Ⅰ期NSCLC的放疗效果有了长足进步。放射治疗本身的特点决定了经治的肿瘤及正常组织往往会在影像学上产生更为直观且特征性的影像改变,这就为临床将影像组学结合于肿瘤的放射治疗提供了良好的契机和理论基础。后续也确实有学者应用影像组学在肺癌上进行了放疗疗效与损伤相关的研究报道。Cunliffe等[12]从放射损伤的角度出发,通过影像组学的分析方法,评估了这些特征与放射性肺炎和放疗剂量的相关性,指出影像组学可以量化并预测放射性肺炎的发生。研究者后续又通过分析106例接受放疗的肺癌患者影像组学特征,讨论了影像组学用以衡量放疗疗效及并发症的可行性[13]。
目前最常用于临床进行影像组学特征提取的方法是CT扫描,传统的CT图像获取的特征信息常包括:① 直方图特征,即将肿瘤体积的三维数据转换成单一的直方图用以描述某选定区域的像素值所对应的体积分数,并从中计算出一些常见的统计量,如均值、中位数、最大值、最小值和变化范围等;② 形状特征,这一特征主要用来定量描述肿瘤的几何形状,常常通过提取肿瘤的三维表面信息来获得;③ 纹理特征,即通过一定的图像处理技术提取出纹理特征参数,从而获得纹理的定量或定性描述的处理过程,其中基于灰度共生矩阵的纹理特征最为常用,在共生矩阵基础上常常还可以进一步导出包括能量、对比度、相关性、熵和局部平稳性在内的一些更加直观的反映纹理状况的参数[14-17]。
近年来,PET/CT在肺癌的诊断、分期、疗效判断和预后预测方面发挥了日益重要的作用,各项指南及众多研究都明确了PET/CT应用于肺癌的独特优势[18-20]。但到目前为止,关于应用PET/CT进行的影像组学相关研究,只在直肠癌中见到相关报道。因此,如何将PET/CT中所隐含的庞大影像学数据进一步应用与NSCLC的个体化治疗,如何更好的将其与肺癌的放射治疗相结合,基于PET/CT进行影像组学分析较常规CT是否独具优势,是我们进行这项回顾性研究的初衷。
本研究将NSCLC患者治疗前的PET/CT提供的影像信息,通过影像组学的方法加以提取、分析和总结,将提取到的PET特征值与Ⅰ期NSCLC进行SABR后的局部控制加以关联,得到了一些初步数据。相较于定位CT进行的特征值分析,PET/CT能够提供更具统计效能的特征值用以预测疗效,在对患者的影像数据进行小波滤波后,在是否出现局部进展的两类患者的特征值中发现了两个差异有统计学意义的特征值(灰度共生矩阵最大相关系数和灰度游程共生矩阵长行程加重),灰度共生矩阵是一个对称矩阵,不仅反映图像灰度在相邻方向、相邻间隔和变化幅度的综合信息,也反映相同的灰度级像素之间的位置分布特征,是计算纹理特征的基础,得出灰度共生矩阵后可通过进一步计算相关系数更加直观地表示纹理特征,而长行程加重则与图像粗糙平滑有关。我们同时注意到,这两个特征均为PET所特有,在所有定位CT图像中提取的特征值中并没有类似发现,因此推测对比CT提供的影像组学信息,PET/CT中反应的影像组学特征可能更敏感、更全面。
本研究有一定的局限性,回顾性资料收集造成可以纳入分析的患者数目较少,因此,结果中体现出来的信息及检验效能亦相当有限。我们将扩大样本量进行进一步研究。
[1] LAMBIN P, RIOS-VELAZQUEZ E, LEIJENAAR R, et al. Radiomics: extracting more information from medical images using advanced feature analysis [J]. Eur J Cancer, 2012, 48(4): 441-446.
[2] LAGERWAARD F, VERSTEGEN N, HAASBEEK C, et al. Outcomes of stereotactic ablative radiotherapy in patients with potentially operable stage Ⅰ non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1): 348-353.
[3] HOYER M, ROED H, HANSEN A, et al. Prospective study on stereotactic radiotherapy of limited stage non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2006, 66(7): 128 -135.
[4] BRAL S, GEVAERT T, LINTHOUT N, et al. Prospective, risk-adapted strategy of stereotactic body radiotherapy for early-stage non-small cell lung cancer: results of a phase Ⅱtrial[J]. Int J Radiat Oncol Biol Phys, 2011, 80(5): 1343-1349.
[5] TIMMERMAN R, PAULUS R, GALVIN J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076.
[6] GUTMAN D, DUNN W, GROSSMANN P, et al. Somatic mutations associated with MRI-derived volumetric features in glioblastoma[J]. Neuroradiology, 2015, 57(12): 1227-1237.
[7] VAN STIPHOUT R, VALENTINI V, BUIJSEN J, et al. Nomogram predicting response after chemoradiotherapy in rectal cancer using sequential PET/CT imaging: a multicentric prospective study with external validation[J]. Radiother Oncol, 2014, 113(2): 215-222.
[8] HU P, WANG J, ZHONG H, et al. Reproducibility with repeat CT in radiomics study for rectal cancer[J]. Oncotarget, 2016, 7(44): 71441-71446.
[9] MAX K. Applied predictive modeling[M]. New York. Springer Science Business Media, 2013: 109-116.
[10] BRUNET J P, TAMAYO P, GOLUB T R, et al. Metagenes andmolecular pattern discovery using matrix factorization[J]. Proc Natl Acad Sci U S A, 2004, 101(12): 4164-4169.
[11] AERTS H J, VELAZQUEZ E R, LEIJENAAR R T, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach[J]. Nat Commun, 2014, 5:4006-4014.
[12] CUNLIFFE A R, ARMATO S R, STRAUS C, et al. Lung texture in serial thoracic CT scans: correlation with radiologist-defined severity of acute changes following radiation therapy[J]. Phys Med Biol, 2014, 59(18): 5387-5398.
[13] CUNLIFFE A, ARMATO S G 3rd, CASTILLO R, et al. Lung texture in serial thoracic computed tomography scans:correlation of radiomics-based features with radiation therapy dose and radiation pneumonitis development[J]. Int J Radiat Oncol Biol Phys, 2015, 91(5): 1048-1056.
[14] LEE J, NISHIKAWA R M, REISER I, et al. Local curvature analysis for classifying breast tumors: Preliminary analysis in dedicated breast CT[J]. Med Phys, 2015, 42(9): 5479-5789.
[15] VIRMANI J, KUMAR V, KALRA N, et al. SVM-based characterization of liver cirrhosis by singular value decomposition of GLCM matrix[J]. J Digit Imaging, 2013, 26(3): 530-543.
[16] KUNAR P, ANWAR M I. Brain tumor and CAD through MRI by using wavelet transform and genetic algorithm[J]. J Inform Eng Appl, 2014, 4(4): 52-60.
[17] 夏 凡, 胡盼盼, 王佳舟, 等. 影像组学应用于肝脏特征分析及其预测治疗反应的初步研究[J]. 中国癌症杂志, 2016, 26(6): 521-526.
[18] 刘 笛, 陈佳艳, 沈钰新, 等. PET/CT标准摄取值与Ⅲ期非小细胞肺癌西妥昔单抗联合同期放化疗预后相关性的研究[J]. 中国癌症杂志, 2016, 26(6): 225-230.
[19] LEE D , KIM S , LEE H, et al. Early prediction of response to first-line therapy using integrated18F-FDG PET/CT for patients with advanced/metastatic non-small cell lung cancer[J]. J Thorac Oncol, 2009, 4(7): 816-821.
[20] KONG F , FREY K , QUINT L, et al. A pilot study of [18F]fluorodeoxyglucose positron emission tomography scans during and after radiation-based therapy in patients with non-small cell lung cancer[J]. J Clin Oncol, 2007, 25(21): 3116-3123.
Application of radiomics information captured from PET/CT and CT to predict therapeutic ef f ect of stereotactic ablative radiotherapy in stage Ⅰ non-small cell lung cancer
CHEN Jiayan, WANG
Jiazhou, ZHANG Junhua, LIU Di, ZHANG Jing, XU Xinyan, HUANG Lü, FAN Min (Department of Radiotherapy, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Background and purpose: Radiomics is an emerging field that generates large amounts of valuable clinical information through extracting quantitative imaging features. The purpose of this study was to use the radiomics approach to assess the value of features captured from PET and CT in predicting the therapeutic ef f ect in stage Ⅰ non-small cell lung cancer (NSCLC) after stereotactic ablative radiotherapy (SABR). Methods: Patients with stage Ⅰ NSCLC conf i rmed by pathology and treated with SABR were included retrospectively. The gross tumor volume (GTV) was def i ned by two radiologists. PET and CT scan images were collected, and radiomic features were further extracted and analyzed. Non-negative matrix factorization was used to distinguish patients with or without local control. Results: Sixteen patients were eligible for analysis. This study identif i ed two PET features (LL_GLCM_ Maximal_Correlation_Coefficient and HL_GLRMS_LRE) captured from PET/CT as having signif i cance in classifying patients with or without disease development. This study not fi nd similar results in CT scans. Conclusion: It seemsfeasible to use radiomics information ef f ects from PET/CT to predict therapeutic ef f ects of SABR in stage Ⅰ NSCLC. Further investigation is needed.
Radiomics; PET/CT; Lung cancer; Stereotactic ablative radiotherapy
FAN Min E-mail: fanming@fudan.edu.cn
10.19401/j.cnki.1007-3639.2017.02.008
R734.2
A
1007-3639(2017)02-0128-07
2016-09-15
2016-12-25)
樊 旼 E-mail:fanming@fudan.edu.cn

