miR-17-92基因簇增强前列腺癌DU145细胞的迁移、侵袭能力及对顺铂的耐药性
陈 昊,周 鹏,徐晶晶,周 珺,国 风
苏州大学附属第一医院中心实验室,江苏 苏州 215007
miR-17-92基因簇增强前列腺癌DU145细胞的迁移、侵袭能力及对顺铂的耐药性
陈 昊,周 鹏,徐晶晶,周 珺,国 风
苏州大学附属第一医院中心实验室,江苏 苏州 215007
背景与目的:miR-17-92基因簇与多种疾病的发生密切相关,其在肺癌、肝癌、胃癌和前列腺癌等多种肿瘤细胞中均高表达。本研究利用慢病毒包装系统建立稳定高表达miR-17-92基因簇的DU145细胞株,探讨miR-17-92基因簇对前列腺癌DU145细胞的迁移、侵袭能力及对顺铂耐药性的影响。方法:构建高表达miR-17-92基因簇的表达载体,转染DU145细胞株,同时转染空载体作为对照,并用实时荧光定量聚合酶链反应(real-time fl uorescent quantitative polymerase chain reaction,RTFQ-PCR)进行鉴定。用xCELLigence系统监测细胞的迁移、侵袭能力及顺铂处理后的生长情况;通过划痕实验观察细胞的迁移情况;采用蛋白[质]印迹法(Western blot)、凝胶酶谱实验和RTFQ-PCR检测相关蛋白质和基因的表达以探讨miR-17-92增强DU145细胞的迁移、侵袭能力及对顺铂耐药性的相关机制。结果:DU145-miR-17-92细胞迁移速率和侵袭能力高于DU145-control细胞(P<0.01)。DU145-miR-17-92细胞中整合素β1的蛋白质表达水平和基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)的活性显著高于DU145-control细胞。顺铂处理后,DU145-miR-17-92细胞的生长速度自12 h起快于DU145-control细胞并呈顺铂耐药性(P<0.01)。细胞外调节蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)在DU145-miR-17-92细胞中呈现持续高水平磷酸化,顺铂处理后,其磷酸化水平无明显变化。DU145-miR-17-92细胞中切除修复互补交叉基因1(excision repair cross complementing1,ERCC1)的mRNA和蛋白质表达水平显著高于DU145-control细胞。结论:高表达miR-17-92增强了DU145细胞的迁移、侵袭能力,其机制与整合素β1的表达上调及MMP-9活性增强有关。此外,高表达miR-17-92增强了DU145细胞对顺铂的耐药性,该过程与ERK1/2的磷酸化水平增加和ERCC1的表达水平上调相关。
miR-17-92;前列腺肿瘤;DU145;侵袭;迁移;顺铂
miRNA是一类由大约22个核苷酸组成的非编码RNA,它们通过与其目标mRNA结合,调控mRNA的表达,参与细胞的分化、凋亡及肿瘤形成[1]。miR-17-92基因簇是第1个被发现的与肿瘤形成有关的miRNA基因簇,在一系列人类肿瘤如淋巴瘤、白血病和实体瘤中均存在miR-17-92的过表达[2]。近年来,有研究证实,前列腺癌组织和细胞株当中也存在miRNA的异常表达[3-4],但关于miR-17-92在前列腺癌中的作用及其机制的研究报道甚少。本研究通过建立高表达miR-17-92的前列腺癌细胞株,研究miR-17-92对其生物学行为及对顺铂耐药性的影响,并探讨其作用机制。
1 材料和方法
1.1 主要仪器、试剂和抗体
流式细胞仪FASCalibur购自美国BD Biosciences公司;System Microscope IX7荧光倒置显微镜购自奥林巴斯(中国)有限公司;NanoDrop1000购自美国Thermo公司;xCELLigence细胞实时动态监测系统、E-Plate培养板、LightCycler 480荧光定量PCR仪和FuGENE HD均购自美国Roche公司;Odyssey荧光扫描成像系统购自美国LI-COR公司;RPMI-1640和胎牛血清购自美国Gibco公司;抗体ERK(4695)、pERK(4370S)和整合素β1(9699)购自美国Cell Signaling Technology公司;β-actin(AT0001)抗体购自美国CMCTAG公司;α-tubulin(AJ1034a)抗体购自美国ABGENT公司;嘌呤霉素(J539-25MG)购自美国Amresco公司;逆转录试剂M-MLV(28025-013)和合成引物购自美国Invitrogen公司;SYBR Premix Ex Taq(RR420)购自宝生物工程(大连)有限公司;Matrigel(356234)购自美国BD Biosciences公司。
1.2 方法
1.2.1 细胞培养
前列腺癌DU145细胞株为本实验室长期培养,完全培养基为含10%胎牛血清、100 U/mL青霉素和100 µg/mL链霉素的RPMI-1640,在37 ℃、CO2体积分数为5%的饱和湿度细胞培养箱中培养。Phoenix A包装细胞(中国科学院动物研究所赵勇教授赠送)使用含10%胎牛血清、100 U/mL青霉素和100 µg/mL链霉素的DMEM培养基进行培养。选用生长良好的对数生长期细胞进行后续实验。
1.2.2 建立稳定高表达miR-17-92基因簇的细胞株
在35 mm培养皿中接种Phoenix A包装细胞,第2天细胞融合度达到70%~80%时进行转染。转染试剂为FuGENE HD,使用包装载体pCL和MSCV-miR-17-92按照产品说明共同转染Phoenix A包装细胞,18 h后通过荧光显微镜观察转染效率,更换新鲜培养基,48 h后收集病毒上清液,并用此病毒上清液转染DU145靶细胞。同时使用包装载体pCL和空载体MSCV转染DU145细胞作为对照。利用嘌呤霉素(5 μg/mL)筛选,最终获得稳定转染的细胞株。
1.2.3 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)
Trizol一步法提取细胞总RNA,并用NanoDrop进行核酸质量控制。按照逆转录试剂说明,利用M-MLV将2 µg RNA逆转录合成cDNA。反应体系20 µL,25 ℃ 10 min,37 ℃50 min,70 ℃ 15 min,4 ℃保存。RTFQ-PCR在LightCycler 480荧光定量PCR仪上进行,每个反应设3个复孔,40个循环,以U6作为内参照,检测每个反应孔中荧光达到设定值时所经历的循环数(即Ct值),基因mRNA相对表达水平用2-ΔΔCt计算。引物序列用NCBI的PrimerBlast设计,具体引物序列见表1。
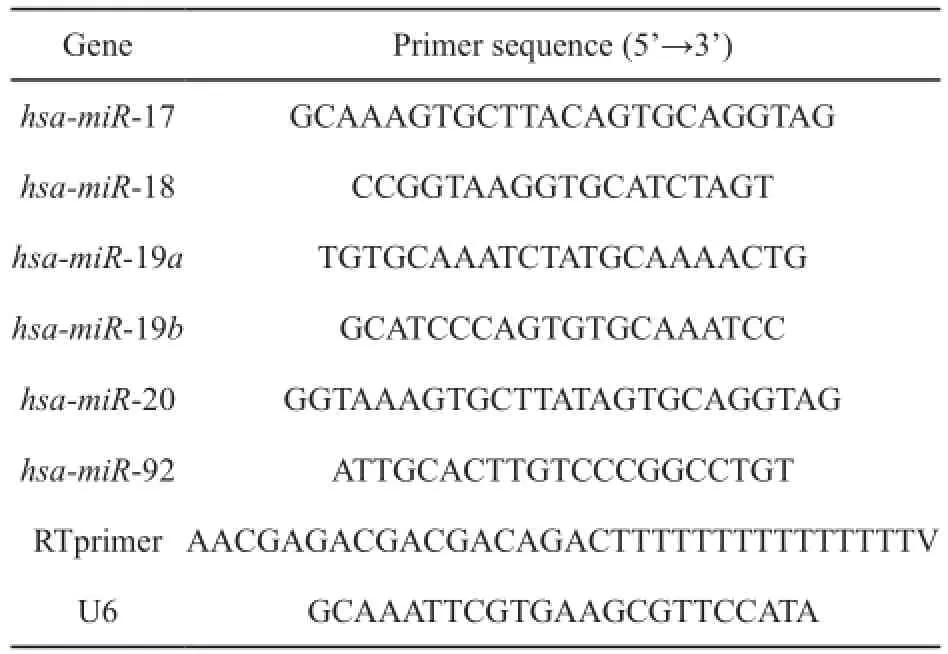
表1 RTFQ-PCR所用引物序列Tab. 1 The primer sequences used in RTFQ-PCR
1.2.4 蛋白[质]印迹法(Western blot)检测蛋白质表达水平
将DU145-control细胞和DU145-miR-17-92细胞分别在RIPA裂解缓冲液中进行裂解,提取细胞全蛋白。经过10%SDS丙烯酰胺凝胶电泳后,半干转到硝酸纤维素膜上。用5%脱脂奶粉室温封闭1 h后,加入一抗,4 ℃温育过夜。PBST洗膜后,二抗封闭1 h,用Odyssey荧光扫描成像系统成像检测。
1.2.5 细胞迁移实验
利用xCELLigence系统和RTCA 1.2软件进行细胞指数的实时动态监测,细胞指数是由测得的生物电阻抗推算出的一个无量纲参数,它与黏附上去的细胞数量直接相关。系统专用的培养板(CIM-plate)中未加细胞时,各个培养孔中的细胞指数相同,为起始空白值,当加入细胞后,随着细胞的贴壁和增殖生长,由此产生的生物电阻抗信号产生变化,即细胞贴壁多,信号高,细胞指数数值大。先在下室中加入170 µL含10%胎牛血清的RPMI-1640,上室加入30 µL无血清的RPMI-1640进行细胞培养的背景生物电阻抗监测,然后每孔加入100 µL细胞悬液,细胞数为40 000个,设置固定的时间间隔测定电阻。
1.2.6 体外划痕实验
用同等力度分别在两株细胞间划一道痕,用PBS洗细胞3次,去除划下的细胞,加入培养基,放入37 ℃、CO2体积分数为5%的培养箱培养。分别在24、48和72 h各时间点拍照记录。
1.2.7 细胞侵袭实验
利用xCELLigence系统和RTCA 1.2软件进行细胞指数的实时动态监测。将matrigel用无血清的培养基按1∶40稀释后加20 µL到上室,在37 ℃培养箱中温育4~6 h,而后在下室中加入170 µL含10%胎牛血清的RPMI-1640,上室加入30 µL无血清的RPMI-1640进行细胞培养的背景生物电阻抗监测,最后每孔加入100 µL细胞悬液,细胞数为40 000个,设置固定的时间间隔测定电阻。
1.2.8 凝胶酶谱实验
DU145-miR-17-92和DU145-control细胞常规培养24 h,细胞融合度达70%~80%后,换无胎牛血清培养基,继续培养24 h,收集培养上清液。取20 µL上清液于8%聚丙烯酰胺凝胶(含1%明胶)电泳后,取出凝胶,置于复性液中温育1 h,然后置于消化液中37 ℃温育40 h,温育后经染色液染色1 h,再经脱色液脱色,终止液终止脱色。最后显示,基质金属蛋白酶-2(matrix metalloprotein-2,MMP-2)和基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)为蓝色背景上的透亮带,干燥,封胶,拍照。
1.3 统计学处理
2 结 果
2.1 建立高表达miR-17-92基因簇的前列腺癌细胞株
在荧光显微镜下观察,DU145-control细胞和DU145-miR-17-92细胞均表达很强的绿荧光信号;用流式细胞仪检测各自的荧光率分别为97.1%和98.6%。RTFQ-PCR检测发现,DU145-miR-17-92细胞中miR-17-92家族各个成员的表达均较DU145-control细胞显著上调,其中,miR-17上调10倍,miR-18上调5倍,miR-19a上调8倍,miR-19b上调3倍,miR-20上调13倍,miR-92上调7倍(图1)。
2.2 高表达miR-17-92增强DU145细胞的迁移能力
在迁移实验中,xCELLigence系统实时动态监测显示,DU145-miR-17-92细胞的细胞指数曲线自2 h起高于DU145-control细胞,即DU145-miR-17-92细胞迁移速率快于DU145-control细胞,两者差异呈时间依赖性增加,差异有显著统计学意义(P<0.01,图2A)。体外划痕实验的结果显示,DU145-miR-17-92细胞从划痕边缘向中间的迁移速度显著快于DU145-control细胞(图2B)。
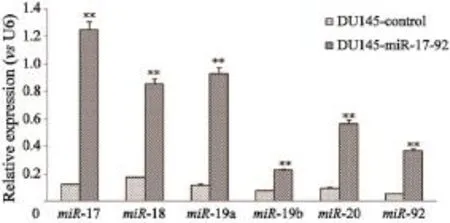
图1 RTFQ-PCR检测DU145-control和DU145-miR-17-92细胞中miR-17-92基因簇的mRNA表达水平Fig. 1 The mRNA expression of miR-17-92 gene cluster in DU145-control and DU145-miR-17-92 cells was examined by RTFQ-PCR
2.3 高表达miR-17-92增强DU145细胞的侵袭能力
xCELLigence系统实时动态监测显示,18 h起DU145-miR-17-92细胞的细胞指数曲线高于DU145-control细胞(P<0.01),即DU145-miR-17-92细胞侵袭能力强于DU145-control细胞,两者差异呈时间依赖性增加,差异有显著统计学意义(P<0.01,图3A)。Western blot检测DU145-miR-17-92细胞和DU145-control细胞中整合素β1的表达水平发现,DU145-miR-17-92细胞中整合素β1的表达水平显著高于DU145-control细胞(图3B)。凝胶酶谱实验检测两细胞中MMP的活性发现,MMP-2在两细胞株中的活性均很低,而MMP-9在DU145-miR-17-92细胞中的活性高于DU145-control细胞(图3C)。
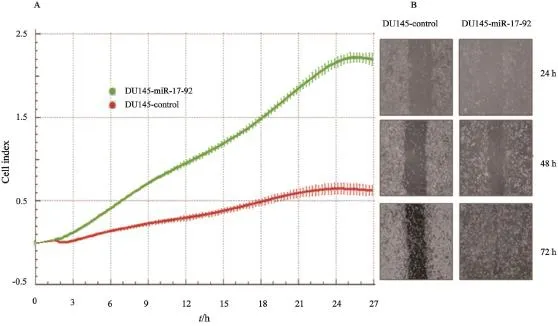
图2 DU145-miR-17-92和DU145-control细胞迁移实验Fig. 2 The migration of DU145-miR-17-92 and DU145-control cells
2.4 高表达miR-17-92增强DU145细胞对顺铂的耐药性
xCELLigence系统实时动态监测显示,顺铂处理后各时间点DU145-control细胞死亡显著,DU145-miR-17-92细胞死亡却并不明显。在12 h后的各时间点上,DU145-miR-17-92细胞相对于对照组细胞,呈现出顺铂抵抗性(图4A)。动态监测数据分析发现,DU145-control细胞的顺铂半抑制浓度为3.45 μmol/L,DU145-miR-17-92细胞的顺铂半抑制浓度为5.88 μmol/L,高表达miR-17-92使DU145细胞顺铂耐药性增强。Western blot检测发现,用顺铂处理后两株细胞中基础性ERK1/2的蛋白质表达均较高且差异无统计学意义,DU145-control细胞中ERK1/2的磷酸化水平呈时间依赖性增加;而DU145-miR-17-92细胞中ERK1/2的磷酸化水平并没有受到顺铂的影响,呈持续高水平磷酸化(图4B)。RTFQ-PCR和Western blot检测发现,DU145-miR-17-92细胞中ERCC1在mRNA和蛋白质水平的表达均高于DU145-control细胞(图4C、D)。
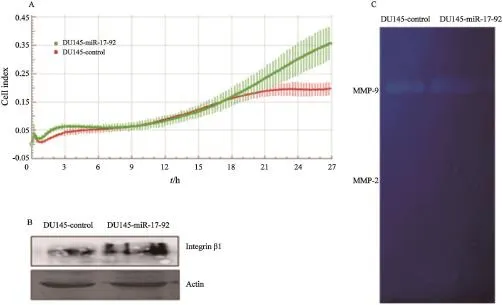
图3 DU145-miR-17-92和DU145-control细胞侵袭实验及侵袭相关蛋白质的表达水平Fig. 3 The invasion of DU145-miR-17-92 and DU145-control cells and the expression level of invasion-related proteins
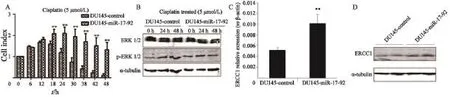
图4 顺铂处理后DU145-miR-17-92和DU145-control细胞的生长情况以及顺铂耐药相关基因的mRNA和蛋白质表达水平Fig. 4 The cell growth of DU145-miR-17-92 and DU145-control cells after the treatment of cisplatin and the expression level of drugresistance-related gene
3 讨 论
miR-17-92基因簇是第一个被发现的具有致瘤作用的miRNA,由miR-17、miR-18、miR-19a、miR-20a、miR-19b和miR-92组成,各个成员之间及与各个信号通路如PTEN、TGF-β之间相互协作,靶向调控肿瘤抑制蛋白质的表达,从而增强miR-17-92的致瘤作用[5]。
整合素β1是与细胞黏附相关的Intergrins家族中的重要成员,在肿瘤细胞的侵袭方面扮演着重要角色,整合素β1的活化和表达的上调涉及多种人类肿瘤细胞的诱导形成和播散过程[6],上皮恶性肿瘤如乳腺癌和恶性胶质瘤,发生转移和侵袭时,整合素β1会过表达[7]。另有研究表明,整合素β1与胃癌转移相关,抑制整合素β1的表达,会降低胃癌的转移[8]。本实验中,高表达miR-17-92促进了整合素β1在DU145中的表达,因此,miR-17-92增强DU145细胞的迁移及侵袭能力可能和整合素β1的上调有关。
MMP-2和MMP-9是MMP家族成员,肿瘤细胞通过高表达MMP改变细胞外基质,增加侵袭能力。MMP参与肿瘤发生、发展的各个阶段,包括增殖、分化、凋亡、黏附、迁移及肿瘤的转移和侵袭[9]。近年来,有研究表明,miRNA在转录后参与MMP调控,最终影响MMP基因的翻译和表达[10-11]。本研究发现,高表达miR-17-92,会上调MMP-9的表达,进一步验证了miR-17-92增强DU145细胞的迁移、侵袭能力。
以铂类为基础的化疗药物第1次转变了肿瘤的治疗模式,而顺铂是其中一种广谱并有效的抗癌药。它通过与细胞核内的基因组DNA结合,引起DNA的复制和转录分离,导致细胞死亡[12-13]。然而,肿瘤细胞对顺铂的耐药性又限制了它的使用。细胞内药物浓度过低、细胞内解毒作用增强和对药物诱导的损伤的强修复反应是介导细胞对顺铂耐药的几种方式。有研究发现,在对顺铂耐药的细胞中,依赖ERCC1和色素性干皮症基因A的表达,核苷酸切除修复活性增强,导致顺铂耐药[14]。在本研究中,与DU145-control细胞相比,DU145-miR-17-92细胞具有显著的顺铂耐药性,且DU145-miR-17-92细胞中ERCC1的mRNA和蛋白质表达水平均高于对照组,表明miR-17-92增强DU145细胞的顺铂耐药性可能和ERCC1表达上调有关。
PI3K/AKT信号通路的活化与化疗药物耐药性密切相关,此外,ERK1/2的活化能促进多种肿瘤细胞对化疗药物的耐药性,抑制ERK1/2的活化能抑制肿瘤细胞增殖,促进凋亡,逆转药物耐药性[15]。在本研究中,顺铂作用后,DU145-control细胞中ERK1/2的磷酸化水平呈时间依赖性增加,表明其顺铂耐药性逐渐增强,而在DU145-miR-17-92细胞中ERK1/2呈现持续高水平的磷酸化,进一步证实了miR-17-92能够增强DU145细胞的顺铂耐药性。
综上所述,高表达miR-17-92显著增强了DU145细胞的迁移、侵袭能力,其机制与整合素β1的表达上调及MMP-9活性增强有关。此外,miR-17-92能够增强DU145细胞对顺铂的耐药性,该过程与ERK1/2的持续高水平磷酸化密切相关;另外,ERCC1表达水平的上调可能是导致DU145对顺铂耐药的重要机制之一。
[1] CALIN G A, CROCE C M. MicroRNA-cancer connection:the beginning of a new tale[J]. Cancer Res, 2006, 66(15):7390-7394.
[2] JIN H Y, LAI M, XIAO C. MicroRNA-17-92 is a powerful cancer driver and a therapeutic target[J]. Cell Cycle, 2014, 13(4): 495-496.
[3] PORKKA K P, PFEIFFER M J, WALTERING K K, et al. MicroRNA expression profiling in prostate cancer[J]. Cancer Res, 2007, 67(13): 6130-6135.
[4] OZEN M, CREIGHTON C J, OZDEMIR M, et al. Widespread deregulation of microRNA expression in human prostate cancer[J]. Oncogene, 2008, 27(12): 1788-1793.
[5] CESAR S F, EDNA T K. Insights into Regulation of the miR-17-92 Cluster of miRNAs in Cancer[J]. Front Med (Lausanne), 2015, 2: 64.
[6] AHMED N, RILEY C, OLIVA K, et al. Integrin-linked kinase expression increases with ovarian tumour grade and is sustained by peritoneal tumour fluid[J]. J Pathol, 2003, 201(2): 229-237.
[7] WEAVER V M, LELIEVRE S, LAKINS J N, et al. Beta4Integrin-dependent formation of polarized three-dimensional architecture confers resistance to apoptosis in normal and malignant mammary epithelium[J]. Cancer Cell, 2002, 2(3): 205-216.
[8] LIN M T, CHANG C C, LIN B R, et al. Elevated expression of Cyr61 enhances peritoneal dissemination of gastric cancer cells through integrain alpha2beta1[J]. J Biol Chem, 2007, 282(47): 34594-34604.
[9] DERYUGINA E I, QUIGLEY J P. Matrix metalloproteinases and tumor metastasis[J]. Cancer Metastasis Rev, 2006, 25(1): 9-34.
[10] CROCE C M. Oncogenes and cancer[J]. N Engl J Med, 2008, 358(5): 502-511.
[11] ESQUELA K A, SLACK F J. Oncomirs-microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-269.
[12] GONZALEZ V M, FUERTES M A, ALONSO C, et al. Is cisplatin-induced cell death always produced by apoptosis?[J]. Mol Pharmacol, 2001, 59(4): 657-663.
[13] FUERTES M A, ALONSO C, PEREZ J M. Biochemical modulation of cisplatin mechanisms of action: enhancement of antitumor activity and circumvention of drug resistance[J]. Chem Rev, 2002, 103(3): 645-662.
[14] MEHMOOD R K. Review of Cisplatin and oxaliplatin in current immunogenic and monoclonal antibody treatments[J]. Oncol Rev, 2014, 8(2): 256.
[15] SI H, PENG C, LI J, et al. RNAi-mediated knockdown of ERK1/2 inhibits cell proliferation and invasion and increases chemosensitivity to cisplatin in human osteosarcoma U2-OS cells in vitro[J]. Int J Oncol, 2012, 40(4): 1291-1297.
miR-17-92 cluster increases the migration and invasion abilities of DU145 prostate cancer cells and enhances the cisplatin resistance
CHEN Hao, ZHOU Peng, XU Jingjing, ZHOU Jun, GUO Feng (Central
Lab, the First Affiliated Hospital of Soochow University, Suzhou 215007, Jiangsu Province, China)
Background and purpose: miR-17-92 gene cluster overexpression has been observed in various cancers, such as lung cancer, liver cancer, gastric cancer and prostate cancer. In this study, we established the stable cell line overexpressing miR-17-92 to explore the inf l uence of miR-17-92 on the migration, invasion abilities and cisplatin resistance of the prostate cancer DU145 cells. Methods: miR-17-92 overexpression vectors were constructed. DU145 cells were infected with the viral supernatants produced by Phoenix A packaging system. Real-time fl uorescent quantitative polymerase chain reaction (RTFQ-PCR) was conducted to detect the expression level of miR-17-92 in the cells. The migration and invasion abilities were measured by a real-time xCELLigence system. The scratch healing assay was carried out to investigate the migration abilities. The expression of integrin β1 was detected by Western blot, and the activities of matrix metalloprotein-2 (MMP-2) and matrix metalloprotein-9 (MMP-9) were measured by gelatinzymography experiment. The cell growth of the two cell lines after the treatment of cisplatin was detected by a real-time xCELLigence system. The mRNA expression of ERCC1 was measured by RTFQ-PCR. Western blot was conducted to investigate the protein expressions of ERCC1, ERK1/2 and pERK1/2. Results: DU145-miR-17-92 cells migrated faster than DU145-control cells during the 24 h continuous monitoring (P<0.01). The scratch healing assay indicated that DU145-miR-17-92 cells migrated from the edge towards the scratch center faster than DU145-control cells. DU145-miR-17-92 cells invaded through matrigel markedly faster than DU145-control cells (P<0.01). The protein expression level of integrin β1 and the MMP-9 activities in DU145-miR-17-92 cells were increased than those in DU145-control cells. After the treatment of cisplatin, DU145-miR-17-92 cells grew faster than DU145-control cells, presenting cisplatin resistance (P<0.01). The phosphorylation of ERK1/2 in DU145-miR-17-92 cells was constantly at a high level regardless of the treatment of cisplatin. Compared with DU145-control cells, the expression of drug resistance-related gene ERCC1 was dramatically increased in DU145-miR-17-92 cells after the treatment of cisplatin. Conclusion: miR-17-92 overexpression increases the migration and invasion abilities of the prostate cancer DU145 cells, which is associated with the upregulated expression of integrin β1 and the increased activity of MMP-9. Besides, miR-17-92 overexpression enhances the cisplatin resistance of DU145, which is correlated with the increased phosphorylation level of ERK and the upregulated expression of ERCC1 at both the mRNA and protein levels.
miR-17-92; Prostate cancer; DU145; Invasion; Migration; Cisplatin
GUO Feng E-mail: guofeng27@suda.edu.cn
10.19401/j.cnki.1007-3639.2017.02.003
R737.25
A
1007-3639(2017)02-0095-07
2016-04-18
2016-07-24)
国家自然科学基金资助项目(81172433,81400154);江苏省自然科学基金资助项目(BK20151211)。
国 风 E-mail:guofeng27@suda.edu.cn

