重金属Cd胁迫对元宝枫幼苗生长特性的影响
刘培杰+张静静
摘 要:为了探明重金属Cd胁迫对元宝枫幼苗生长特性的影响,以元宝枫扦插苗为试材,通过不同浓度的重金属Cd处理,测定了胁迫下元宝枫幼苗的株高增长量、叶片形态指数、叶绿素含量和根系生长相关指数。结果表明:重金属Cd处理均降低了元宝枫幼苗的株高增长量、叶片生长速度、叶绿素含量和根系生长速度,不同浓度处理间有差异。
关键词:元宝枫;叶绿素;根系生长率
中图分类号:S718.43 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2017.03.022
Effects of Heavy Metal Cd Stress on Growth Characteristics of Acer truncatum Seedlings
LIU Peijie,ZHANG Jingjing
(Taian Xinze Construction Engineering Limited Company, Taian, Shandong 271000, China)
Abstract: In order to investigate the effect of cadmium stress on seedling growth characteristics of Acer truncatum, the plant height increment of leaves, the leaf morphological index, chlorophyll content and root growth of Acer truncatum seedlings under different stress were measured with different concentrations of heavy metal cadmium. The results showed that Cd treatment reduced the plant height increment, leaf growth rate, chlorophyll content and root growth rate, and there were significant difference among different treatments.
Key words: Acer truncatum;chlorophyll;root growth rate
元寶枫,又名五角枫、元宝槭等,槭树科槭树属植物,变种繁多。元宝枫以其独特的叶形、春秋叶色变红等特点受到广泛关注,是我国重要的园林绿化树种和彩色叶树种,应用前景广泛[1]。土壤重金属是指密度在5.0 g·cm-3以上的金属元素,许多重金属(如Cu、Zn等)都是植物必需的微量元素,对植物的生长发育起着十分重要的作用[2]。但是,当土壤中重金属过量、超过某一临界值时,就会对植物产生胁迫作用,轻则导致植物体代谢过程发生紊乱,生长发育受到抑制;重则导致植物死亡,改变植物群落结构[3]。
近年来,随着农药和化肥的大量使用、污水灌溉、工业废渣填埋渗漏和大气沉降等,土壤重金属污染日趋严重。通过对大量城市土壤调查发现,污染土壤的主要重金属元素为铜、镉、铅、锌、砷、锰等,就我国而言,目前污染面积最大的为镉,毒性危害最强的为砷[4]。重金属通过破坏植物细胞膜,导致膜脂过氧化和巯基化合物含量下降,细胞内的离子和有机物质大量外渗[5];同时重金属易促使植物体内产生大量自由基,自由基攻击不饱和脂肪酸,造成细胞膜结构松散,膜功能被破坏,导致植物体内一系列生理生化过程失调,进而影响植物的生长,严重时导致植物死亡[6]。本研究以元宝枫幼苗为试验材料,通过外源添加重金属Cd离子,研究了不同重金属浓度对元宝枫幼苗生长的影响,旨在为元宝枫的引种利用提供参考。
1 材料和方法
1.1 试验时间、地点
本试验于2016年8月在泰山林业科学研究院温室中进行。
1.2 试验材料
供试材料为泰山林业科学研究院选育的元宝枫当年生扦插苗。
1.3 试验方法
1.3.1 材料处理 本试验以元宝枫无性系为材料,取6 cm长的插穗在塑料盒中进行水培,每盒30株,待生根后转至1/2改良Hoagland营养液,pH值=6.0,每两周换一次营养液。培养4周后,选取长势一致的植株用于Cd2+胁迫处理,Cd2+由CdCl2·2.5H2O(分析纯)提供。Cd2+浓度设定为处理1,50 mg·L-1;处理2:100 mg·L-1。以 1/2改良Hoagland 营养液配制,pH值=6.0。每处理无性系1株,3次重复,胁迫处理30 d后测定相应指标。
1.3.2 株高增长量测定 设定茎基到茎尖为测量长度,在进行胁迫处理前测定F0,胁迫处理10,20,30 d后测定FX,株高生长量为F=FX-F0。
1.3.3 叶面积测定 选择相同部位叶片,采用YMJ-B叶面积仪测定片叶叶面积,测定3次取平均值。剪去叶柄,洗净叶片,置于烘干箱中烘至恒重,称质量。计算比叶重:比叶重=总叶干质量/总叶面积。
1.3.4 叶绿素含量测定 采用丙酮法测定。
1.3.5 根系生长量测定 胁迫处理30 d后,取对照组和试验组根系,自基部剪下、洗净,采用专业版 WinRHIZO 根系分析系统测定根系构型参数,包括根总表面积、根尖数、总体积、根系平均直径及根系总长度。
1.4 数据处理
数据采用EXCEL、DPS7.05、SPSS13.0进行分析处理。
2 结果与分析
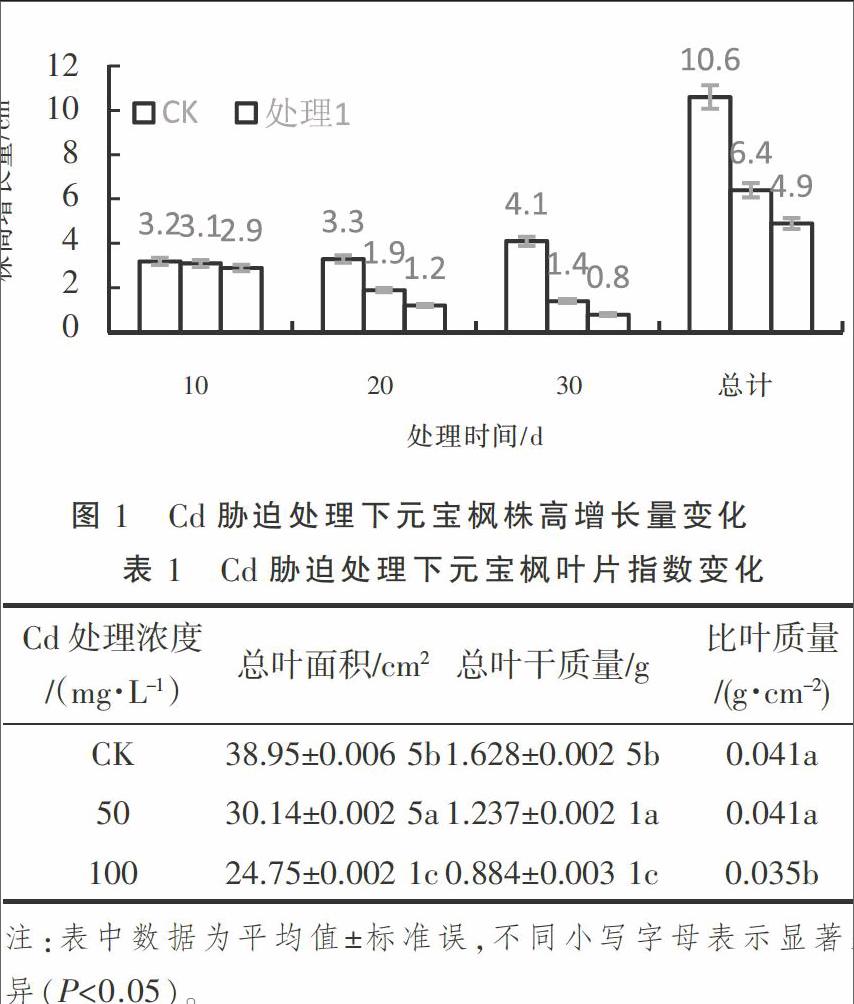
2.1 Cd胁迫下元宝枫株高增长量变化
由图1可知,重金属Cd胁迫严重制约了元宝枫株高的生长。随着胁迫时间的延长,元宝枫株高生长均呈现降低趋势。处理10 d时,对照组、处理1组和处理2组分别增长了3.2,3.1,2.9 cm,差别不大,此时元宝枫尚未受到严重伤害。处理20 d时,分别增长了3.3,1.9,1.2 cm,与对照组相比,株高生长速度分别下降了42.42%和63.63%,不同处理之间也表现出明显的生长差异。处理30 d时,分别增长了4.1,1.4,0.8 cm,与对照组相比,株高生长速度分别下降了65.85%和80.48%。统计生长30 d的株高增长量,对照组、处理1组和处理2组分别增长了10.6,6.4,4.9 cm,与对照相比,处理1组和处理2组比对照组分别降低了39.62%和53.77%,处理2比处理1降低了23.43%。可见,元宝枫在重金属Cd低浓度、短时间胁迫下,生长速度影响不明显,随着胁迫浓度的增高和时间的延长,元宝枫受伤害程度越深,生长越缓慢。
2.2 Cd胁迫下元宝枫叶片指数变化
由表1可知,重金属Cd胁迫影响了元宝枫叶片的生长。通过对胁迫30 d后叶片相关指标的测定发现,对照组、处理1组和处理2组叶片总面积差异显著,分别为38.95,30.14,24.75 cm2,与对照组相比,处理1组和处理2组分别降低了22.61%和36.45%,处理2组比处理1组降低了17.88%。总叶干质量差异显著,分别为1.628,1.237,0.884 g,与对照组相比,处理1组和处理2组分别降低了24.02%和45.70%,处理2组比处理1组降低了28.53%。对照组与处理1组比,叶干质量差异不显著,二者与处理2组差异显著,总叶干质量分别为0.041,0.041,0.035,与对照组和处理1组相比,处理2组均降低了14.63%。可见,重金属Cd胁迫降低了叶片生长速率,抑制了叶的增长,低浓度Cd胁迫下差异不显著,高浓度胁迫显著抑制叶的生长和干物质的合成。
2.3 Cd胁迫下元宝枫叶绿素含量变化
由表2可以看出,不同Cd浓度胁迫下元宝枫叶片叶绿素含量不同。随着胁迫浓度的增加,元宝枫叶绿素a、叶绿素b、叶绿素总量显著降低。与对照相比,50 mg·L-1 CdCl2·2.5H2O处理下叶绿素a、叶绿素b、叶绿素总量分别降低了15.54%,27.74%,16.61%;100 mg·L-1 CdCl2·2.5H2O處理下叶绿素a、叶绿素b、叶绿素总量分别降低了42.83%,43.90%,43.19%;处理2与处理1相比,元宝枫叶片叶绿素a、叶绿素b、叶绿素总量分别降低了32.31%,22.36%,29.33%。可见,重金属Cd胁迫严重降低了叶绿素的合成,进而影响了植物的光合作用,阻碍植物的正常生长。
2.4 Cd胁迫处理下元宝枫根系生长指标变化
通过WinRHIZO 根系分析系统测定根系构型参数,数据见表3。胁迫30 d后,对照组、处理1组和处理2组元宝枫根系根尖数呈显著性差异,分别为885,775,556个,与对照相比,处理1组和处理2组分别降低了12.43%,37.17%,处理2组比处理1组降低了28.25%。根系直径呈显著性差异,分别为0.84,0.62,0.53 mm,与对照相比,处理1组和处理2组分别降低了26.19%,36.90%,处理2组比处理1组降低了14.51%。根系总长度呈显著性差异,分别为954.62,875.43,595.54 mm,与对照相比,处理1组和处理2组分别降低了8.29%,37.61%,处理2组比处理1组降低了31.97%。根系总表面积呈显著性差异,分别为623.54,498.23,299.65 mm2,与对照相比,处理1组和处理2组分别降低了20.09%,51.94%,处理2组比处理1组降低了39.85%。根系总体积呈显著性差异,分别为65.36,52.74,43.22 mm3,与对照相比,处理1组和处理2组分别降低了19.31%,33.87%,处理2组比处理1组降低了18.05%。可见,重金属Cd胁迫影响了根系的生长,高浓度Cd胁迫不利于元宝枫根系生长,长时间胁迫下,将降低根系活力,影响根系吸水,从而对植物生长产生致命危害。
3 结论与讨论
本试验发现,重金属Cd胁迫影响了元宝枫的正常生长,元宝枫株高增长量、比叶重、总叶干质量、总叶面积、叶绿素含量、根系直径、根尖数、根总长度、根总表面积、根总体积均有不同程度的降低,不同浓度Cd处理影响不同。低浓度胁迫下对植物影响不大,尤其随着植株的增长,这种不利影响会逐渐减小。高浓度严重制约根系生长,进而影响根系吸水,从而影响地上部生长。这与孔祥生等[7]、李永杰[8]研究结果一致。重金属对植物生长影响主要是通过降低植物的光合作用,光合作用是生物界最基本的物质代谢和能量代谢,重金属胁迫能够抑制植物的光合作用,且抑制程度与胁迫程度呈正相关[9]。徐向华[10]研究发现,商陆成熟叶片叶绿素含量随Mn2+处理浓度的提高而降低。龙葵幼苗叶片净光合速率随Cd2+浓度的增加比对照下降了6.01%~61.71%[11]。众多研究表明,重金属胁迫能够影响叶绿素的合成,且随着胁迫浓度增加,膜系统崩溃,叶绿体球形皱缩,出现大量脂类小球,导致叶绿体功能遭到破坏[12-14]。同时,研究发现,植物叶片细胞膜在重金属环境下易遭到破坏,膜脂过氧化和巯基化合物含量下降,细胞内的离子和有机物质大量外渗;同时重金属易促使植物体内产生大量自由基,自由基攻击不饱和脂肪酸,造成细胞膜结构松散,膜功能被破坏,导致植物体内一系列生理生化过程失调。
本试验仅对元宝枫幼苗进行了不同浓度的重金属Cd处理,研究了对元宝枫生长特性的影响。至于成年植株是否有差异,元宝枫又可通过何种方式抵御重金属胁迫,通过何种外源物质或基因调控可以提高重金属Cd抗性,还有待于进一步研究。
参考文献:
[1]臧德奎.园林树木学[M].北京:中国建筑工业出版社,2007:340.
[2]史貴涛,陈振楼,李海雯,等.城市土壤重金属污染研究现状与趋势[J].环境监测管理与技术,2006,18(6):9-12, 24.
[3]王忠.植物生理学[M].北京:中国农业出版社,2000:121.
[4]郭亚平,胡曰利.土壤-植物系统中重金属污染及植物修复技术[J].中南林学院学报,2005,25(2):59-62.
[5]李子芳,刘惠芬,熊肖霞,等.镉胁迫对小麦种子萌发幼苗生长及生理生化特性的影响[J].农业环境科学学报, 2005,24(S1):17-20.
[6]刘登义,王友保.Cu、As对作物种子萌发和幼苗生长影响的研究[J].应用生态学报,2002,13(2):179-182.
[7]孔祥生,张妙霞,郭秀璞.Cd2+毒害对玉米幼苗细胞膜透性及保护酶活性的影响[J].农业环境科学学报,1999,18(3):133-134.
[8]李永杰.6种城市绿化树种苗木对土壤Cu、Pb污染的生理响应及耐性评价[D].北京:北京林业大学,2010.
[9]田生科.超积累东南景天(Sedum alfredii Hance)对重金属(Zn/Cd/Pb)的解毒机制[D].杭州:浙江大学,2010.
[10]徐向华.超积累植物商陆吸收累积锰机理研究[D].杭州:浙江大学,2006.
[11]郭智,原海燕,奥岩松.镉胁迫对龙葵幼苗光合特性和营养元素吸收的影响[J].生态环境学报,2009,18(3):824-829.
[12]SHAINBERG O,RUBIN B,RABINOWITCH H D,et al.Loading beans with sublethal levels of Copper enhances conditioning to oxidative stress[J].Journal of plant physiology,2001,158(11):1415-1421.
[13]陈花,王建军,杨斌.镉胁迫对菠菜和油菜早期生长的影响[J].山西农业科学,2016,44(9):1308-1311, 1371.
[14]赵雄伟,曹艳花,李玉桦,等.重金属镉对玉米苗期生理特性和转运变化的研究[J].华北农学报,2015,30(6):119-127.

