产谷胱甘肽荧光假单胞菌发酵条件的优化
石征宇,易弋,苏家敏,韦阳道,黎娅*
(1.广西科技大学生物与化学工程学院,广西柳州 545006;2.广西科技大学广西糖资源绿色加工重点实验室,广西柳州 545006;3.广西科技大学广西高校糖资源加工重点实验室,广西柳州 545006)
产谷胱甘肽荧光假单胞菌发酵条件的优化
石征宇1,2,3,易弋1,2,3,苏家敏1,2,3,韦阳道1,2,3,黎娅1,2,3*
(1.广西科技大学生物与化学工程学院,广西柳州 545006;2.广西科技大学广西糖资源绿色加工重点实验室,广西柳州 545006;3.广西科技大学广西高校糖资源加工重点实验室,广西柳州 545006)
方法:在实验室前期工作中,分离得到一株可生产谷胱甘肽(GSH)的荧光假单胞菌BJYG12,在单因素的基础上,通过正交试验对该菌株发酵生产GSH的条件进行了优化。结果:发酵温度28℃,初始pH 7.5,接种量5%,培养基含酵母膏25g/L,蔗糖15g/L,KH2PO41.5g/L,MgSO42.5g/L,优化发酵条件后,菌株产GSH的能力增长了15.7%。
荧光假单胞菌;谷胱甘肽;GSH;优化
谷胱甘肽(γ-L-谷氨酰基-L-半胱氨酰基甘氨酸[1],英文名称为γ-L-glutamyl-cysteinyl-glycine,简称GSH),是一种含γ-酰胺键和巯基的三肽[2,3],由谷氨酸、半胱氨酸及甘氨酸组成。谷胱甘肽分子结构中的巯基能与蛋白质的半胱氨酸残基形成二硫键[4],是一种特殊的抗氧化剂,具有清除氧自由基式、解毒和提高免疫等作用。临床上,由于GSH强大的还原作用,也可用作肝病的改善[5]和治疗以及化疗和放疗副作用的缓解[6]。在食品应用方面,GSH与肌苷酸(IMP)、鸟苷酸(GMP)及L-谷氨酸混合后有非常强的肉类风味[7,8],是调味品和健康食品中的鲜味增强剂和营养强化剂。另外,GSH也被添加到保健品和化妆品中,用于人体的保健和美容[9]。目前,由于谷胱甘肽的产量受限而使其价格十分昂贵,因此,探索并建立谷胱甘肽的高效发酵技术具有重要的应用价值。
在已报道的文献中,可发酵生产GSH的微生物主要以酵母菌为主,也有研究者尝试利用重组大肠杆菌[10,11]生产GSH。另外,一些革兰氏阳性菌如乳酸乳球菌[12]、藤黄八叠球菌[13]也可产GSH。也有研究指出荧光假单胞菌(Pseudomonassp.)可以生产GSH,但并未对其进行更深入的研究。本实验室在前期研究过程中,分离获得了一株产谷胱甘肽的荧光假单胞菌BJYG12[14]。作为原核生物,该菌株相对于酵母菌来说,具有营养需求简单、生长周期短、易于基因改造等优点,显示出了较好的研究价值。本文对该菌发酵生产GSH的条件进行了优化,为该菌株的进一步应用提供了部分理论依据。
1 材料与方法
1.1 材料
荧光假单胞菌BJYG12(Pseudomonassp.BJYG12):由广西科技大学生物与化学工程学院微生物研究室提供、分离并保藏。KB液体培养基:牛肉膏蛋白胨20g,甘油10mL,K2HPO41.5g,MgSO4·7H2O 1.5g,pH调至7,蒸馏水定容到1L,121℃灭菌20min。
1.2 试验方法
1.2.1 发酵流程
1.2.1.1 种子活化
取甘油法保藏的菌种10μL于3mL KB液体培养基中,放置在恒温摇床中于30℃,120r/min培养48h。
1.2.1.2 种子培养
从种子活化培养基中取出100μL接种于装有50mL KB液体培养基的三角瓶(250mL)中,放置于30℃恒温摇床中120r/min培养24h,作为种子液。
1.2.1.3 发酵
取1mL种子液接种于50mL KB液体培养基(自然pH)的三角瓶(500mL)中,30℃,160r/min培养30h。然后测定下列指标:生物量,取10mL发酵液离心洗涤,于烘箱中80℃烘干至恒重称重;GSH含量,采用DTNB法测定其GSH含量[15]。DTNB(5,5-二硫双-(2-硝基苯甲酸)能和巯基反应生成TNB(5-硫代-2-硝基苯甲酸),TNB在紫外412nm处有最大吸收且30min内有稳定的性质,测定其412nm处的分光光度值进而计算巯基物质的量。
1.2.2 发酵条件优化
1.2.2.1 培养温度、初始pH及接种量
根据1.2.1所述,分别改变培养温度、培养基初始pH及接种量进行单因素试验。
1.2.2.2 培养基优化
碳源的选择:在1.2.2.1的基础上,以葡萄糖、蔗糖、乳糖代替KB培养基中的甘油,按1.2.1所述进行发酵,优化碳源及其浓度。
氮源的选择:在1.2.2.1的基础上,用有机氮源及无机氮源代替KB培养基中的牛肉膏蛋白胨,按1.2.1所述进行发酵,优化氮源及其浓度。
KH2PO4的选择:在1.2.2.1的基础上,用KH2PO4替换KB培养基中的K2HPO4,按1.2.1所述进行发酵,优化磷酸盐浓度。
硫酸镁的选择:在1.2.2.1的基础上,调整KB培养基中的MgSO4浓度,按1.2.1所述进行发酵,优化MgSO4浓度。
正交试验:在1.2.2.1的基础上,以最优碳源、氮源、磷酸盐和MgSO44个因素为考察指标,进行四因素三水平的正交试验,对培养基成分进行进一步优化。
2 结果与分析
2.1 培养温度、初始pH及接种量
2.1.1 培养温度
按照1.2.1的发酵流程,分别在26,28,30,32,34℃下考察最适温度,结果见图1。

图1 培养温度对GSH含量的影响
由图1可知,BJYG12在28℃下的GSH产量最高,因此选择28℃进行后续试验。
2.1.2 初始pH
在KB培养基的基础上,利用低浓度HCl和NaOH调节KB培养基的初始pH至6.0,6.5,7.0,7.5,8.0,考察发酵液初始pH对GSH产量的影响,结果见图2。
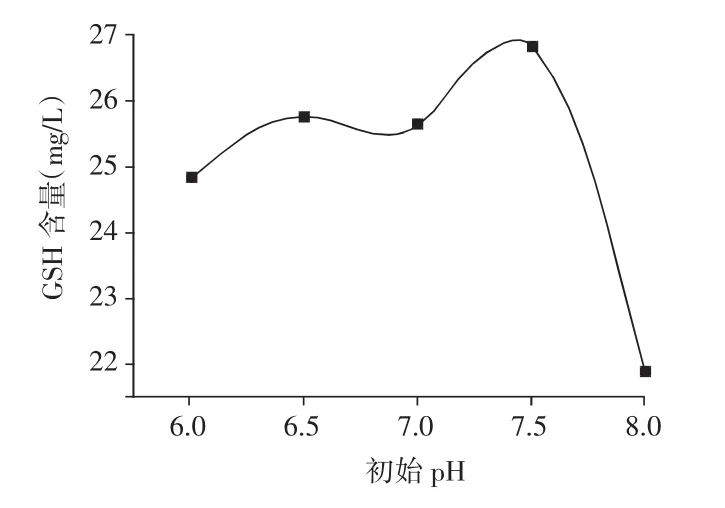
图2 初始pH对GSH含量的影响
由图2可知,pH为7.5时GSH的产量明显高于其他条件。pH为8.0时GSH含量突然下降,说明菌株对碱性条件较为敏感。
2.1.3 接种量
将种子液分别按1%,3%,5%,10%,15%的接种量接种于KB培养基中,考察接种量对GSH产量的影响,结果见图3。

图3 接种量对GSH含量的影响
由图3可知,接种量在1%~5%范围内,GSH含量波动不大,5%时GSH的产量最高。
2.2 培养基优化
培养基成分与其浓度对菌体的生长和产GSH能力有着重要的影响,因此,在2.1中的最优发酵条件下以KB培养基为基础,考察最优碳源、氮源、磷酸盐和硫酸镁以及它们的最佳浓度,最后利用正交试验对培养基组分进行再次优化。
2.2.1 碳源及其最佳浓度
查看伯杰氏手册可知,在常见的碳源中荧光假单胞菌可利用葡萄糖、蔗糖和乳糖,因此选择这3种糖替代培养基中的甘油,按所述的发酵流程进行发酵,结果见图4。

图4 不同碳源对GSH含量和生物量的影响
由图4可知,甘油和乳糖所对应的生物量和GSH含量较葡萄糖和蔗糖低很多。虽然蔗糖所对应的生物量较葡萄糖高约5%,但是葡萄糖所对应的GSH含量比蔗糖的高约25%,故选择葡萄糖作为最优碳源。
为了进一步了解葡萄糖浓度对GSH产量的影响,以不同浓度的葡萄糖(10,15,20,25,30,35g/L)来代替KB培养基中的碳源进行发酵,结果见图5。

图5 不同葡萄糖浓度对生物量及GSH含量的影响
由图5可知,不同浓度的葡萄糖可使GSH含量和生物量有较大范围的变化,二者的变化趋势一致。当葡萄糖浓度为20g/L时所对应的生物量和GSH产量最高。
2.2.2 氮源及其最佳浓度
在此部分试验中,选择常见的有机氮源(蛋白胨、酵母膏、牛肉膏)和无机氮源(尿素、硝酸铵、氯化铵),等量替换KB培养基中的氮源,按1.2.1的发酵流程进行发酵,通过比较生物量和GSH含量确定最优氮源后,再对其浓度进行进一步,优化结果见图6和图7。

图6 不同氮源对生物量和GSH含量的影响
由图6可知,菌株BJYG12对有机氮源的利用远远大于无机氮源,在有机氮源中酵母膏所对应的生物量和GSH含量最高。
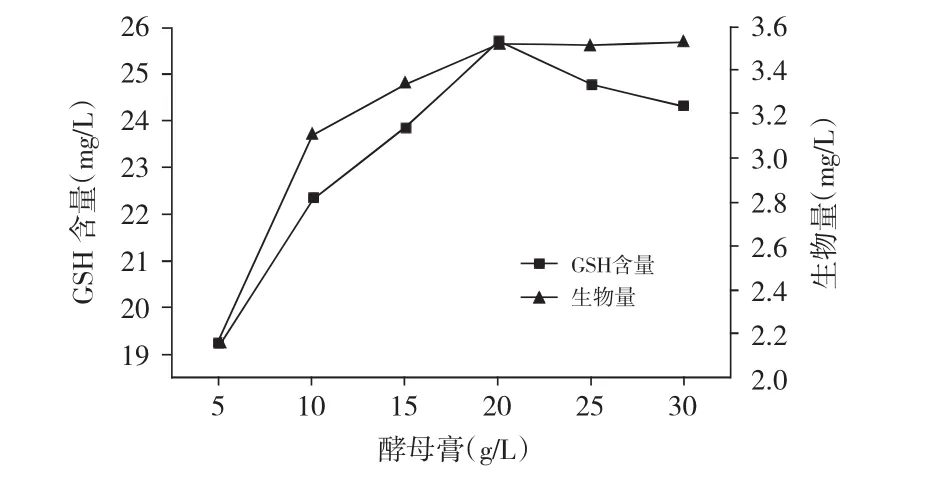
图7 不同浓度的酵母膏对生物量和GSH含量的影响
由图7可知,当酵母膏浓度小于20g/L时,所对应的生物量和GSH含量随酵母膏浓度的增加而增加;当酵母膏浓度大于20g/L时,其生物量趋于平稳而GSH含量迅速下降,故选择酵母膏浓度20g/L为最佳浓度。
2.2.3 KH2PO4浓度的确定
配制不同KH2PO4浓度(1,2,3,4,5g/L)的KB培养基中进行发酵,结果见图8。
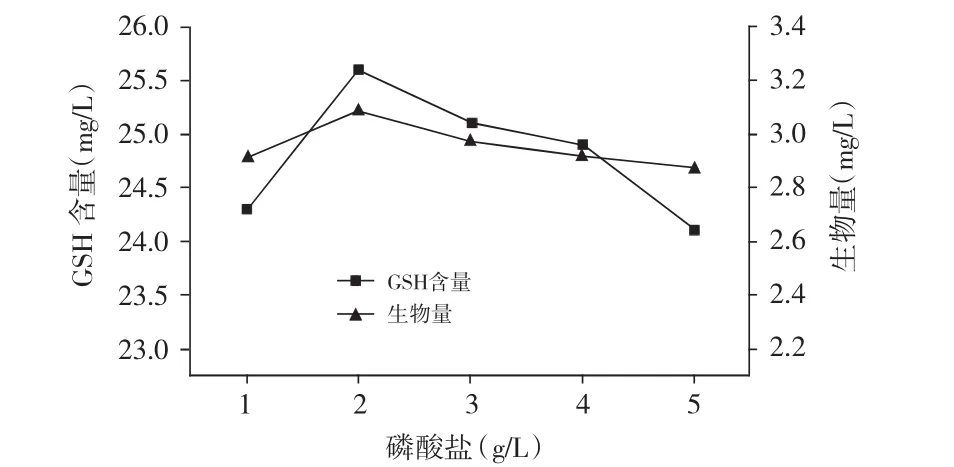
图8 不同浓度KH2PO4所对应的生物量和GSH含量
由图8可知,生物量和GSH含量随KH2PO4浓度增加而呈现出先增加后降低的趋势,在浓度为2g/L时生物量和GSH含量均达到最高。
2.2.4 硫酸镁浓度的确定
配制不同浓度的MgSO4(1,2,3,4,5g/L)且KB培养基中的其他成分不变配制培养基,调节培养基初始pH 7.5,灭菌,按1.2.1的发酵流程,选出最适MgSO4浓度,结果见图9。
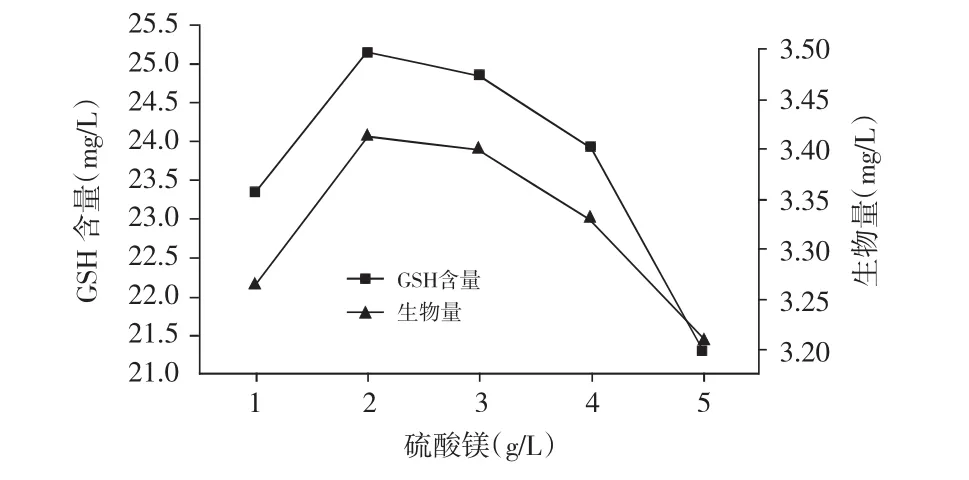
图9 不同浓度硫酸镁对GSH含量和生物量的影响
由图9可知,随MgSO4浓度的增加,生物量和GSH含量呈现先增加后降低的趋势,在2g/L时生物量和GSH含量均相对较高。
2.2.5 正交试验优化培养基
在单因素的基础上,采用正交试验对葡萄糖、酵母膏、磷酸盐和硫酸镁的浓度进行进一步的优化,选用L9(43)正交表,其因素水平见表1,试验结果见表2。

表1 正交试验因素水平表 g/L
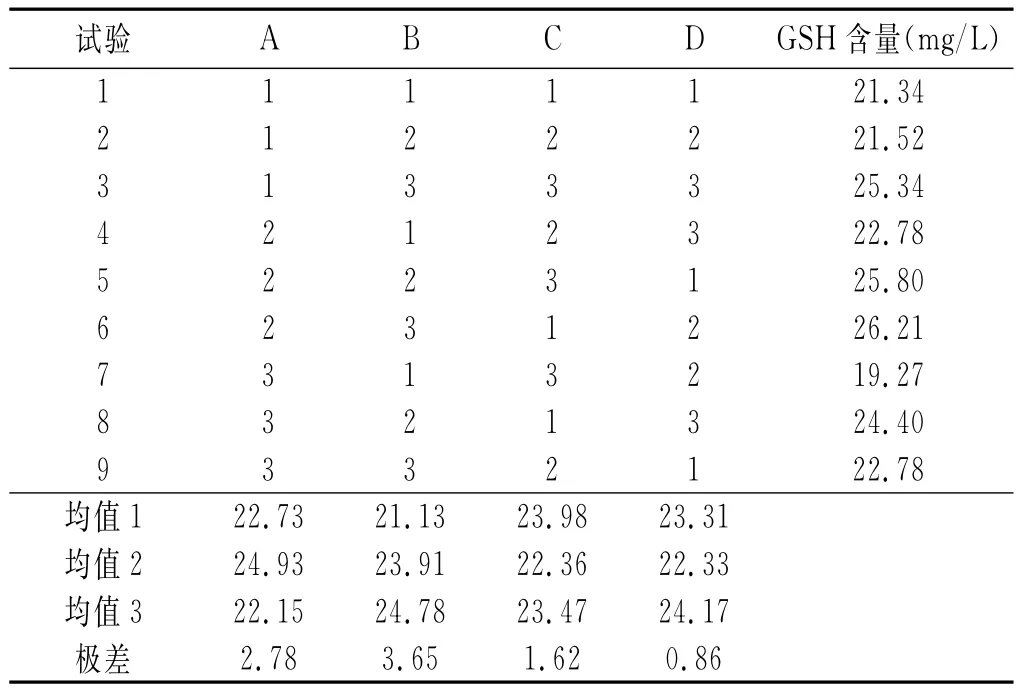
表2 正交试验结果
由表2可知,最优组合为:B3A2C1D3,即葡萄糖25g/L,酵母膏20g/L,MgSO42.5g/L,KH2PO41.5g/L。采用优化后的培养基进行发酵,测得GSH含量和生物量分别为26.13mg/L和4.339g/L(初始培养基分别为22.58mg/L和3.044g/L),表明优化后的培养基较原始培养基GSH含量提高了约15.7%,生物量提高了约42.5%,由此可见优化培养基对提高GSH含量是有利的。
3 结论与讨论
目前,在利用发酵法生产GSH的研究中,所使用的菌种主要是酵母菌,发酵终浓度一般在100~300mg/L左右[16,17],很少使用细菌。虽然目前使用细菌发酵法生产GSH的产量较酵母菌低,但细菌较酵母具有生长快,营养需求简单,易于基因改造等优点,显示出较好的研究前景。
MgSO4并不是常见的调节培养基的盐成分,本试验发现Mg2+浓度对该菌株产谷胱甘肽有一定影响,可能是因为Mg2+通过影响谷胱甘肽代谢相关酶的活力从而影响谷胱甘肽的产量,这与丁燏在南极硅藻[18]产谷胱甘肽研究中结果一致,谷胱甘肽的含量都呈现出随Mg2+浓度的升高而出现先增加而后降低的现象。
pH值是影响生物代谢和各种酶活力的又一重要因素,本试验结果表明:荧光假单胞菌产谷胱甘肽的最适pH为7.5,而卫功元等研究产朊假丝酵母产谷胱甘肽的最适pH为5.5[19],这与酵母菌喜欢偏酸环境的特性相关。
此外,本试验通过培养基成分优化得出无机氮源不利于该菌株产谷胱甘肽,可能是因为该菌株利用无机氮源的能力较弱,这与聂敏等研究氮源对产朊假丝酵母合成谷胱甘肽的影响结果不同[20],其研究结果为有机氮源和无机氮源对该菌产谷胱甘肽的能力影响相差无几。
本试验最终结果表明荧光假单胞菌产谷胱甘肽的最适温度为28℃,最适pH为7.5,最佳接种量为5%,通过对培养条件的优化和最适培养基浓度的确定,设计四因素三水平的正交试验优化培养基,优化后的培养基组成为葡萄糖25g/L,酵母膏20g/L,KH2PO41.5g/L,MgSO42.5g/L。在优化后的条件下进行发酵,GSH含量为26.13mg/L,较初始培养基提高了约15.7%。
[1]Lu S C.Regulation of hepatic glutathione synthesis:current concepts and controversies[J].The FASEB Journal,1999,13(10):1169-1183.
[2]Meister A,Anderson M E.Glutathione[J].Annual Review of Biochemistry,1983,52(1):711-760.
[3]Zhang T,Wen S,Tan T.Optimization of the medium for glutathione production inSaccharomycescerevisiae[J].Process Biochemistry,2007,42(3):454-458.
[4]Binsan W,Benjakul S,Visessanguan W,et al.Antioxidative activity of Mungoong,an extract paste,from the cephalothorax of white shrimp[J].Food Chemistry,2008,106(1):185-193.
[5]李斌晨,吴明营,蒙革,等.还原型谷胱甘肽临床研究及应用进展[J].中国医疗前沿,2008(6):9-10.
[6]Pastore A,Federici G,Bertini E,et al.Analysis of glutathione:implication in redox and detoxification[J].Clinica Chimica Acta,2003,333(1):19-39.
[7]冮洁,单立峰.谷胱甘肽的生产及其在食品工业中的应用[J].中国调味品,2009,34(2):7.
[8]Sen C K.Nutritional biochemistry of cellular glutathione[J].The Journal of Nutritional Biochemistry,1997,8(12):660-672.
[9]邵伟,乐超银,唐明,等.啤酒废酵母中谷胱甘肽提取工艺条件优化研究[J].食品科学,2008,29(5):173-176.
[10]张锦,邹玉明,张小松,等.反相高效液相色谱法测定还原型谷胱甘肽制剂的含量[J].中国药业,2005,14(12):41-42.
[11]王爱月,解魁,李发生.高效液相色谱法测定保健食品中谷胱甘肽含量的方法研究[J].中国卫生检验杂志,2007,17(7):1181-1182.
[12]李芳芳,易弋,左跃.一株谷胱甘肽高产荧光假单胞菌的分离与鉴定[J].中国调味品,2013,38(7):35-39.
[13]何俊勇,裘娟萍,黄敏,等.高产谷胱甘肽新菌种的选育及其发酵条件的研究[J].工业微生物,2005,35(3):31-35.
[14]付瑞燕,陈坚,李寅.一株具有谷胱甘肽合成能力的乳酸乳球菌的分离与初步研究[J].微生物学通报,2007,34(6):1057-1059.
[15]赵旭东,魏东芝.谷胱甘肽的简便测定法[J].药物分析杂志,2000,20(1):34-37.
[16]童群义,陈坚,李华钟.高产谷胱甘肽的酵母菌选育及其培养条件研究[J].工业微生物,2002,32(2):13-17.
[17]杜丽平,肖冬光,时丽萍.高产谷胱甘肽酵母菌株的选育[J].酿酒科技,2010(2):3-7.
[18]丁燏,廖锦来,唐啸尘.南极硅藻GJ01谷胱甘肽合成酶法生产谷胱甘肽[J].中国水产科学,2007,14(5):829-835.
[19]卫功元,李寅,堵国成.溶氧及pH对产朊假丝酵母分批发酵生产谷胱甘肽的影响[J].生物工程学报,2003,19(6):734-739.
[20]聂敏,卫功元,邵娜.氮源及碳源比对产朊假丝酵母合成谷胱甘肽的影响[J].生物加工过程,2010(2):23-29.
Optimization of the Fermentation Condition ofPseudomonas fluorescensProducing Glutathione
SHI Zheng-yu1,2,3,YI Yi1,2,3,SU Jia-min1,2,3,WEI Yang-dao1,2,3,LI Ya1,2,3*
(1.College of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China;2.Guangxi Key Laboratory of Green Processing of Sugar Resources,Guangxi University of Science and Technology,Liuzhou 545006,China;3.Key Laboratory for Processing of Sugar Resources in Guangxi Higher Education Institutes,Guangxi University of Science and Technology,Liuzhou 545006,China)
Methods:During the previous work of the laboratory,a strain ofPseudomonasfluorescensBJYG12is separated,which has the ability to produce glutathione.On the basis of single factor,the fermentation condition ofPseudomonasfluorescensstrain producing glutathione is optimized by the orthogonal test.Results:The fermentation temperature of 28℃,original pH of 7.5,inoculum concentration of 5%,culture medium containing yeast extract of 25g/L,sucrose of 15g/L,KH2PO4of 1.5g/L,MgSO4of 2.5g/L.After promoting the fermentation condition,the capacity of strain producing GSH increases by 15.7%.
Pseudomonasfluorescens;glutathione;GSH;optimization
TS201.3
A
10.3969/j.issn.1000-9973.2017.03.008
1000-9973(2017)03-0031-05
2016-09-15 *通讯作者
广西科学基金(2014GXNSFAA118086);广西科学基金(2015GXNSFBA139068)
石征宇(1990-),男,河南新乡人,硕士,研究方向:微生物分子生物学;黎娅(1980-),女,助理研究员,硕士,研究方向:微生物学。

