单增李斯特菌环介导等温扩增快速检测方法的建立
杨爱华 李秀梅 韩文瑜
(1.吉林大学动物医学学院,吉林长春 130062; 2.天津市动物疫病预防控制中心,天津 300402)
单增李斯特菌环介导等温扩增快速检测方法的建立
杨爱华1,2李秀梅2韩文瑜1
(1.吉林大学动物医学学院,吉林长春 130062; 2.天津市动物疫病预防控制中心,天津 300402)
研究针对细胞增生性李斯特菌(以下简称单增李斯特菌)hlyA基因设计了4条特异性的环介导等温核酸扩增(loopmediated isothermal amplification,LAMP)引物,通过优化反应条件,建立了单增李斯特菌的LAMP快速检测方法。特异性和敏感性试验结果显示,该方法能够特异地检测单增李斯特菌,其最低检测限为3 CFU/mL。扩增产物可通过琼脂糖凝胶电泳、显色反应进行判定。LAMP可以快速、直观、准确地检测单增李斯特菌,是一种适合基层现场应用的检测方法。
单增李斯特菌 环介导等温扩增 快速检测 hlyA基因
单增李斯特菌(Listeria monocytogenes,LM)是一种重要的人畜共患病原菌和食源性病原菌,人畜在食用了被该菌污染的食物后,除了出现恶心、呕吐、腹痛等一般细菌性食物中毒症状外,还会导致脑膜炎、骨髓炎、败血症、心肌炎、流产等,病死率高达30%。该菌在自然界分布广泛,4℃的环境中仍可生长、繁殖,增加了冷藏食品威胁人类健康的风险,WHO已将该菌列为重点检测的食源性致病菌之一,因此,建立快速、准确的检测方法对保证人类和动物生命安全具有重要意义。
目前,用于单增李斯特菌的检测技术主要有细菌分离鉴定、免疫学方法和PCR等,但上述方法花费时间较长,而且判定结果需要借助精密仪器设备,难以在基层生产中普及应用,因此建立一种简单、快速、准确的病原诊断方法显得十分必要。Notomi等于2000年发明了环介导等温核酸扩增技术,该技术依赖4条特异性引物和一种具有链置换特性的DNA聚合酶,在等温条件下快速、高效、高特异、高灵敏地扩增靶序列。本试验针对单增李斯特菌的hlyA基因设计了一套LAMP特异性引物,建立了一种用于单增李斯特菌基因检测的方法。与传统PCR相比,该方法操作简便,实验仪器要求较低,在普通恒温水浴锅中反应45min即可完成,而且可以通过在终产物中加入染料的方法直接用肉眼观察结果,能快速、准确地鉴定单增李斯特菌,在基层生产中具有广阔的推广应用前景。
1 材料和方法
1.1 材料
Bst DNA聚合酶、dNTP、10×buffer(Mg2+Free)缓冲液购自纽英伦生物技术(北京)有限公司;Betaine Solution(甜菜碱)、钙黄绿素购自美国Sigma公司,MgCl2、DNA marker购自天根生化科技(北京)有限公司;细菌基因组DNA提取试剂盒、普通质粒小提试剂盒购自杭州博日股份科技有限公司;单增李斯特菌菌株(54003,2013.11.22)由CDC惠赠;金黄色葡萄球菌、鼠伤寒沙门氏菌、志贺氏菌、副溶血性弧菌、肺炎克雷伯菌、大肠杆菌菌株购自广州粤晨生物科技有限公司。
1.2 引物设计与合成
采用引物设计软件Primer 4.0(http://primerexlorer.jp;Eiken Chemical Co.Ltd,Japan),针对单增李斯特菌保守的hlyA基因设计了4条LAMP的特异性引物,包括2条外引物(F3和B3)以及2条内引物(FIP和BIP)。引物由北京三博远志生物技术有限公司合成,引物序列见表1。
1.3 单增李斯特菌DNA模板的提取
使用细菌基因组DNA提取试剂盒对单增李斯特菌细菌培养液提取基因组DNA,经核酸蛋白定量仪定量后,-20℃保存备用。
1.4 单增李斯特菌LAMP检测方法反应体系的建立
根据反应体系优化策略,依次对引物浓度、Mg2+浓度、甜菜碱浓度和反应温度进行优化,具体梯度如下:内、外引物浓度比分别为:4、6、8、10,外引物终浓度为0.2μmol·L-1,其对应的内引物终浓度分别为:0.8、1.2、1.6、2.0μmol·L-1;Mg2+终浓度分别为2、3、4、6、8、10 mmol·L-1;甜菜碱终浓度分别为:0.4、0.6、0.8、1.0mmol·L-1;反应温度分别为61、62、63、64、65℃;在25μL的反应体系中dNTP混合液终浓度为1.4 mmol·L-1,1×buffer(Mg2+free),Bst DNA聚合酶8 U,模板2μl。所有体系在63℃分别反应45 min,80℃加热2 min终止反应,取5μl反应产物上样于1.5%琼脂糖凝胶电泳鉴定,以确定最佳的反应体系。
1.5 单增李斯特菌LAMP反应产物的鉴定
1.5.1 电泳分析与测序鉴定
将含LAMP反应液的PCR反应管置于水浴锅中63℃等温扩增45min后,取5μL反应产物用1.5%琼脂糖凝胶分析和测序验证。
1.5.2 可视化鉴定
反应前在LAMP反应液中加入1μl的荧光染料钙黄绿素,LAMP反应结束后用肉眼直接观察LAMP反应液的颜色变化。反应液颜色呈现绿色为阳性,反应液颜色呈现橘红色为阴性。
1.6 LAMP的敏感性试验
将单增李斯特菌细菌培养液经平板菌落计数后进行10倍梯度稀释,用建立的LAMP检测方法分别对各稀释度单增李斯特菌菌液DNA模板进行扩增,扩增产物经1.5%的琼脂糖凝胶电泳鉴定,以确定检测方法的敏感性。
1.7 LAMP的特异性试验
将单增李斯特菌与金黄色葡萄球菌、鼠伤寒沙门氏菌、志贺氏菌、副溶血性弧菌、肺炎克雷伯菌、大肠杆菌菌株基因组核酸,按照建立的LAMP检测方法,进行特异性试验。
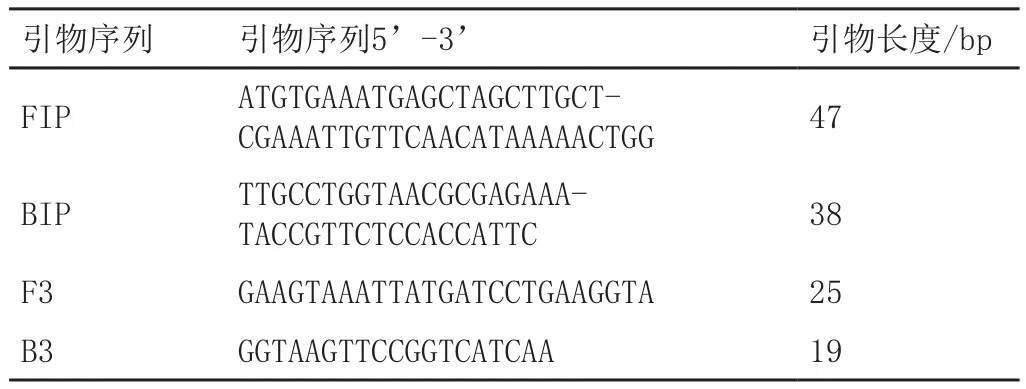
表1 引物序列表
2 结果
2.1 LAMP 检测方法反应条件的建立
优化后的反应体系(2 5 μ l)确定为:外引物(F 3和B3)(5pmol·μl-1)各0.5μl,内引物(FIP和BIP)(40pmol·μl-1)各0.5μL,Mg2+(25mM)6μl,甜菜碱(5M)4μl,dNTP混合液(10mM)3.5μl,10×buffer(Mg2+free)2.5μl,Bst DNA聚合酶(8 U·μl-1)1μl,模板2μl,去离子水3μl,钙黄绿素1μl。最佳反应温度为63℃。
2.2 LAMP产物的电泳与测序分析结果
将提取的单增李斯特菌DNA进行LAMP扩增,取5μl反应产物用1.5%的琼脂糖凝胶电泳检测,结果见图1,单增李斯特菌DNA扩增出了梯状条带,而阴性对照没有扩增产物,表明建立的LAMP检测方法可以用于单增李斯特菌核酸的检测。测序结果分析表明,扩增产物目的片段与单增李斯特菌(GENBANK:HM589603.1)的同源性达到99.92%,证明LAMP产物为单增李斯特菌基因片段。

图1 单增李斯特菌LAMP产物电泳图
2.3 LAMP产物的可视化鉴定结果
在LAMP反应前加入荧光染料钙黄绿素,反应结束后通过肉眼观察,阳性样品管呈绿色,而对照阴性管橘红色,见图2。其结果与LAMP产物电泳结果一致,表明加入钙黄绿素后所呈现的颜色反应具有特异性。

图2 单增李斯特菌LAMP可视化结果
2.4 LAMP敏感性试验
单增李斯特菌细菌培养液经平板菌落计数后,原始菌浓度为3×106CFU/ml,10倍梯度稀释菌液后,分别提取DNA模板进行LAMP扩增,扩增产物经1.5%的琼脂凝胶电泳鉴定,结果见图3。图中3 CFU/mL以上的稀释度均显示了典型的LAMP扩增条带,且信号依次递增。说明该方法的灵敏度理论上可达到大约3 CFU/ml的水平。

图3 敏感性试验结果
LAMP特异性试验
将单增李斯特菌与金黄色葡萄球菌、鼠伤寒沙门氏菌、志贺氏菌、副溶血性弧菌、肺炎克雷伯菌、大肠杆菌菌株的基因组DNA进行LAMP反应,结果见图4。该结果表明,只有单增李斯特菌的DNA出现目的条带,其他均未扩增出任何条带。
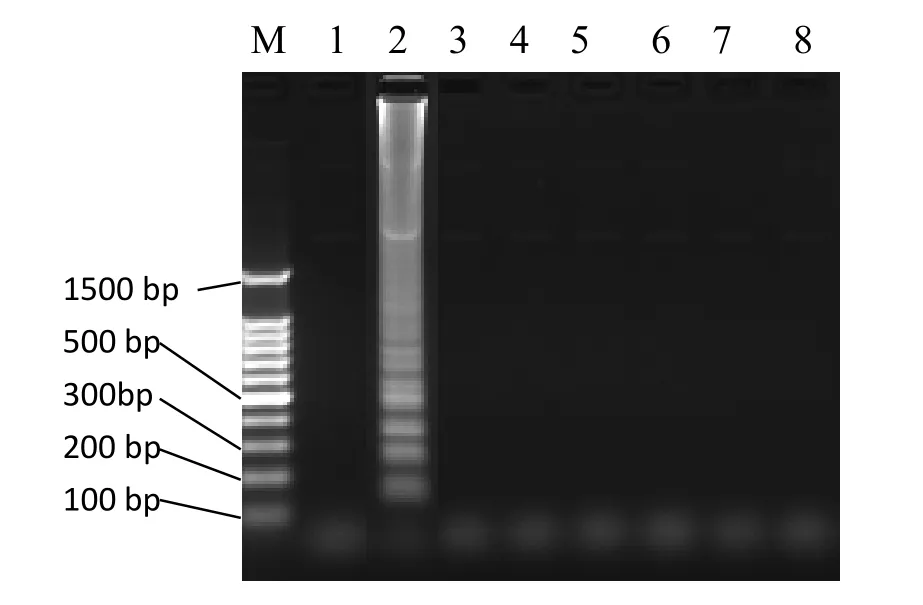
图4 特异性试验结果
3 讨论
从本试验可以看出,LAMP 扩增方法具有普通PCR 无法比拟的优点:(1)只需一恒定温度就能扩增反应。(2)高特异性。原理上LAMP法扩增的特异性很高,因此可以根据是否扩增就能判断目标基因的存在与否,即能够进行细菌或病毒的定性检测。(3)快速、高效扩增。整个扩增大约1 h 即可完成。(4)灵敏度高:扩增模板可达约3 CFU/ml。(5)步骤简单。反应不需PCR 仪和特殊试剂,在水浴锅中就能进行。(6)鉴定简便。LAMP 扩增过程中,核酸大量合成时,从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生大量的副产物—焦磷酸镁沉淀,使阳性反应管有明显的变浑浊现象,肉眼即可直接观察结果。但在本试验中我们发现产生这种沉淀的重复性不高且量很小,其灵敏度也低于琼脂糖凝胶电泳分析法,这也是今后需要进一步研究的内容。同时大量的扩增产物在结合核酸染色剂钙黄绿素的情况下,有肉眼可见的颜色变化(阴性为橙黄色,阳性偏绿色),结果肉眼可视。
保证引物的特异性是LAMP方法建立的关键。因此,选择特异的保守基因作为靶基因,用来设计合适的引物至关重要。本研究选择的靶基因是在李斯特菌属种间有很高同源性,并且是单增李斯特菌最主要的致病因子的hlyA基因。利用该设计引物,经Blastn和Clustal W比对分析,在理论上保证其特异性并位于hlyA基因保守区段,再经对实际菌株样品检测进一步验证,结果表明,本研究建立的LAMP快速检测方法能特异性的检测和鉴定单增李斯特菌,与金黄色葡萄球菌、鼠伤寒沙门氏菌、志贺氏菌、副溶血性弧菌、肺炎克雷伯菌、大肠杆菌无交叉反应,具有很高的特异性,能够有效地避免假阳性问题。
为了提高检测效率,缩短检测周期,本研究建立了检测单增李斯特菌的LAMP检测方法。结果显示该方法是一种快速、实用、灵敏的检测技术,如果进一步优化、完善和推广,该技术将会在单增李斯特菌的早期诊断及预防控制方面发挥重要作用。
[1] Kathariou S.Listeria monocytogenes virulence and pathogenicity a food safety perspective[J].Food Prot,2002,(65):1811-1829.
[2] Vazquez-Boland JA,Kuhn M,Berche P,et al.Listeria pathogenesis and molecular virulence deteminants[J].Clin Microbiol Rev,2001,(14):584-640.
[3] 李翠云.单核细胞李斯特菌研究近况[J].中国热带医学,2010,10(1):120-122.
[4] 周晓辉,焦新安.产单核细胞李斯特菌的分子鉴定与亚分型研究[J].中国人兽共患病杂志,2003,19(5):44-47.
杨爱华(1981-),女,兽医师,本科学历,主要从事动物疫病防控及实验室检测工作。
韩文瑜(1955-),男,教授,博士,博士生导师,研究方向为病原微生物学与免疫学。

