辛伐他汀对白癜风氧化应激模型中角质形成细胞趋化因子分泌的影响
辛伐他汀对白癜风氧化应激模型中角质形成细胞趋化因子分泌的影响
常毓倩 李舒丽 坚 哲 安亚文 高天文 李春英
目的:明确辛伐他汀对氧化应激下人原代角质形成细胞(KC)分泌趋化因子CXCL9、CXCL10、CXCL11和CCL22的影响。方法:常规培养KC,H2O2组给予1 mM H2O2模拟白癜风KC氧化应激模型,实验组予不同浓度辛伐他汀(0.1μmol/L、0.5μmol/L、1.0μmol/L)预处理后加入H2O2;采用Real-time PCR、ELISA及Western blot检测CXCL9、CXCL10、CXCL11和CCL22的mRNA表达及蛋白分泌。结果:辛伐他汀组CXCL9、CXCL10、CXCL11水平低于H2O2组,CCL22水平高于且呈H2O2组,呈剂量依赖方式。结论:辛伐他汀能通过应激的角质形成细胞调控分泌Th1型趋化因子CXCL9、CXCL10、CXCL11及CCL22的水平。
辛伐他汀;原代角质形成细胞;氧化应激;趋化因子
白癜风是一种常见的自身免疫性皮肤病,氧化应激被公认为是发病的重要原因之一,而T细胞介导的自身免疫是黑素细胞破坏的关键效应环节。研究表明[1],白癜风皮损Th1型趋化因子CXCL9、CXCL10、CXCL11显著升高,介导白癜风CD8+T细胞向皮肤迁移,而CCL22显著降低,抑制Treg细胞向皮肤浸润,最终导致黑素细胞免疫损伤[2,3]。最近研究发现,辛伐他汀可显著降低CD8+T细胞在白癜风小鼠皮损处局部的浸润,促进白癜风复色,但具体机制不清[4]。辛伐他汀是甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,也是临床上广泛使用的降脂类药物。近年来,大量研究证实其药物的多效性,即“非降脂作用”,具体表现在抗氧化、免疫调节、抗肿瘤、抗炎等方面[5]。值得注意的是,辛伐他汀的免疫调节作用被证实可治疗多种自身免疫性疾病,并在多发性硬化中取得临床证据[6,7]。早在2004年,No l等报道一位白癜风合并高胆固醇血症的患者,每日80mg大剂量口服辛伐他汀时显著促进了其白癜风皮损复色[8],首次证实辛伐他汀可以治疗白癜风。本研究拟证明在氧化应激条件下,白癜风发病重要趋化因子CXCL9、CXCL10、CXCL11和CCL22的表达变化,进一步探讨辛伐他汀对这些趋化因子表达的影响。
1 材料与方法
1.1 主要仪器与试剂原代角质形成细胞培养基KSFM购自美国Gibco公司。辛伐他汀(分子式:C25H39NaO6,货号D00175272)购自Calbiochem公司。细胞总RNA提取试剂盒购自日本Takara公司。RIPA裂解液及BCA蛋白定量试剂盒为碧云天生物技术有限公司产品。ELISA检测试剂盒购自美国RD公司。兔抗人CXCL9、CXCL10、CXCL11和CCL22抗体均购自美国Abcam公司,鼠抗人β-actin单克隆抗体购自Sigma公司,辣根过氧化物酶标记山羊抗兔及山羊抗小鼠IgG购自康为世纪生物科技公司。
1.2.1 原代角质形成细胞培养及处理正常包皮组织均来源于第四军医大学西京医院泌尿外科2015年度2~4月,2~18岁男性,取泌尿外科包皮环切术后皮损,约3.0cm直径大小,用添加双抗的DMEM培养基反复漂洗。剪除脂肪组织和结缔组织,避免破坏表皮,将皮损剪至条状,约1.0cm×0.5cm大,反复漂洗后移入Dispase液中,4℃过夜消化17 h。轻轻剥离皮肤表皮层,剪碎,无菌滤网过滤,收集过滤细胞悬液,加入含有0.25%胰酶的DMEM培养基,37℃消化10min,确保表皮层90%角质形成细胞分离后终止消化。1000rpm离心10min,收集细胞,置于限制性角质形成细胞培养基(KSFM)调定细胞密度(1~2)×106接种,37℃、5%CO2、90%湿度条件下培养。光学显微镜下持续观察细胞,选择培养到第三代至第五代的原代角质形成细胞,进行常规伊红和苏木精染色,鉴定其纯度达95%,方可用于后续实验。常规培养原代角质形成细胞培养待细胞生长至70%~80%融合时,实验组予以浓度梯度的辛伐他汀预处理24 h,之后再予以1mM H2O2处理24 h。对照组予DMSO处理,培养后收集细胞裂解液及上清检测CXCL9,CXCL10,CXCL11及CCL22的分泌及蛋白、mRNA的表达水平。
1.2.2 Real-time PCR检测趋化因子的表达Trizol试剂提取细胞RNA,按照试剂盒说明反转录成cDNA后进行qRT-PCR检测。引物设计及合成由上海生工生物工程技术服务有限公司完成,人CXCL9上游引物:5'-TCTAAACCCAGATTCAGCA-3',下游引物:5'-CTCCTTTGGAATGATAGCG-3';人CXCL10上游引物:5'-CTGACTCTAAGTGGCATTCAAGGA-3',下游引物:5'-CAATGATCTCAACACGTGGACAA-3';人CXCL11上游引物:5'-GGGTACATTATGGAGGCTTTCTCA-3',下游引物:5'-GAGGACGCTGTCTTTGCATAGG-3',人CCL22上游引物:5'-ATCGCCTACAGACTGCACTC-3',下游引物:5'-GACGGTAACGGACGTAATCAC-3';人β-actin上游引物:5'-CACGATGGAGGGGCCGGACTCATC-3',下游引物:5'-TAAAGACCTCTATGCCAACACAGT-3'。
1.2.3 ELISA检测趋化因子的表达收集实验组及对照组细胞上清,按照ELISA检测试剂盒操作说明检测CXCL9、CXCL10、CXCL11及CCL22分泌水平。
1.2.4 Western blot印迹检测趋化因子蛋白表达的水平收集实验处理组及对照组原代角质形成细胞,以RIPA裂解液裂解并提取细胞总蛋白,经BCA法定蛋白含量后进行聚丙烯酰胺凝胶电泳(5%浓缩胶,12%分离胶)。PVDF膜经甲醇激活后,湿转法转膜(直流电300mA)。转膜后,用5%脱脂奶粉室温封闭1~4 h,加入一抗(兔抗人CCL22单克隆抗体1:1000;兔抗人CXCL9多克隆抗体1:1500;兔抗人CXCL10多克隆抗体1:500;兔抗人CXCL11多克隆抗体1∶500;鼠抗人β-actin 1∶5000,均购自美国Sigma公司)4℃过夜,次日予以辣根过氧化物酶标记山羊抗兔IgG (1∶5000)、山羊抗小鼠IgG(1∶5000)二抗室温孵育1 h,使用化学发光仪检测结果。
1.2.5 统计学方法用Graphpad Prism 5统计软件进行分析,采用student t检验,P<0.05为差异有统计学意义。
2 结果
2.1 辛伐他汀对氧化应激下KC中CXCL9、CXCL10、CXCL11及CCL22 mRNA表达的影响在1 mM H2O2模拟白癜风KC氧化应激模型,Real Time-PCR检测发现CXCL9、CXCL10及CXCL11的mRNA水平均明显上调(图1a,c),而CCL22的mRNA表达呈现下调趋势(图1d)。当用不同浓度辛伐他汀预处理KC 24 h,发现辛伐他汀可呈剂量依赖趋势抑制H2O2诱导的CXCL9、CXCL10及CXCL11的mRNA表达,其中对CXCL10的影响最为显著(图1a,b),并且可以呈浓度依赖的趋势增强CCL22的mRNA表达(图1d)。
2.2 辛伐他汀对氧化应激下KC分泌CXCL9、CXCL10、CXCL11及CCL22的影响通过ELISA实验发现,同Real time-PCR结果一致,氧化应激条件下KC分泌CXCL9、CXCL10、CXCL11的能力增强,且CXCL10明显呈时间依赖趋势(图2a,b,c),CCL22分泌降低(图2d)。同样,当用不同浓度辛伐他汀预处理后,可以呈浓度依赖的趋势抑制H2O2诱导的CXCL9、CXCL10及CXCL11分泌(图2a,b,c),上调CCL22的水平(图2d)。
2.3 伐他汀对氧化应激下KC中CXCL9、CXCL10、CXCL11及CCL22蛋白水平表达的影响选取最佳辛伐他汀药物浓度1.0μmol/L,预处理KC,再经1.0 mmol/L H2O2刺激后,检测KC中不同趋化因子蛋白表达情况。Western印记结果显示辛伐他汀可显著下调细胞内氧化应激诱导的CXCL9、CXCL10及CXCL11蛋白表达,上调CCL22的表达(图3)。
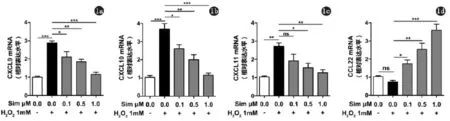
图1 a,b,c,d辛伐他汀对氧化应激下KC中CXCL9、CXCL10、CXCL11及CCL22 mRNA表达的影响(n=3,*P<0.05,**P<0.01,***P<0.001)
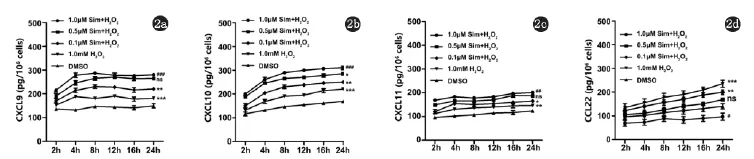
图2 a,b,c,d辛伐他汀对氧化应激下KC分泌CXCL9、CXCL10、CXCL11及CCL22的影响(n=3,#与DMSO组比较,#P<0.05,## P<0.01,###P<0.001;*与DMSO+H2O2处理组比较,*P<0.05,**P<0.01,***P<0.001)

图3 辛伐他汀对氧化应激下KC中CXCL9、CXCL10、CXCL11及CCL22蛋白水平表达的影响
3 讨论
研究表明,白癜风是在特定遗传背景下,氧化应激与自身免疫共同作用于黑素细胞导致表皮色素脱失的疾病,其中氧化应激引起免疫失调是白癜风发病的关键环节[9-11]。最近有研究表明Th1型趋化因子CXCL9、CXCL10及CXCL11在白癜风皮损处高表达,通过与受体CXCR3结合促进IFN-γ活性效应CD8+细胞定向皮肤迁移。此外有研究发现,白癜风患者皮损中介导Treg细胞皮肤迁移的趋化因子CCL22表达下调,并认为其造成Treg细胞数量减少,不能有效抑制CD8+T细胞对黑素细胞的杀伤效应,促进白癜风进展[2,12]。并且体内研究表明,通过上调CCL22表达,促进Treg细胞的皮肤浸润,或是采用中和抗体抑制Th1型趋化因子CXCL10表达,减少CD8+T细胞的皮肤聚集,均可抑制白癜风进展,促进复色[13-15]。该系列研究表明这些趋化因子的异常表达是白癜风致病的关键。我们的研究发现,氧化应激条件下,角质形成细胞可促进致病性Th1型趋化因子CXCL9、CXCL10及CXCL11分泌增多,而对CCL22的表达及分泌具有显著抑制作用,提示白癜风角质形成细胞在调控致病性趋化因子表达方面起重要作用。
最近有研究报道,辛伐他汀通过作用于IFN-r-STAT1通路可显著抑制鼻病毒感染引起的单核细胞中CXCL10的表达,因此被多位学者指出可作为鼻病毒导致相关呼吸系统疾病的治疗[4]。值得注意的是,John E Harris领导的研究小组在白癜风小鼠模型中,予以高剂量的辛伐他汀治疗亦可产生同拮抗CXCL10、CXCR3一致的效果,即减少CD8+T细胞的皮肤浸润,促进白癜风白斑复色[16]。然而辛伐他汀是否可以在原代细胞水平影响白癜风中角质形成细胞趋化因子的表达目前尚没有研究。我们的研究发现,辛伐他汀可以剂量依赖的方式,抑制氧化应激下角质形成细胞分泌Th1型趋化因子CXCL9、CXCL10及CXCL11,并且对CXCL10的影响最为显著,且能恢复氧化应激导致的CCL22分泌障碍,显著上调CCL22表达水平。该结果为辛伐他汀可用于白癜风治疗提供了新的理论依据,辛伐他汀调控这些趋化因子表达的具体机制,有待进一步研究。
综上所述,本研究明确辛伐他汀通过调控应激的角质形成细胞分泌Th1型趋化因子CXCL9、CXCL10及CXCL11,以及CCL22的水平,促进白癜风局部免疫稳态平衡,起到治疗白癜风的作用。
[1]Antonelli A,Ferrari SM,Fallahi P.The role of the Th1 chemokine CXCL10 in vitiligo[J].Ann Transl Med,2015,(Suppl 1):S16.
[2]Rashighi M,Harris JE.Interfering with the IFN-γ/CXCL10 pathway to develop new targeted treatments for vitiligo[J].Ann Transl Med,2015,3(21):343.
[3]Eby JM,Kang HK,Tully ST,et al.CCL22 to Activate Treg Migration and Suppress Depigmentation in Vitiligo[J].J Invest Dermatol.2015,135(6):1574-1580.
[4]Wickert LE,Karta MR,Audhya A,et al.Simvastatin attenuates rhinovirus-induced interferon and CXCL10 secretion from monocytic cells in vitro[J].J Leukoc Biol,2014,95 (6):951-959.
[5]Kavalipati N,Shah J,Ramakrishan A,et al.Pleiotropic effects of statins[J].Indian J Endocrinol Metab,2015,19 (5):554-562.
[6]Bindeman WE,Peiffer DS,Chatterjee S,et al.Simvastatin decreases free radicals formation in the human abdominal aortic aneurysm wall via NF-κB[J].Eur J Vasc Endovasc Surg,2012,4(2):133-137.
[7]Van Der Putten C,Kuipers HF,Zuiderwijk-Sick,et al.Statins amplify TLR-induced responses in microglia via inhibition of cholesterol biosynthesis[J].Glia,2012,60(1):43- 52.
[8]No l M,GagnéC,Bergeron J,et al.Positive pleiotropic effects of HMG-CoA reductase inhibitor on vitiligo[J].Lipids Health Dis,2004,3:7.
[9]Picardo M,Dell'Anna ML,Ezzedine K,et al.Vitiligo[J].Nat Rev Dis Primers,2015,1:15011.
[10]Ezzedine K,Eleftheriadou V,Whitton M,et al.Vitiligo[J].Lancet,2015,386(9988):74-84.
[11]Li S,Zhu G,Yang Y,et al.Oxidative stress-induced chemokine production mediates CD8(+)T cell skin trafficking in vitiligo[J].J Investig Dermatol,2015,17(1):32-33.
[12]Wang XX,Wang QQ,Wu JQ,et al.Increased expression of CXCR3 and its ligands in patients with vitiligo and CXCL10 as a potential clinical marker for vitiligo[J].Br J Dermatol,2016,174(6):1318-1326.
[13]Basak PY,AdilogluAK,Ceyhan AM,et al.The role of helper and regulatory T cells in the pathogenesis of vitiligo[J].J Am Acad Dermatol,2009,60:256-260.
[14]Klarquist J,Denman CJ,Hernandez C,et al.Reduced skin homing by functional Treg in vitiligo[J].Pigment Cell Melanoma Res,2010,23:276-286.
[15]Eby JM,Kang HK,Tully ST,et al.CCL22 to Activate Treg Migration and Suppress Depigmentation in Vitiligo[J].J Invest Dermatol,2015,135(6):1574-1580.
[16]Agarwal P,Rashighi M,Essien KI,et al.Simvastatin prevents and reverses depigmentation in a mouse modelof vitiligo[J].J Invest Dermatol,2015,135(4):1080-1088.
(收稿:2016-09-07修回:2016-10-26)
Effects of simvastatin on the expression of chemokine in the keratinocyte under oxidative stress
CHANGYuqian,LIShuli,JIANZhe,ANYawen,GAOTianwen,LIChunying.
DepartmentofDermatology,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032,China Correspondingauthor:LIChunying,E-mail:lichying@fmmu.edu.cn
Objective:To determine the effect of simvastatin on the expression of CXCL9,CXCL10,CXCL11 and CCL22 in H2O2-treated primary human keratinocytes(KC).Methods:KC in the experimental group was pre-treated with different concentration of simvastatin(0.1μmol/L,0.5μmol/L and 1.0μmol/ L),and then,exposed to 1.0 mM H2O2for 24 h.KC in the H2O2group was treated with 1.0 mM H2O2only.The expression levels of mRNA and protein of CXCL9,CXCL10,CXCL11 and CCL22 were detected by Real-time PCR,Western blot and ELISA.Results:The expression levels of mRNA and protein of CXCL9,CXCL10 and CXCL11 in the experimental group were higher than those in H2O2group,and the level of CCL22 was lower than that in H2O2group.Conclusion:Simvastatin can influence the levels of CXCL9,CXCL10,CXCL11 and CCL22 through regulating oxidatively stressed KC.
simvastatin;keratinocytes;oxidative stress;chemokine
国家自然科学基金资助项目(编号:XJZT15M10,81402599)作者单位:第四军医大学西京皮肤医院,西安,710032
李春英,E-mail:lichying@fmmu.edu.cn

