紫杉醇微胶囊的制备及其靶向释放性能评价
郑 义, 张焕新, 丁 宁, 刘 萍, 苏怡乐, 姚 成
紫杉醇微胶囊的制备及其靶向释放性能评价
郑 义1,2, 张焕新*1, 丁 宁1, 刘 萍1, 苏怡乐1, 姚 成2
(1.江苏农牧科技职业学院,江苏 泰州225300;2.南京工业大学,江苏 南京211816)
以银杏辛烯基琥珀酸淀粉酯为壁材,紫杉醇为芯材,采用喷雾干燥法制备微胶囊。通过正交试验确定了喷雾干燥法制备紫杉醇微胶囊的最优工艺组合:紫杉醇与银杏辛烯基琥珀酸淀粉酯质量比例1∶8,乳状液固形物质量分数15.0%,均质压力40.0 MPa,喷雾干燥进风温度200℃。在此工艺条件下,紫杉醇包埋率为96.82%,微胶囊中紫杉醇质量分数为10.63%。产品气味纯正,没有明显的苦味,颗粒表面平整光滑,细小均匀,具有良好的流散性,包埋效果好。在模拟人工胃液中,90.0 min,累积溶出率4.27%,基本不释药;在模拟人工小肠液中,紫杉醇4.0 h的累积溶出率25.6%;在模拟人工大肠环境中,12.0 h的体外累积溶出率达89.26%,24.0 h的体外累积溶出率达95.34%。表明紫杉醇微胶囊具有抗酸、抗消化、在大肠中易降解等特性,达到了大肠定位释药的效果,且其制备工艺简单、可行,是一种有潜力用于提高紫杉醇的药效并且降低不良反应的缓释新剂型。
银杏辛烯基琥珀酸淀粉酯;紫杉醇;微胶囊;喷雾干燥;靶向释放
紫杉醇(paclitaxel,taxol,PTX)是从红豆杉属植物组织提取的一种四环二萜类次生代谢产物,通过促进微管聚合和稳定已聚合微管抑制多种肿瘤细胞的增殖和转移并触发明显的细胞凋亡,主要用于乳腺癌、卵巢癌及结肠癌等肿瘤疾病的治疗[1]。由于紫杉醇难溶于水,临床上采用聚氧乙烯蓖麻油和无水乙醇溶解后静脉注射,给药后存在严重过敏反应和许多毒副作用,如骨髓抑制、神经毒性反应、心脏毒性反应、关节或肌肉痛、肝脏毒性反应、肾脏毒性反应等不良反应,使其应用受到限制[2]。为消除毒副作用,设计新的更能被接受的剂型以淘汰含有聚氧乙烯蓖麻油的传统剂型成为有关紫杉醇研究的热点,如微乳、囊泡、胶束、前体药物、包合物、脂质体、纳米粒等[3-5]。
微胶囊技术是指利用天然的或者合成的高分子包囊材料,将固体、液体或气体物质包埋在微小、半透性或密封的胶囊内,使内容物在特定条件下以可控的速率进行释放的技术。通过微胶囊技术可以达到隔离活性成分、保护芯材免受环境影响、掩盖不良味道或气味、控制释放等目的[6]。辛烯基琥珀酸淀粉酯 (Octenyl succinic anhydride modified starch,简称OSA starch)是由辛烯基琥珀酸酐(OSA)与淀粉在碱性或弱碱性条件下反应所制取的酯化产品[7],商品名为纯胶(Pure Gum),是一种安全性高的乳化增稠剂。1972年被列入美国食品添加剂范畴,联合国粮农组织和世界卫生组织(FAOW/HOF A O)对其评价为评价:酸酐的最大处理量是3.0%,取代度约0.02,日需量无需特殊规定,可将其用于食品,使用范围没有限制。1997年,在国内被批准作为食品添加剂使用,2001年使用范围被扩大到其用量可根据需求添加,无需控制[8]。由于分子中同时引入了亲水和疏水两个基团,因此辛烯基琥珀酸淀粉酯有着其它淀粉无法兼有的优良乳化性能和增稠性能[9],被广泛的应用于饮料乳浊液、乳化香精、微胶囊粉末、色拉调味油以及制药、化妆品、纺织和造纸等行业[10]。同时,辛烯基琥珀酸淀粉酯由于其又具有良好的慢消化特性[11]和可降解性,常被用来制备微胶囊壁材,并在药物控制释放等方面得到应用。
作者以银杏辛烯基琥珀酸淀粉酯为壁材,紫杉醇为芯材,采用喷雾干燥技术制备紫杉醇微胶囊靶向制剂,以期改善传统药物剂型的不良影响,实现紫杉醇在大肠中的靶向释放,降低血液及其他组织中药物,从而减少用药剂量,提高疗效,降低毒副反应。
1 材料与方法
1.1 材料与试剂
银杏辛烯基琥珀酸淀粉酯:实验室自制;紫杉醇原料药(纯度>99%):南京泽朗生物科技有限公司产品;紫杉醇标准品(含量测定用)上海阿拉丁生化科技股份有限公司产品。
1.2 仪器与设备
AL204分析天平:梅特勒-托利多中国有限公司产品;B-290型小型喷雾干燥机:瑞士Buchi有限公司产品;实验型GYB高压均质机:上海东华均质机厂产品。高效液相色谱仪:美国Waters公司产品;KQ3200型超声波清洗机:昆山市超声仪器有限公司产品。
1.3 方法
1.3.1 紫杉醇微胶囊制备工艺 银杏辛烯基琥珀酸淀粉酯溶解→加入无水乙醇紫杉醇溶液,初乳化→均质(保持60.0℃)→喷雾干燥→紫杉醇微胶囊,置干燥器内保存备用。
1.3.2 微胶囊包埋率的测定 采用Jafari等人的方法[12]。假设包埋于微胶囊颗粒中的所有紫杉醇都仍存在于微胶囊颗粒中或者表面,不考虑黏附在干燥壁上和在喷雾干燥过程中分解的紫杉醇量,包埋率由表面紫杉醇含量和紫杉醇总量确定,按以下公式计算。
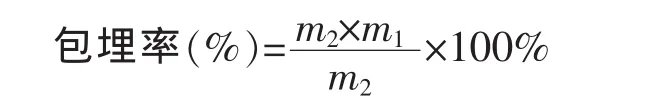
式中,m1为一定质量微胶囊颗粒中表面紫杉醇的质量,g;m2为一定质量微胶囊颗粒实际引入紫杉醇的质量,g。
1.3.3 微胶囊表面紫杉醇含量的测定 准确称取10.0 mg紫杉醇微胶囊溶于10.0 mL乙腈中,置超声波发生器中超声10.0 min后,5 000 r/min下离心5 min后取上清液600.0 μL,加400.0 μL超纯水完全混匀,使乙腈与水的体积比为60/40,采用高效液相色谱法进行测定[13]。色谱柱采用Inersil ODS-3 C18柱,流动相为V(乙腈)∶V(水)=60∶40,流量为1.0 mL/min,进样量为100.0 μL,检测波长为227.0 nm。
1.3.4 体外溶出度测定 按 《中国药典》2010年版二部(转篮法),评价喷雾干燥粉的体外释药性能[14]。
1.3.5 体外发酵实验 采集健康成人新鲜粪便200.0 g溶于1 000 mL磷酸盐(0.1 mol/L,pH 6.5)缓冲液中,充分振荡(2.0 min),制成200.0 g/L的悬浮液,用尼龙筛网粗滤,去除颗粒状物质,粪便收集和处理应在1.0 h内完成。所选对象近期内(1个月)内未服用过抗生素类的药物、未有腹泻和肠炎的病史。取50.0 mL健康成人粪便悬浮液转移至50.0 mL依次测定其在人工胃、小肠液处理之后紫杉醇微胶囊的磷酸缓冲液(0.1 mol/L,pH 7.8)试管中,加塞、混匀,至恒温培养箱(37.0℃)厌氧培养,分别在培养4.0、8.0、12.0、16.0、20.0及24.0 h时取样分析[15]。
1.3.6 微胶囊质量评定 感官评定 对喷雾干燥后得到的微胶囊进行气味、色泽、组织状态评定[16];水分含量、密度、粒度指标等,按照中国药典2010年版二部方法测定[14]。
1.4 试验设计
在预试验基础上,选择芯材与壁材比例、乳状液固形物浓度、均质压力及喷雾干燥进风温度等四个对微胶囊包埋率影响较大的因素,采用正交试验设计L9(34),优化紫杉醇微胶囊制备工艺,各因素与水平如表1所示。
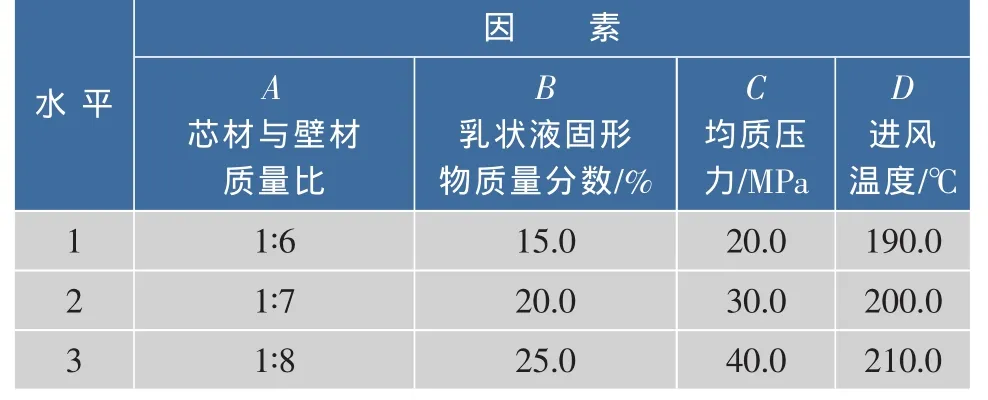
表1 正交试验因素水平表Table 1 Factors and levels in orthogonal experiment L9(34)
2.1 紫杉醇微胶囊的制备
2.1.1 微胶囊制备最佳工艺条件的确定 以微胶囊中紫杉醇的包埋率作为评价指标,通过正交试验确定芯材与壁材比例、乳状液固形物浓度、均质压力及喷雾干燥进风温度最佳工艺组合。试验结果见表2,方差分析见表3。
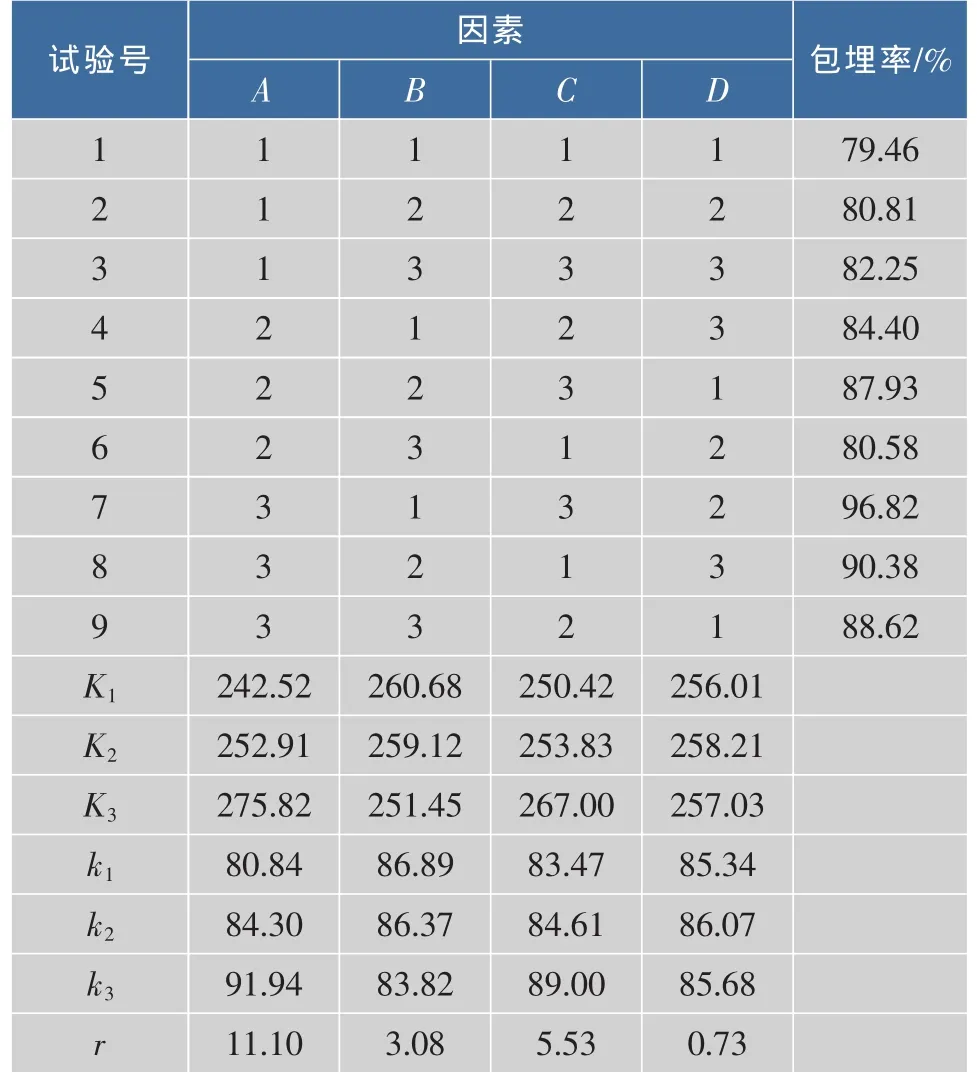
表2 正交试验设计组合及试验结果Table 2 Arrangement of orthogonal array design and the experimental results
对不同因素水平组合试验结果进行极差分析,由表2可知:各因素对紫杉醇包埋率的影响大小依次为:芯材与壁材比例(A)﹥均质压力(C)﹥乳状液固形物质量分数(B)﹥进风温度(D)。芯材与壁材比例是影响微胶囊包埋率的重要因素,芯材所占的比例越低,包埋率越高。银杏辛烯基琥珀酸淀粉酯及紫杉醇难溶于水,均质压力大小影响乳状液的平均粒径,粒径大小直接影响微胶囊的包埋率。压力越大,越有利于芯材在壁材体系中均匀分散,均质后形成的液滴平均粒径越小,喷雾干燥后产品的包埋率也越高。乳状液中的固形物浓度也是影响产品包埋率的重要因素。固形物浓度过低,乳状液的稳定性较差,降低喷雾干燥的效率;固形物浓度提高,体系粘度的增加,减少了心材向壁表面的扩散迁移,液滴雾化困难。进风温度低,微胶囊成膜速度降低,包埋效果差,同时产品的水分含量也会升高,流动性变差,影响产品的品质。提高进风温度,可较快的形成坚实的壁,有利于阻止芯材的损失,但进风温度过高时,水分散失速度过快,囊壁表面凹陷,同样影响产品的品质。喷雾干燥法制备紫杉醇微胶囊的最优工艺组合为:A3B1C3D2,即:芯材与壁材质量比例1∶8,乳状液固形物质量分数15.0%,均质压力40.0 MPa,进风温度200.0℃,紫杉醇的包埋率为96.82%。

表3 正交试验方差分析Table 3 Variance analysis of the orthogonal experiment
在试验选定的水平范围内,进风温度对紫杉醇的包埋率影响较小 (极差最小),以其为作为误差项,对试验结果进行方差分析(表3),由表3可知:芯材与壁材比例、均质压力、乳状液固形物浓度对紫杉醇微胶囊包埋率均具有显著影响 (P<0.05),其中芯材与壁材比例对包埋率的影响极显著 (P< 0.01)。因此,喷雾干燥法制备紫杉醇微胶囊时,银杏辛烯基琥珀酸淀粉酯与紫杉醇的添加比例是是获得高包埋率的关键因素。
2.1.2 紫杉醇微胶囊的物性分析 气味纯正,乳白色,颗粒细小均匀,流散性好,没有明显的苦味,流散性、混合性良好;水分质量分数:2.38%,密度:0.79 g/cm3,粒度:大小在10.0~14.0 μm,紫杉醇质量分数:10.63%。
2.2 体外溶出度评价
取适量样品分别装于普通胶囊壳中,分别依次测定其在人工胃液(pH 1.2的稀盐酸)2.0 h、人工小肠液 (pH 6.8的磷酸缓冲液)4.0 h中的释放情况。转速为100 r/min,介质温度为(37.0±0.5)℃,于规定时间 (根据药物在不同模拟环境中停留时间不同,停留较短的则取样时间点较为密集,停留时间长的取样时间间隔较长,在人工胃液中分别于10.0、30.0、60.0、90.0、120.0 min取样,人工小肠液中分别于30.0、60.0、120.0、180.0、240.0 min取样,并迅速补充等体积等温度的溶出介质,0.45 μm微孔滤膜滤过后,测定紫杉醇含量,结果见图1。

图1 紫杉醇与紫杉醇微胶囊在人工胃液、小肠液中的溶出曲线Fig.1 Dissolution curves of paclitaxel and paclitaxel-Octenyl Succinic Anhydride Modified Ginkgo starch microcapsule in simulated gastric fluid,simulated intestinal fluid
如图1(a)结果所示,在人工胃液对照组紫杉醇快速释放,溶出时间30 min时,累计溶出度为67.73%;溶出时间 90 min时,累计溶出度达95.32%,几乎完全释放。表明普通胶囊壳在模拟人工胃液环境中可以迅速降解,紫杉醇迅速被释放出来。而试验组紫杉醇在人工胃液环境中有一定的释放且释放缓慢,表明喷雾干燥过程中,紫杉醇被银杏辛烯基琥珀酸淀粉酯均匀包埋形成微胶囊,由于壁材具有较强的抗酸性能,紫杉醇不易被释放到外环境中去;在溶出时间90 min时,累计溶出度为4.27%;在溶出时间120 min时,累计溶出度为5.62%,主要原因可能是微胶囊表面紫杉醇与溶出介质充分接触后或者银杏辛烯基琥珀酸淀粉酯在酸性条件下发生少量水解所致。在模拟人工小肠液环境中,对照组和试验组展现出和人工胃液中相似的释放规律:对照组快速释放,实验组释放缓慢。当溶出时间120 min时,对照组中紫杉醇的累计溶出度为96.06%,几乎完全释放,微胶囊中紫杉醇的累计溶出度21.37%;当溶出时间240 min时,累计溶出度25.60%,表明壁材银杏辛烯基琥珀酸淀粉酯具有较强的抗消化性能。这与Heacock等[17-18]的研究发现淀粉经过OSA改性之后与α-淀粉酶的结合能力削弱,因此淀粉的可消化性降低结果相一致。
2.3 紫杉醇微胶囊在大肠环境中的释放
模拟人体大肠的微生物菌群的自然分布,加入一定量的紫杉醇微胶囊进行持续培养观察微胶囊中紫杉醇在大肠环境的的释放情况,如图2所示:发酵过程大致可以分为3个阶段:发酵时间0~8.0 h,微胶囊中紫杉醇累计溶出度增加缓慢 (0%~38.72%),发酵时间8.0~12.0 h,紫杉醇累计溶出度迅速增加(38.72%~89.26%);发酵时间12.0~24.0 h,紫杉醇累计溶出度趋于稳定 (89.26%~95.34%),胶囊中紫杉醇接近完全释放。紫杉醇累计溶出度取决于壁材银杏辛烯基琥珀酸淀粉酯在大肠中被微生物的降解速度,曾艳华[19]等用成人肠道厌氧菌对果聚糖进行体外发酵试验时发现:发酵液中总厌氧菌在0~8.0 h增殖较慢,为菌体生长滞后期,8.0~10.0 h各个样品中总厌氧菌迅速增殖,为对数生长期,与作者研究结论相一致。将某些口服蛋白类的药物、维生素和活性食品成分,完好地通过人体的消化系统输送至大肠释放出来,对于治疗和预防溃疡性结肠炎、结肠癌等肠道疾病具有重要意义[20]。制药工业中常用虫胶、直链淀粉醋酸酯、醇溶蛋白、纤维素衍生物及甲基丙烯酸甲酯聚合物等作为微胶囊壁材对药物进行传递,但这些材料在通过胃和小肠时,易受pH值的剧烈变化和消化酶的影响,快速释放芯材,不能起到真正保护芯材的作用;或者,在大肠中降解速度缓慢影响释放效率和芯材的作用效果。以银杏辛烯基琥珀酸淀粉酯为壁材制备的紫杉醇进行微胶囊在模拟人体胃、小肠环境中具有良好的抗酸、抗酶解性,在大肠中易被肠道微生物降解,释放充分等特性。

图2 紫杉醇微胶囊在人工大肠液中的溶出曲线Fig.2 Dissolution curves of paclitaxel-Octenyl Succinic Anhydride Modified Ginkgo starch microcapsule in simulated colonic fluid
3 结语
通过正交试验确定了喷雾干燥法制备紫杉醇微胶囊的最优工艺组合:紫杉醇与杏辛烯基琥珀酸淀粉酯比例1∶8,乳状液固形物质量分数15.0%,均质压力40.0 MPa,进风温度200.0℃。各因素对酯包埋率的影响大小依次为:芯材与壁材比例﹥均质压力﹥乳状液固形物浓度﹥进风温度。芯材与壁材比例、均质压力、乳状液固形物浓度对紫杉醇微胶囊包埋率均具有显著影响(P<0.05),其中芯材与壁材比例对包埋率的影响极显著(P<0.01)。在此工艺条件下,紫杉醇的包埋率为96.82%,微胶囊中紫杉醇质量分数为10.63%。产品气味纯正,没有明显的苦味,颗粒细小均匀,具有良好的流散性。
在模拟人体胃、小肠环境中,与对照组相比,微胶囊中紫杉醇溶出缓慢,且累计溶出度低:在胃液中累计溶出度为4.27%(溶出时间90 min);在肠液中累计溶出度为25.6%(溶出时间240 min),表明紫杉醇微胶囊具有抗酸、抗酶解性的特性显著。
模拟人体大肠环境环境中,微胶囊壁材杏辛烯基琥珀酸淀粉酯易被肠道微生物降解,发酵时间12.0 h,紫杉醇体外累积溶出率达89.26%;24.0 h,累计溶出度95.34%,接近完全释放。
以银杏辛烯基琥珀酸淀粉酯为壁材,紫杉醇为芯材,采用喷雾干燥技术制备紫杉醇微胶囊靶具有包埋率高高和载药量、均匀的粒径及分布、抗消化性能强,是一种可以提高紫杉醇的药效并且降低不良反应的缓释新剂型。
[1]SINGLA A K,GARG A,AGGARWAL D.Paclitaxel and its formulations[J].International journal of pharmaceutics,2002,235(1):179-192.
[2]MRI L,SUN H,SONG C.Progress in the development of paclitaxel formulation[J].Chinese Pharmaceutical Journal-Beijing,2006,41(18):1366-1370.
[3]YANG T,CHOI M K,CUI F D,et al.Preparation and evaluation of paclitaxel-loaded PEGylated immunoliposome[J].Journal of Controlled Release,2007,120(3):169-177.
[4]HUH K M,MIN H S,LEE S C,et al.A new hydrotropic block copolymer micelle system for aqueous solubilization of paclitaxel [J].Journal of Controlled Release,2008,126(2):122-129.
[5]ZHANG Linhua,HE Yingna,MA Guilei,et al.Preparation,characterization,in vitro and in vivo studies on folate-targeted biodegradable polymersomes loaded with paclitaxel[J].Chinese Pharmaceutical Journal,2010(22):1742-174.(in Chinese)
[6]JIN Legang,ZHAO Xinhuai.Effects of ratio of wall material to core material and concentration of material on properties of products during preparation of compound vitamin microcapsules[J].Transactions of the Chinese Society of Agricultural Engineering,2008,24(1):303-306.(in Chinese)
[7]CALDWELL C G,HILLS F,WURZBURG O B.Polysaccharide derivatives of substitut dicarboxylic acids.United State Patent,2661349.1953.
[8]XU Qiong,HE Guoqing,Song Xiaoyan.Studies on the preparation of octenyl succinic anhydride modified potato starch[J]. Journal of Chinese Institute of Food Science and Technology,2006,6(6):19-24.(in Chinese)
[9]LIN Honghui,ZHENG Weiwan,ZHAO Weixue,et al.Study on synthesis and application of starch octenylsuccinate[J].Food Science,2008,29(8):314-317.(in Chinese)
[10]HU Fei,HE Xi.Surface properties of starch octenyl succinate anhydride(Ⅱ)[J].Journal of Food Science and Biotechnology,2005,24(3):30-33.(in Chinese)
[11]HEACOCK P M,HERTZLER S R,WOLF B.The glycemic,insulinemic,and breath hydrogen responses in humans to a food starch esterified by 1-octenyl succinic anhydride[J].Nutrition Research,2004,24(8):581-592.
[12]JAFARI S M,ASSADPOOR E,BHANDARI B,et al.Nano-particle encapsulation of fish oil by spray drying[J].Food Research International,2008,41(2):172-183.
[13]GUO Tao,SUN Fangdi,PAN Weisan,et al.Preparation and identification of paclitaxel inclusion complex [J].Chinese Pharmaceutical Journal,2010(4):283-286.(in Chinese)
[14]国家药典委员会.中华人民共和国药典:二部[M].北京:中国医药科技出版社,2005.
[15]ZHANG H,XU X,JIN Z.Fermentation characteristics of resistant starch from maize prepared by the enzymatic method in vitro [J].International Journal of Biological Macromolecules,2012,51(5):1185-1188.
[16]LI Yanhui,ZHENG Mingzhu,LIU Jingsheng.Study on the technology of microencapsulated hazelnut oil[J].Food Science,2006,27(6):136-138.(in Chinese)
[17]HEACOCK P M,HERTZLER S R,WOLF B.The glycemic,insulinemic,and breath hydrogen responses in humans to a food starch esterified by 1-octenyl succinic anhydride[J].Nutrition Research,2004,24(8):581-592.
[18]HAN J A,BEMILLER J N.Preparation and physical characteristics of slowly digesting modified food starches[J].Carbohydrate Polymers,2007,67(3):366-374.
[19]曾艳华.中性大蒜果聚糖调节肠道菌群功能体外发酵研究[D].暨南大学,2010.
[20]CHEN L,LI X,PANG Y,et al.Resistant starch as a carrier for oral colon-targeting drug matrix system[J].Journal of Materials Science:Materials in Medicine,2007,18:2199-2203.
Preparation and Targeted Release Evaluation Studies on Micro-Encapsulation of Paclitaxel
ZHENG Yi1,2, ZHANG Huanxin*1, DING Ning1, LIU Ping1, SU Yile1, YAO Cheng2
(1.Jiangsu Agri-animal Husbandry Vocational College,Taizhou 225300,Chian;2.Nanjing Tech University,Nanjing 211816,China)
The paper studies the technological conditions of the spray-drying method for the preparation of targeted delivery microcapsule with octenyl succinic anhydride modified ginkgo starch as wall material,paclitaxel as core,respectively.With microencapsulating efficiency as the main evaluating index,the processing technology for preparing paclitaxel micro-encapsulation by spray-drying was investigated and optimized by the orthogonal experiments as followed:the proportion of core material and wall material is 1∶8,the solid concentration of emulsion is 15.0%,the homogeneous pressure is 40.0 MPa,and the temperature of inlet wind for the spray-drying is 200℃. Encapsulating rate of micro-encapsulation under the optimized technology is 96.82%,content ofpaclitaxel is 10.63%and its quality is good.The micro-encapsule was really stabe.The encapsulated paclitaxel released 4.27%after it was disposed in simulated gastric fluid and the accumulative drug-release percent in vitro at 240 min was 25.60%in simulated intestinal fluid;But in the simulated colonic fluid,the accumulated drug release percent reached 89.26%within 12.0 h,95.34% at 24.0 h,nearly perfectly released.These results indicate that the paclitaxel of micro-encapsulation had the characteristics higher resistance to digestibility and as a colon-specific delivery system.The preparation process is simple and feasible,it would be a novel paclitaxel preparation in clinic for the treatment of tumor.
Octenyl Succinic Anhydride Modified Ginkgo starch,paclitaxel,microcapsule,spraydrying,targeted release
TS 239
A
1673—1689(2017)01—0087—06
2015-03-23
江苏省“青蓝工程”资助项目(20160418);江苏省高等学校大学生创新创业训练计划(20150809);泰州市科技支撑工业项目(TG201421)。
郑 义(1976—),女,江苏泰州人,应用化学博士研究生,副教授,主要从事应用化学研究。E-mail:zysm76@yahoo.com
*通信作者:张焕新(1972—),男,河南叶县人,工学博士,教 授,主要从事粮食、油脂及植物蛋白工程研究。E-mail:hxinzh@hotmail.com
郑 义,张焕新,丁 宁,等.紫杉醇微胶囊的制备及其靶向释放性能评价[J].食品与生物技术学报,2017,36(01):87-92.

