MicroRNA-184靶向作用EPB41L5抑制肾细胞癌存活与迁移研究
赖永旭,李艳萍
四川省绵阳市中心医院药剂科(绵阳 621000)
MicroRNA-184靶向作用EPB41L5抑制肾细胞癌存活与迁移研究
赖永旭,李艳萍
四川省绵阳市中心医院药剂科(绵阳 621000)
目的:研究MicroRNA-184(miR-184)对肾癌细胞存活与迁移的影响,并分析其靶基因及功能。方法:RT-PCR法检测肾细胞癌模型小鼠肿瘤组织及细胞系中miR-184的表达水平。脂质体法转染miR-184 mimic至肾癌细胞A498、786-O,利用平板克隆及Transwell法测细胞克隆形成及迁移能力。生物信息学分析预测miR-184靶基因,荧光素酶报告基因法检测miR-184对靶基因的作用,Western blot法检测靶基因表达量。转染靶基因siRNA检测细胞克隆形成及迁移情况。结果:肾细胞癌小鼠肿瘤组织及肾癌细胞中miR-184表达水平显著降低(P<0.05)。转染miR-184mimic后,肾癌细胞的克隆形成能力及细胞迁移数目显著减少(P<0.05)。靶基因预测结果表明,EPB41L5的3’-UTR包含miR-184的潜在结合位点。miR-184 mimic转染降低EPB41L5正常3’-UTR载体的荧光素酶活性,而对突变3’-UTR的荧光素酶活性则无影响。EPB41L5 siRNA转染后,肾癌细胞中EPB41L5表达水平较对照组明显下降,同时,细胞体外克隆形成数目及迁移数目显著减少。结论:miR-184可通过作用靶基因EPB41L5而调控肾癌细胞的存活及迁移能力,影响肾细胞癌的发展。
肾细胞癌(Renal cell carcinoma,RCC),具有较高的发病率,且患者在术后仍具有较高的复发及死亡风险[1]。癌细胞的转移与扩散是决定肾癌病理进程及危害程度的重要因素[2-3]。因此,寻找肾癌发病过程调控癌细胞转移与侵袭的关键分子及机制对于肾癌的诊断和治疗具有重要价值。
MicroRNA是一类长约19~24个核苷酸的非编码单链小分子RNA,可与靶信使RNA的3'-UTR互补结合,降解或抑制mRNA的翻译过程,影响其表达,进而调控靶分子所参与的作用过程,影响细胞行为[4-5]。已有研究表明,MicroRNA-184(miR-184)是一种重要的调控分子,在胶质瘤等多种癌症的病理组织及细胞中均存在异常表达,其表达水平的改变直接或间接影响着癌细胞的增殖、凋亡、迁移等过程,对癌症的病理进程具有重要调节作用[6]。本实验以RCC病理组织及细胞为对象,分析miR-184表达水平的变化情况及对肾癌细胞迁移、侵袭能力的调节,并对其潜在靶基因进行研究,为理解肾细胞癌的发病机制提供帮助。
材料与方法
1 材料、试剂 10例肾细胞癌模型小鼠取自山东省立医院,实验小鼠未经过化疗、放疗及其他治疗过程,本研究获山东省立医院伦理委员会批准。正常小鼠肾细胞株HK-2、小鼠肾癌细胞株A498、786-O购自山东省立医院。miR-184 mimic、negative control miRNA、EPB41L5 siRNA(锐博生物科技有限公司);EPB41L5、β-actin一抗、羊抗兔二抗(Abcam公司);Lipofectamine 2000转染试剂(Invitrogen公司);实时定量PCR试剂盒套装(Takara公司);Transwell侵袭小室(Millipore公司)。
2 方 法
2.1 细胞培养与转染: HK-2细胞培养于DMEM 培养液(含10%胎牛血清)中,A498、786-O细胞培养于RPMI1640培养液(含10%胎牛血清)中,37℃恒温培养。细胞与96孔板中培养至密度约80%时,采用脂质体2000法转染miR-184 mimic、EPB41L5 siRNA及阴性对照序列。转染24~48 h后,进行相关检测。
2.2 RT-PCR检测: Trizol试剂法提取组织或细胞中总RNA,反转录cDNA,进行RT-PCR检测,反应程序为:95 ℃,60 s;60 ℃,45 s;72 ℃,45 s;72 ℃,10 min,共30次循环。2-ΔΔCT法计算mRNA表达量。
2.3 Western blot检测: 取大鼠肿瘤组织或培养的细胞,SDS裂解法提取总蛋白,进行SDS-PAGE电泳并转膜。经由3%脱脂奶粉封闭后,一抗(1∶2000稀释)4 ℃孵育过夜,洗膜,加入二抗HRP室温孵育1 h,ECL显色曝光,灰度分析条带值。
2.4 细胞克隆实验: 转染处理后的细胞(5×106个/ml)接种于培养板中,每2天更换新鲜培养基,至多数克隆超过50个细胞后,弃培养液,PBS清洗,5%结晶紫染色后计数。
2.5 细胞迁移实验: 转染处理后的细胞重悬于无血清培养基中,细胞悬液(5×106个/孔)接种至覆盖有Matrigel的Transwell上层小室中,在Transwell下层添加含血清的培养基,37℃恒温培养24 h。弃培养液,PBS清洗后,4%多聚甲醛固定15min,室温下5%结晶紫染色30min,用棉球擦去未穿膜细胞,显微镜下观察计细胞迁移数。
2.6 荧光素酶报告基因检测: 构建含miR-184结合位点的正常(UTR-wt)及突变(UTR-mut)EPB41L5 3’UTR序列,连接至pGL3荧光素酶载体上,分别与miR-184 mimic共转染至肾癌细胞中,36 h后检测荧光活性。同时转染海参荧光素酶基因为内参。
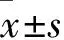
结 果
1 肾细胞癌模型小鼠肿瘤组织及细胞系中miR-184的表达情况 与癌旁组织相比,肾细胞癌小鼠肿瘤组织中miR-184表达水平显著降低(图1-A),差异具有统计学意义(P<0.05)。同时,小鼠肾癌细胞株A498、786-O中miR-184的表达量也较正常小鼠肾细胞株HK-2低(图1-B)。

A:RCC小鼠中miR-184的表达量; B:肾癌细胞中miR-184的表达量;与对照组比较,*P<0.05
2 miR-184过表达对肾癌细胞存活和体外迁移能力的影响 与对照相比,转染miR-184mimic后,小鼠肾癌细胞株A498、786-O的克隆形成能力明显减弱(图2-A),差异具有统计学意义(P<0.05)。同时,miR-184 mimic转染后A498、786-O细胞的迁移数目也较对照组显著减少(图2-B)。
3 miR-184作用于靶分子EPB41L5 图3-A所示为miR-184序列及其靶基因预测结果,EPB41L5的3’-UTR包含miR-184的潜在结合位点。将包含EPB41L5正常(UTR-wt)及突变(UTR-mut)3’-UTR的pGL3荧光素酶载体与miR-184 mimic分别共转染至肾癌细胞A498、786-O中。检测结果显示,miR-184 mimic转染后两种细胞中正常靶基因载体的荧光素酶活性较对照组均显著下降(图3-B),差异具有统计学意义(P<0.05);而突变靶基因的荧光素酶活性则不受影响。同时,miR-184 mimic转染后两种细胞中EPB41L5的表达水平均显著降低(图3-C)。
4 EPB41L5沉默对肾癌细胞存活和体外迁移能力的影响 EPB41L5 siRNA转染后,肾癌细胞A498、786-O中EPB41L5表达水平较对照组均明显下降 (图4-A),差异具有统计学意义(P<0.05)。同时,A498、786-O细胞的体外克隆形成数目及迁移细胞数目也较对照组显著减少(图4-B、C)。
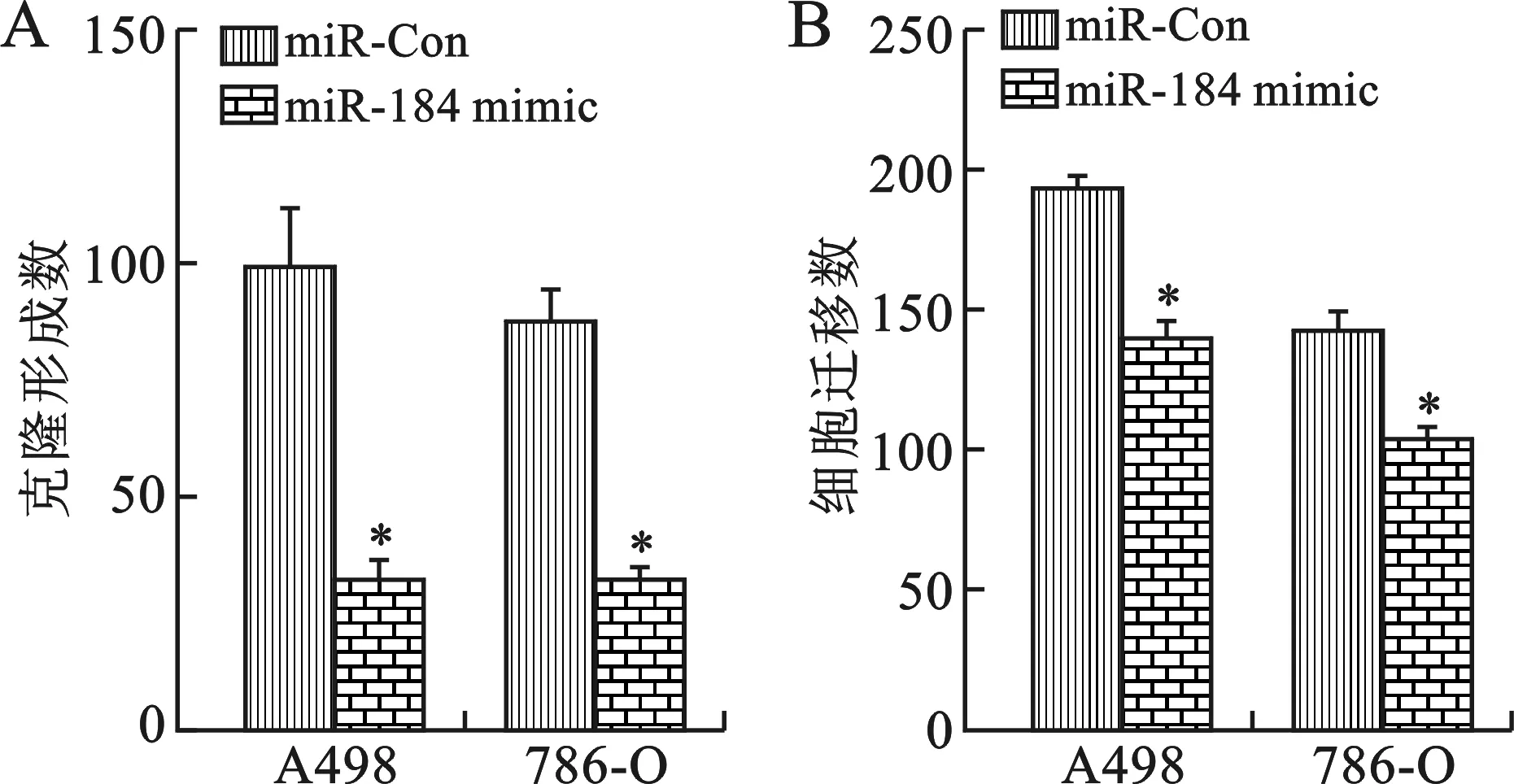
A:肾癌细胞存活水平; B:肾癌细胞迁移数目;与对照组比较,*P<0.05
图2 miR-184过表达对肾癌细胞存活和体外迁移能力的影响

A:miR-184序列及其靶基因预测结果; B:EPB41L5 3’-UTR荧光素酶活性检测; C:EPB41L5表达水平;与对照组比较,*P<0.05

A: EPB41L5表达水平; B:肾癌细胞存活水平; C:肾癌细胞迁移数目;与对照组比较,*P<0.05
讨 论
作为一类内源性的非编码基因,miRNAs广泛存在于动植物细胞内,通过对靶基因的协同作用,形成复杂的基因表达调控网络,在细胞增殖、分化、凋亡、迁移等过程中发挥着重要调节作用[7]。近年来,miRNA在肿瘤癌变过程中的作用也逐渐被人们发现,在胶质瘤、胃癌、乳腺癌等主要肿瘤组织中均存在miRNA的异常表达现象[8]。不同的miRNAs在肿瘤进程当中发挥着促进或抑制肿瘤发展的作用[9-10]。在肾细胞癌中,miR-119a-5p、miR-221 /222、miR-185、miR-26a、miR-449a/b、miR-34a等均被证实与肾癌疾病的发生密切相关[11]。Leng等[12]研究也发现,miR-184可抑制肾癌的发展,但其并作用机制尚不清楚。本文以肾细胞癌小鼠模型及体外培养细胞系为基础,证实了miR-184在肾癌肿瘤组织及癌细胞中表达水平降低。而高表达miR-184则可以抑制肾癌细胞的存活及迁移侵袭能力,表明miR-184在肾癌发展过程中发挥着抑癌基因的作用。
EPB41L5是红细胞膜蛋白4.1类似物,参与机体发育过程,并可通过调节下游钙粘蛋白E-cadherin的表达在TGF-β诱导的EMT转化过程中发挥作用[13]。研究发现,EPB41L5还参与癌症发病过程中肿瘤细胞的迁移、侵袭过程[14]。佐藤等[15]报道了EPB41L5的高表达与头颈鳞癌患者淋巴结转移及手术后的存活率存在相关性。Daimon等[16]则证实了在上尿路移行细胞癌的转移组织中,EPB41L5的表达水平显著升高,且高表达的EPB41L5与肿瘤分级、病理分期、肿瘤细胞的侵袭呈正相关。本实验通过生物信息学分析及荧光素酶报告基因检测验证EPB41L5为miR-184的靶基因,miR-184过表达的肾癌细胞中EPB41L5表达水平显著降低。而EPB41L5沉默后,肾癌细胞的存活及迁移能力明显降低,表明miR-184对肾癌细胞存活迁移的抑制作用是通过调节其靶基因EPB41L5实现的。
本文以肾细胞癌小鼠模型及体外培养细胞系为对象,证实了肾细胞癌肿瘤组织中miR-184的表达下调,而高表达miR-184可通过作用其靶基因EPB41L5,抑制肾癌细胞的存活及迁移能力。
[1] 张志林, 宋 晓,崔书君, 等. 64排螺旋CT诊断肾细胞癌120例临床价值探讨[J].陕西医学杂志, 2016, 45(1):40-42.
[2] Zang YC, Shan YX, Yang DR,etal. Cox regression analysis of prognostic factors for renal cell carcinoma [J]. Journal of Contemporary Urologic & Reproductive Oncology, 2010, 2(1):19-22.
[3] Yusuke S, Tetsuichi Y, Yuichi S,etal. Integrated molecular analysis of clear-cell renal cell carcinoma [J]. Nature Genetics, 2013, 45:860-867.
[4] Ha M, Kim VN. Regulation of microRNA biogenesis [J]. Nature Reviews Molecular Cell biology, 2014, 15:509-524.
[5] Sayed D, Abdellatif M. MicroRNAs in development and disease [J]. Physiological Reviews, 2011, 91:827-887.
[6] Cheng Z, Wang HZ, Li X,etal. MicroRNA-184 inhibits cell proliferation and invasion, and specifically targets TNFAIP2 in Glioma [J]. Journal of Experimental & Clinical Cancer Research, 2015, 34:1-13.
[7] Kim YK. Extracellular microRNAs as Biomarkers in Human Disease [J]. Chonnam Med J, 2015, 51:51-57.
[8] Tang K, Xu H. Prognostic value of meta-signature miRNAs in renal cell carcinoma: an integrated miRNA expression profiling analysis [J]. Scientific Reports, 2015, 5:10272.
[9] 陈双江, 王 铮, 姚英民, 等. miRNA-106a在肝癌中的表达及其作用[J]. 陕西医学杂志, 2014,43(2):139-142.
[10] 谢小娟, 潘晶晶, 侯慧莲, 等. 长链非编码RNA UCA1与 miRNA-99b在膀胱癌细胞株和膀胱癌组织表达的相关性分析[J]. 陕西医学杂志, 2015,44(10):1278-1280.
[11] Khella HWZ, Bakhet M, Allo G,etal. miR-192, miR-194 and miR-215: A convergent miRNA network suppressing tumor progression in renal cell carcinoma [J]. Carcinogenesis, 2013, 34:2231-2239.
[12] Leng H, Qian W, Zhou L,etal. Abnormal expression and significance of MIR-184 in human renal carcinoma[J]. Journal of Peking University. Health Sciences, 2011, 43:509-513.
[13] Vaisman F, Shaha A, Fish S,etal. EPB41L5 plays essential roles in EMT [J]. Clinical Endocrinology, 2009, 126:75-80.
[14] Hirano M, Aizawa S. Arf6 recruits EPB41L5 for E-cadherin endocytosis during epithelial-mesenchyme transition [J]. Developmental Biology, 2010, 344(344):509.
[15] 佐藤宏紀. High-Expression of AMAP1 and EPB41L5 proteinscorrelates with lymph node metastasis and survival rate after surgical therapy of HNSCC [D]. Hokkaido: Hokkaido University, 2014: 2093.
[16] Daimon T, Kosaka T, Mikami S,etal. Erythrocyte protein bond 4.1-like5 expression in patients with upper urinary tract urothelial carcinoma correlates with tumor recurrence [C]. ASCO Annual Meeting Proceedings. 2014, 32(15): e22131.
(收稿:2016-08-11)
MicroRNA-184 inhibits cell growth and migration by targeting EPB41L5 in renal cell carcinoma
Lai Yongxu, Li Yanping.Department of Pharmacy, Mianyang Central Hospital(Mianyang 621000)
Objective:To analysis the effects of miR-184 on the growth and migration of renal cell carcinoma and the potential target. Methods:RT-PCR was used to measure the expression of miR-184 in RCC rats and cell lines. miR-184 mimic was transfected into the A498 and 786-O cells by Lipofectamine 2000. The growth and migration of renal cell carcinoma were evaluated using colony formation and Transwell assay, respectively. The prediction and validation of target of miR-184 were performed by bioinformatics, luciferase assay and Western blot. The growth and migration of renal cell carcinoma were tested after transfection of target gene siRNA. Results:The levels of miR-184 were significantly down-regulated in RCC rats and cells. The cells transfected with miR-184 mimic exhibited a decrease in colonies and migrating cells. Bioinformatics results showed that EPB41L5 has the binding sites of miR-184 on its 3’UTR. miR-184 mimic reduced the luciferase activity of pGL-EPB41L5 3’UTR, whereas had no effect on the mutant pGL-EPB41L5 3’UTR. After transfection of EPB41L5 siRNA, the expression of EPB41L5 was reduced, and the numbers of colonies and migrating cells were also down-regulated. Conclusion:miR-184 regulates the growth and migration of renal cell carcinoma by targeting EPB41L5, contributing to the progression of RCC.
Kidney neoplasms/physiopathology @ miR-184 @EPB41L5 Cells migration asssys Models,animal Mice
肾肿瘤/病理生理学 @miR-184 @EPB41L5 细胞迁移测定 模型,动物 小鼠
R392.6
A
10.3969/j.issn.1000-7377.2017.03.006

