结肠腺癌中Orai1与STIM1的表达及临床意义
李艳东,朱 琳,周永莉,周 伊,郑建云
结肠癌是最常见的恶性肿瘤之一,结肠癌病死率位居恶性肿瘤的第2位[1]。由钙释放激活钙通道蛋白1(calcium release-activated calcium channel protein 1, Orai1)和基质相互作用分子1(stromal interaction molecule 1, STIM1)为主要因子组成的钙池调控钙内流(store-operated calcium entry, SOCE)通道是钙离子内流的主要途径,已经被证明其参与许多肿瘤的发生及侵袭转移,包括胃癌[2]、鼻咽癌[3]、前列腺癌[4]等。有关结肠癌中Orai1和STIM1表达的研究报道较少,本实验通过检测结肠腺癌中Orai1和STIM1蛋白的表达,分析两者之间的关系,探讨两者表达与结肠癌侵袭、转移及预后的关系。
1 材料与方法
1.1材料收集西安医学院第一附属医院病理科2006年~2014年存档的结肠腺癌石蜡标本80例及正常结肠黏膜标本50例。结肠腺癌病例根据《美国肿瘤联合委员会癌症分期手册》(7版)相关组织学分型和临床病理分期标准进行病理诊断。兔抗人Orai1抗体、兔抗人STIM1抗体均购自英国Abcam公司。
1.2免疫组化将收集的蜡块切片行免疫组化SP法检测,DAB显色,苏木精复染,操作严格按照说明书进行。用PBS代替一抗作阴性对照。
1.3结果判定Orai1及STIM1蛋白以细胞质中出现浅黄色至棕褐色信号为阳性细胞。结果判读采用二级计分法:(1)按染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(2)按阳性细胞所占百分比评分:阴性为0分,阳性细胞数≤10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。最后将两项得分结果相乘:总分>4分为高表达,≤4分为低表达。
1.4统计学处理使用SPSS 13.0软件对数据进行统计学分析,分类计数资料的组间比较采用χ2检验,等级资料相关性采用Spearman等级相关分析,采用Kaplan-Meier法计算生存率,单因素生存率的比较采用Log-rank检验,多因素生存分析采用Cox比例风险回归模型,以P<0.05为差异有统计学意义。
2 结果
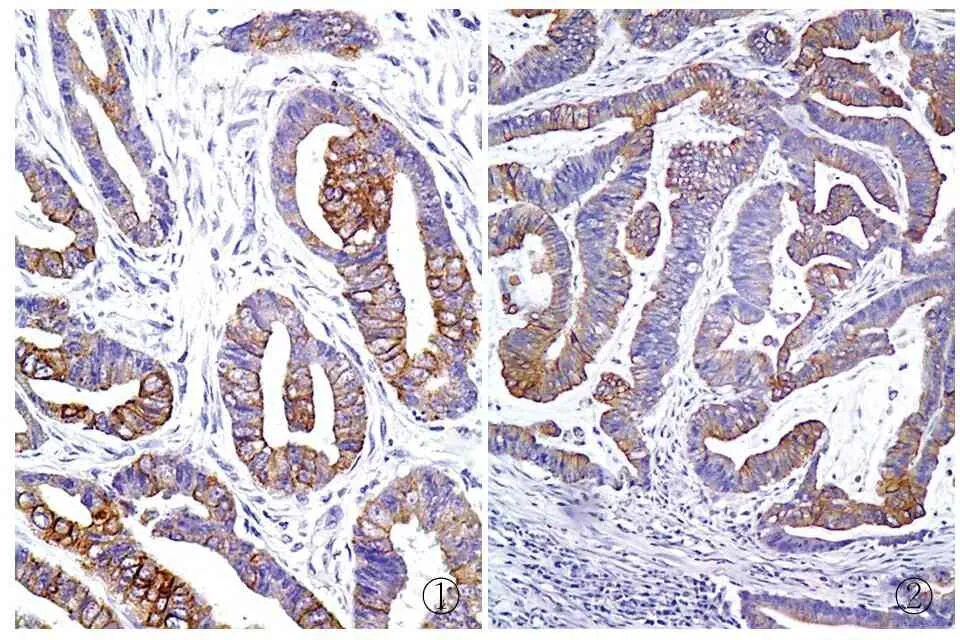
2.1Orai1在结肠腺癌及正常结肠黏膜中的表达Orai1在结肠腺癌中的表达定位于细胞质,呈浅黄色至棕黄色颗粒状物质(图1)。Orai1在结肠腺癌中的高表达率为68.8%(55/80),在正常结肠黏膜中的高表达率仅为28.0%(14/50),两组相比差异有统计学意义(P<0.05,表1)。
2.2STIM1在结肠腺癌及正常结肠黏膜中的表达STIM1在结肠腺癌中的表达亦定位于细胞质,呈浅黄色至棕黄色颗粒状物质(图2)。STIM1在结肠腺癌中的高表达率为61.3%(49/80),而在正常结肠黏膜中的高表达率仅为24.0%(12/50),STIM1在结肠腺癌中的表达显著高于正常结肠黏膜(P<0.05,表1)。

表1 Orai1和STIM1在结肠腺癌及正常结肠黏膜中的表达
①②
图1Orai1在结肠腺癌中的表达,SP法图2STIM1在结肠腺癌中的表达,SP法
2.3Orai1、STIM1表达与结肠腺癌临床病理特征的关系及两者表达的相关性Orai1和STIM1在结肠腺癌中的表达均与TNM分期及有无淋巴结转移有关(P<0.05),与患者性别、年龄及分化程度无关(P>0.05,表2)。Spearman等级相关性分析显示,Orai1、STIM1蛋白在结肠腺癌中的表达呈显著正相关(P=0.001,rs=0.349,表3)。
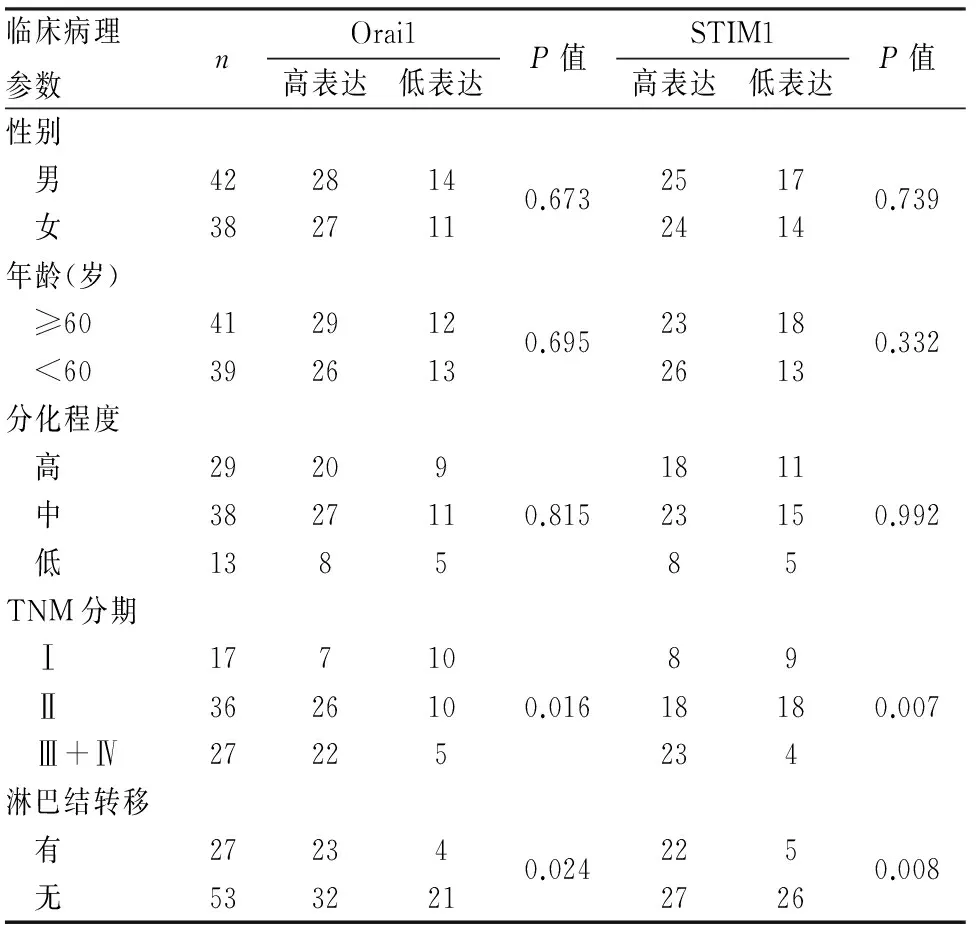
表2 Orai1和STIM1表达与结肠腺癌临床病理特征的关系

表3 结肠腺癌中Orai1和STIM1表达的相关性
2.4Orai1与STIM1表达与结肠腺癌患者预后的关系Kaplan-Meier生存分析显示,Orai1高表达组5年生存率(52.7%,29/55)明显低于Orai1低表达组(76%,19/25)(Log-rank=4.633,P=0.031,图3)。STIM1高表达组5年生存率(49%,24/49)明显低于STIM1低表达组(77.4%,24/31)(Log-rank=7.833,P=0.005,图4)。对Orai1表达(P=0.031)、STIM1表达(P=0.005)、患者年龄(P=0.89)、性别(P=0.751)、分化程度(P=0.184)、TNM分期(P=0.000)、淋巴结转移(P=0.001)进行单因素生存分析显示,Orai1表达、STIM1表达、TNM分期、淋巴结转移与患者生存率均有相关性。Cox比例风险回归模型多因素生存分析结果显示,TNM分期、淋巴结转移是影响结肠腺癌患者预后的独立危险因素(P<0.05),Orai1及STIM1表达不是影响患者预后的独立危险因素(P>0.05,表4)。
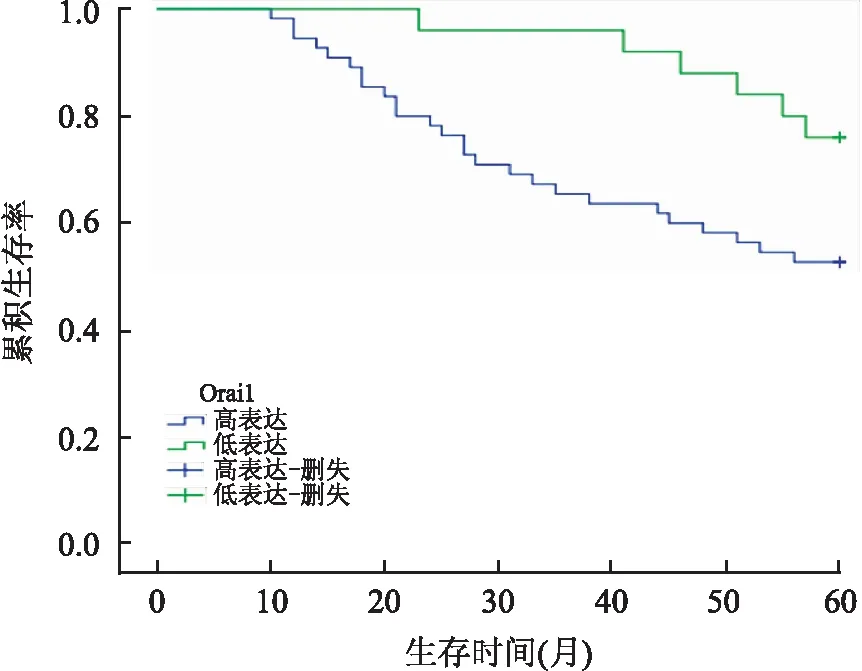
图3 Orai1表达与结肠腺癌患者生存率的关系

图4 STIM1表达与结肠腺癌患者生存率的关系

预后因素BSEWalddfP值Exp(B)95.0%CI用于Exp(B)下限上限Orai1表达0.0430.5840.00510.9411.0440.3323.277STIM1表达0.0760.5740.01810.8951.0790.3503.323TNM分期2.6160.42238.4171<0.00113.6855.98331.301淋巴结转移-1.7610.45115.2661<0.0010.1720.0710.416
3 讨论
Orai1和STIM1是SOCE通道的核心蛋白,介导胞外Ca2+内流,STIM1是STIM的亚型之一,STIM蛋白位于细胞的内质网膜上,感受内质网内Ca2+浓度的变化。Orai1是Orai的亚型之一,Orai蛋白位于细胞膜,能够被STIM所激活。STIM1位于人染色体11p15.5,蛋白相对分子质量为9.0×104,在人类正常组织中广泛存在。Orai1为4次跨膜蛋白,位于人染色体12q24.31,蛋白相对分子质量为3.8×104[5]。Orai1和STIM1介导的SOCE通道在肿瘤中能够促进肿瘤细胞血管的生成,影响细胞周期,促进肿瘤增殖、侵袭。研究显示[6],STIM1和Orai1介导的Ca2+通路在促进恶性黑色素瘤的侵袭过程中发挥重要作用,并提示Orai1主要通过对细胞外基质的降解促进黑色素瘤细胞侵袭。Umemura等[7]的研究结果进一步显示,通过敲除STIM1或者Orai1能够抑制黑色素瘤细胞的增殖,其机制是SOCE介导的细胞功能通过CaMKII Raf-1/ERK信号通路发挥作用。肿瘤细胞的侵袭转移需要与细胞外基质黏附,黏附斑的拆装依靠Pyk2,这些均需要Ca2+激活发挥作用,SOCE通道通过内质网释放Ca2+,激活细胞膜上钙通道,促进Ca2+内流,促进肿瘤侵袭[8]。
Orai1蛋白被证实在食管癌中过表达[9],并且其表达与肿瘤分化及临床分期相关,总生存期高表达者较低表达者短。Zhu等[10]研究结果显示,在胶质瘤中,Orai1表达升高,下调Orai1能够抑制SOCE通道从而抑制胶质瘤细胞的迁移和侵袭,其机制是调节Pyk2磷酸化。本组实验结果显示,Orai1在结肠腺癌中的表达高于正常结肠黏膜,两者差异有统计学意义。并且Orai1在结肠腺癌中的表达与TNM分期及有无淋巴结转移有关,与患者性别、年龄及分化程度无关。Orai1高表达组5年生存率低于低表达组。研究结果提示Orai1可能在结肠癌的发生、发展中起重要作用。
对STIM1的研究显示,STIM1在非小细胞肺癌[11]、胃癌[2]中过表达。本组实验结果显示,STIM1在结肠腺癌中的表达显著高于正常结肠黏膜,这与Wong等[12]研究结果显示STIM1在结肠癌中高表达结果一致。本组实验进一步显示STIM1的高表达与结肠腺癌临床分期及淋巴结转移相关,并与患者预后相关,STIM1高表达组较低表达组预后更差。研究揭示STIM1与结肠癌的发生、发展及预后密切相关。
结肠癌的发生、发展是涉及多因素、多基因、多步骤的过程,许多基因被证明参与其中[13-14]。本组实验发现,Orai1蛋白与STIM1蛋白在结肠癌中均过表达,并且Orai1与STIM1蛋白的表达呈正相关,两者表达均与患者预后密切相关,提示Orai1与STIM1可能具有协同作用,共同促进结肠癌的发生、发展。Xia等[2]研究认为在胃癌中,Orai1和STIM1的高表达能够上调MACC1的表达从而促进胃癌细胞增殖、侵袭及转移。STIM1参与了肝癌的发生,其与HIF-1相互作用促进了肝癌的发展[15]。子宫颈癌中,STIM1过表达,对子宫颈癌细胞的增殖、迁移及血管生成起重要作用[8]。胰腺癌细胞中,STIM1和Orai1过表达免于凋亡从而促进肿瘤细胞增殖[16]。Orai1与STIM1蛋白在结肠癌中的作用机制有待于进一步深入探讨。作为SOCE的关键分子,Orai1和STIM1可能是临床治疗结肠癌及预测预后的潜在新靶标。
[1] Siegel R, Ma J, Zou Z,etal. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014,64(1):9-29.
[2] Xia J, Wang H, Huang H,etal. Elevated Orai1 and STIM1 expressions upregulate MACC1 expression to promote tumor cell proliferation, metabolism, migration, and invasion in human gastric cancer[J]. Cancer Lett, 2016,381(1):31-40.
[3] Zhang J, Wei J, Kanada M,etal. Inhibition of storeoperated Ca2+entry suppresses EGF-induced migration and eliminates extravasation from vasculature in nasopharyngeal carcinoma cell[J]. Cancer Lett, 2013,336(2):390-397.
[4] Holzmann C, Kilch T, Kappel S,etal. ICRAC controls the rapid androgen response in human primary prostate epithelial cells and is altered in prostate cancer[J]. Oncotarget, 2013,4(11):2096-2107.
[5] Weilapierre L, Carrell E M, Boncompagni S,etal. Orai1-dependent calcium entry promotes skeletal muscle growth and limits fatigue[J]. Nat Commun, 2013,4:2805.
[6] Sun J, Lu F, He H,etal. STIM1-and Orai1-mediated Ca2+oscillation orchestrates invadopodium formation and melanoma invasion[J]. J Cell Biol, 2014,207(4):535-548.
[7] Umemura M, Baljinnyam E, Feske S,etal. Store-operated Ca2+entry (SOCE) regulates melanoma proliferation and cell migration[J]. PLoS One, 2014,9(2):e89292.
[8] Chen Y F, Chiu W T, Chen Y T,etal. Calcium store sensor stromal-interaction molecule 1-dependent signaling plays an important role in cervical cancer growth, migration, and angiogenesis[J]. Proc Natl Acad Sci USA, 2011,108(37):15225-15230.
[9] Zhu H, Zhang H, Jin F,etal. Elevated Orai1 expression mediates tumor-promoting intracellular Ca2+oscillations in human esophageal squamous cell carcinoma[J]. Oncotarget, 2014,5(11):3455-3471.
[10] Zhu M, Chen L, Zhao P,etal. Store-operated Ca2+entry regulates glioma cell migration and invasion via modulation of Pyk2 phosphorylation[J]. J Exp Clin Cancer Res, 2014,33:98.
[11] Li W, Zhang M, Xu L,etal. The apoptosis of non-small cell lung cancer induced by cisplatin through modulation of STIM1[J]. Exp Toxicol Pathol, 2013,65(7):1073-1081.
[12] Wong H S, Chang W C. Correlation of clinical features and genetic profles of stromal interaction molecule 1 (STIM1) in colorectal cancers[J]. Oncotarget, 2015,6(39):42169-42182.
[13] 张炜明, 宋国新, 平国强, 等. 结肠癌组织中LKB1的表达及其与上皮-间质转化的关系[J]. 临床与实验病理学杂志, 2016,32(10):1081-1083.
[14] 姜维娜, 黄维清, 刘 鑫, 等. 结肠癌组织中OTUB1的表达及其临床意义[J]. 临床与实验病理学杂志, 2015,31(9):1009-1012.
[15] Li Y, Guo B, Xie Q,etal. STIM1 mediates hypoxia-driven hepatocarcinogenesis via interaction with HIF-1[J]. Cell Rep, 2015,12(3):388-395.
[16] Kondratska K, Kondratskyi A, Yassine M,etal. Orai1 and STIM1 mediate SOCE and contribute to apoptotic resistance of pancreatic adenocarcinoma[J]. Biochim Biophys Acta, 2014,1843(10):2263-2269.

