胚胎小鼠神经干细胞的培养和诱导分化
任丽伊,赵海霞,左 璇,李淑蓉,苏炳银△
1.成都医学院 基础医学院 (成都 610500);2.发育与再生四川省重点实验室(成都 610500)
·论 著·
胚胎小鼠神经干细胞的培养和诱导分化
*任丽伊1,赵海霞2,左 璇1,李淑蓉2,苏炳银2△
1.成都医学院 基础医学院 (成都 610500);2.发育与再生四川省重点实验室(成都 610500)
目的 探索体外培养和诱导分化胚胎小鼠神经干细胞(neural stem cells,NSCs)的方法。方法 分离12.5 d ICR小鼠胚胎的大脑皮质,通过Accutase酶消化法和机械消化法,将组织消化成单个细胞,置于完全培养基中培养,3 d后神经干细胞增殖成神经球;将传代的神经球消化,通过诱导培养基诱导其分化;采用细胞免疫荧光染色和qRT-PCR技术检测巢蛋白(Nestin)、中间微管相关蛋白2(Map2)和胶质纤维酸性蛋白(Gfap)的表达,鉴定NSCs、分化形成的神经元和星形胶质细胞。结果 NSCs能被Nestin特异性标记,诱导分化后的细胞可被Map2和Gfap抗体特异识别;qRT-PCR结果显示,诱导后Nestin的表达水平降低,而Map2和Gfap的表达水平升高。 结论 通过Accutase酶消化法联合机械消化法分离小鼠胚胎脑皮质,进行体外培养,可获得具有自我更新能力和多向分化潜能的NSCs。
神经干细胞;神经元;星形胶质细胞;诱导分化
神经干细胞(neural stem cells,NSCs)是一类具有分化为神经元、星形胶质细胞和少突胶质细胞潜能,并能增殖和自我更新,为脑组织提供大量细胞的细胞群[1]。它不仅存在于哺乳动物胚胎时期,在成体脑组织中也有分布。胚胎时期,NSCs在细胞微环境和各种因子共同作用下,可分化成不同类型的神经元和神经胶质细胞;成年脑组织中NSCs处于静息状态,损伤或疾病可以刺激潜在NSCs分化[2]。成体中NSCs作为一种后备贮存细胞,可参与神经系统损伤修复或细胞正常死亡的更新,补充因损伤、变性、衰老而丧失的神经元或胶质细胞,成为多种中枢神经系统疾病新的治疗途径[3]。
成年哺乳动物中枢神经系统损伤后,可激活分布于脑室下区(subventricular zone,SVZ)和海马齿状回的颗粒细胞下层(subgranular zone,SGZ)的NSCs或神经祖细胞(neural progenitor cell,NPC),招募到损伤部位进行神经再生修复,以弥补神经疾病导致的神经细胞缺失[4]。但此内源性的祖细胞招募和神经再生能力有限,人们开始寻求外源性NSCs移植治疗中枢神经系统疾病的可能[5]。NSCs的体外培养为外源性NSCs移植提供了重要的细胞来源。
本实验通过分离胚胎期小鼠大脑皮质进行体外培养,筛选出具有NSCs特性的体外细胞群,旨在提供一种从小鼠胚胎中获取NSCs的方法,丰富体外培养NSCs技术,为NSCs移植研究奠定基础。
1 材料与方法
1.1 实验动物与材料
ICR小鼠购自成都达硕实验动物有限公司;DMEM/F12(1∶1)培养基、青霉素-链霉素溶液、Lipofectamine 2000、Trizol购自美国Invitrogen公司;碱性成纤维生长因子(bFGF)、表皮生长因子(EGF)购自美国PeproTech公司;小鼠单克隆抗体Nestin和Map2、抗兔多克隆抗体Gfap购自美国Sigma公司产品。仪器:倒置荧光显微镜(Olympus CKX41)、冷冻离心机(美国Thermo公司)、实时荧光定量PCR仪(美国Bio-Rad公司)、CO2恒温培养箱(美国Bio-Rad公司)、体视显微镜(日本Olympus公司)。
1.2 NSCs的分离培养和诱导分化
收集12.5 d胚胎小鼠的皮质,切成小碎块,置于DMEM/F 12中,用枪头轻轻吹散,1 000 rpm离心5 min,去上清后加入适量Accutase酶重悬,消化5~10 min,消化时用枪头轻轻吹打,直至组织消化成单细胞。经200目的细胞筛滤过,收集过滤后细胞液,再次以1 000 rpm离心5 min,去上清。加入1 mL完全培养基(配方:DMEM/F 12、B 27(终浓度2%)、青霉素-链霉素溶液(1%)、GlutaMax(1%)、肝素(2 μg/mL)、bFGF(20 ng/mL)、EGF(20 ng/mL))重悬细胞沉淀,轻吹混匀后统计细胞数量,将细胞以2×105cells/mL的密度接种到加完全培养基的100 mm培养皿中。37 ℃、5%CO2孵箱培养,2~3 d半量换液1次,5~7 d后收集增殖而成的神经球,将其消化成单个细胞,以上述相同的密度接种到新鲜的完全培养基中传代培养[6]。
准备一个用多聚赖氨酸包被处理过的24孔板,细胞传代2次后,将其培养成神经球,收集大量神经球,用Accutase酶消化,机械轻轻吹打成单个细胞,细胞计数后以2×105cells/mL 的密度接种到24孔板中,加入适量分化培养基(DMEM/F 12、B 27(终浓度2%)、青霉素-链霉素溶液(1%)、GlutaMax(1%)、肝素(2 μg/mL)、10%胎牛血清),置于培养箱中贴壁培养3 d或7 d[6]。
1.3 细胞免疫荧光技术
对贴壁培养的细胞进行免疫荧光染色以检测细胞内特异抗原。先吸尽孔中培养液,用4%多聚甲醛(PFA)室温固40 min,吸出,洗涤。加透化性封闭液(10%血清配制)室温封闭1 h;加入抗体Anti-Nestin、Anti-Map2或Anti-Gfap配制的一抗稀释液(浓度1∶200),4 ℃过夜。吸出一抗,洗涤。加入相应荧光二抗稀释液(浓度1∶200),常温孵育2 h;吸出,洗涤。加入DAPI细胞核染剂后,用PBS配制的50%甘油封片,在荧光显微镜下观察并拍照[7]。
1.4 qRT-PCR技术
将传代的NSCs以2×105cells/mL的密度接种到多聚赖氨酸包被的6孔板中,加诱导培养基,诱导分化3 d或7 d。收集细胞,用Trizol法提取总RNA,使用cDNA反转录试剂盒将RNA反转录成cDNA。以此cDNA为模板,进行实时荧光定量PCR检测目的基因的表达量[7]。引物序列为:Nestin上游:5′-CGGGAGAGTCGCTTAGAGGT-3′,下游5′-AGACCCTGCTTCTCCTGCTC-3′;Sox2上游:5′-CATGCACCGCTACGACGTGAG-3′,下游:5′-TGGGAGGAAGAGGTAACCACAGG-3′;Map2上游:5′-GTCACAGGGCACCTATTC-3′,下游:5′-CACCTTTCAGGACTGCTAC-3′;Gfap上游:5′-ACCCTGGCTCGTGTGGAT-3′,下游:5′-GCCACATCCATCTCCACG-3′;Gapdh上游:5′-GAAACCTGCCAAGTATGATGACA-3′,下游:5′-GGTCCTCAGTGTAGCCCAAGA-3′。
1.5 细胞测量和计数
使用图像处理分析软件Image-Pro Plus(IPP)进行神经球的直径测量;将图片导入Photoshop图像处理软件,对细胞数量进行手动精确计数。
1.6 统计学方法

2 结果
2.1 NSCs的原代和传代培养
分离12.5 d ICR胚胎小鼠脑皮质,将其消化为单个细胞进行体外培养。在显微镜下相差观察2、4 、6 d细胞生长情况(图1A-C),原代NSCs由单个细胞增殖分裂,逐渐形成直径约100 μM的神经球。在培养过程中细胞有丝分裂导致细胞数量增多,神经球变大。传代后,镜下观察相同生长时段的细胞(图1D-F),相较原代细胞传代后的细胞折光度更强,神经球形状更规整,细胞紧密度更高;镜下所见相同生长时段,传代细胞形成的神经球大部分比原代神经球小。
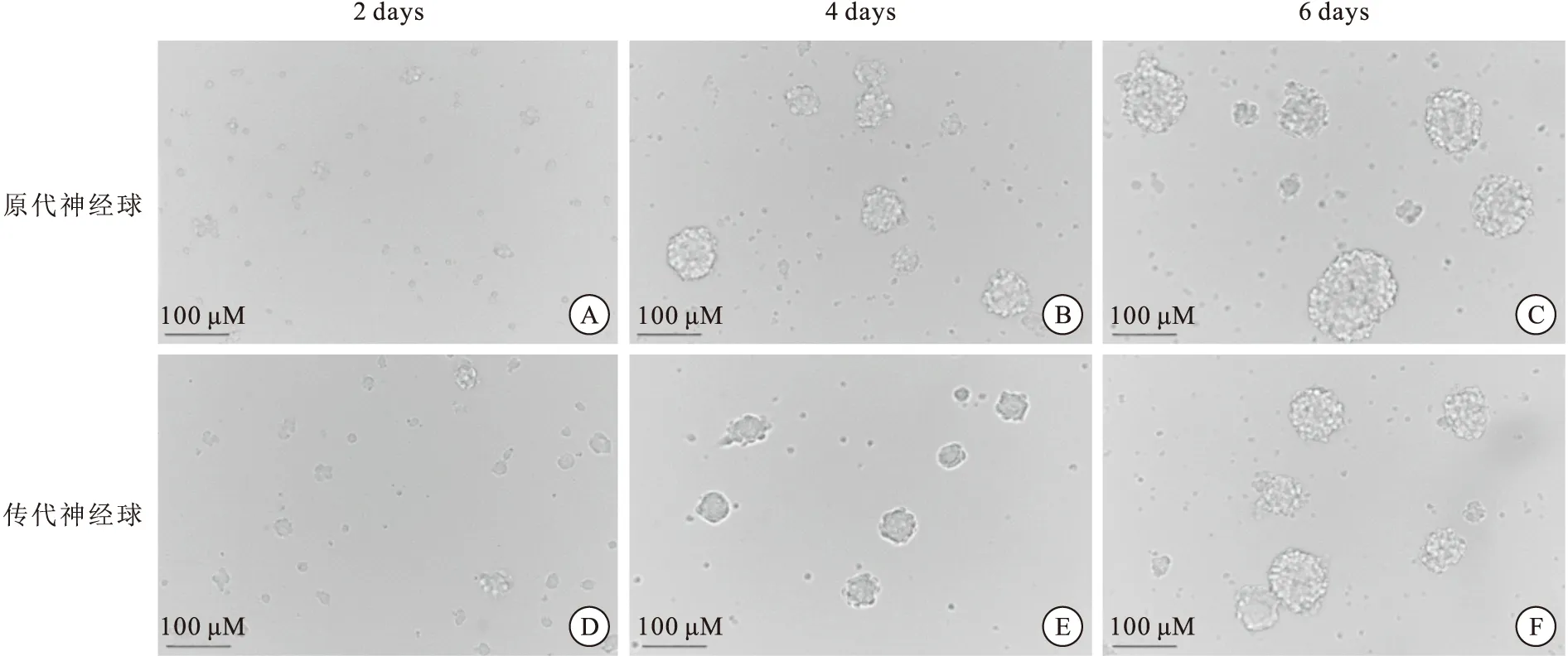
图1 体外培养的NSCs形态
用IPP软件测量不同时段原代和传代的神经细胞球直径(图2),可见:原代和传代的神经球直径都随时间增大,细胞数稳定增多。无论是原代细胞还是传代细胞,生长6 d的神经球直径都较4 d明显增大,差异有统计学意义(P<0.001)。传代神经球变化趋势与原代神经球大致相同,但比较发现,传代神经球生长到第6天时,直径明显小于同时段的原代神经球,差异有统计学意义(P<0.001 )。

图2 生长不同时间段的神经球直径比较
2.2 巢蛋白Nestin鉴定NSCs
已知Nestin是NSCs特异性标记物,本实验采用细胞免疫荧光技术,对传代神经球进行标记。染色后,在倒置荧光显微镜下观察,见神经球被Anti-Nestin抗体标记,显红色荧光,与DAPI蓝染的细胞核合成后,如图3(Merge)所示。由此可鉴定神经球由NSCs聚合形成。
2.3 检测NSCs分化后3 d和7 d后的细胞类型
NSCs能分化成3种神经细胞:神经元、星形胶质细胞和少突胶质细胞[8]。就比例而言,NSCs大部分分化成神经元和星形胶质细胞,极少数分化为少突胶质细胞[9]。本实验针对前2种细胞类型,进行细胞免疫荧光检测,鉴别细胞类型。在血清分化培养基的诱导下,NSCs分化情况如图4所示,贴壁的NSCs分化成神经元可被Map2标记,镜下胞质显红色荧光,成熟的神经元突起为拖尾的彗星状(白箭头),有些突起上出现分支;分化成星形胶质细胞可被Gfap标记,胞质呈现绿色荧光,星形胶质细胞胞质丰富,细胞形态似梭形或多爪形;细胞核被DAPI标记呈蓝色。
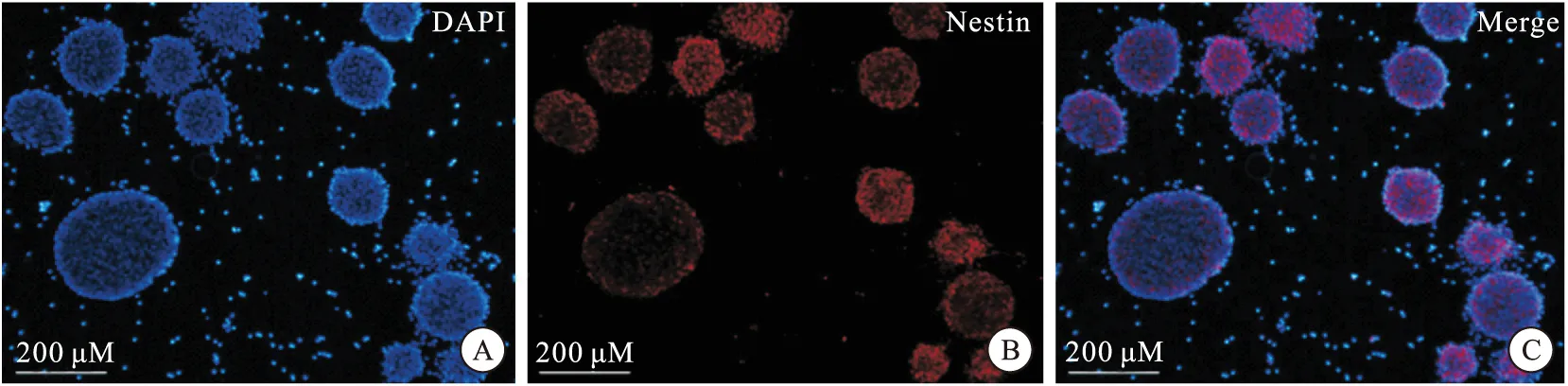
图3 细胞免疫荧光技术鉴定神经球
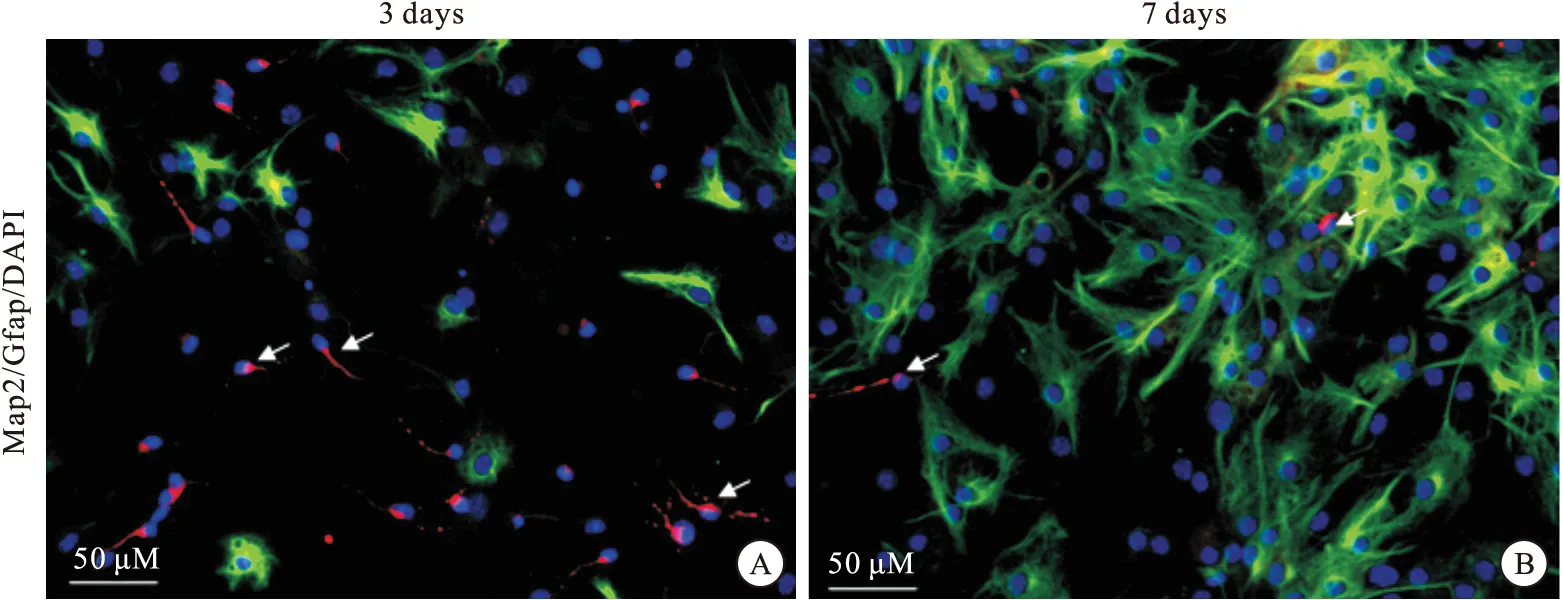
图4 血清诱导NSCs分化IHC
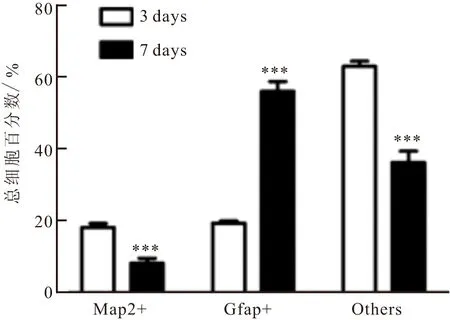
图5 分化不同时段细胞的数量统计
诱导分化3 d和7 d所形成的细胞比例不同,统计结果如图5所示。在血清诱导下,被Map2标记的神经元数量随着分化时间3~7 d,数量先增多后变少,而Gfap标记的星形胶质细胞数目从分化3~7 d呈明显增长趋势;其他未标记细胞数却由多变少,差异有统计学意义(P<0.001)。诱导NSCs分化过程中,分化3 d时,可见部分细胞分化,可朝神经元和星形胶质细胞方向分化;分化7 d后,参与分化的细胞数量增加,而朝星形胶质细胞方向分化的细胞增多,朝神经元方向分化的细胞减少。
2.4 检测分化3 d和7 d的NSCs相关基因的表达
提取血清诱导下NSCs分化3 d和7 d的细胞总RNA,反转录成cDNA进行qRT-PCR实验,检测NSCs分化时期相关基因的表达。Nestin是NSCs的经典标记物,转录因子Sox2是NSCs的核心转录因子之一,也可作为NSCs的标记物。实验中发现,二者mRNA表达量均随分化时间的延长而降低,说明分化细胞中,Nestin和Sox2表达量随时间而减少(图6A,6B)。神经元标记物Map2的表达水平在分化过程中也有变化,在分化3 d时明显升高,分化7 d后Map2的表达量明显降低(图6C),表明本实验中NSCs朝神经元方向分化主要在诱导分化前期。另外,代表星形胶质细胞的Gfap基因表达水平从诱导分化开始到3 d和7 d处于持续升高状态,差异具有统计学意义(P<0.001)。由此可见,血清诱导NSCs分化过程中,NSCs相关基因表达量呈降低趋势,而代表分化细胞的两种基因表达水平随分化时间明显升高。

图6 qRT-PCR显示NSCs诱导分化基因的表达
3 讨论
自NSCs的无限增殖能力和多向分化潜能特性被揭示后,人们对其在中枢神经系统损伤和退行性疾病中可能发挥的治疗作用充满期望。大量研究[10]发现,NSCs在神经再生和损伤修复中发挥重要作用,可修复和代替受损神经组织,重建部分环路,帮助恢复其生物学功能。目前,动物模型上移植NSCs用于治疗帕金森病、脑胶质瘤、阿尔茨海默病、脊髓损伤等疾病已取得一定的成效[11]。NSCs移植是治疗中枢神经系统损伤、退行性病变和神经元缺失导致的神经系统疾病的重要方法[12]。但是,NSCs移植治疗在人体中的应用仍受限于细胞来源与不成熟的体外稳定培养扩增技术[13]。外源性NSCs大部分来自活体脑组织中NSCs的分离培养。哺乳动物胚胎期,NSCs主要分布在大脑的皮层、纹状体、海马、室管膜下层和中脑等区域;成年后,中枢神经系统中存在静止状态的NSCs,其分布主要局限在海马齿状回、纹状体和双侧脑室下区[2]。
不同来源背景的NSCs干性维持情况和基因修饰等不同,用于移植治疗的效果也有差异[14]。据报道,NSCs于胚胎12 d开始出现,15 d达高峰,因此,本实验提取的NSCs来源于12.5 d胚胎大脑皮质,此发育阶段的NSCs干性维持较好,在皮质中分布较广[15]。分离这个时期的皮质,消化后进行体外培养,细胞分裂能力强,5~7 d就能形成直径约100 μM的神经球,且形成的神经球能被Nestin鉴别。实验中选用温和的Accutase酶消化组织和神经球,其间配合移液枪轻柔的吹打混匀,此方法相较于其他实验利用胰酶消化或直接机械消化法,可以减少消化酶和单纯的机械吹打对细胞的损伤[16]。此外,在NSCs成球过程中,神经球中间的细胞堆积,养分供给不足,导致中间细胞状态较差,所以在神经球直径>100 μM前及时传代,能很好的提高传代细胞的活力,使传代神经球折光度更高,细胞状态更好。最后,本实验培养的NSCs分化潜能也得到了验证。在培养基中添加血清,诱导贴壁的NSCs分化3 d,能形成可被Map2标记的神经元,也能分化成被Gfap标记的星形胶质细胞,分化到第7天时,NSCs大量分化成星形胶质细胞,此时还有少量分化成神经元,这一结果与已发表的文献所述相符[17]。本实验不仅通过细胞免疫荧光实验证实了NSCs分化成神经元和星形胶质细胞,qRT-PCR检测也显示了同样的结果。检测分化0、3、7 d相关基因的表达水平,结果发现,NSCs标记分子Nestin和Sox2的表达水平在分化过程中呈降低趋势;分别代表神经元的标记分子Map2和星形胶质细胞的标记分子Gfap分化3 d均有明显升高,但是分化7 d时Map2表达量降低,而Gfap仍然持续升高,结果与免疫荧光染色后细胞计数结果一致。
综上所述,本实验所提供的NSCs培养方法,成功地从12.5 d ICR胚鼠大脑皮质中分离出细胞,体外培养,获得了具有增殖能力和分化潜能的NSCs。作为一种NSCs体外培养方法,本研究对于外源性NSCs的获取具有重要的意义。
[1]Gage F H. Mammalian neural stem cells[J]. Science, 2000, 287(5457): 1433-1438.
[2]Temple S. The development of neural stem cells[J]. Nature, 2001, 414(6859): 112-117.
[3]Wennersten A, Meier X, Holmin S,etal. Proliferation, migration, and differentiation of human neural stem/progenitor cells after transplantation into a rat model of traumatic brain injury[J]. J Neurosurg, 2004, 100(1): 88-96.
[4]Bond A M, Ming G L, Song H. Adult Mammalian Neural Stem Cells and Neurogenesis: Five Decades Later[J]. Cell Stem Cell, 2015, 17(4): 385-395.
[5]Zizkova M, Sucha R, Tyleckova J,etal. Proteome-wide analysis of neural stem cell differentiation to facilitate transition to cell replacement therapies[J]. Expert Rev Proteomics, 2015, 12(1): 83-95.
[6]Hosseini S M, Sharafkhah A, Koohi-Hosseinabadi O,etal. Transplantation of Neural Stem Cells Cultured in Alginate Scaffold for Spinal Cord Injury in Rats[J]. Asian Spine J, 2016, 10(4): 611-618.
[7]赵祥宇, 舒鹏程, 张靖, 等. 小鼠脑皮质神经干细胞体外培养及miRNAs影响其分化能力[J]. 基础医学与临床, 2011, 31(6): 630-635.
[8]Song H, Stevens C F, Gage F H. Astroglia induce neurogenesis from adult neural stem cells[J]. Nature, 2002, 417(6884): 39-44.
[9]Reynolds B A, Weiss S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell[J]. Dev Biol, 1996, 175(1): 1-13.
[10] De Feo D, Merlini A, Laterza C,etal. Neural stem cell transplantation in central nervous system disorders: from cell replacement to neuroprotection[J]. Curr Opin Neurol, 2012, 25(3): 322-333.
[11] Srinageshwar B, Maiti P, Dunbar G L,etal. Role of Epigenetics in Stem Cell Proliferation and Differentiation: Implications for Treating Neurodegenerative Diseases[J]. Int J Mol Sci, 2016,17(2):199.
[12] 钱晓丹, 罗春霞, 朱东亚. 神经干细胞移植研究进展[J]. 中国细胞生物学学报, 2012, 34(3): 212-217.
[13] 高海霞, 金华君, 钱其军. 神经干细胞的干性维持机制[J]. 中国组织工程研究, 2012, 16(19): 3593-3597.
[14] Piltti K M, Salazar D L, Uchida N,etal. Safety of human neural stem cell transplantation in chronic spinal cord injury[J]. Stem Cells Transl Med, 2013, 2(12): 961-974.
[15] Louis S A, Mak C K, Reynolds B A. Methods to culture, differentiate, and characterize neural stem cells from the adult and embryonic mouse central nervous system [J]. Methods Mol Biol, 2013,946:479-506.
[16] 钟德君, 张德盛, 宋跃明. 鼠胚神经干细胞体外培养方法的优化[J]. 中国组织工程研究与临床康复, 2007, 11(50): 10088-10092.
[17] Horner P J, Power A E, Kempermann G,etal. Proliferation and differentiation of progenitor cells throughout the intact adult rat spinal cord[J]. J Neurosci, 2000, 20(6): 2218-2228.
The Culture and Induced Differentiation of Neural Stem Cells of Embryonic Mice
RenLiyi1,ZhaoHaixia2,ZuoXuan1,LiShurong2,SuBingyin2△.
1.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610500,China; 2.SichuanKeyLaboratoryofDevelopmentandRegeneration,Chengdu610500,China
Objective To explore the method of culture and induced differentiation of neural stem cells in vitro. Methods The neural stem cells were isolated from the cerebral cortex of 12.5-day mouse embryo and digested into single cells by the Accutase enzyme digestion method and mechanical percussion. The single cells were cultured in complete medium. After 3 days, the neural stem cells proliferated into neurospheres. The subcultured neurospheres were digested and differentiated by induced medium. The methods of immunofluorescence staining and qRT-PCR were adopted to assay the expression levels of Nestin, microtubule-associated protein 2 (Map2), and glial fibrillary acidic protein (Gfap) and identify the neural stem cells and the neurons and astrocytes differentiated from the neural stem cells. Results The cultured neural stem cells were marked by Nestin specific markers; the cells induced from the neural stem cells could be identified by anti-Map2 or anti-Gfap specific antibody. According to the results of qRT-PCR, the expression level of Nestin decreased, while the expression levels ofMap2 and Gfap increased. Conclusion The Accutase enzyme digestion method combined with the mechanical percussion can separate the cells from the cerebral cortex of embryonic mouse and those cells can be cultured in vitro to obtain the neural stem cells with the capability of self-renewal and multi-directional differentiation potential.
Neural stem cells; Neuron; Astrocyte; Induced differentiation
http://www.cnki.net/kcms/detail/51.1705.R.20170220.1138.012.html
10.3969/j.issn.1674-2257.2017.01.001
国家自然科学基金资助项目(No:31600973);发育与再生四川省重点实验室基金资助项目(No:SYS14-003);四川省教育厅科研基金资助项目(No:16ZA0278);成都医学院校基金资助项目(No:CYZ14-004)
R329.2
A
△通信作者:苏炳银,E-mail:subingyinn@163.com

