液体活检指导下的非小细胞肺癌精准治疗*
李均勇,王 椿, 周晓娟,丁振宇△
1.四川大学(成都 610065);2.成都市龙泉驿区第一人民医院 肿瘤科(成都 610100);3. 四川大学华西医院 内分泌与代谢科(成都 610041); 4. 四川大学华西医院 胸部肿瘤科(成都 610041)
液体活检指导下的非小细胞肺癌精准治疗*
李均勇1,2,王 椿3, 周晓娟4,丁振宇4△
1.四川大学(成都 610065);2.成都市龙泉驿区第一人民医院 肿瘤科(成都 610100);3. 四川大学华西医院 内分泌与代谢科(成都 610041); 4. 四川大学华西医院 胸部肿瘤科(成都 610041)
目的 探讨液体活检用于非小细胞肺癌(non-small cell lung cancer, NSCLC)精准治疗的潜在价值。方法 本研究采用回顾性分析,纳入2015年3月到2016年3月四川大学华西医院胸部肿瘤科及肺癌中心液体活检指导下,行精准治疗的晚期NSCLC患者共11例。液体活检方法采用扩增阻滞突变系统方法,或数字PCR方法,或下一代测序方法。靶向治疗药物包括吉非替尼、埃克替尼及奥西替尼。结果 11例患者分别口服吉非替尼(7例,63.6%)、埃克替尼(2例,18.2%)和奥西替尼(2例,18.2%)。7例患者最佳疗效达到部分缓解(partial response,PR)(63.6%),3例最佳疗效为稳定(stable disease,SD)(27.3%),有1例患者口服奥西替尼很快出现进展(progression disease,PD)(9.1%)。全组病人中位无进展时间(progression free survival,PFS)为8.0月(95%CI:2.3~13.7月),中位总生存时间(overall survival, OS)仍未达到。有3例肿瘤组织与液体活检结果不符的患者,疗效分别为PR(2例)及PD(1例)。 结论 液体活检用于指导NSCLC的精准治疗值得进一步研究。
非小细胞肺癌;液体活检;精准治疗
肺癌是一类严重威胁人类生命健康的恶性疾病,其发病率和死亡率占恶性肿瘤第1位。肺癌中80%是非小细胞肺癌(non-small cell lung cancer, NSCLC)。NSCLC病人就诊时,大部份都属于不可手术的局部晚期或转移性病人。对于这类病人,化疗是主要治疗方式,但化疗的客观缓解率(objective response rate,ORR)只有30%左右,中位无进展时间(progression free survival,PFS)约3~4个月,病人总生存时间(overall survival, OS)不足1年。化疗效果有限且已达平台期,很难继续提高[1]。近年来,肺癌精准治疗迅速成为肺癌研究的热点。具有表皮生长因子受体(epithelial growth factor receptor, EGFR)基因突变的肺癌病人,采用靶向EGFR精准治疗后,ORR可提高到70%左右,PFS提高到8个月左右[2],OS可达2年[3]。
精确的基因检测是个体化治疗的前提,没有EGFR基因突变的病人接受靶向药物治疗,有效率不足10%,效果仅与安慰剂相当[4]。因而,基因检测越来越受到重视,已经成为肺癌的常规诊疗。基因检测可极大地节约医疗成本,并真正实现精准治疗,但基因检测需要肿瘤组织,临床活检特别纤支镜小活检很难提供足够组织,造成病人失去靶向治疗机会,或是接受不适当的靶向治疗,这是个体化治疗面临的难题。近年来,发展起来的液体活检技术,通过检测患者外周血游离DNA(cfDNA)中EGFR基因突变,显示与肿瘤组织基因检测极高一致性,文献[5]报道达70%左右。这些结果提示,采用液体活检可望用于指导NSCLC病人的精准治疗。然而,现有研究仅将液体活检作为肿瘤组织基因的补充与验证,精准治疗仍需要在肿瘤组织基因检测指导下进行,将液体活检结果直接指导精准治疗,目前仍缺乏相应临床验证和研究支持。
本研究回顾纳入了前期工作中采用外周液体活检技术检测cfDNA中EGFR基因突变状况,并将结果作为指导EGFR靶向治疗的晚期NSCLC病人11例。现报道如下。
1 资料与方法
1.1 临床资料
本研究纳入2015年3月到2016年3月四川大学华西医院胸部肿瘤科及肺癌中心晚期NSCLC患者共11例。纳入标准:患者经组织学或细胞学诊断证实为NSCLC;临床分期Ⅳ期【包括Ⅳa及Ⅳb期,美国癌症联合委员会(AJCC)分期第7版】;年龄≥18岁;至少有1个可测量的病灶;体力状态评分0~2分;预期寿命>3个月;既往未接受化放疗;血液学及肝肾功能正常,合并有心肺疾患者病情稳定。要求患者外周血EGFR基因检测为敏感突变,肿瘤组织EGFR基因检测不要求。经治医生根据外周血EGFR基因检测结果,给予小分子靶向治疗(吉非替尼、厄洛替尼或埃克替尼均可)。排除标准:任何不稳定的系统性疾病(包括消化道溃疡、活动性感染、3级高血压、不稳定性心绞痛、充血性心力衰竭、肝肾疾病、代谢性疾病或骨折、伤口未愈合);在5年内患有任何其他恶性肿瘤(完全治愈的宫颈原位癌、基底细胞或鳞状上皮细胞皮肤癌除外);体质量下降明显,如6周内体质量下降10%;骨转移灶为唯一观察指标者。
1.2 基因检测方法
本研究未限定基因检测方法。采用临床常规开展的扩增阻滞突变系统(ARMS)方法,包括双环引物法(厦门艾德公司)及蝎子法(英国凯捷公司),或是数字PCR(dPCR)方法,或是下一代测序(NGS)方法均可。本研究没有病例采用直接测序法。
1.3 评价标准
治疗前,行头颅 MRI、胸部及上腹部螺旋增强 CT 和全身骨扫描作为基线,依据影像学检查结果进行疗效评价。按照 RECIST 1.1[6]评价标准,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progression disease,PD)。CR+PR 为客观缓解率(objective response rate, ORR),CR+PR+SD 为疾病控制率(disease control rate, DCR)。肿瘤进展时间(time-to-progression, TTP)为病人开始接受化疗到肿瘤出现进展或症状明显恶化的时间。
1.4 统计学分析
采用SPSS 18.0(美国IBM公司)进行数据处理。定性资料以例数(%)表示,采用McNemar检验,生存分析用Kaplan-Meier法,组间比较采用Log-Rank检验。检验水准α设定为0.05。
2 结果
2.1 病人特征
11例晚期NSCLC患者中,男5例,女6例,年龄42~68岁,中位年龄52岁,分期均为IV期,病理类型均为腺癌,不吸烟有3例,体力状态均为1分。
2.2 基因状态
11例患者肿瘤组织及外周血cfDNA的检测方法及结果显示:有3例患者二者检测结果不一致,分别为1例肿瘤组织检测失败,其液体活检为L858R+T790M联合突变(4号患者),1例肿瘤组织野生型,其液体活检为L858R突变(5号患者),1例肿瘤组织为19DEL+L858R联合突变,其液体活检为19DEL +T790M联合突变(11号患者)。肿瘤组织与液体活检结果符合率为72.7%(8/11)(表1)。
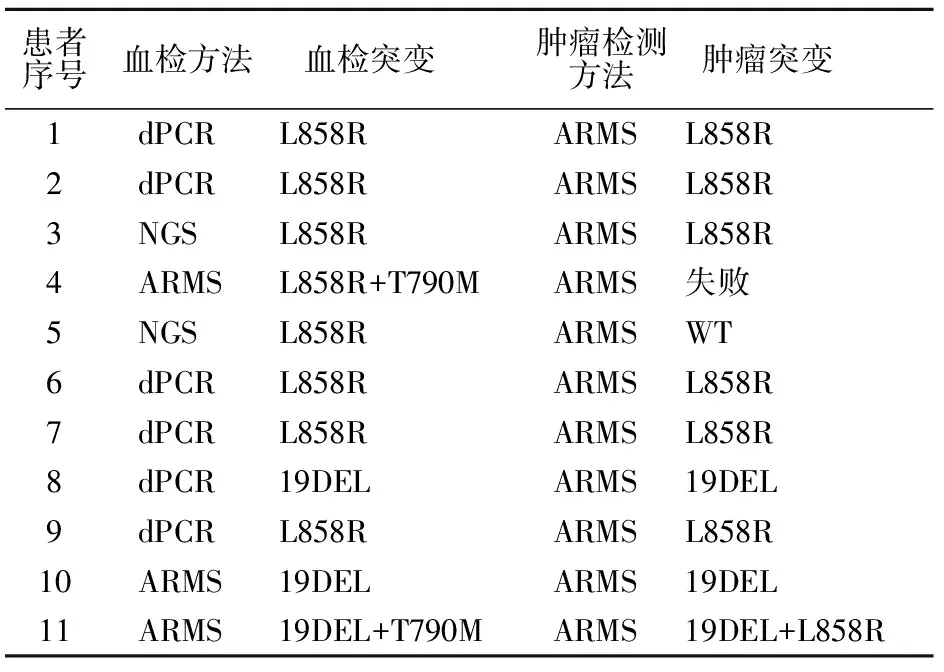
表1 患者基因检测方法及结果
2.3 治疗
现有研究[7]支持,吉非替尼、厄洛替尼及埃克替尼3种小分子靶向药物疗效相当。本研究不限定采用的靶向治疗药物,由经治医生决定。11例患者中,采用吉非替尼有7例,采用埃克替尼2例,另有2例患者液体活检发现携有T790M突变者,口服奥西替尼。11例患者中,疗效评价无CR,7例患者最佳疗效达到PR,3例最佳疗效为SD,有1例患者口服奥西替尼很快出现PD,总有效率(PR+SD)达90.9%(10/11)。全组病人中位PFS为8.0月(95%CI:2.3~13.7月),中位OS仍未达到(图1)。3例肿瘤组织与液体活检结果不符的患者疗效,4号及5号均为PR,11号患者病例胸水增多,腋窝淋巴结增多增大,疗效为PD(图2)。

图1 全组病人的PFS
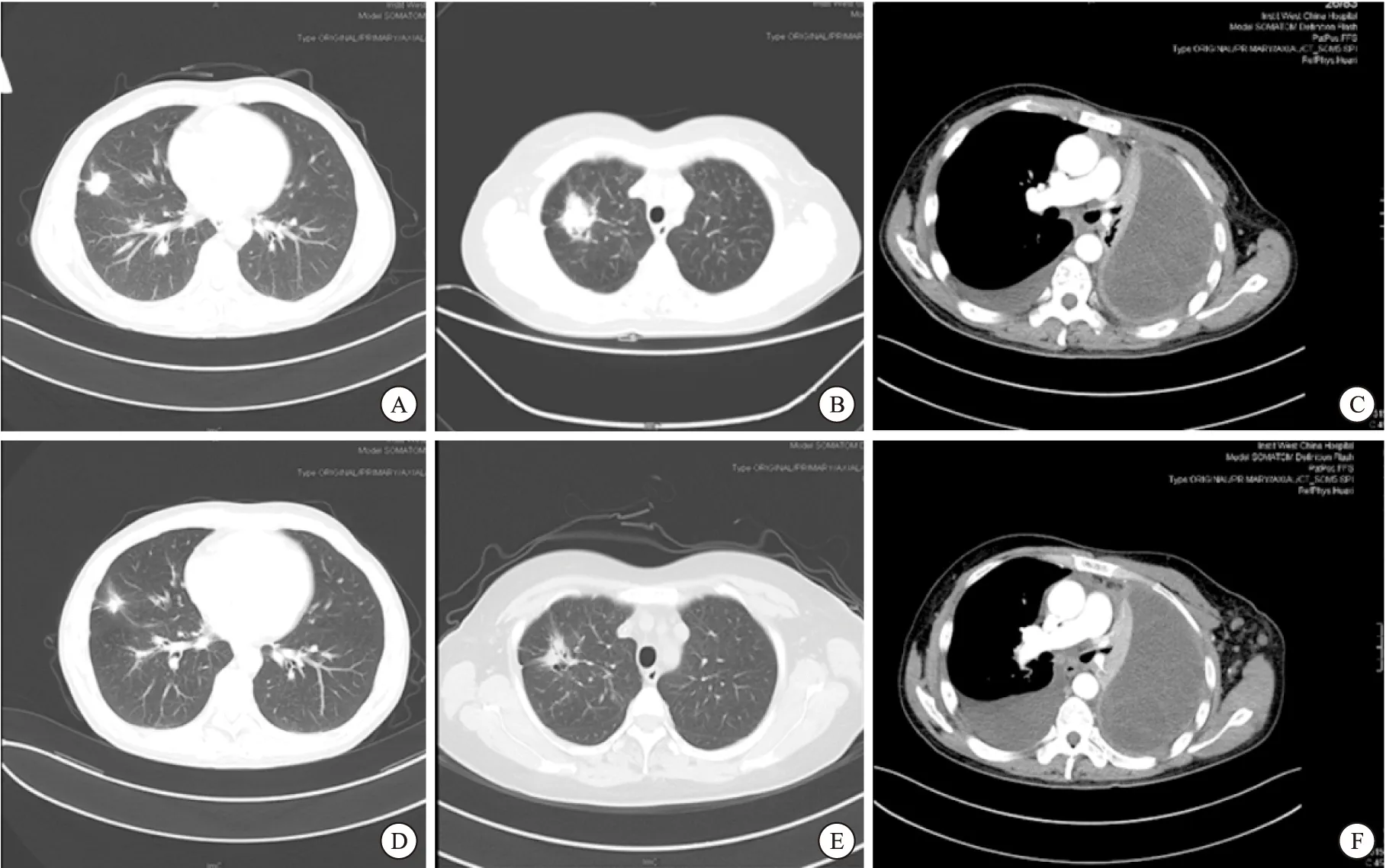
图2 3例肿瘤组织与液体活检基因检测不一致的患者疗效
3 讨论
精准治疗能提高肺癌治疗缓解率,改善预后。无论是亚洲开展的IPASS、NEJ002、LUX-6或欧洲开展的EURTAC、LUX-3等 III期临床试验,均证实携有EGFR基因突变的肺癌患者一线治疗采用靶向治疗,其疗效远优于传统化疗[1]。具有EGFR基因突变的患者中,接受过靶向治疗的较未接受的生存时间更长[3]。精准治疗迅速成为肺癌研究的热点,也带动了与之相应的基因检测。肿瘤EGFR基因检测方法从最初的直接测序法发展到液体活检技术,但这些检测方法面临的问题是需要肿瘤组织,而临床工作中取得活检组织,特别是纤支镜标本等小检组织极少,难以满足基因检测的需要。
为解决肿瘤组织获取困难的问题,随着新检测技术如dPCR和NGS应用日益广泛,近年来,液体活检技术渐渐兴起[5]。现有的液体活检技术主要包括3类,即ARMS、dPCR与NGS。ARMS方法的原理是利用引物的3′端碱基与模板碱基不互补的情况下,PCR反应无法延伸。根据已知点突变设计引物,即可将有某种点突变的模板与正常模板区分开来,开展难度较低,在临床广泛应用,但对T790M继发耐药点突变检测敏感性较低;dPCR检测敏感性高,而且可以对突变EGFR基因丰度进行绝对定量,可惜不能对突变基因进行广谱和多位点检测;而NGS有与dPCR相当的检测灵敏度,也可用于突变基因的广谱乃至全基因谱筛查,是一种较理想的检测方法,缺点是技术复杂,临床难于广泛开展。液体活检与肿瘤组织基因检测有很高的一致性,回顾性分析发现,液体活检可望用于指导精准治疗,但这一假设至今仍无临床研究结果加以证实。本研究为回顾性分析,第1次为采用液体活检结果指导的精准治疗提供了依据。值得注意的是,现在开展的1项IIb期前瞻性BENEFIT研究还在进行中,其结果可能提供进一步证据。
本研究纳入11例患者,肿瘤组织与液体活检结果符合率为72.7%(8/11),结果与多数报道[ 5,8-11]相一致。过去将肿瘤组织基因检测作为金标准,液体活检结果与之相比,得出检测的“敏感性”与“特异性”。但肿瘤存在异质性,不同病人之间,同一病人不同部位肿瘤,乃至同一肿瘤病灶内部存在不同的恶性细胞种群。已有研究[12]表明,肺癌内部广泛存在不同基因表达谱的细胞克隆,因此,EGFR在肺癌内部表达状态可能并不一致,单纯活检取样很难认识其全貌。现在通过对肿瘤异质性的理解,肿瘤组织基因检测亦不能作为金标准。液体活检的结果只能通过能否指导临床治疗加以判断。这也正是本研究及上述前瞻性BENEFIT研究的出发点。
本研究11例患者,总有效率(PR+SD)达90.9%(10/11),超过了大多数EGFR敏感突变患者口服TKI治疗的总有效率(约70%)。因本研究是一个小样本探索性研究,这样高的总有效率极有可能是源于小样本量的偏倚因素造成的。而中位PFS为8.0月(95%CI:2.3~13.7月),这一结果与大多数EGFR敏感突变患者口服靶向治疗PFS时间相一致。总之,本研究所取得的结果与既往肺癌精准治疗的疗效相当,说明采用液体活检结果指导精准治疗在临床工作中具有应用和推广的前景。
本研究中,发现3例患者肿瘤组织与液体活检结果不一致。仔细分析这3例患者,第1例患者(第4号)因肿瘤组织过少未能检测出EGFR基因状态,该名患者口服吉非替尼后疗效达PR。第2例患者(5号)肿瘤组织EGFR基因野生型,其液体活检为L858R突变,该名患者口服吉非替尼后疗效达PR。第3例患者(11号患者)肿瘤组织EGFR基因状态为19DEL+L858R联合突变,而液体活检为19DEL +T790M联合突变,该例患者口服奥西替尼,但仅1月就出现PD。奥西替尼对EGFR基因经典敏感突变也有很好疗效(FLAURA研究,现在进行中尚未正式发表,NCT02296125),因此,该例患者临床疗效至少不支持肿瘤组织基因检测结果。如果从临床疗效的观点出发,3例基因检测不一致的患者,其液体活检结果较肿瘤组织更有可能为“真”。
本研究为回顾性研究,从单一中心纳入病人,而且纳入病例数较少(11例),因而本研究仅仅是一种探索性研究,偏倚在所难免,结论需要谨慎解释。同时,应当指出,采用液体活检指导肺癌精准治疗,至今国内外仍无直接报道,临床也不常规开展,造成临床病例极少,可供总结分析的例数更少。
综上所述,本研究通过回顾性分析发现,液体活检能很好地指导精准治疗,3例检测结果不一致的患者,临床疗效更支持液体活检结果。本研究为液体活检应用于临床,指导肺癌精准治疗提供了直接依据,研究结论需要进一步前瞻性研究加以证实。
[1]Reck M, Heigener D F, Mok T,etal. Management of non-small-cell lung cancer: recent developments[J].Lancet, 2013, 382(9893): 709-719.
[2]Maemondo M, Inoue A, Kobayashi K,etal. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362(25): 2380-2388.
[3]Zhou C, Wu Y L, Chen G,etal. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 735-742.
[4]Kobayashi S, Boggon T J, Dayaram T,etal. EGFR mutation and resistance of non-small-cell lung cancer to gefitinib[J]. N Engl J Med, 2005, 352(8): 786-792.
[5]Mok T, Wu Y L, Lee J S,etal. Detection and Dynamic Changes of EGFR Mutations from Circulating Tumor DNA as a Predictor of Survival Outcomes in NSCLC Patients Treated with First-line Intercalated Erlotinib and Chemotherapy[J]. Clin Cancer Res, 2015, 21(14): 3196-3203.
[6]Eisenhauer E A, Therasse P, Bogaerts J,etal. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(2): 228-247.
[7]Shi Y, Zhang L, Liu X,etal. Icotinib versus gefitinib in previously treated advanced non-small-cell lung cancer (ICOGEN): a randomised, double-blind phase 3 non-inferiority trial[J]. Lancet Oncol, 2013, 14(10): 953-961.
[8]Liu X, Lu Y, Zhu G,etal. The diagnostic accuracy of pleural effusion and plasma samples versus tumour tissue for detection of EGFR mutation in patients with advanced non-small cell lung cancer: comparison of methodologies[J]. J Clin Pathol, 2013, 66(12): 1065-1069.
[9]Yung T K, Chan K C, Mok T S,etal. Single-molecule detection of epidermal growth factor receptor mutations in plasma by microfluidics digital PCR in non-small cell lung cancer patients[J]. Clin Cancer Res, 2009, 15(6): 2076-2084.
[10] Bai H, Mao L, Wang H S,etal. Epidermal growth factor receptor mutations in plasma DNA samples predict tumor response in Chinese patients with stages IIIB to IV non-small-cell lung cancer[J]. J Clin Oncol, 2009, 27(16): 2653-2659.
[11] Goto K, Ichinose Y, Ohe Y,etal. Epidermal growth factor receptor mutation status in circulating free DNA in serum: from IPASS, a phase III study of gefitinib or carboplatin/paclitaxel in non-small cell lung cancer[J]. J Thorac Oncol, 2012, 7(1): 115-121.
[12] De Bruin E C, McGranahan N, Mitter R,etal. Spatial and temporal diversity in genomic instability processes defines lung cancer evolution[J]. Science, 2014, 346(6206): 251-256.
The Precision Therapy of Non-small Cell Lung Cancer Under the Guidance of Liquid Biopsy
LiJunyong1,2,WangChun3,ZhouXiaojuan4,DingZhenYu4△.
1.SichuanUniuersity,Chengdu610065,China; 2.CancerDepartment,TheFirstpeople′sHospitalofLongquanyiDistrict,Chengdu610100,China; 3.DepartmentofEndocrinologyandMetabolism,WestChinaHospitalofSichuanUniversity,Chengdu610041,China; 4.DepartmentofThoracicCancer,WestChinaHospitalofSichuanUniversity,Chengdu610041,China
Objective To explore the potential value of liquid biopsy in the precision therapy for the non-small cell lung cancer (NSCLC). Methods The retrospective method was adopted to analyze the data of 11 cases with advanced NSCLC treated with the precision therapy under the guidance of liquid biopsy from March of 2015 to March of 2016 in West China Hospital of Sichuan University. The liquid biopsy was performed by the methods including the amplification refractory mutation system, digital polymerase chain reaction (PCR) and next generation sequencing. The targeted drugs involved Gefitinib, Icotinib and Osimertinib. Results Among the 11 cases, 7 patients (63.6%) were given Gefitinib, 2 patients (18.2%) were given Icotinib and the other two patients were given Osimertinib. After the treatment, 7 cases (63.6) achieved the partial response (PR), 3 cases (27.3%) had the stable disease (SD), and the only one case (9.1%) taking Osimertinib had propression disease (PD). The median progression free survival (PFS) was 8.0 months (95%CI: 2.3-13.7 months) and the median overall survival was not reached. 3 patients had discordant results in the tests of tumors and liquid biopsy and they were 2 cases with PR and 1 case with PD respectively. Conclusion More further research is worth doing in the precision therapy for NSCLC under the guidance of liquid biopsy.
Non-small cell lung cancer; Liquid biopsy; Precision therapy
http://www.cnki.net/kcms/detail/51.1705.R.20170111.1046.010.html
10.3969/j.issn.1674-2257.2017.01.012
国家自然科学基金(No:82172684)
R246.5
A
△通信作者:丁振宇, E-mail: dingzhenyu@scu.edu.cn

