HPLC法同时测定葡萄和葡萄酒中6种基本花色苷
刘冰,葛谦*,张艳,苟春林,赵子丹
(宁夏农产品质量标准与技术研究所,宁夏银川750002)
HPLC法同时测定葡萄和葡萄酒中6种基本花色苷
刘冰,葛谦*,张艳,苟春林,赵子丹
(宁夏农产品质量标准与技术研究所,宁夏银川750002)
该研究建立了高效液相色谱法同时测定葡萄和葡萄酒中6种基本花色苷的检测方法。样品经无水乙醇/盐酸/水(2∶1∶1,V/V)提取,采用Agilent-ZORBAXSB-C18色谱柱(250 mm×4.6 mm,5 μm)为固定相,流动相A(乙腈)和B(0.1%磷酸水溶液)梯度洗脱,流速0.8 mL/min,检测波长525 nm。在该色谱条件下,6种花色苷在30 min内得到了很好的分离效果,其含量与峰面积呈现良好线性关系(R>0.9993),且回收率为82.2%~93.3%、精密度好(RSD<5.0%)。该方法方便、快速,能够实现对葡萄和葡萄酒中6种花色苷物质的定性及定量检测。
花色苷;高效液相色谱;葡萄;葡萄酒;检测
花色苷在自然界中常以糖苷形式存在,是由花色素与葡萄糖相结合而生成的糖苷类化合物[1]。花色苷主要有五种基本形式:飞燕草花色素苷、锦葵花色素苷、芍药花色素苷、矢车菊花色素苷和矮牵牛花色素苷[2]。花色苷的结构可以分为四大类:基本花色苷(非酰化花色苷)、酰化花色苷、聚合花色苷和吡喃花色苷[3-6]。花色苷作为葡萄酒主要呈色物质,使其呈现出红色、砖红色、紫红色等不同颜色,对葡萄酒的感官品质起到决定性作用[7-9]。葡萄中,花色苷主要存在于红色、紫色葡萄浆果皮中最靠近表皮3~4层细胞的液泡中[10-11]。葡萄酒中花色苷的组成特征蕴含了产地、品种、年份以及酿酒工艺等信息,可作为区分不同品种红葡萄酒的化学标志。因此,分析葡萄及葡萄酒中花色苷尤显重要[12]。
目前对于花色苷含量的测定,主要有pH值差异法、比色法以及高效液相色谱法[13]。其中比色法操作繁琐,且容易受到其他酚类物质干扰而影响结果的准确性。而高效液相色谱法具有样品用量少、方法操作简单并且能够准确对单一组分进行定性和定量等优点而被广泛使用[14-16]。本试验前处理结合顶空瓶密封加热的方法,大幅度提高了样品前处理速度,采用高效液相色谱(high performance liquid chromatography,HPLC)法能适应国内大部分实验室检测要求,建立了相对快速、便捷、稳定的检测方法。以期为葡萄酒相应法规标准的制定提供了理论依据,为酿酒工艺的改良提供了重要数据支撑[17]。
1 材料与方法
1.1 材料与试剂
赤霞珠干红葡萄酒(2008年)、霞多丽干白葡萄酒(2008年):宁夏志辉源石酒庄。酿酒葡萄取自银川市芦花台园林场,将样品在室温下进行打浆、去葡萄籽处理。
标准品:矢车菊色素-3-O-葡萄糖苷(cyaniding-3-O-glucoside)、芍药色素-3-O-葡萄糖苷(peonidin-3-O-glucosi de)、飞燕草色素-3-O-葡萄糖苷(delphinidin-3-O-glucoside)、矮牵牛色素-3-O-葡萄糖苷(petunidin-3-O-glucoside)、锦葵色素-3-O-葡萄糖苷(malvidin-3-O-glucoside)、天竺葵色素-3-O-葡萄糖苷(pelargonidin-3-O-glucoside):美国Chromadex公司。
将购得的标准品分别用盐酸/甲醇(1∶9,V/V)配制成100 mg/kg的标准储备液,保存于-20℃。
甲醇、乙腈(均为色谱纯):德国Merck公司;无水乙醇、磷酸(均为分析纯)、盐酸(优级纯):上海化学试剂有限公司。
1.2 仪器与设备
Waters 2695高效液相色谱仪(配2475紫外检测器及Xcalibur1.2数据处理系统):美国Waters公司;凯航HH-8数显恒温水浴锅:常州市凯航仪器有限公司;FRQ-1006单槽超声波清洗机:杭州法兰特超声波科技有限公司;Mili-Q型超纯水机:美国密理博公司。
1.3 方法
1.3.1 色谱条件
Agilent-ZORBAXSB-C18色谱柱(4.6mm×250mm,5μm);柱温:40℃;检测波长:525 nm;流动相:A乙腈;B 0.1%磷酸水溶液;流速:0.8 mL/min,梯度洗脱;进样体积:5 μL,洗脱程序见表1。

表1 梯度洗脱程序Table 1 Gradient elution program
1.3.2 样品预处理
称取5.00 g葡萄酒于100 mL顶空瓶中,加入无水乙醇/盐酸/水(2∶1∶1,V/V)提取剂25 mL,摇匀后用压盖器将瓶盖压紧密封,超声30 min后于100℃沸水浴1 h。取出样品冷却至室温,经0.22 μm微孔滤膜过滤后待测。
酿酒葡萄样品预处理方法同葡萄酒预处理方法。
2 结果与分析
2.1 检测波长的确定
用紫外分光光度计对6种花色苷标准样品溶液进行全波扫描。结果显示,6种标准样品最大吸收峰虽然各不相同,但在波长525 nm处均有最大或者较大吸收峰。因此,本试验选择525 nm作为仪器的检测波长。
2.2 流动相条件的确定
根据所查文献[7,15,18],本试验对3种流动相组成进行了优选。
流动相Ⅰ:流动相A:乙腈∶水(60∶40,V/V),流动相B:乙腈∶水(5∶95,V/V)(均使用磷酸调pH=1.5)。洗脱程序为梯度洗脱:0~10 min,5%~10%A,10~25 min,10%~25%A;25~26 min,25%~5%A,30 min,5%A。柱温:40℃;检测波长:525 nm;流速:0.8 mL/min,进样体积:5 μL。
流动相Ⅱ:流动相A:乙酸∶水(2∶98,V/V),流动相B:乙腈。洗脱程序为梯度洗脱:0~10 min,16%B,10~25 min,20%~40%B;25~30 min,40%~0%B。柱温:40℃;检测波长:525 nm;流速:0.8 mL/min,进样体积:5 μL。
流动相Ⅲ:流动相A:水∶乙酸∶乙腈=(89∶2∶9,V/V),流动相B:水∶乙腈(20∶80,V/V)。洗脱程序为等度洗脱。柱温:40℃;检测波长:525nm;流速:0.8mL/min,进样体积:5μL。
流动相Ⅳ:A:乙腈;B:0.1%磷酸水溶液。梯度洗脱:0~25min:10%~25%A,25~25.1min:25%~10%A。柱温:40℃;检测波长:525nm;流速:0.8mL/min,进样体积:5μL。
结果表明:采用流动相Ⅰ时,各花色苷峰形较尖但有拖尾,且分离效果较差;采用流动相Ⅱ时,各花色苷峰形较宽,分离效果较差,尤其芍药色素-3-O-葡萄糖苷和锦葵色素-3-O-葡萄糖苷无法很好分离;采用流动相Ⅲ时,各花色苷分离效果较差、响应值较低且分离时间长。采用流动相Ⅳ时,各花色苷分离效果较好、且保留时间较短。综合各方面因素,本试验选用流动相Ⅳ进行实验。
2.3 前处理方法的选择
分别选用超声波法、不同温度(25℃、60℃、80℃、100℃、120℃)、不同时间(0.5 h、1.0 h、1.5 h、2.0 h)水浴振荡法、盐酸、磷酸等提取手段,结果表明,超声波法虽然能够很好将样品内溶物溶出于提取溶剂中,但花色苷需在酸性条件下,且进行加热处理,才能很好显色。加热的长短对本试验影响不大,用盐酸进行pH调酸处理较磷酸更稳定,因此,本试验最终选择无水乙醇/盐酸/水(2∶1∶1,V/V)为提取试剂,超声30 min(50 kHz、120 W),100℃加热1 h为样品前处理方法。
2.4 标准曲线及线性范围的确定
采用外标峰面积定量,混合标准品高效液相色谱图见图1。

图16 种花色苷混合标样高效液相色谱图Fig.1 HPLC chromatogram of six anthocyanins mixture standard samples
分别将6种花色苷的标准溶液母液稀释成5.0 mg/kg、10.0 mg/kg、50.0 mg/kg、80.0 mg/kg、100 mg/kg个质量浓度的标准溶液系列,以标准溶液质量浓度(x)为横坐标,峰面积(y)为纵坐标作标准曲线。6种花色苷的标准曲线线性回归方程、相关系数、检出限(detection limit,LOD)结果见表2。由表2可知,6种花色苷的标准曲线线性回归方程相关系数R值>0.9993,各方法检出限较低(0.008~0.010mg/kg),该方法对花色苷检测显示了较高的灵敏度。
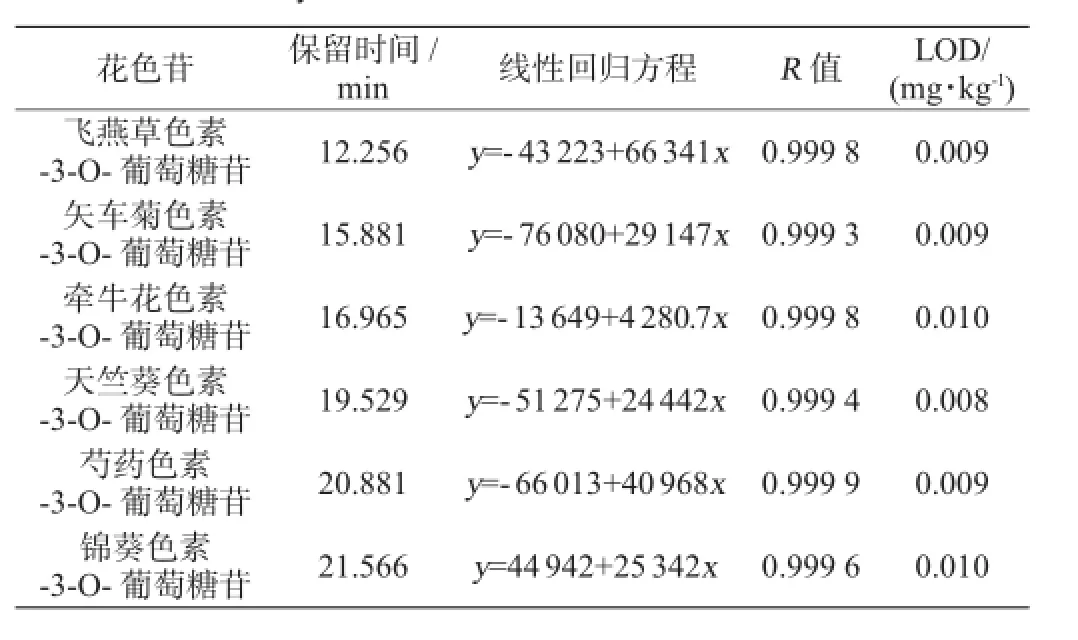
表26 种花色苷回归方程及相关系数Table 2 Regression equation and correlation coefficient of six anthocyanins
2.5 精密度及回收率试验
以2.0 mg/kg、5.0 mg/kg、10.0 mg/kg 3个质量浓度为添加水平,每个水平重复5次,在霞多丽白葡萄和葡萄酒(本底值均为0)中添加相应浓度6种花色苷标准溶液,室温静置30 min后,按照1.3.1和1.3.2方法,测定酿酒葡萄和葡萄酒中6种花色苷含量,结果见表3。

表3 精密度及加标回收率试验结果(n=5)Table 3 Results of precision and adding standard recovery rate tests(n=5)
由表3可知,酿酒葡萄和葡萄酒中6种花色苷测定结果的相对标准偏差(relativestandarddeviation,RSD)在1.1%~4.5%,均<5.0%;回收率为82.2%~93.3%,均在80%~110%之间。结果表明,该方法精密度、准确度较高。
2.6 样品测定

图2 赤霞珠酿酒葡萄(A)及葡萄酒(B)中5种花色苷高效液相色谱图Fig.2 HPLC chromatograms of five anthocyanins in Cabernet Sauvignon grape(A)and wine(B)
在相同实验条件下对葡萄和葡萄酒样品中6种花色苷含量进行分析,葡萄和葡萄酒样品中6种花色苷含量高效液相色谱图见图2,结果见表4。
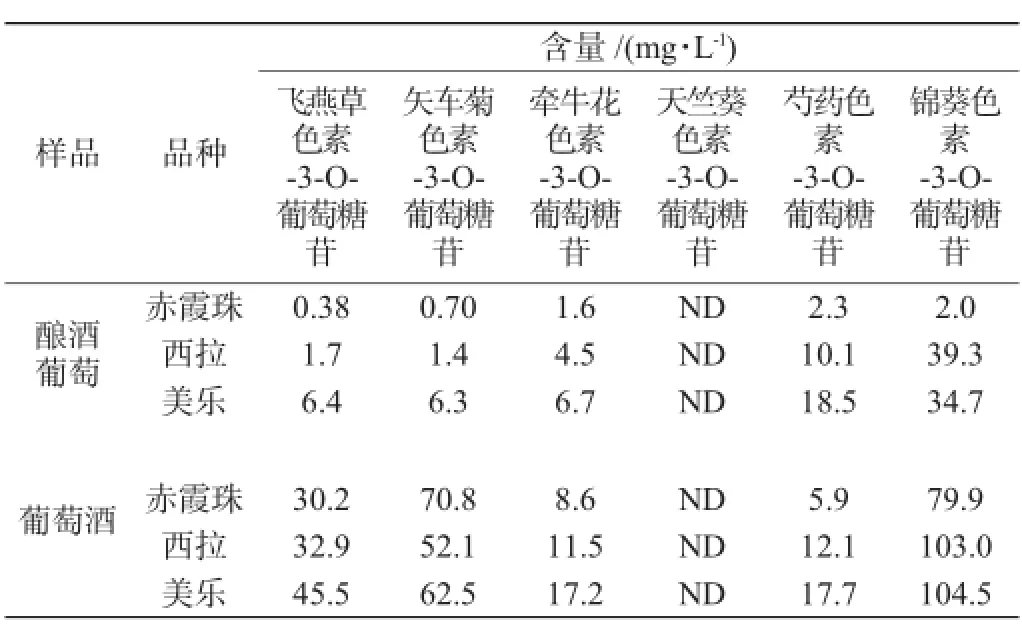
表4 酿酒葡萄和葡萄酒中花色苷含量测定结果(n=3)Table 4 Determination results of anthocyanins contents in grape and wine(n=3)
由表4可知,在酿酒葡萄和葡萄酒中,各花色苷含量差别大。酿酒葡萄中主要花色苷为锦葵色素-3-O-葡萄糖苷和芍药色素-3-O-葡萄糖苷,葡萄酒中主要花色苷为锦葵色素-3-O-葡萄糖苷和矢车菊色素-3-O-葡萄糖苷。在酿酒葡萄和葡萄酒中,西拉和美乐花色苷含量整体高于赤霞珠品种,天竺葵色素-3-O-葡萄糖苷均未检出,这与文献[10]报道不同品种山葡萄酒中花色苷的组成与含量基本一致。在酿酒葡萄中,西拉锦葵色素-3-O-葡萄糖苷含量最高为39.3 mg/kg,美乐次之为34.7mg/kg,赤霞珠最低为2.0 mg/kg。在葡萄酒中,美乐锦葵色素-3-O-葡萄糖苷最高为104.5 mg/kg,西拉次之为103.0 mg/kg,赤霞珠最低为79.9 mg/kg。葡萄酒中5种花色苷含量均高于酿酒葡萄。
3 结论
本试验采用高效液相色谱对酿酒葡萄及葡萄酒种6种花色苷进行分析测定,6种花色苷在30 min内完全分离。在一定线性范围内,各分析物有良好的线性关系(R值≥0.999 3)和较低的方法检出限(0.008~0.010 mg/kg),回收率在82.2%~93.3%,RSD<4.5%。该方法操作简单快速,灵敏度高,准确度良好,可以作为建立花色苷指纹图谱较好的手段。
[1]王丽娜.宁夏产区酿酒葡萄品质与葡萄酒质量的研究[D].杨凌:西北农林科技大学,2011.
[2]季梅,李强,娄红祥.高效液相色谱-质谱检测红葡萄皮中花色苷[J].药物分析杂志,2011,31(12):2240-2243.
[3]HAN F L,JIANG S M,HE J J,et al.The anthocyanins in Cabernet Gernischet(Vitis viniferaL.cv.)aged red wine and their color in aqueous solution analyzed by partial least square regression[J].Food Sci Biotechnol,2009,28(3):724-731.
[4]MONAGAS M,MARTIN-ALVAREZ P J,BARTOLOME B,et al.Statistical interpretation of the color parameters of red wines in function of their phenolic composition during aging in bottle[J].Eur Food Res Tech,2005,222(4):702-709.
[5]RENTZSCH M,SCHWARZ M,WINTERHALTER P.Pyranoanthocyanins-an overview on structures,occurrence,and pathways of formation[J].Trend Food Sci Technol,2007,18(5):526-534.
[6]IBERN-GOMEZ M,ANDRES-LACUEVA C,LAMUELA-RAVENTOS R M,et al.Rapid HPLC analysis of phenolic compounds in red wines[J]. Am J Enol Viticult,2001,53(3):218-221.
[7]陈曦,周小平,韩舜愈,等.HPLC测定葡萄和葡萄酒中花色苷[J].光谱实验室,2013,30(4):1704-1709.
[8]韩富亮,李杨,李记明,等.红葡萄酒花色苷结构和颜色的关系研究进展[J].食品与生物技术学报,2011,30(3):328-336.
[9]杜文华,刘忠义.葡萄酒中花色苷的研究进展[J].食品与机械,2011,27(4):169-172,176.
[10]赵权,王军,韩富亮.不同品种山葡萄酒中花色苷的成分分析[J].西北农林科技大学学报:自然科学版,2013,41(6):195-201.
[11]刘丽媛,苑伟,刘延琳.红葡萄酒中花色苷辅助成色作用的研究进展[J].中国农业科学,2010,43(12):2518-2526.
[12]于庆泉,段长青.蛇龙珠葡萄酒酿造过程中颜色变化规律研究[J].中国酿造,2006,25(11):28-30.
[13]李安文,廖寅平,徐小江,等.花色苷研究进展[J].吉林农业,2010,30(12):87-88.
[14]LEE J,RENNAKER C,WROLSTAD E R.Correlation of two anthocyanin quantification methods:HPLC and spectrophotometric methods [J].Food Chem,2008,110(3):782-786.
[15]梁娜娜,韩深,何非.几种红葡萄酿酒过程中花色苷组成与CIELab参数的相关分析[J].中国酿造,2014,33(1):48-55.
[16]王锐.贺兰山东麓土壤特征及其与酿酒葡萄生长品质关系研究[D].杨凌:西北农林科技大学,2016.
[17]罗赟,陈宗玲,宋卫堂,等.草莓果实花色苷成分组成鉴定及分析[J].中国农业大学学报,2014,28(5):86-94.
[18]郝笑云.贺兰山东麓新红葡萄酒酚类物质对颜色影响的研究[D].银川:宁夏大学,2013.
Simultaneous determination of six kinds of basic anthocyanins in grape and wine by HPLC
LIU Bing,GE Qian*,ZHANG Yan,GOU Chunlin,ZHAO Zidan
(Quality Standards and Testing Institute of Agricultural Technology,Yinchuan 750002,China)
The method for simultaneous determination of six kinds of basic anthocyanins in grape and wine by HPLC was established.The simple was extracted by ethanol/hydrochloric acid/water(2∶1∶1,V/V),separated by Agilent-ZORBAX SB-C18chromatographic column(250 mm×4.6 mm,5 μm), with acetonitrile and 0.1%phosphoric acid solution as mobile phase,flow rate 0.8 ml/min,and detection wavelength 525 nm.Under the chromatographic conditions,the six anthocyanins got good separation effect within 30 min,and the contents showed a good linear relation with the peak area(R>0.999 3),recovery rate was 82.2%-93.3%and the precision was good(RSD<5.0%).The method was convenient and fast,which could realize qualitative and quantitative detection of the six anthocyanins in grape and wine.
anthocyanins;HPLC;grape;wine;determination
O657.6
0254-5071(2017)02-0162-04
10.11882/j.issn.0254-5071.2017.02.035
2016-10-24
宁夏回族自治区自然基金项目(NZ15108);宁夏农林科学院科技创新先导资金(NKYJ-15-08)
刘冰(1980-),男,工程师,本科,主要从事林业产品品种及营养成分研究工作。
*通讯作者:葛谦(1988-),女,硕士研究生,助理研究员,主要从事农产品质量安全及风险评估工作。

