林芝青稞酒曲酵母菌的分离鉴定及性能测定
马斌,隋超,马长中*
(西藏农牧学院食品科学学院,西藏林芝860000)
林芝青稞酒曲酵母菌的分离鉴定及性能测定
马斌,隋超,马长中*
(西藏农牧学院食品科学学院,西藏林芝860000)
以西藏林芝八一镇采购青稞酒曲为样品,对酒曲中的产酸、产酒精酵母菌进行分离、鉴定及性能测定。结果表明,菌株Y1、Y7为脲酶阴性菌,使MRS培养基变黄,能利用多种氮源和碳源;菌株Y8、Y10为脲酶阳性菌,能发酵多种糖类。根据个体形态、菌落特征、生理生化特征,初步鉴定菌株Y1、Y7为产酸酵母菌,菌株Y8、Y10为产酒精酵母。进行了不同条件对酵母菌产酸和产酒精能力的影响实验及耐受性实验,并分析产酸酵母菌和产酒精酵母菌的发酵性能。其中,菌株Y1、Y7的产酸量分别为145.06 μg/mL、128.59 μg/mL,菌株Y8、Y10酒精度分别为2.84%vol、2.31%vol。
青稞酒曲;酵母菌;分离;鉴定;性能测定
青稞自古以来是西藏地区的重要主食也是开发功能性食品的最佳原料[1]。青稞中含有多类酚类化合物[2],酚类物质具有预防心血管疾病和抗氧化作用[3]。此外,青稞中β-葡聚糖的含量达8.62%,具有降糖、降脂、降血压等多种生理功能[4],淀粉、蛋白均有较高的含量,同时含有人体所需的8种必需氨基酸、高于玉米两倍的烟酸和多种对人体有益的矿物质[5-7]。青稞用来酿酒已经有悠久的历史,早已成为西藏特色的饮品[8]。目前,青稞酒的种类很多,备受藏区人民的青睐,但还存在很多问题,如口感不好、浑浊、沉淀等[9]。酿酒酵母是影响酒的重要影响因素之一,它的选择会直接影响酒的感官和品质[10-11]。
该实验从青稞酒曲中筛选产酸及产酒精能力强并且耐酸能力和耐酒精力强的菌株,无论采用单一发酵还是混合发酵,对缩短青稞酒的发酵时间和风味的改善具有较大影响,对青稞酒的工业化纯种发酵改善奠定理论基础。
1材料与方法
1.1 材料与试剂
青稞酒曲:西藏林芝八一镇农家自制;无水乙醇、肌酸、已胺、硝酸钾、亚硝酸盐等所用试剂均为国产分析纯;液化酶(2 000 U/g):北京东华强盛生物技术有限公司;糖化酶(50 000 U/g):湖南鸿鹰祥生物工程股份有限公司。
MRS培养基:蛋白胨10 g、牛肉膏10 g、酵母粉5 g、磷酸氢二钾2 g、醋酸钠5 g、柠檬酸铵2 g、硫酸镁0.2 g、硫酸锰0.05g、碳酸钙20g、琼脂20g、吐温-801.0g、蒸馏水1000mL。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母膏10 g、蛋白胨18 g、葡萄糖20 g、蒸馏水1 000 mL。
豆芽汁培养基:黄豆芽12g、蒸馏水100mL,煮沸20min,过滤取汁。
McClary培养基:葡萄糖10g、次氯酸钾18g、醋酸钠8g、酵母膏2.5 g、琼脂20 g。
玉米琼脂培养基:玉米粉6g、琼脂20g、蒸馏水1000mL。
青稞培养基:青稞粉20 g、蒸馏水400 mL、氯化钙0.022 g、液化酶0.02 g,糖化酶0.075 g,调pH6.2~6.4。
以上培养基均经过121℃灭菌20 min。
1.2 仪器与设备
PR-CJT-4超净工作台:上海普瑞斯仪器有限公司;YXQ-LS-50SII型立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;DHP-9162电热恒温培养箱:浙江托普仪器有限公司;MS-105电子天平、Easy Plus pH计:瑞士梅特勒公司;2102PCS紫外-可见光分光光度计:上海尤尼柯公司。
1.3 方法
1.3.1 菌株的分离
取粉碎好的青稞酒曲1 g,放入装有20 mL无菌水的小烧杯中,充分摇匀后,用移液枪准确吸取0.5 mL,加入装有4.5 mL无菌水试管中制成菌悬液后逐级稀释,稀释至10-1~10-9。分别取9个梯度的菌悬液100 μL,滴加到MRS培养基上进行涂布,30℃的恒温培养箱中培养2~3 d,进一步划线分离纯化,观察酵母菌在培养基上的形态,对分离得到的酵母进行初步鉴定,并进行保藏[13-15]。
1.3.2 菌株形态学鉴定
将分离纯化的菌株活化后以6%的接种量接入YEPD培养基[16],25~28℃条件下培养3 d后观察菌落形态[17]。根据酵母菌的有性生殖主要形成子囊孢子,可将其划分为生孢子酵母和无孢子酵母,待鉴定菌株用YEPD培养基移接2~3代,再以生长旺盛的培养物移种于产孢培养基中,涂片观察子囊饱子的形状和表面纹饰。同时采用划线法接种于薄层玉米粉琼脂培养基上,用显微镜观察记录盖片下划线两旁是否形成假菌丝。
1.3.3 生理生化鉴定
参照《酵母菌的特征与鉴定手册》和《The yeast,a taxonomy study》进行生理生化实验。
1.3.4 酵母菌的性能测定
选取经过分离鉴定的菌株进行试验,菌种活化后的菌以2%的比例接种到青稞粉培养基上,测定产酸及产酒精酵母菌最适生长条件,温度和pH对酵母菌产酸和产酒精能力的影响,酵母菌的耐受性,产酸酵母菌的产酸量和产酒精酵母菌的产酒精量。
1.3.5 测定方法
生物量(OD660nm值)测定采用分光光度法;酸度测定采用pH计;酒精度测定采用甲基橙褪色法[18];乳酸测定采用对羟基联苯比色法[19]。
2 结果与分析
2.1 形态学鉴定
在MRS培养基上培养3 d,观察细菌个体特征,其酵母的菌落形态及特征见表1。由表1可知,其中疑似为酵母菌的菌株分别编号为Y1~Y10。据形态特征和MRS固体培养基有醇香味,可初步判定菌株Y2、Y6、Y8、Y10为产酒精酵母菌,菌株Y1、Y4、Y7的MRS培养基变为黄色,可初步判定菌株Y1、Y4、Y7为产酸酵母菌,菌株Y3在豆芽汁培养基为红色,疑似红酵母菌。

表1 酵母菌的菌落形态特征Table 1 Colony morphology characteristics of yeast
2.2 生理生化鉴定

表2 酵母菌生理生化特征Table 2 Physiological and biochemical characteristics of yeast
由表2可知,碳源同化实验中菌株Y6、Y8、Y10不能同化乳糖,葡糖糖、麦芽糖、D-半乳糖、蔗糖、乙醇、肌醇均能被同化,氮源同化实验中菌株Y1、Y7不同化乙胺,硝酸钾、亚硝酸盐、肌酸均能被同化,菌株Y8、Y10不同化肌酸,硝酸钾、亚硝酸盐、乙胺均能被同化,菌株Y2、Y4、Y5不同化硝酸钾,乙胺、亚硝酸盐、肌酸均能被同化。菌株Y1可同化生类淀粉,菌株Y4、Y5、Y6、Y7、Y8、Y9、Y10能耐50%葡萄糖的高渗透压,在60%葡萄糖的高渗透压及37℃条件下10株菌都不生长,菌株Y3、Y4、Y8、Y10脲酶试验呈阳性。在实验中还发现菌株Y9生出菌膜,菌株Y3能同化多种糖类而不能发酵酒精,初步鉴定菌株Y3为红酵母(Rhodotorula),菌株Y2、Y4、Y5为假丝酵母(Candida),菌株Y6为卡尔斯伯酵母(Saccharomycescarlsberyensis),菌株Y9为球拟酵母(Torulopsis)。
综合以上实验,菌株Y1、Y7鉴定为产酸酵母,菌株Y8、Y10鉴定为产酒精酵母,从实验室存有的产酸酵母和产酒酵母菌中分别挑选Y11、Y12用作对比开展以下实验。
2.3 酵母菌的性能测定
2.3.1 产酸及产酒精酵母菌最适生长温度的测定
6株菌株(Y1、Y7、Y8、Y10、Y11、Y12)经活化后,在青稞培养基接种1%(V/V),在26℃、28℃、30℃、32℃、34℃培养24 h,测其OD660nm值,结果见图1。

图1 酵母菌最适生长温度的测定Fig.1 Determination of optimum growth temperature of yeast
由图1可知,菌株Y1、Y7和Y11的OD660nm值在26~32℃范围内逐渐增大,在32~34℃范围内逐渐变小;Y10、Y12的OD660nm值在26~30℃范围内逐渐增大,在30~34℃范围内逐渐变小;Y8的OD660nm值在26~28℃范围内随温度增加而增大,在30~34℃逐渐变小。结果表明,菌株Y1、Y7和Y11的最适生长温度为32℃,菌株Y10、Y12的最适生长温度为30℃;菌株Y8的最适生长温度为28℃。
2.3.2 产酸及产酒精酵母菌最适pH的生长测定
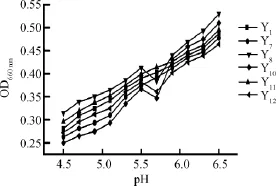
图2 酵母菌最适生长pH的测定Fig.2 Determination of optimum growth pH of yeast
6株菌株(Y1、Y7、Y8、Y10、Y11、Y12)经活化后,在pH 4.5、4.7、4.9、5.1、5.3、5.5、5.7、5.9、6.1、6.3、6.5青稞培养基接种1%(V/V),在各自最适温度培养24 h,测其OD660nm值,结果见图2。
由图2可知,菌株在相同pH范围内OD660nm值的变化幅度不尽相同,菌株在pH4.5时收到明显的抑制,OD660nm值在pH4.5~6.5范围内与pH值成正比。菌株Y8、Y10和Y12的OD660nm值在pH4.5~5.5、5.7~6.5随pH值增大而增大,在5.5~5.7内出现OD660nm值降低的现象,但总体呈现增大趋势。因此,最适生长pH均值为6.5。
2.3.3 温度对酵母菌产酸和产酒精能力的影响
6株菌株(Y1、Y7、Y8、Y10、Y11、Y12)经活化后,在pH6.5青稞培养基接种1%(V/V),在28℃、30℃、32℃、34℃培养24h,测定菌株Y1、Y7、Y11培养液的pH值,在26℃、28℃、30℃、32℃培养24h,测定菌株Y8、Y10、Y12培养液的酒精度,结果见图3。
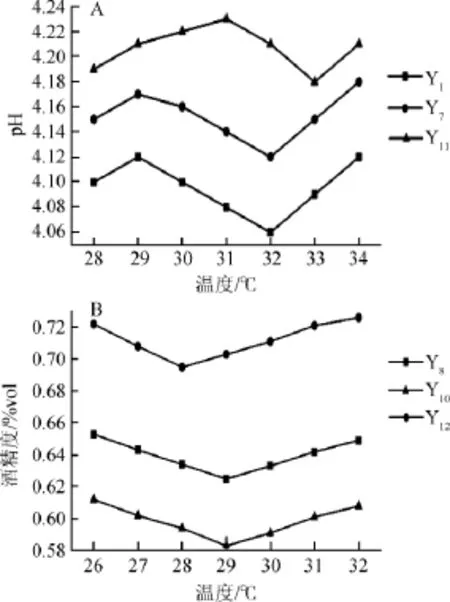
图3 温度对酵母菌产酸(A)及产酒(B)能力的影响Fig.3 Effect of temperature on acid-producing(A)and alcoholproducing(B)capacity of yeast
由图3A可知,菌株Y1在32℃,最低pH 4.06;菌株Y7在32℃,最低pH4.12,菌株Y11在33℃,最低pH4.18。菌株Y1产酸最强,菌株Y7次之、菌株Y11最弱,菌株Y1、Y7产酸最适温度为32℃,菌株Y11产酸最适温度为33℃。
由图3B可知,菌株Y8和Y10,在26~29℃,随温度的增加,酒精度减少,在29~32℃,随温度的增加,酒精度增加。菌株Y12在26~28℃随温度的增加,酒精度减少,在28~32℃,随温度的增加,酒精度增加。菌株Y8在26℃,酒精度最高为0.652%vol;菌株Y10在26℃,酒精度最高为0.622%vol;菌株Y12在32℃,酒精度最高为0.721%vol。菌株Y8和Y10产酒精最适温度为26℃,菌株Y12产酒精最适温度为32℃。
2.3.4 pH对酵母菌产酸和产酒精能力的影响
6株菌株(Y1、Y7、Y8、Y10、Y11、Y12)经活化后,在pH 6.2、6.4、6.6、6.8、7.0青稞培养基接种1%(V/V),在各自产酸、产酒精的最适温度培养24h,测定pH值、酒精度,结果见图4。

图4 pH值对酵母菌产酸(A)及产酒(B)能力的影响Fig.4 Effect of pH on acid-producing(A)and alcohol-producing(B) capacity of yeast
由图4A可知,菌株Y1、Y7、Y11在pH6.2~7.0时,pH值减小,其有效酸度在逐渐增大,3株菌的最适产酸pH值为7.0。由图4B可知,菌株Y8在pH6.2~6.6时,酒精度随pH值的增加呈下降趋势,pH6.6~7.0时,酒精度比较稳定,其酒精发酵最适pH值为6.2;菌株Y10在pH6.2~6.4时,酒精度随pH值的增加呈下降趋势,在pH6.4~7.0时,酒精度随pH值的增加而增加,其酒精度较稳定,其酒精发酵最适pH值为6.2;菌株Y12在pH6.2~6.4时,酒精度随pH值的增加呈下降趋势,再pH6.4~7.0时,酒精度比较稳定,其酒精发酵最适pH值为6.4。
2.3.5 产酸及产酒酵母的耐受性
6株菌株(Y1、Y7、Y8、Y10、Y11、Y12)经活化后,青稞培养基接种1%(V/V),在各自产酸、产酒精的最适温度及pH值培养24 h,测定OD660nm值,结果见图5。
由图5A可知,菌株pH值与OD660nm成正比,说明在酸度较强的环境下,酵母菌的的生长都受到了抑制。由图5B可知,随酒精度的增加菌株生长受到抑制,虽然菌株的耐受力各有不同,但都呈现下降的趋势,当酒精度为9%vol时菌株的代谢活动受到明显的抑制,产酒酵母相对酒精的耐受力更强。
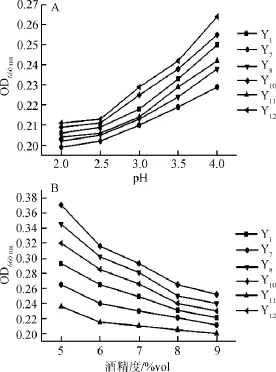
图5 pH(A)及酒精度(B)对酵母菌的生长的影响Fig.5 Effect of pH(A)and alcohol content(B)on yeast growth
2.3.6 酵母菌的产酸、产酒能力测定
6株菌株(Y1、Y7、Y8、Y10、Y11、Y12)经活化后,青稞培养基接种1%(V/V),在各自产酸、产酒精的最适温度及pH值培养96 h,分别测定其乳酸含量及酒精度,结果见图6。

图6 酵母菌产酸、产酒能力比较Fig.6 Comparison of acid-producing and alcohol-producing capacity of yeast
由图6可知,菌株Y1产酸能力最强(145 μg/mL),菌株Y7产酸能力次之(129 μg/mL),菌株Y11产酸能力最弱(83 μg/mL)。菌株Y10、Y78、Y12的产酒精度分别为2.84%vol、2.31%vol、2.25%vol,菌株Y10产酸能力最强,菌株Y8产酸能力次之,菌株Y12产酸能力最弱。
3 结论
本实验从青稞中分离出产酸酵母Y1、Y7,其中菌株Y1产酸量为145 μg/mL,菌株Y7产酸量为129 μg/mL;分离得到产酒酵母Y8、Y10,其中菌株Y8酒精度为2.31%vol,菌株Y10酒精度为2.84%vol。菌株Y1、Y7、Y8、Y10具有纯种液态发酵青稞酒的应用前景。
本实验虽然没有对菌种进行分子水平上的鉴定,但筛选的菌种具有发酵青稞就得优良性质,目前市场上销售青稞酒的酒精度>1%vol和>3%vol两种类型,酸度并没有标注,菌株Y1、Y7、Y8、Y10对单一发酵或者是混合发酵都是较大的进步,为下一步发酵优质青稞酒奠定基础。
[1]申瑞玲,绍舒,董吉林.萌动青稞的研究进展[J].粮油食品科技,2015,23(3):23-24.
[2]KENDALL C W C,ESFAHANI A,JENKINS D J A.The link between dietaryfibreandhumanhealth[J].Food Hydrocolloid,2010,24(1):42-48.
[3]ZHAO Z H,MOGHADASIAN M H.Chemistry,natural sources,dietary intake and pharmacokinetic properties of ferulic acid:A review[J].Food Chem,2008,109(4):691-702.
[4]杨文宇,江春艳,严冬,等.以青稞β-葡聚糖为主要基质的保健果冻的研制[J].食品科学,2012,33(4):296-300.
[5]马得泉.西藏野生大麦种质资源品质评价[J].西南农业学报,2000,13(1):216-265.
[6]刘新红,杨希娟,吴昆仑,等.青稞品质特性及加工利用现状分析[J].粮食工程技术,2013(5):49-53
[7]杜木英,伍怡郦,阚建全,等.传统发酵青稞酒发酵过程中化学成分动态变化的研究[J].食品工业科技,2007,28(9):94-97.
[8]牛放.藏民族与青稞酒[J].中国西部,2006(2):152-155.
[9]孙晗,王有智.利用巴氏灭菌法解决西藏民间酿制青稞酒的变酸问题[J].中国酿造,2011,30(5):63-66.
[10]LURTON L,SNAKKERS G,ROULLAND C,et al.Influence of the fermentation yeast strain on the composition of wine spirits[J].J Sci Food Agr,1995,67(4):485-491.
[11]LAMBRECHTS M G,PRETORIUS I S.Yeast and its importance to wine aroma:a review[J].South Afr J Enol Viticult,2000,21(1):97-129.
[12]马长中,辜雪冬,罗章.乳酸菌发酵青稞饮料的研制[J].内江科技,2011,32(11):102-103.
[13]唐明礼,王勃,马涛,等.煎饼发酵面糊中优势菌种的筛选与鉴定[J].食品科学,2015,36(17):208-211.
[14]郝瑶,王陶,李文,等.富硒猕猴桃果酒酵母的筛选及鉴定[J].食品科学,2014,35(21):176-121.
[15]温洪宇,史进,王璐.发酵醋醅酵母菌的分离、生长特性及分子鉴定[J].中国酿造,2013,32(2):49-50.
[16]岑涛,岳田利,袁亚宏,等.云南芒果中酵母菌分离鉴定及在芒果酒发酵中的应用[J].食品科学,2015,36(11):120-121.
[17]黄秀梨,辛明秀.微生物学实验指导[M].北京:高等教育出版社,2008:87-90.
[18]虞精明,谢勤关,杨凤华.酒中乙醇含量检测方法[J].中国卫生检验杂志,2008,18(9):1930-1932.
[19]杨江威,王越,安家彦.对羟基联苯比色法测定葡萄酒发酵过程中的乳酸[J].大连工业大学学报,2012(6):402-404.
Separation,identification and performance determination of yeast from barley wine starters in Linzhi
MA Bin,SUI Chao,MA Changzhong*
(College of Food Science,Tibet Agricultural and Animal Husbandry College,Linzhi 860000,China)
Using the barley wine starters from Bayi town,Linzhi,Tibet as simple,the acid-producing and alcohol-producing yeasts in barley wine starters were separated and identified,and their performances were determined.The results showed that the strains Y1and Y7were urease-negative bacteria,could make the MRS medium turn yellow and take advantage of a variety of carbon and nitrogen sources.The strains Y8and Y10were urease-positive bacteria,could ferment a variety of sugars.According to the individual morphology,colony characteristics,physiological and biochemical characteristics,the strains Y1and Y7were preliminarily identified as acid-producing yeast,strains Y8and Y10were preliminarily identified as alcohol-producing yeasts.The effects of different conditions on the acid-producing and alcohol-producing capacity of yeasts and their tolerance were researched,the fermentation performance of the acid-producing and alcohol-producing yeasts were analyzed.The acid productions of strains Y1and Y7were 145.06 μg/ml and 128.59 μg/ml,respectively.The alcohol contents of strains Y8and Y10were 2.84%vol and 2.31%vol,respectively.
barley wine starters;yeast;separation;identification;performance determination
TS261.11
0254-5071(2017)02-0080-05
10.11882/j.issn.0254-5071.2017.02.017
2016-11-08
西藏野生特色生物资源开发平台资助项目(Kypt2014-04);西藏自治区大学生创新创项目
马斌(1993-),男,本科生,研究方向为农产品加工与贮藏。
*通讯作者:马长中(1975-),男,副教授,硕士,研究方向为高原特色农畜产品加工及贮藏。

