酶解法提取银杏叶多糖的初步研究*
张 琳,张 彦,仙 靓,张 寒,丁淑梅,汪兴军,申旭霁,刘文斌
(1.西安市中心医院,陕西 西安 710003;2.西安医学院 药学院,陕西 西安 710021;3.西安交通大学 药学院,陕西 西安 710065)
银杏叶为银杏科植物银杏(GinkgobilobaL.)的干燥叶,主要活性成分较为复杂,主要含有黄酮类、银杏内酯,此外还有银杏叶多糖、银杏酸、聚戊烯醇及微量元素等。其中,银杏叶多糖是一种重要的生物活性物质,具有降血糖[1]、抗肿瘤[2]等多种作用。虽有银杏多糖的提取研究报道,但通过酶解法来提取银杏多糖的研究较少见。作者比较传统水提法与酶解法提取银杏多糖的提取效率,考察酶解法提取银杏多糖的可行性。
1 实验部分
1.1 试剂与仪器
银杏叶:采自西安医学院未央校园,由生药教研室汪兴军老师鉴定为GinkgobilobaL.;D-无水葡萄糖:上海雅吉生物科技有限公司;浓硫酸:分析纯,西陇化工有限公司;蒽酮:分析纯,上海科丰化学试剂有限公司;乙醚:分析纯,利安隆博平医药化学有限公司;氯仿:分析纯,成都市科化化工试剂厂;正丁醇:分析纯,广东省化学试剂工程技术研究开发中心;纤维素酶:成都艾科达化学试剂有限公司。
高速万能粉碎机:FW100D-FW-1000AD,天津鑫博得仪器有限公司;电子天平:BSA224S,赛多斯科学仪器有限公司;电热恒温水浴锅:DZKW-S-6,北京市永光明仪器厂;循环水真空泵:SHZ-D,巩义市予华仪器有限公司;干燥箱:101-1,上海市实验仪器总厂;紫外可见分光光度仪:UV-160A,日本岛津有限公司;变换红外光谱仪:TENSOR27,德国布鲁克。
1.2 实验方法
1.2.1 试剂配制
葡萄糖标准溶液的配制:取葡萄糖标准品约0.025 0 g,精密称定,溶解并定容于250 mL容量瓶中。
蒽酮-浓硫酸:取蒽酮约0.2 g,精密称定,溶解于5 mL乙醇中,再于100 mL容量瓶中以质量分数75%硫酸定容至刻度,摇匀。
醋酸-醋酸钠缓冲溶液的配制(pH=4.5):取醋酸钠约1.8 g,精密称定,置于100 mL容量瓶中,量取0.98 mL冰醋酸,用蒸馏水定容至刻度。
Sevag试剂的配制:量取氯仿40 mL,正丁醇8 mL,混匀。
碘-碘化钾的配制:取碘化钾约0.8 g,精密称定,置于烧杯中,加入2 mL水溶解,再精确称取碘0.1 g加入,待全部溶解,移至10 mL容量瓶中,定容至刻度。
淀粉指示液的配制:取淀粉约0.5 g,精密称定,用20 mL水溶解,量取80 mL水在电热套上加热至沸腾,加入淀粉液,至沸取出,冷却。
1.2.2 银杏叶中多糖的提取
1.2.2.1 不同提取方法提取多糖
将200 g银杏叶洗净、晒干、粉粹、50 ℃干燥备用。
酶法:称取银杏叶粉10 g,放置于250 mL烧瓶中,加蒸馏水150 mL,50 ℃恒温振荡2 h,加入纤维素酶0.05 g,用醋酸-醋酸钠缓冲溶液调节pH≈4.5,50 ℃水浴酶解50 min,抽滤,药渣加入50 mL蒸馏水,水浴提取2.5 h,抽滤,合并提取液[3-4]。
水提法:称取银杏叶粉10 g,放置于250 mL烧瓶中,加蒸馏水150 mL,50 ℃恒温振荡2 h,继续在50 ℃水浴提取50 min,抽滤,药渣加入50 mL蒸馏水,水浴提取2.5 h,抽滤,合并提取液。
1.2.2.2 除脂溶性杂质[5]
银杏叶提取液中加入10 mL乙醚,振荡10 min,置于分液漏斗中静置分液,收集下层的多糖溶液。
1.2.2.3 除蛋白质[6]
使用Sevag法,将脱脂后的银杏叶提取液与Sevag试剂以体积比3∶1 混合,充分振荡20 min,置于分液漏斗中静置分液,取上层溶液,得银杏叶多糖提取液。
1.2.2.4 乙醇沉淀多糖[7]
在装有多糖溶液的烧杯中加入3倍体积的质量分数95%乙醇,静置12 h;将沉淀后的多糖进行干燥,获得银杏叶多糖粗品。
2 结果与讨论
2.1 多糖粗品提取量比较
平行操作三次,比较提取量,结果见表1。
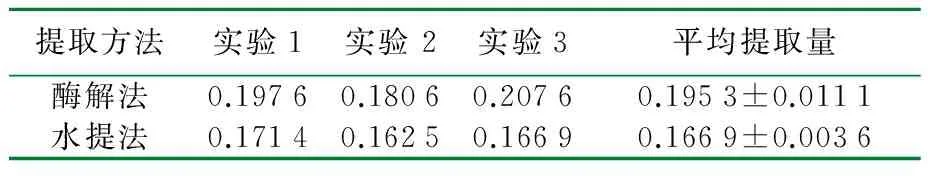
表1 不同方法提取银杏叶多糖提取量比较 g
由表1可知,酶解法的平均提取量高于传统的水解法。
2.2 银杏叶w(多糖粗品)的测定
2.2.1 葡萄糖标准曲线的绘制
移取0.00、0.40、0.80、1.20、1.60、2.00 mL葡萄糖标准溶液于10 mL容量瓶中,分别加蒸馏水至2 mL,再加入蒽酮-浓硫酸试剂8 mL充分混匀,于100 ℃恒温水浴锅中保温10 min,室温冷却,在620 nm波长下测吸光度,以吸光度A对葡萄糖质量浓度ρ绘制标准曲线,进行线性回归,得标准曲线方程见图1。
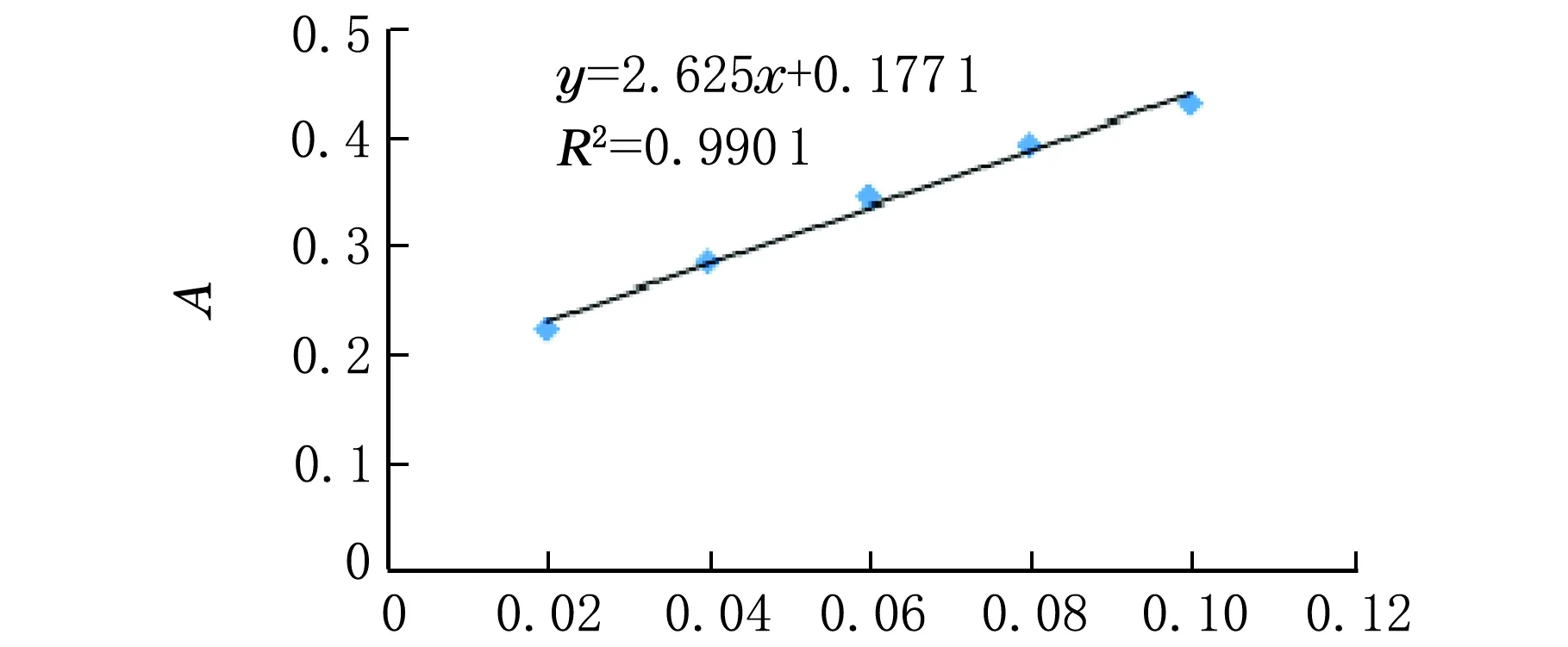
ρ/(mg·mL-1)图1 葡萄糖标准曲线
2.2.2w(多糖)测定[8]
取银杏叶多糖粗品约15 mg,精密称定,于50 mL容量瓶中,用蒸馏水溶解并定容至刻度。将溶液过滤,弃去初滤液,取续滤液1.5 mL,加入水0.5 mL,再加入蒽酮-浓硫酸试剂8 mL充分混匀,于100 ℃ 恒温水浴锅中保温10 min,室温冷却,用紫外可见分光光度计在620 nm波长下测吸光度,平行三次,计算平均w(多糖),结果见表2。
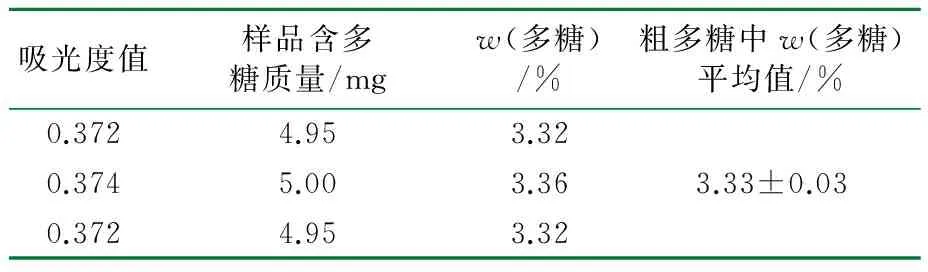
表2 银杏叶w(多糖)
由表2可知,银杏叶粗提物中平均w(多糖)为3.33%。
2.3 酶解法提取的银杏叶多糖产品分析
2.3.1 理化性质
干燥后的银杏叶多糖为灰白色粉末,水溶性较好,难溶于乙醇等有机试剂。
2.3.2 淀粉的碘反应[9]
将多糖配制成质量分数5%的溶液,取多糖指示液上清液和质量分数5%的多糖溶液各5 mL,加入碘-碘化钾0.2 mL,水浴加热5 min,观察颜色变化。银杏叶多糖溶液的碘-碘化钾反应呈阴性,表明银杏叶多糖不含淀粉。
2.3.3 银杏叶多糖红外光谱分析
将多糖与溴化钾烘干,取多糖2 mg与100 mg的溴化钾研磨,压片,在400~4 000 cm-1用红外光谱仪器进行扫描,红外色谱图见图2。

σ/ cm-1图2 银杏叶多糖红外吸收光谱

3 结 论

[1] 陈群,刘天骄.银杏叶多糖的抗肿瘤和免疫调节作用[J].中药药理与临床,2003(5):18-19.
[2] 夏秀华.银杏叶多糖的分离纯化和降血糖功效研究[D].无锡:江南大学,2006.
[3] 鲍会梅.酶解法提取银耳多糖的工艺及稳定性研究[J].食品研究与开发,2015(11):17-21.
[4] 徐澜,王明华,渠娟娟,等.酶解法提取蒲公英多糖工艺[J].食品研究与开发,2016(5):46-51.
[5] 吉惠杰,杨艳俊,沈启慧,等.超声辅助酶解法提取仙人草多糖的工艺研究[J].粮油食品科技,2017(2):74-77.
[6] 吕凤娇.响应面优化酶解法提取缢蛏多糖的工艺研究[J].泉州师范学院学报,2016(6):16-21.
[7] 刘双双,刘丽芳,朱华旭,等.酶解等4种方法用于中药废弃物资源化研究初探(Ⅰ)——以脉络宁注射液生产中石斛药渣的多糖资源化研究为例[J].中国实验方剂学杂志,2016(22):34-40.
[8] 吴远耀,汪劲松,张新潮,等.酶解法提取紫甘薯多糖及其生物活性研究[J].化学与生物工程,2017(3):49-52.
[9] 刘洋,余冬阳,李美琪,等.响应面法优化大兴安岭金莲花多糖提取工艺研究[J].食品研究与开发,2017(3):46-51.
[10] 王莹,王华,丁宁,等.响应曲面法优化水溶性银杏叶多糖提取工艺[J].江苏农业科学,2015(5):268-270.
[11] 高英,叶小利,李学刚,等.黄精多糖的提取及其对α-葡萄糖苷酶抑制作用[J].中成药,2010(12):2133-2137.
[12] 芦莲,戴余军,李长春.银杏叶多糖提取工艺的研究[J].中国酿造,2012(10):106-108.
[13] 李洪燕,罗浩,刘结容,等.酶解法提取罗汉果多糖的工艺研究[J].食品安全质量检测学报,2015(2):689-694.

