‘金丝小枣’在生长与成熟过程中活性成分及抗氧化活性变化规律研究
丁胜华,王蓉蓉,张菊华,谢秋涛,李高阳,单 杨,*
(1.湖南省农业科学院,湖南省农产品加工研究所,湖南长沙 410125;2.湖南农业大学食品科技学院,湖南长沙 410128)
‘金丝小枣’在生长与成熟过程中活性成分及抗氧化活性变化规律研究
丁胜华1,王蓉蓉2,*,张菊华1,谢秋涛1,李高阳1,单 杨1,*
(1.湖南省农业科学院,湖南省农产品加工研究所,湖南长沙 410125;2.湖南农业大学食品科技学院,湖南长沙 410128)
本文以6个不同生长与成熟期(S1~S6)的‘金丝小枣’为研究对象,通过高效液相色谱测定分析了枣果中的维生素C、酚类物质、环核苷酸、三萜酸、α-生育酚和β-胡萝卜素,同时采用分光光度计法测定了其在不同生长与成熟期的总酚、总黄酮含量以及枣果抗氧化活性。研究结果表明:随着枣果的生长成熟:其总酚、总黄酮、α-生育酚和β-胡萝卜素以及FRAP值、清除DPPH·以及ABTS+·自由基能力均呈现下降趋势;儿茶素和表儿茶素是枣果在生长与成熟过程中主要酚类物质。三萜酸含量在枣果的S3~S4期时最高,而cAMP和cGMP则随着枣果的生长成熟逐渐积累。
枣果,多酚,环核苷酸,三萜酸,生长成熟期
枣果营养价值高且具有多种功效,是一种天然的药食两用食品。研究表明:枣果中含有多糖、酚酸、黄酮、萜类化合物、核苷、核苷碱基、生物碱、胡萝卜素、α-生育酚、维生素C、挥发油类化合物等功能成分,并具有抗癌、抗氧化、抗炎、护肝、提高免疫活性、保护肠道活性等功效[1]。
果实的生长成熟对其品质特性的形成起着非常重要的作用。随着果实的生长成熟,果实发生着非常复杂的物理、生化反应,如糖酸的积累、果胶的水解、次生代谢物的转化等。枣果因其含有多种活性成分而呈现多重生物功效,关于枣果果实中活性成分在生长成熟过程如何发生变化引起了较多关注。焦中高等[2]发现梨枣中含有没食子酸、原儿茶酸、绿原酸、咖啡酸和肉桂酸,随着梨枣成熟,没食子酸含量大幅降低,原儿茶酸、绿原酸和肉桂酸含量上升。Siriamornpun等[3]比较了两个成熟期枣果中不同部位的酚酸组成与含量,共检出7种酚酸,包括没食子酸、原儿茶酸、对羟基苯甲酸、p-香豆酸、阿魏酸、丁香酸、芥子酸,其中,两种成熟期枣果果核中的没食子酸与原儿茶酸含量均高于果肉。刘杰超等[4]研究了不同品种枣果实发育过程中多酚类物质、维生素C含量的变化及其抗氧化活性。结果表明,供试各品种枣果实中总酚、总黄酮、维生素C含量和氧化活性均在幼果期为最高,其后随着果实的发育呈现逐渐下降的趋势;儿茶素、表儿茶素和芦丁是供试各品种枣果实中最主要的酚类物质,这些酚类物质在枣果实发育过程中也呈现下降趋势,但在不同品种间存在较大差异。‘金丝小枣’作为一种鲜食加工兼用的优良品种,也因其种植适应性强,在我国黄河流域多有种植。但关于 ‘金丝小枣’的抗氧化特性、多酚、三萜酸、α-生育酚、β-胡萝卜素等的在生长成熟过程中的变化还鲜见报道。因此本文以不同生长成熟期的‘金丝小枣’为研究对象,系统研究其在生长成熟过程中的多酚、维生素C、三萜酸、α-生育酚、β-胡萝卜素、环核苷酸含量以及抗氧化能力的动态变化规律,旨在为‘金丝小枣’的最佳加工采收期及其资源的高效利用提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料 不同生长成熟期的‘金丝小枣’于2013年6月下旬到9月下旬到北京市门头沟区王龙口村枣园采收。从枣树盛花期开始采集枣果样品,每隔15~18 d采集样品,每批次约5 kg,经分级挑选,选择大小均一,色泽基本一致、无机械伤、无病害和无裂纹的枣果作为该批次的样品,一共采集6个批次,按照枣果大小与果皮色泽分为6个生长成熟期,记为S1、S2、S3、S4、S5和S6期枣果,如图1。

图1 不同生长成熟期‘金丝小枣’外观Fig.1 Appearance changes of jujube fruits cv. ‘Jinsixiaozao’from different growth stages
色谱纯乙腈、甲醇、正己烷、四氢呋喃 购自MREDA公司;色谱纯甲酸 购自Sigma-Aldrich公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH·)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox);2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、维生素C、cAMP、cGMP、α-生育酚标准品购自Sigma-Aldrich上海贸易有限公司;没食子酸、香草酸、丁香酸、儿茶素、表儿茶素、芦丁、β-胡萝卜素、齐墩果酸、熊果酸和桦木酸标准品 购自成都曼斯特公司,其余分析纯试剂 购自北京化学试剂厂。
1.1.2 主要仪器与设备 万分之一分析天平(BT 124S) SARTORIUS公司;超纯水仪器(ELGA) Veolia Water Solutions & Technologies公司;超低温冰箱 海尔公司;pH计(PB-10) SARTORIUS公司;恒温水浴锅(HH.S11-4) 北京长安仪器厂;紫外分光光度计(T6) 北京普析通用有限责任公司;高效液相色谱(LC-20A) 日本SHIMADUZU公司;高效液相色谱(2695) 美国WATERS公司;冷冻干燥机(LGJ-25C) 北京四环科学仪器厂;高速冷冻离心机(CR21GIII) 日本HITACHI公司;旋转蒸发器(R501) 上海申顺生物科技有限公司;超声波清洗机(KQ-250DE) 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 维生素C含量的测定 取去核切碎的样品10 g加入100 mL 2.5%的偏磷酸溶液匀浆,于4 ℃浸提2 h,在4 ℃下以9000×g离心15 min,收集上清液,定容,采用HPLC的方法测定维生素C(VC)含量[5]。以同样的方法绘制标准曲线:y=104822.6x+269521.8,R2=0.998,枣果VC的含量以mg/100 g鲜重计(mg/100 g FW)。
1.2.2 总酚和总黄酮的测定 总酚(TPs)和总黄酮(TFs)提取液的制备[6]:取20个枣果,去核切碎,取其中部分于冰温研磨至匀浆,准确称取匀浆样品6.0 g,置于50 mL离心管中,加入80%甲醇水溶液25 mL,常温超声辅助提取30 min,4 ℃以10000×g离心10 min,收集上清液,滤渣以同样条件重复提取2次,合并上清液,用80%甲醇定容至100 mL,备用。
TPs的测定:采用Folin-Ciocalteu比色法[6]。准确取各提取液0.4 mL,分别加入稀释10倍的Folin酚试剂2.0 mL,混匀,加入质量分数为10%的Na2CO3溶液3.0 mL,混合均匀。常温下避光反应2 h后,以80%甲醇做空白对照,于765 nm波长处测定其吸光值,以没食子酸为标准物质绘制标准曲线,y=0.0071x+0.0199,R2=0.997,枣果中TPs的含量以100 g鲜重样品中含有相当没食子酸的毫克数表示(mg GAE/100 g FW)。
TFs的测定:采用NaNO2-Al(NO3)3-NaOH方法测定[6]:取2 mL提取液转至10 mL离心管,加入0.2 mL 5% NaNO2溶液,摇匀,常温下反应6 min,加入0.2 mL 10% Al(NO3)3溶液,常温下反应6 min,加入4% NaOH溶液2 mL,常温下反应15 min,蒸馏水定容至5 mL。以甲醇为对照,测定在510 nm处的吸光值。以芦丁为标准物质,按上述方法绘制标准曲线,y=1.1635x-0.0179,R2=0.999,样品中的TFs含量以100 g鲜重样品含毫克芦丁当量表示(mg RE/100 g FW)。

表1 酚类物质浓度与HPLC响应值之间的线性关系Table 1 Correlation between phenolic compounds concentration and their HPLC responses
1.2.3 酚类物质的测定 酚类物质的提取及含量的测定:按照Wang等[6]的方法采用HPLC并做修改。流动相A:0.5%甲酸水溶液,流动相B乙腈;洗脱条件:0~5 min 95%A、5~30 min 95%~85%A、30~44 min 85%~76% A、44~50 min 76%~30% A、50~70 min 30%~10% A、70~75 min 10%~95%。流速为0.8 mL/min,检测波长为280 nm,进样量20 μL,柱温为30 ℃。标准曲线绘制:准确称取10 mg的标准品,溶解于80%甲醇溶液中,定容至10 mL,作为母液。将母液根据实际需要稀释成不同浓度,绘制标准曲线。六种酚类物质的保留时间、标准曲线、线性范围以及决定系数(R2)如表1,样品中的酚类物质含量以每100 g鲜重中所含毫克数计(mg/100 g FW)。
1.2.4 抗氧化能力测定 抗氧化提取液的制备:同1.2.2中TPs和TFs的制备方法。清除DPPH·能力测定[6]:采用分光光度计进行样品测定,取400 μL的提取液加入3.5 mL DPPH·溶液,混匀后于室温下避光静置30 min,测定其在517 nm处的吸光值。以不加样品的DPPH·溶液做对照。以Trolox作为标准物质,分别取400 μL与DPPH·溶液在相同条件下反应,测定吸光值,计算清除率,绘制标准曲线。样品中清除DPPH·的能力以每100 g鲜重样品中Trolox的毫克当量数表示(mmol Trolox. eq/100 g FW)。
清除ABTS+·能力测定采用分光光度法[6]。将ABTS溶解于20 mmol/L、pH4.5的醋酸盐缓冲液中得到7 mmol/L的ABTS+·贮液,取5 mL 7 mmol/L的ABTS+·与5 mL 2.45 mmol/L过硫酸钾溶液混合,在室温下避光反应12~16 h,使溶液达到稳定的氧化态。测定前用20 mmol/L、pH4.5的醋酸缓冲液按照适当的比例稀释ABTS+·贮液,使溶液在734 nm处吸光度在0.7±0.002,以此得到ABTS+·工作液,该工作液每次测定前现配。取3.6 mL ABTS+·工作液和0.4 mL不同浓度的测试液混合,于暗处反应30 min,以80%甲醇为对照,分别测定734 nm处的吸光值,计算清除率。以Trolox为标准物质,分别取400 μL与3.6 mL ABTS+·工作液在相同条件下反应,测定吸光值,计算清除率,绘制标准曲线,样品中清除ABTS+·的能力以每100 g 鲜重样品中Trolox的毫克当量数表示(mmol Trolox. eq/100 g FW)。
1.2.5 环腺苷酸和环鸟甘酸的测定 cAMP和cGMP的提取:将枣果于匀浆机匀浆,准确称取8.0 g匀浆样品(来自20个枣果),加入50 mL蒸馏水常温下超声辅助提取30 min,于9000×g下离心15 min,收集上清液,滤渣重复提取1次,合并滤液,过0.45 μm的水系滤膜后待测。cAMP和cGMP的测定:采用张岩等[7]的方法。液相条件:HPLC设备为岛津LC-20A型,配备PDA检测器;Hypersil C18色谱柱(250 mm×4.6 mm,5 μm);流动相A,0.02 mol/L KH2PO4,流动相B,甲醇;程序洗脱:0~30 min,0~15% A;30~35 min,15%~0% A;检测波长为254 nm,流速为0.6 mL/min,柱温为30 ℃,进样量为20 μL。
1.2.6 三萜酸的测定 三萜酸的提取和测定参考Guo等的方法[8]并略作修改。不同品种枣果去核、切碎置于超低温冰箱冷冻6 h,然后取出置于冷冻干燥机冷冻干燥42 h,其中冷阱温度为-55 ℃,面板加热温度为25 ℃,绝对压强为10 Pa。经FD的枣片,于研钵碾碎粉,过40目筛,收集枣粉,密封于-20 ℃冰箱备用。取2.0 g样粉,加入45 mL氯仿,常温下UAE 30 min,负压过G4砂芯漏斗,滤渣重新加入45 mL氯仿,重复提取,收集两次上清液,于低压旋转挥干氯仿,加入甲醇溶解,定容至4 mL,过0.45 μm有机滤膜待测。
HPLC条件:Hypersil C18色谱柱(250 mm×4.6 mm,5 μm),流动相A:甲醇;流动相B:0.3%甲酸水溶液,程序洗脱:0~15 min,75%~87% A;15~45 min,87% A;45~50 min,87%~100% A。色谱柱再平衡时间为15 min。流速为0.5 mL/min,柱温为25 ℃。检测器为蒸发光散射检测器(Evaporative Light Scattering Detector,ELSD),漂移管温度为40 ℃,调节空气流速,使得压力稳定在400 kPa,进样量为20 μL。
1.2.7α-生育酚和β-胡萝卜素的测定α-生育酚与β-胡萝卜素的提取和测定参考San和Yildirim的方法[9]并略作修改。2.0 g枣粉(制备过程参考三萜酸方法)加入10 mL正己烷,混匀,震荡,5000×g离心5 min,收集上清液。重复此操作4次,合并上清液,40 ℃蒸干,加入1 mL的流动相溶解。样品收集密封避光至于-20 ℃保存,测定前过0.45 μm有机滤膜。液相条件:HPLC设备为Waters 2695 型,配备二极管阵列检测器(waters,2996),流动相:甲醇/乙腈/四氢呋喃(73∶20∶7,v/v/v),等度洗脱,流速为1.0 mL/min,色谱柱为C30YMC-Carotenoid专用柱(4.6×250 mm,5 μm)。进样量为20 μL,柱温为40 ℃,α-生育酚和β-胡萝卜素的检测波长分别设定为296 nm和450 nm。α-生育酚与β-胡萝卜素含量以每千克干重样品含毫克数表示(mg/kg DW)。
1.3 数据统计与分析
采用Origin 8.0统计分析实验数据,计算标准偏差;数据结果以平均值±标准差表示;并进行单因素方差分析,采用t检验,显著水平p为0.05,当p<0.05时,表示差异显著。枣果的抗氧化能力与抗氧化物质之间的进行相关性分析,相关类型为pearson类型,相关系数显著性进行双尾检验分析,*表示显著相关(p<0.05),**表示差异极显著相关(p<0.01)。
2 结果与讨论
2.1 不同生长成熟期‘金丝小枣’的VC、TPs和TFs的变化
VC是枣果中重要的抗氧化性成分之一,从图2A中可以看出,在‘金丝小枣’生长成熟过程中,枣果中VC含量经历了快速积累与缓慢降解两个过程。从S1~S2期,枣果中VC含量从330.71 mg/100 g FW显著跃升至605.52 mg/100 g FW(p<0.05);此后从S2~S6期,枣果中的VC含量呈现逐渐降解的趋势,其中S6期枣果含量为380.26 mg/100 g FW,显著高于S1期枣果的VC含量(p<0.05)。而Wang等[10]在研究不同生长成熟期的枣果中成分变化时发现VC未经历快速积累的过程,这可能是由于采集成熟期果实的个数太少的缘故(仅4个),没有采集到枣果实中VC快速积累阶段的‘金丝小枣’。
从图2B可知,‘金丝小枣’的生长成熟中,枣果中的TPs和TFs含量呈现相似的变化规律,均随着枣果的生长成熟呈现下降的趋势(p<0.05),TPs与TFs的含量范围分别为525.40~1123.1 mg GA/100 g FW与373.11~2303.00 mg RE/100 g FW。多种果实在生长成熟过程中,其TPs含量均呈现下降趋势。Gruz等[11]发现枸杞在生长成熟过程中,TPs含量和清除DPPH·能力均呈现下降趋势,呈现类似规律的果实还包括枣椰果[12]。
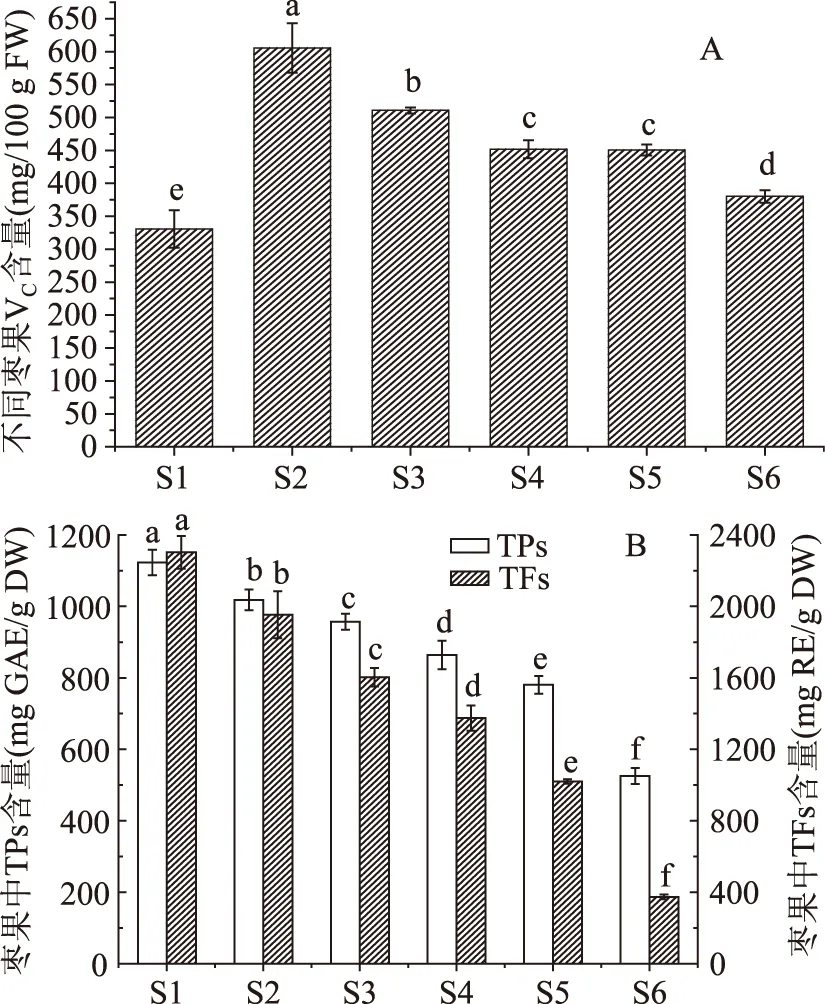
图2 不同生长成熟期枣果VC、TPs和TFs含量的变化Fig.2 Changes of ascorbic acid,TPs and TFs content in jujube fruits cv. ‘Jinsixiaozao’ from different growth stages
2.2 不同生长成熟期‘金丝小枣’抗氧化活性的变化
表2为不同生长成熟期‘金丝小枣’抗氧化活性的变化。从表2可知,随‘金丝小枣’生长成熟,枣果提取液的FRAP值、清除DPPH·以及ABTS+·自由基的能力逐渐下降。其中各生长成熟期‘金丝小枣’清除ABTS+·自由基能力存在显著差异(p<0.05),与S1期相比,S6期降低了39.88%。除S2期与S3期之间,其余生长成熟期的枣果清除DPPH·能力也存在显著差异(p<0.05),与S1期相比,S6期下降了44.26%。类似地,S6期枣果的FRAP值较S1期枣果下降了64.96%。随着‘金丝小枣’生长成熟,其抗氧化能力下降是其抗氧化活性物质变化的体现,包括枣果中的VC、TPs与TFs等。
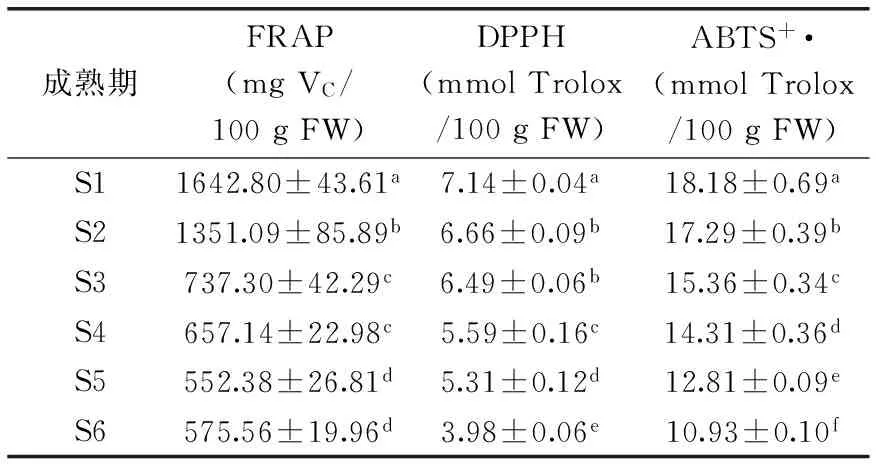
表2 不同生长成熟期‘金丝小枣’抗氧化活性的变化Table 2 Changes antioxidant activities in jujube fruitscv. ‘Jinsixiaozao’ from different growth stages
注:同列进行单因素方差分析多重比较,t检验;表中不同字母表示有显著差异(p<0.05),表3同。
2.3 不同生长成熟期‘金丝小枣’中酚类物质的变化
表3为不同生长成熟期‘金丝小枣’中酚类物质的变化。从表3中可知,各生长成熟期的枣果中,其儿茶素和表儿茶素的含量明显高于其它四种酚类物质的含量。枣果中表儿茶素含量则在S1~S3期呈现迅速显著增加的趋势(p<0.05),并维持在非常高的含量(31.48~48.82 mg/100 g FW),其中S1~S2枣果中的表儿茶素的含量仅次于同样成熟度枣果中儿茶素的含量,S3~S4期枣果中表儿茶素含量则为同样成熟度枣果中含量最高的,是S3~S4期中含量最丰富的酚类物质。从S5到S6期,表儿茶素含量则迅速显著降低(p<0.05),S5期和S6期的表儿茶素含量分别为S3期的34.5%和2.2%。综上分析,儿茶素和表儿茶素在整个枣果成熟过程中代谢非常活跃。儿茶素、咖啡酸、丁香酸和芦丁含量均以S1期枣果最高,表明在盛花期到幼果期合成代谢活跃,而随着‘金丝小枣’的成熟,四种酚类物质均呈现逐渐下降的趋势,S1期枣果中四种酚类物质的含量分别是S6期的相应物质含量13.3、9.1、3.1和4.6倍。香草酸含量在成熟前期S1~S3期出现波动,成熟后期(S4~S6期)则呈现逐渐下降的趋势(p<0.05),其中S3期含量最高,为18.55 mg/100 g FW。果蔬中主要酚类物质的代谢主要涉及到莽草酸途径、苯丙烷代谢途径和类黄酮合成途径。苯丙氨酸解氨酶(PAL)是连接莽草酸途径和苯丙氨酸途径的关键酶。乜兰春[13]报道苹果果实在成熟过程酚类代谢时发现:‘新红星’和‘富士’在7月底前,儿茶素和表儿茶素均呈现迅速下降的趋势,其后‘新红星’保持缓慢下降,而‘富士’则在8月中旬后又有所上升。两种品种苹果中PAL活性在发育前期也呈现迅速下降的趋势,而后又开始缓慢升高。
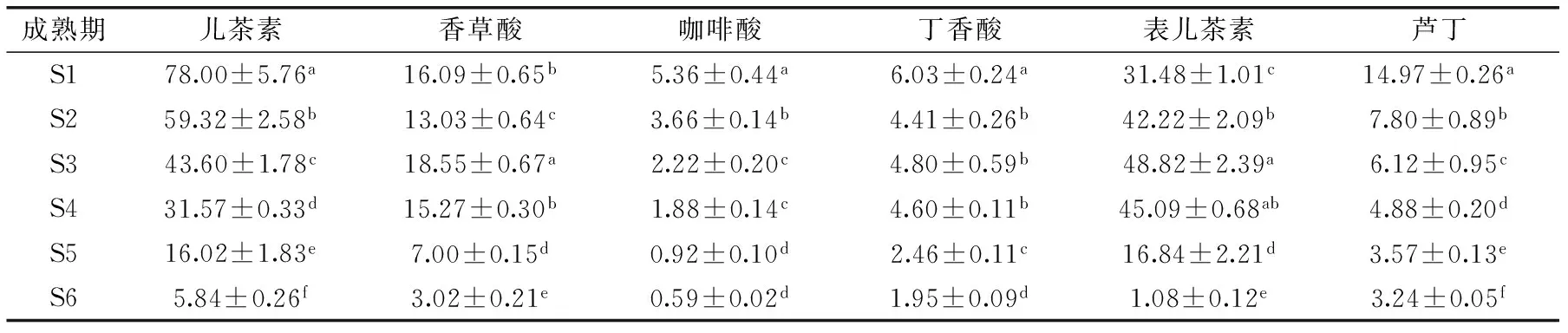
表3 不同生长成熟期‘金丝小枣’酚类物质组分含量变化(mg/100 g FW)Table 3 Changes of phenolic compounds content in jujube fruits cv. ‘Jinsixiaozao’ from various growth stages(mg/100 g FW)

表4 不同生长成熟期‘金丝小枣’的VC、酚类物质与其抗氧化特性(FRAP、DPPH和ABTS)的相关性系数Table 4 Correlation coefficients(r)VC,and antioxidant activity(FRAP,DPPH,and ABTS)of jujube fruits cv ‘Jinsixiaozao’ from various growth stages
注:相关类型为pearson类型,相关系数显著性进行双尾检验分析,*表示显著相关(p<0.05),**表示差异极显著相关(p<0.01)。
2.4 ‘金丝小枣’抗氧化特性与抗氧化成分之间相关性分析
表4为不同生长成熟期‘金丝小枣’的抗氧化性成分与抗氧化特性之间的相关性系数及其显著相关性。从表4可以看出,不同生长成熟期的‘金丝小枣’的FRAP值分别与儿茶素、咖啡酸以及芦丁呈极显著正相关(p<0.01),而与TFs显著正相关(p<0.05);不同生长成熟期‘金丝小枣’清除DPPH·和ABTS+·能力分别与TPs、TFs、儿茶素呈极显著正相关(p<0.01);而与VC、表儿茶素不存在显著相关性(p>0.05);此外,不同生长成熟期‘金丝小枣’清除DPPH·能力还分别与香草酸、咖啡酸以及丁香酸呈现显著正相关(p<0.05);而清除ABTS+·能力则分别与丁香酸以及芦丁呈现显著正相关(p<0.05)。这表明在‘金丝小枣’生长成熟过程中,TPs与TFs是枣果的主要抗氧化物质,其中含量丰富的儿茶酸、丁香酸和芦丁以及含量相对较低的咖啡酸是具体呈现抗氧化特性的酚类物质。已有文献也发现花楸浆果[14]中的TPs与抗氧化特性之间存在极显著相关性,与本文的实验结论相一致。
2.5 不同生长成熟期‘金丝小枣’三萜酸的变化
三萜酸作为枣果中重要的活性成分之一,具有防癌、降血压、降血脂等多种功效作用,本文中采用HPLC-ELSD方法,利用已有三萜酸标准品,对枣果中的三萜酸进行定性定量。对照已有三萜酸的保留时间,从图3中可以看出,六个生长成熟期的‘金丝小枣’枣果均含桦木酸、齐墩果酸和熊果酸,其含量也随之发生变化,且各生长成熟期的枣果均以桦木酸含量最高,齐墩果酸次之,而熊果酸最低。
随着‘金丝小枣’枣果的成熟,桦木酸和齐墩果酸均呈先上升后略微下降的趋势,且枣果中的各三萜酸的含量均在S3期达到最高;而从S3期到S6期,桦木酸和齐墩果酸含量则呈现下降的趋势,其含量分别下降了43.97%和31.56%。枣果中熊果酸含量则随着枣果的成熟呈现先增加后基本保持稳定的趋势,其中以S4期枣果中的熊果酸含量最高,为24.57 mg/100 g DW。王向红等[15]采用高效液相色谱法测定了成熟枣果经自然风干后枣果中的齐墩果酸和熊果酸含量,结果表明,供测枣果中齐墩果酸的含量范围为8.4~22.0 mg/100 g DW,熊果酸含量范围为3.6~23.8 mg/100 g DW。与文献结果相比,成熟‘金丝小枣’中的齐墩果酸含量高于上述文献中的报道含量,而熊果酸含量则在上述文献报道的含量范围内。

图3 不同生长成熟期‘金丝小枣’桦木酸、齐墩果酸和熊果酸含量的变化Fig.3 Betulinic acid,oleanolic acid,and ursolic acid profiles of jujube fruits cv ‘Jinsixiaozao’ from various growth stages
2.6 不同生长成熟期‘金丝小枣’cAMP和cGMP的变化
从图4中可以看出,随着‘金丝小枣’枣果的成熟,其cAMP与cGMP含量均呈现上升的趋势,其中S1、S2期枣果的cAMP和cGMP含量均较低,其含量分别为12.34、14.30 μg/g DW和17.05、22.17 μg/g DW。‘金丝小枣’从S1期生长到S2期,其cAMP含量变化很小,相互间不存在显著差异(p>0.05);而从S2~S6期,其cAMP含量迅速增加,并在S6期达到最大,含量为130.94 μg/g DW,是S1期枣果cAMP含量的10.6倍。类似地,枣果中的cGMP含量也在S6期达到最大值,为150.21 μg/g DW,是S1期枣果cGMP含量的8.8倍;而且各生长成熟期枣果其cGMP含量相互之间存在显著差异(p<0.05)。与文献结果相比,本文‘金丝小枣’成熟过程中其cGMP含量增加的倍数低于比文献报道。Cyong和 Takahashi[16]从枣果中分离纯化出cGMP,并发现枣果成熟过程中,其cGMP含量增加90倍。综上分析,枣果中的cAMP和cGMP在成熟过程中呈现上升趋势,合适的采收期与否关系着枣果中cAMP和cGMP含量的高低。
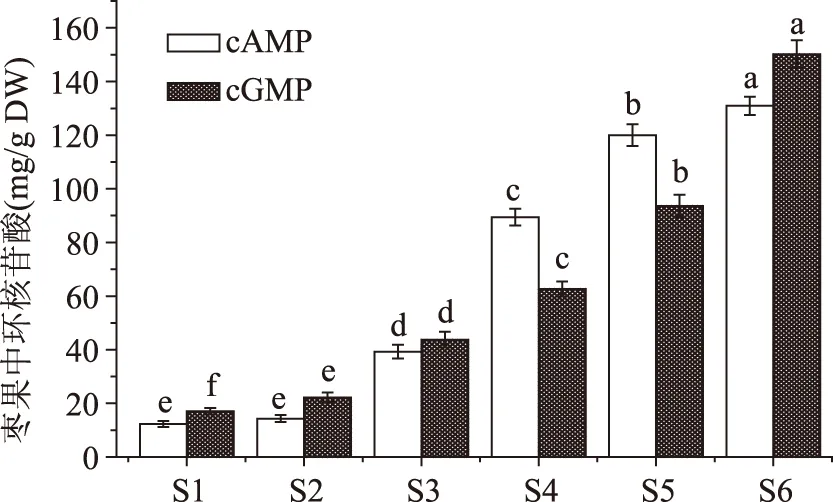
图4 不同生长成熟期‘金丝小枣’cAMP和cGMP含量的变化Fig.4 Changes of cAMP and cGMP contents of jujube fruits cv ‘Jinsixiaozao’ from different developmental stages
2.7 不同生长成熟期‘金丝小枣’α-生育酚、β-胡萝卜素的变化
图5是不同生长成熟期枣果中α-生育酚、β-胡萝卜素含量变化。从图5可以看出,随着‘金丝小枣’的生长成熟,枣果中的β-胡萝卜素含量呈现下降的趋势,从S1~S6期,其含量从65.31 mg/kg降到1.64 mg/kg,且各生长成熟期的β-胡萝卜素含量之间存在显著差异(p<0.05)。Criado等[17]研究了两种橄榄果成熟过程中色素含量的变化,发现总胡萝卜素与β-胡萝卜素含量均呈现下降趋势。α-生育酚在‘金丝小枣’成熟过程中的变化与β-胡萝卜素呈现类似的规律,其中S1、S2期枣果中的α-生育酚含量不存在显著差异(p>0.05),而二者的含量显著高于其余生长成熟期枣果中α-生育酚的含量(p<0.05)。Bouali等[18]在研究坦桑尼亚美洲山核桃在成熟过程时发现其α-生育酚含量整体呈现下降的趋势,但前期迅速下降,后期则差异不显著(p>0.05)。
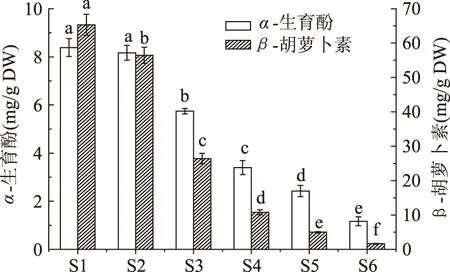
图5 不同生长成熟期‘金丝小枣’α-生育酚和β-胡萝卜素含量的变化Fig.5 Change of α-tocopherol and β-carotene contents of jujube fruits cv ‘Jinsixiaozao’ from different developmental stages
3 结论
‘金丝小枣’生长成熟过程中,枣果中的抗氧化性成分TPs、TFs、VC、α-生育酚和β-胡萝卜素、儿茶素、咖啡酸、丁香酸、芦丁含量降低,枣果的FRAP值、清除DPPH·以及ABTS+·自由基能力均呈下降趋势;儿茶素和表儿茶素是枣果在生长与成熟过程中主要酚类物质,‘金丝小枣’中cAMP和cGMP含量随枣果成熟而增加,而三萜酸含量在枣果的S3~S4期时最高。
[1]丁胜华,王蓉蓉,吴继红,等. 枣果实中生物活性成分与生物活性的研究进展[J]. 现代食品科技,2016,32(5):332-348.
[2]焦中高,刘杰超,周红平,等. 枣果中酚类物质的高效液相色谱分析[J]. 食品与发酵工业,2008,34(4):133-136.
[3]Siriamornpun S,Weerapreeyakul N,Barusrux S. Bioactive compounds and health implications are better for green jujube fruit than for ripe fruit[J]. Journal of Functional Foods,2015,12:246-255.
[4]刘杰超,张春岭,陈大磊,等. 不同品种枣果实发育过程中多酚类物质、VC含量的变化及其抗氧化活性[J]. 食品科学,2015,36(17):94-98.
[5]Liu F,Fu S,Bi X,et al. Physico-chemical and antioxidant properties of four mango(MangiferaindicaL.)cultivars in China[J]. Food Chemistry,2013,138(1):396-405.
[6]Wang R R,Ding S H,Zhao D D,et al. Effect of dehydration methods on antioxidant activities,phenolic contents,cyclic nucleotides,and volatiles of jujube fruits[J]. Food Science andBiotechnology,2016,25(1):137-143
[7]张岩,吕品,王红,等. 高效液相色谱法同时测定浓缩枣汁中环磷酸腺苷和环磷酸鸟苷的含量[J]. 食品科学,2009,30(18):321-322.
[8]Guo S,Duan J,Tang Y,et al. Characterization of triterpenic acids in fruits ofZiziphusspecies by HPLC-ELSD-MS[J]. Journal of Agricultural and Food Chemistry,2010,58(10):6285-6289.
[9]San B,Yildirim A N. Phenolic,alpha-tocopherol,beta-carotene and fatty acid composition of four promising jujube(ZiziphusjujubaMiller)selections[J]. Journal of Food Composition and Analysis,2010,23(7):706-710.
[10]Wang C T,Cheng D,Cao J K,et al. Antioxidant capacity and chemical constituents of Chinese jujube(ZiziphusjujubaMill.)at different ripening stages[J]. Food Science and Biotechnology,2013,22(3):639-644.
[11]Gruz J,Ayza F A,Torun H,et al. Phenolic acid content and radical scavenging activity of extracts from medlar(MespilusgermanicaL.)fruit at different stages of ripening[J]. Food Chemistry,2011,136(1):41-45.
[12]Amira E A,Behija S E,Beligh M,et al. Effects of the ripening stage on phenolic profile,phytochemical composition and antioxidant activity of date palm fruit[J]. Journal of Agricultural and Food Chemistry,2012,60(44):10896-10902.
[13]乜兰春. 苹果果实酚类和挥发性物质含量特征及其与果实品质关系的研究[D]. 保定:河北农业大学,2004.
[14]Hukkanen A T,Pölöene S S,Kärenlampi S O,et al. Antioxidant capacity and phenolic content of sweet rowanberries[J]. Journal of Agricultural and Food Chemistry,2006,54(1):112-119.
[15]王向红,崔同,齐小菊,等. HPLC法测定不同品种枣及酸枣中的齐墩果酸和熊果酸[J]. 食品科学,2002,23(6):137-138.
[16]Cyong J,Takahashi M. Identification of guanosine 3′:5′-monophosphate in the fruit ofZizyphusjujube[J]. Phytochemistry,1982,21(8):1871-1874.
[17]Cordeiro N,Sousa L,Freitas N,et al. Changes in the mesocarp of Annona cherimola Mill. Madeira’ during postharvest ripening[J]. Postharvest Biology and Technology,2013,85:179-184.
[18]Bouali I,Trabelsi H,Abdallah I B,et al. Changes in fatty acid,tocopherol and xanthophyll contents during the development of Tunisian-grown pecan nuts[J]. Journal of the American Oil Chemists’ Society,2013,90(12):1869-1876.
Changes of bioactive compounds and antioxidant capacities of jujube(Zizyphusjujuba)fruit cv ‘Jinsixiaozao’during different growth/ripening stages of growth
DING Sheng-hua1,WANG Rong-rong2,*,ZHANG Ju-hua1,XIE Qiu-tao1,LI Gao-yang1,SHAN Yang1,*
(1.Hunan Agricultural Product Processing Institute,Hunan Academy of Agricultural Sciences,Changsha 410125,China;2.College of Food Science and Technology,Hunan Agricultural University,Changsha 410128,China)
Changes of ascorbic acid,phenolic compounds,cyclic nucleotides;triterpene acids,α-tocopherol,andβ-carotene in jujube fruits during six stages(S1~S6)of growth were analyzed by HPLC and the total phenolics,total flavonoids,and antioxidant capacities were spectrophotometrically investigated. The results showed that the contents of total phenolics,total flavonoids,and the capacities of FRAP,scavenging DPPH· or ABTS+· were decreased as the jujube fruits developed. Catechin and epicatechin were the predominant phenolic compounds in the whole developmental stages. Levels of cAMP and cGMP were accumulated as the fruit developed and triterpene acids maximized their content during S3~S4 stage.
jujube fruit;polyphenolic;cyclic nucleotides;triterpene acid;development
2016-08-19
丁胜华(1985-),男,博士, 助理研究员,主要从事果蔬加工与贮藏研究,E-mail:shhding@hotmail.com。
*通讯作者:王蓉蓉(1985-),女,博士,讲师,主要从事果蔬加工理论与技术研究,E-mail:wrrsdau@163.com。 单杨(1963-),男,博士,研究员,主要从事果蔬加工理论与技术研究,E-mail:sy6302@sohu.com。
国家自然科学基金项目(31501543);湖南特色果品采后贮藏及加工示范关键技术研究与示范(2016NK2182)。
TS255.1
A
:1002-0306(2017)03-0074-07
10.13386/j.issn1002-0306.2017.03.006

