耐高温蛋白酶产生菌的筛选及酶学特性的初步研究
刘唤明,张芷欣,洪鹏志,*,周春霞,杨 萍,陈康健,吴金红
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高校重点实验室,广东湛江 524088;2.广东省水产品深加工及副产物高值化利用工程技术研究中心,湛江恒兴水产科技有限公司,广东湛江 510300)
耐高温蛋白酶产生菌的筛选及酶学特性的初步研究
刘唤明1,张芷欣1,洪鹏志1,*,周春霞1,杨 萍1,陈康健2,吴金红2
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高校重点实验室,广东湛江 524088;2.广东省水产品深加工及副产物高值化利用工程技术研究中心,湛江恒兴水产科技有限公司,广东湛江 510300)
为了提供可用于水产饲料添加剂用途的蛋白酶,从玛珥湖环境中筛选出耐高温蛋白酶产生菌株。通过牛奶平板筛选的方法从土壤中分离获得30株产蛋白酶菌株,并通过摇瓶发酵复筛的方法筛选产酶最高的菌株HL-3,其发酵液的蛋白酶活性高达399.2 U/mL。通过生理生化特征鉴定、16S rDNA基因序列和系统发育分析,初步鉴定菌株HL-3为地衣芽孢杆菌。菌株HL-3所产蛋白酶的最适作用温度为70 ℃,最适pH为7.0,在90 ℃保温10 min 后酶活力仍可保留75.12%。在离子浓度为 1.0×10-3mol/L 时,Cu2+和Mn2+对该酶有较强的抑制作用,Fe2+、Zn2+、Ca2+对该酶有激活作用,Mg2+和K+对该酶活性几乎没有影响。预期该菌株产的蛋白酶具有用于水产饲料添加剂的潜力。
耐高温蛋白酶,地衣芽孢杆菌,玛珥湖
酶制剂可降解饲料中的抗营养因子,提高营养物质的消化利用率,对于高效环保饲料的研制生产具有积极的指导意义。近年来,由于鱼粉资源的紧缺和价格的上涨,植物蛋白源在水产饲料配方的比例逐渐增大。然而与鱼粉相比,植物蛋白源通常具蛋白质消化率低,含有多种抗营养因子等缺点[1],会对动物生长性能产生不利影响。因而,近年来有关水产饲料中饲用酶制剂的研究成为研究热点。研究表明,水产饲料中添加蛋白酶可促进水产动物的生长性能[2-3],特别是在植物蛋白源用量比例大的水产饲料中[2]。目前大多数饲用酶在饲料中多以干粉粒的形式在饲料加工、调制和制粒之前添加,然而饲料制粒是一个高温、高湿过程,绝大多数生物酶的热稳定性很差,在高温制粒时很容易失活[4],因而水产饲料中更需要的是耐高温的蛋白酶。
耐高温蛋白酶具有较好的耐热性,在工业与食品加工方面都有着更为广阔的应用前景,已成为国内外酶研究领域的热点。目前已发现的耐高温蛋白酶生产菌株有嗜热脂肪芽孢杆菌[5]、嗜热芽孢杆菌[6]、荧光假单孢杆菌[7]和苏云金芽孢杆菌[8]等。然而,不同来源的耐高温蛋白酶的酶学特性存在较大的差异[9]。用于不同领域的耐高温蛋白酶对其酶学性质有着不同的要求。尽管目前已发现了许多耐高温蛋白酶产生菌,但其酶学特性适合应用于水产饲料添加剂用途的耐高温蛋白酶产生菌株还尚未有研究报道。
湛江市湖光岩玛珥湖是世界上最大的玛珥湖,它是距今15万年前火山爆发后,火山口洼地积水而成,周围被火山碎屑环包围。目前,已经有从玛珥湖环境中筛选出耐高温微生物的研究报道[10]。本课题组依托地域优势,从湛江湖光岩土壤中筛选出产耐高温蛋白酶的菌株,并对该菌的酶学特性进行研究,为其应用于水产饲料添加剂提供基础资料与技术支持。
1 材料与方法
1.1 材料与仪器
土样 采自湛江市湖光岩风景区玛珥湖附近,用无菌刮铲采集离地面10 cm左右的土样,放在玻璃瓶中于4 ℃保存。
福林酚试剂 购于北京鼎国生物技术发展中心;细菌基因组DNA小量纯化试剂盒 购于碧云天生物技术研究所;脱脂奶粉 购买于内蒙古伊利实业集团股份有限公司;豆粕 购买于中纺粮油(湛江)有限公司。
分离培养基:脱脂奶粉10 g,琼脂2 g,水100 mL,100 ℃灭菌10 min。
斜面培养基:牛肉膏5 g,氯化钠5 g,蛋白胨 10 g,琼脂20 g,蒸馏水1000 mL,pH7.2,121 ℃灭菌20 min。
发酵初筛发酵培养基:豆粕10 g,葡萄糖0.5 g,蒸馏水100 mL,121 ℃灭菌20 min。
SPX-250B生化培养箱 上海博讯实业有限公司;HZQ-F160振荡培养箱 哈尔滨市东联电子技术开发有限公司;CF16RX低温离心机 日本日立公司;LabCycler温度梯度PCR仪 德国SensoQuest;DYY-12电泳仪 北京市六一仪器厂;Multiskan MK3酶标仪 上海精密科学仪器有限公司。
1.2 耐高温蛋白酶产生菌的筛选
称取土样10.0 g,放入250 mL锥形瓶中,加入90 mL无菌水,震荡均匀后于沸水浴煮沸5 min。取蒸煮后的悬浊液进行十倍梯度稀释依次制得10-1~10-55个浓度,从10-3、10-4、10-5这三个梯度中各吸取100 μL稀释液均匀涂布于分离培养基平板,于50 ℃培养箱中培养12 h。观察菌体周围生长圈的大小,记录透明圈直径(D)与菌落直径(d),计算两者的比值,选取D/d较大的菌落菌株转接到斜面培养基保存。将初筛挑选的菌株挑取一环接种至液体发酵培养基中,装液量为30 mL/250 mL,于50 ℃、150 r/min振荡培养6 h后测定发酵液的酶活。
1.3 蛋白酶酶活的测定
蛋白酶酶活力的测定:采用福林(Folin)法,按参照文献[11]进行,用pH4~pH10 的缓冲液,反应温度为50 ℃。酶活单位定义:1 mL酶液在特定条件下每分钟水解酪蛋白溶液生成1 μg酪氨酸所需要的酶量定义为1个酶活力单位U。
1.4 菌种的鉴定
1.4.1 生理生化实验方法 根据《伯杰氏细菌鉴定手册(第九版)》[12]并参考《常见细菌系统鉴定手册》[13]的部分方法对所筛选出的菌株进行鉴定。
1.4.2 16S rDNA序列分析 对三角瓶发酵复筛所得的菌株测定其16S rDNA基因序列以进行菌株鉴定。通过李欣[14]等的方法扩增菌株的16S rDNA,扩增成功的PCR产物送至上海生工公司进行测序,获得的测序结果递交GenBank数据库中Blast比对,进行相似同源性分析,Maximum likelihood法绘制系统发育树,BOOTSTRAP分析法,选取重复1000评估树的准确性。
1.5 酶学特性研究
1.5.1 pH对酶活性的影响 配制pH4.0、5.0、6.0、7.0、8.0、9.0和10.0的缓冲液,以不同pH缓冲液配制0.5%酪蛋白底物,按照上述酶活性测定方法,测定酶液在不同pH条件下的酶活。以酶活力最高时为100%,计算其他条件下的相对酶活力。
1.5.2 温度对酶活性的影响 以最适pH缓冲液配制浓度为0.5%酪蛋白底物,按照酶活性测定方法测定酶液在不同温度下的酶活,以确定酶液的最适反应温度。以酶活力最高时为100%,计算其他条件下的相对酶活力。
1.5.3 酶的热稳定性 各取1 mL酶液分别放入50、60、70、80、90 ℃的水浴锅中保温10 min,然后在最适pH和最适温度下测定酶活性,以未处理酶液的酶活为100%,计算相对酶活。
1.5.4 金属离子对酶活性的影响 按酶活的测定方法,测定终浓度为1.0×10-3mol/L的Fe2+、Mg2+、K+、Mn2+、Cu2+、Zn2+和Ca2+对蛋白酶酶活性的影响,对照反应体系中不加任何化合物,以对照酶活为100%,计算相对酶活。

图1 菌株HL-3的系统发育树Fig.1 The phylogenetic tree of the strain HL-3
1.6 数据统计分析
本文中所有实验均平行3次。所有数据均以平均值(mean)±标准差(SD)表示。运用SAS 8.0软件统计,采用单因素方差分析(ANOVA)进行显著性差异分析(p<0.05)。数据图由Origin 8.0软件完成。
2 结果与分析
2.1 耐高温蛋白酶产生菌株的筛选
从不同土样中分离纯化出30株在筛选培养基上能形成蛋白质水解圈的微生物菌株。选出6株透明圈直径(D)与菌落直径(d)比值大于5的菌株发酵培养16 h后,测定发酵液酶活,见表1。综合D/d值和酶活两个因素,选择HL-3作为出发菌株,进行后续研究。

表1 耐高温蛋白酶产生菌筛选结果Table 1 Result of screening strains producing thermostable protease
2.2 菌种鉴定
2.2.1 生理生化鉴定 菌株HL-3生理生化测定结果如表2所示。由表2结果可知,菌株HL-3的部分生理生化特征为:接触酶实验、厌氧生长、VP实验、葡萄糖产酸、柠檬酸盐利用、丙酸盐利用、硝酸盐还原和7%NaCl耐受实验均为阳性;葡萄糖产气、酪氨酸水解和吲哚实验都为阴性。通过查阅《伯杰氏细菌鉴定手册》,将菌株HL-3初步鉴定为地衣芽孢杆菌。

表2 菌株HL-3的生理生化特征Table 2 Physiological and biochemical characteristics of the strain HL-3
注:“+”为阳性,“-”为阴性。
2.2.2 16S rDNA同源性比较 将菌株HL-3的测序结果,通过NCBI进行16S rDNA数据库BLAST,HL-3与标准菌株BacilluslicheniformisATCC14580的相似性最高,高达99.6%。选取序列相似度达 99% 的部分菌种,采用软件Mega5.05,Maximum likelihood法制作系统发育树,结果见图1。由图1结果可知,菌株 HL-3在系统发育树上与BacilluslicheniformisATCC14580在同一支系。综合以上分析,可初步鉴定菌株HL-3为地衣芽孢杆菌。
2.3 酶学特性的研究
2.3.1 pH对酶活性的影响 不同 pH缓冲液条件下测定的发酵液的蛋白酶活力结果(图2),结果表明,该蛋白酶的最适反应pH为7.0,是一种中性蛋白酶。对于无胃或是消化道偏中性的水产动物来说,需要的是中性饲用酶制剂[15],因而HL-3菌株产蛋白酶具有应用于水产饲料添加剂的潜力。

图2 pH对蛋白酶酶活的影响Fig.2 Effect of pH on protease activity
2.3.2 温度对酶活性的影响 图3显示了不同反应温度条件下测定发酵液蛋白酶活力。结果表明,该蛋白酶的最适反应温度为70 ℃,蛋白酶活力在60~90 ℃仍可保持一定的酶活性,90 ℃下可保持最高酶活的60.13%活性,可见该蛋白酶具有较强的耐热性,是一种耐高温的蛋白酶。

图3 温度对蛋白酶酶活的影响Fig.3 Effect of temperature on protease activity
2.3.3 蛋白酶的热稳定性 发酵液在不同温度水浴后,测得的蛋白酶酶活如图4所示。结果表明:温度低于70 ℃的条件下水浴保温10 min,蛋白酶的酶活基本不变;温度高于70 ℃的条件下水浴保温10 min,蛋白酶的酶活虽开始下降,但是经过90 ℃水浴保温10 min的处理,发酵液蛋白酶的酶活仍保留75.12%,显示该蛋白酶具有良好的热稳定性。
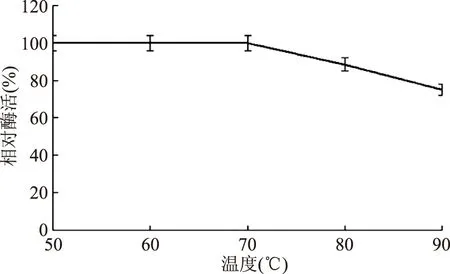
图4 蛋白酶的热稳定性Fig.4 The thermo-stability of the protease
2.3.4 金属离子对酶活的影响 图5显示了在不同金属离子存在下的蛋白酶的酶活。由图4结果可知:在离子浓度为 1.0×10-3mol/L 时,Cu2+和Mn2+对该酶有较强的抑制作用,其中Cu2+抑制作用最强,可使蛋白酶活性降低21.25%;Fe2+、Zn2+、Ca2+对该酶有激活作用,其中Fe2+激活作用最强,可使其活性增强30.52%;Mg2+和K+对该酶活性几乎没有影响。

图5 金属离子对蛋白酶酶活的影响Fig.5 Effect of metal ions on protease activity
3 讨论与结论
饲用蛋白酶既要求酶的最适反应温度与动物消化道生理条件相近,又要有一定的热稳定性,以便于饲料制粒和储存。宋鹏[16]等从土壤中筛选出枯草芽孢杆菌,该菌所产的中性蛋白酶经过70 ℃保温10 min后酶活力全部丧失。李铁晶[17]等从发酵豆酱中筛选出芽孢杆菌,该菌所产的蛋白酶经过70 ℃保温10 min后酶活力全部丧失。以上筛选出的常温型菌种所产蛋白酶热稳定性差,因此没有用于饲料制粒加工的可能性。本实验条件下,筛选出的耐高温地芽孢杆菌HL-3所产蛋白酶在90 ℃保温10 min仍保有较高的酶活,说明此菌株所产蛋白酶具有用于饲料工业的潜力。
本实验从湛江湖光岩土壤中分离出产耐高温蛋白酶酶活较高的HL-3菌株,初步鉴定该菌株为地衣芽孢杆菌,经初步液体发酵蛋白酶活性高达399.2 U/mL。同时对该菌株所产蛋白酶的酶学性质进行了研究,结果表明,该蛋白酶的最适作用温度为 70 ℃,最适pH为7.0;在90 ℃保温10 min后酶活力仍可保持75.12%。在离子浓度为1.0×10-3mol/L时,Cu2+和Mn2+对该酶有较强的抑制作用,Fe2+、Zn2+、Ca2+对该酶有激活作用,Mg2+和K+对该酶活性几乎没有影响。预期该菌株产的蛋白酶具有用于水产饲料添加剂的潜力。
[1]刘鼎云,冷向军,卢永红,等.饲料中添加蛋白酶Aquagrow对鲤生长和蛋白质消化酶活性的影响[J].淡水渔业,2007,37(5):50-52.
[2]冷向军,刘鼎云,李小勤,等.饲料中添加蛋白酶AG对鲤鱼鱼种生长和蛋白质消化酶活性的影响[J].动物营养学报,2008,20(3):268-274.
[3]陈建明,叶金云,许尧兴,等.饲料中添加中性蛋白酶对青鱼生长、消化及鱼体组成的影响[J].水生生物学报,2009,33(4):726-731.
[4]Inbo rr J,Bedfor d M R.Stability of feed enzymes to steam pelleting during feed processing[J].Animal Feed Science and Technology,1994,46(3-4):179-196.
[5]唐兵,周林峰,陈向东,等.嗜热脂肪芽孢杆菌高温蛋白酶的产生条件及酶学性质[J].微生物学报,2000,40(2):188-192.
[6]黄光荣,活泼,蒋家新.嗜热芽孢杆菌HS08 耐热中性蛋白酶的分离纯化及部分特性研究[J].中国食品学报,2006,6(6):30-35.
[7]周虓,郑毅,叶海梅,等.响应面分析法优化耐高温蛋白酶发酵培养基[J].生物数学学报,2007,22(1):113-118.
[8]母智深,白英.原料乳中产耐高温蛋白酶菌株的筛选与鉴定[J].中国乳品工业,2009,37(10):24-26.
[9]张蕾,孙萌,刘岳,等.耐高温中性蛋白酶产生菌株KN1的部分酶学性质及发酵条件的研究[J].中国农学通报 2011,27(30):177-181.
[10]Liu Ying,An Juying,Hu Xuqiong,et al. Isolation and Identification of Thermophilic Protease Bacterium 0701 and its Protease Characterization[J]. Advanced Materials Research,2013,8:1032-1036.
[11]李婵娟,王婧,杨洁.蛋白酶产生菌的筛选、鉴定及酶学性质研究[J].湖北农业科学,2015,54(19):4794-4797.
[12]Hot G J,Krieg R N,Sneath H A P,et al. Bergey’ s manual of determinative bacteriology(9th edition)[M]. Baltimore:Williams &Wilkins Company,1994.
[13]东秀株,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:57-61.
[14]李欣,张丽萍,程辉彩,等.耐低温兼性厌氧淀粉酶产生菌Y89的筛选及酶学特性[J].中国农学通报,2011,27(7):107-111.
[15]柴仙琦,冷向军,张民,等.酶制剂在水产饲料的应用及研究进展[J].饲料工业,2014,35(2):33-36.
[16]宋鹏,陈亮,郭秀璞.产蛋白酶菌株的鉴定及酶学特性[J].食品科学,2012,33(13):152-155.
[17]李铁晶,李沛军,许岩,等.发酵豆酱中蛋白酶高产细菌的筛选及所产蛋白酶的酶学特性研究[J].食品工业科技,2010,31(1):198-200.
Isolation of microbial strain producing thermostable protease and characterization of the enzyme
LIU Huan-ming1,ZHANG Zhi-xin1,HONG Peng-zhi1,*,ZHOU Chun-xia1,YANG Ping1,CHEN Kang-jian2,WU Jin-hong2
(1.College of Food Science and Technology,Aquatic Product Processing and Safety Key Lab of Guangdong Province,Key Lab of Advanced Processing of Aquatic Product of Guangdong Higher Education Institution,Guangdong Ocean University,Zhanjiang 524088,China;2. Guangdong Engineering Research Center for Advanced Processing of Aquatic Product and High-value Utilization of Byproduct,Zhanjiang Hengxing Aquatic Technology Limited Company,Zhanjiang 510300,China)
In order to provide protease for potential use in aquaculture feed industry,the strain producing thermostable protease was screened from the environment of maar lake.Thirty strains were isolated from soil by milk plates. Strain HL-3,which showed the highest production,was screened according to fermenting in shaking flasks,and the enzymatic activity of protease in culture solution of HL-3 was 399.2 U/mL. Based on physiological and biochemical identification,16S rDNA sequence and phylogenetic analysis,the strain HL-3 was preliminarily identified asBacilluslicheniformis. The protease activity preformed optimally at 70 ℃ and pH7.0. The protease retained 75.12% of its original activity after incubation for 10 min at 90 ℃. When ion concentration reached 1.0×10-3mol/L,metal ions of Cu2+and Mn2+would strongly inhibit the protease activity,metal ions of Fe2+,Zn2+and Ca2+would activate the protease activity,metal ions of Mg2+and K+would not affect the protease activity. The protease produced by strain HL-3 in this study may have the potential in aquaculture feed industry.
thermostable protease;Bacilluslicheniformis;maar lake
2016-08-22
刘唤明(1978-),男,硕士,副教授,研究方向:水产品加工,E-mail:lhmgdhydx@sina.com。
*通讯作者:洪鹏志(1965-),男,硕士,教授,研究方向:水产品加工,E-mail:hongpengzhi@sohu.com。
广东省科技计划项目(2016A090922015);湛江市科技计划项目(2015A01004);广东海洋大学创新强校工程科研项目(GDOU2013050204;GDOU2013050313;GDOU2014050203);广东省大学生创新实验项目(201510566049);广东海洋大学大学生创新训练项目(CXXL2015045)。
TS201.3
A
:1002-0306(2017)03-0133-05
10.13386/j.issn1002-0306.2017.03.017

