英国红芸豆蛋白抗氧化肽酶解工艺的研究
高嘉唯,韩 晶,左豫虎,张洪微,崔素萍
(黑龙江八一农垦大学,黑龙江大庆 163319)
英国红芸豆蛋白抗氧化肽酶解工艺的研究
高嘉唯,韩 晶,左豫虎,张洪微,崔素萍*
(黑龙江八一农垦大学,黑龙江大庆 163319)
以英国红芸豆为原料,研究芸豆蛋白质抗氧化活性肽的酶解工艺。首先以水解度和总抗氧化能力为评价指标进行酶的筛选,并采用单因素及正交实验设计优化酶解工艺。结果表明,碱性蛋白酶对芸豆蛋白水解能力最强,酶解产物的抗氧化能力最高;最佳酶解条件为底物浓度5.0%,温度55 ℃,加酶量4000 u/mL,pH10,时间2 h,该条件下总抗氧化能力高达186.97 U/mg pro,英国红芸豆活性肽显示出较强的抗氧化活性。
芸豆蛋白,碱性蛋白酶,酶解,抗氧化肽
芸豆学名菜豆,是普通菜豆(如小黑芸豆、小白芸豆等)和多花菜豆(如圆奶华芸豆 H、N、D、X 等)的总称。芸豆在世界的种植范围比较广泛,而且在我国的种植面积也比较大,产地主要分布在我国的东北、华北、西北和西南等地区[1]。其中英国红芸豆引自英国,粒色紫红,其中还含有花色苷、皂苷等能提高人体非特异性免疫,增强抗病能力的有效成分,可激活淋巴T细胞,抑制肿瘤细胞生长,已受到医学界的广泛重视[2]。芸豆蛋白含量20.29%~27.73%[3],氨基酸比例比较均衡[4]。
本质上氧化是导致人类疾病和发病的主要原因之一。所有的细胞组分和特定的成分都易受到自由基的影响。经过大量研究证明,抗氧化肽能够起到清除自由基、螯合金属离子等作用。用酶水解植物蛋白质可以产生具有抑制生物大分子过氧化或清除体内自由基的抗氧化。 Atsushi Yokomizo等[5]以豆渣蛋白为原料得到了4种抗氧化肽。Kong等[6]对玉米醇溶蛋白进行酶解,得到具有显著的还原能力和清除自由基能力的活性肽。周丽卿[7]对鹰嘴豆多肽的制备及其改性进行研究,结果表明碱性蛋白酶对鹰嘴豆的酶解最好。
到目前为止,对于以植物蛋白来源的抗氧化肽研究主要以大豆蛋白抗氧化肽为主,其次集中在鹰嘴豆[7],米糠[8],黑豆[9],玉米[10],大米[11],菜籽[12]等上。其中胶原肽、大豆肽、鹰嘴豆肽[13]等生物活性肽已经成为食品科学和营养学的研究热点,但还未见英国红芸豆活性肽的相关报道。因为英国红芸豆具有极高的营养和药用价值,芸豆蛋白质的利用率还比较低,是一种潜在的植物蛋白质资源[14]。因此本文选用英国红芸豆作为研究对象。
制备抗氧化肽的方法包括提取法、酶解法,发酵法、化学合成法等,由于酶解法反应条件易于控制,操作简单,可以获得较多的抗氧化肽[15],所以选用生物酶解法制备芸豆氧化活性肽。每种蛋白酶作用的位点不同,使得酶解液所表现的抗氧化能力也不同。本文以英国红芸豆蛋白质为研究对象,选用六种单酶对芸豆蛋白质进行酶解,以总抗氧化能力为指标,筛选出使获得的酶解液抗氧化能力最强的蛋白酶,并确定其最适酶解的条件,希望可以为芸豆主栽品种的进一步研究提供基础,同时也希望可以为抗氧化肽添加到食品中提供初步的研究成果。
1 材料与方法
1.1 材料与仪器
英国红芸豆 由黑龙江省农垦科学院提供。
碱性蛋白酶(2.0×105u/g)、风味蛋白酶(5000 u/g)、胰蛋白酶(250 u/g)、胃蛋白酶(1.2 u/g)、糜蛋白酶(2.0×105u/g) 北京鑫泽天佑生物科技有限公司;浓盐酸、氢氧化钠 为分析纯级;总抗氧化能力(T-AOC)测定试剂盒 南京建成生物工程研究所。
TDZ5-WS型多管架自动平衡离心机 长沙湘仪离心机仪器有限公司;AB204-N型分析天平 上海梅特勒-托利多仪器有限公司;Christ Alpha型冷冻干燥机 CHRIST公司;T6型紫外分光光度计 北京普析通用仪器有限责任公司;PHS.2C型精密pH计 美国METTLER TOLEDO公司;SENCO恒温水浴锅 上海申生科技有限公司。
1.2 实验方法
1.2.1 英国红芸豆蛋白质的提取 参考Osborne[16]的方法对芸豆蛋白质进行提取。芸豆精选、粉碎过筛(60目)得到芸豆粉。芸豆粉以1∶10(w/v)的料液比加蒸馏水,在50 ℃、pH9.0条件下恒温搅拌提取1 h,然后3000 r/min离心20 min,沉淀物再以1∶8(w/v)比例加蒸馏水进行二次提取。合并2次离心后的上层蛋白液,室温下用1.0 mol/L HCl调pH至4.4,4000 r/min离心15 min,超纯水洗涤沉淀3次,冷冻干燥得到芸豆蛋白质。经测定,以干基计算芸豆蛋白质含量,英国红提取率为95.48%。
1.2.2 芸豆抗氧化肽的酶解工艺 芸豆蛋白→加水配制一定浓度→预处理(90 ℃,10 min)→用1.0 mol/L NaOH或HCl调节pH→水浴调温→加一定量蛋白酶恒温酶解一段时间→灭酶(90 ℃,10 min)→调pH至4.4→4000 r/min离心15 min→上清液→真空浓缩→冷冻干燥→芸豆蛋白肽[17]。
1.2.3 制备英国红芸豆蛋白质抗氧化肽酶的筛选 分别选用碱性蛋白酶(2.0×105U/g),风味蛋白酶(5000 U/g),胰蛋白酶(250 U/g),胃蛋白酶(1.2 U/g),糜蛋白酶(2.0×105U/g),按各自的最适条件(见表1)及相同的底物浓度进行水解,测定酶解产物的总抗氧化能力。
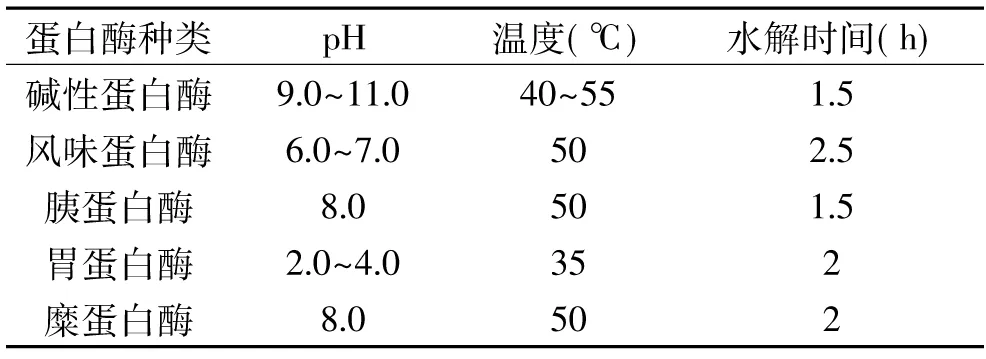
表1 蛋白酶酶解英国红芸豆蛋白质的条件Table 1 Conditions of British red kidney bean protein enzymatic hydrolysis
1.2.4 水解度的测定 英国红芸豆蛋白质酶解水解度的测定采用pH-stat法[18]。称取一定量的芸豆蛋白粉配成一定浓度的蛋白质溶液,在90 ℃下预处理15 min。调节溶液pH至各蛋白酶所需值,加入适量蛋白酶并放入恒温水浴锅中不断搅拌,用0.2 mol/L NaOH溶液调节,使溶液的pH维持不变,记录反应过程中消耗NaOH溶液的体积。水解度的公式如下:
式中,B为消耗的NaOH溶液的体积(mL);Nb为NaOH溶液的浓度(0.2 mol/L);Mp为底物中蛋白质的质量;htot为每克蛋白质中肽键的毫摩尔数,对于芸豆蛋白质来说,htot=7.72[19]。
1.2.5 总抗氧化能力的测定 使用总抗氧化能力(T-AOC)测定试剂盒,按照试剂盒说明书进行操作。机体中有许多抗氧化物质,能使Fe3+还原成Fe2+,后者可与菲啉类物质形成稳固的络合物,通过比色可测出其抗氧化能力的高低。计算公式如下:
1.2.6 最佳酶解条件的研究 单因素实验中,以总抗氧化能力和水解度为指标,分别对蛋白酶进行水解温度(℃)、pH、水解时间(h)及加酶量(u/mL)进行研究,再通过正交实验,以总抗氧化能力为指标确定其最佳酶解条件。
1.2.6.1 最适温度的确定 选用1.2.5中筛选出的蛋白酶,选择酶解温度分别为45、50、55、60、65 ℃的条件下进行酶解,其它酶解条件为:芸豆蛋白溶液浓度为5%,酶解时间2 h,pH为8.5,加酶量为1000 u/mL,以总抗氧化能力和水解度为指标,确定该蛋白酶的最适温度。
1.2.6.2 最适pH的确定 该蛋白酶在pH分别为11.0、10.0、9.5、9.0、8.5、8.0条件下进行酶解,其它酶解条件为:芸豆蛋白溶液浓度为5%,酶解时间2 h,酶解温度为50 ℃,加酶量为1000 u/mL,以总抗氧化能力和水解度为指标,确定该蛋白酶的最适pH。
1.2.6.3 最佳酶解时间的确定 本研究选择了酶解时间分别为0.5、1.0、2.0、3.0、4.0 h进行酶解,其它酶解条件为:芸豆蛋白溶液浓度为5%,酶解温度为50 ℃,pH为8.5,加酶量为1000 u/mL,以总抗氧化能力和水解度为指标,确定该蛋白酶的最佳水解时间。
1.2.6.4 最适加酶量的确定 本研究选择了加酶量分别为1000、2000、3000、4000、5000 u/mL进行酶解,其它酶解条件为:芸豆蛋白溶液浓度为5%,酶解时间2 h,酶解温度为50 ℃,pH为8.5,以总抗氧化能力和水解度为指标,确定该蛋白酶的最适加酶量。

表3 各芸豆蛋白酶解物总抗氧化能力Table 3 Total antioxidant capacity of different kidney bean protease solution
注:a~j指在同一行的不同字母存在显著性差异(p<0.05)。
1.2.6.5 正交实验优化蛋白酶的酶解条件
根据单因素实验的实验结果,本研究采取L9(43)正交表,每组实验进行三次重复,以总抗氧化能力为指标,进一步确定该蛋白酶的酶解条件见表2。
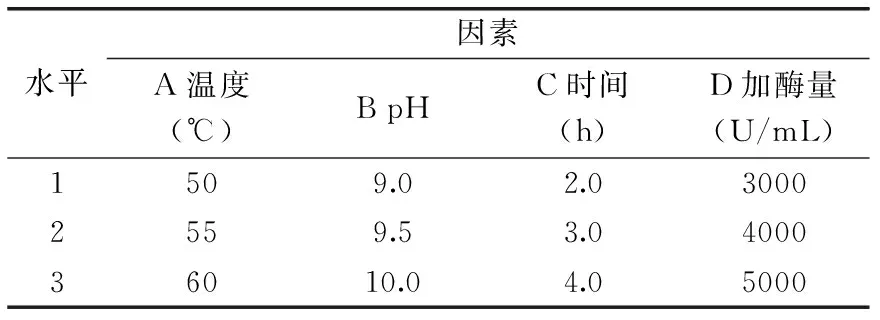
表2 碱性蛋白酶酶解芸豆蛋白质正交实验的因素水平表Table 2 The factors and levels of orthogonal experiments on hydrolysis of kidney bean protein isolates
1.2.6.6 验证实验 按照正交实验得到的最优水平组合进行操作,芸豆蛋白溶液浓度为5%,测定总抗氧化能力,验证最佳实验条件。
2 结果与分析
2.1 不同蛋白酶酶解英国红芸豆蛋白的能力
不同蛋白酶酶解芸豆蛋白,酶解液的总抗氧化能力见表3。
从表3中可以看出,碱性蛋白酶水解芸豆蛋白质所得水解液的总抗氧化能力最强,抗氧化值为167.83 U/mg pro。所以选用碱性蛋白酶进行后续的水解研究。
李艳红[20]对鹰嘴豆蛋白酶解物的制备及其抗氧化肽进行研究,分别用碱性蛋白酶、木瓜蛋白酶、中性蛋白酶等在各自适宜的条件下对鹰嘴豆进行酶解,实验结果表明碱性蛋白酶的酶解效果最好;王璇[20]对黑豆肽的制备及其抗氧化活性进行研究,选取碱性蛋白酶、中性蛋白酶和风味蛋白酶,根据水解度选取最佳的酶为碱性蛋白酶;这与本实验选取碱性蛋白酶的结果相一致,但是也有很多学者的研究结果与本实验不同,如郭延熙[22]采用碱性蛋白酶、中性蛋白酶和酸性蛋白酶对米糠抗氧化肽酶解法的制备进行研究,结果表明酸性蛋白酶对米糠蛋白酶解的效果好。由于蛋白酶的酶切位点不同,使得水解后获得的产物所对应的各种能力存在差异,因此,学者们对蛋白质酶解物制备可选取的蛋白酶的种类是多样化的。
2.2 碱性蛋白酶的最佳酶解条件研究结果
2.2.1 最适温度的确定 不同温度对水解度和总抗氧化能力的影响如图1所示。
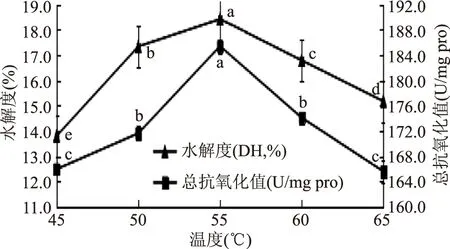
图1 不同温度对水解度和总抗氧化能力的影响Fig.1 Effects of different temperatures on the degree of hydrolysis and total antioxidant capacity
温度对酶解反应的影响是多方面的,由图1可知,在45~55 ℃范围内,随着温度的不断升高,总抗氧化能力呈上升趋势;在55~65 ℃范围内,随着温度的不断升高,总抗氧化能力呈下降趋势;在55 ℃时,总抗氧化能力最强,此时总抗氧化值为185.41 U/mg pro。在55 ℃以后,随着温度的增加,酶解产物的抗氧化能力降低了,可能是由于温度升高造成碱性蛋白酶变性失活。由图1还可以看出,芸豆蛋白质水解度随温度变化的趋势与总抗氧化能力变化趋势一致。在55 ℃时水解度最大,此时的水解度为18.42%。所以,最佳酶解温度暂时选择为55 ℃。
2.2.2 最适pH的确定 不同pH对水解度和总抗氧化能力的影响如图2所示。

图2 不同pH对水解度和总抗氧化能力的影响Fig.2 Effects of different pH on the degree of hydrolysis and total antioxidant capacity
溶液的pH通过影响蛋白酶和酶分子及蛋白质的分子的解离状态,从而影响蛋白酶的稳定性、酶与蛋白质底物的结合以及酶促反应的进行[23]。由图2可知,pH在8.0~9.5的范围内,总抗氧化值随pH的增大,呈现逐渐增大的趋势,pH在9.5~11.0的范围内,总抗氧化值随pH的增大,呈现逐渐减小的趋势,当pH为9.5时,总抗氧化能力最强,此时总抗氧化值为189.10 U/mg pro。pH大于10以后,蛋白质酶解液的抗氧化能力减弱,可能是由于pH过高使得蛋白酶的活性降低造成的。如图2所示,在pH8.0~10.0范围内,随着pH的增大水解度逐渐增加,但是,当pH超过10.0,水解度趋于平缓。水解度在pH达到10.0时,水解度最大。此时的水解度为23.90%。因此,酶解芸豆蛋白的最适pH暂时选择为9.5。
2.2.3 最佳水解时间的确定 不同水解时间对水解度和总抗氧化能力的影响见图3。
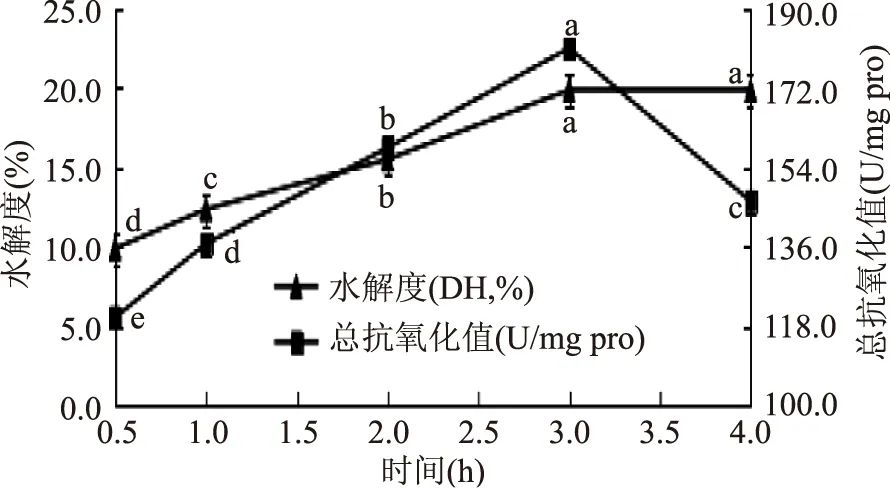
图3 不同水解时间对水解度和总抗氧化能力的影响Fig.3 Effects of different time on the degree of hydrolysis and total antioxidant capacity
由图3可知,在0.5~3.0 h之间,随时间的延长,总抗氧化能力的值越来越大,在3.0~4.0 h的时间内,总抗氧化能力的值随时间的延长逐渐减小,在3 h时,总抗氧化能力最强,此时总抗氧化值为180.86 U/mgpro。在3 h后,酶解液的总抗氧化能力减弱可能是因为具有抗氧化活性的肽段被继续水解,从而使得总抗氧化能力下降。从图3还可以看出,在3 h前水解度随着时间的延长逐渐增加,在3 h后趋于平缓。水解度在3 h达到最大值此时水解度为19.84%。水解度与总抗氧化能力不相关。所以,暂时选择最佳的水解时间为3 h。
2.2.4 最适加酶量的确定 不同加酶量对水解度和总抗氧化能力的影响,如图4所示。
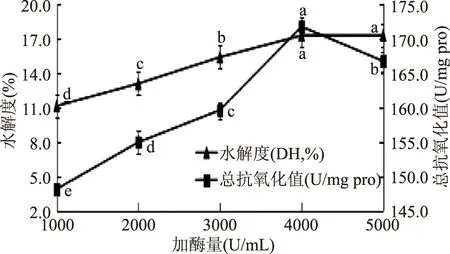
图4 不同加酶量对水解度和总抗氧化能力的影响Fig.4 Effects of different enzyme dosageon the degree of hydrolysis and total antioxidant capacity
由图4可知,加酶量在1000~4000 U/mL时,总抗氧化能力随着加酶量的增加而增大,加酶量在4000~5000 U/mL时,总抗氧化能力随着加酶量的增加逐渐减小,在加酶量达到4000 U/mL时,总抗氧化能力最强,此时抗氧化值为171.65 U/mg pro。可能是由于芸豆多肽片段随加酶量的增加继续断裂,使得酶解液的总抗氧化能力减弱。由图4看出,水解度随着加酶量的增加而增大,水解度在加酶量为5000 U/mL时,达到最大值,此时水解度为19.33%。水解度与总抗氧化能力不相关。故选用加酶量为4000 U/mL。
2.2.5 正交实验优化蛋白酶的酶解条件 根据以上单因素的实验结果选取正交实验表,如表2所示。正交实验结果见表4。
以总抗氧化能力为考察指标,通过极差分析得出,各因素对碱性蛋白酶酶解芸豆蛋白的影响主次顺序是A>C>B>D,即温度>水解时间>溶液pH>加酶量。由表4可以得出碱性蛋白酶水解芸豆蛋白质的最优组合为A2B3C1D2,即酶解温度为55 ℃,溶液pH为10,水解时间为2.0 h,加酶量为4000 U/mL,此时的总抗氧化能力为187.42 U/mg pro。
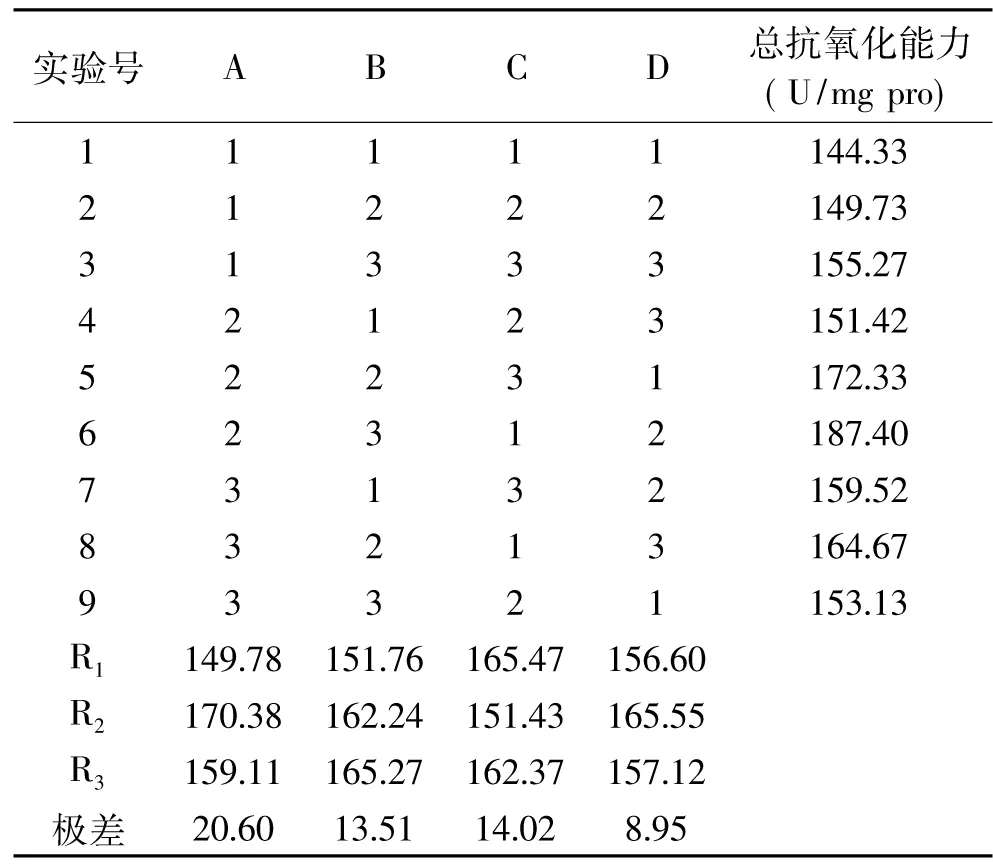
表4 碱性蛋白酶酶解芸豆蛋白质正交实验结果Table 4 The results of orthogonal experiments on hydrolysis of kidney bean protein isolates
2.2.6 验证实验 采用以上得出的碱性蛋白酶的最佳酶解条件,即酶解温度为55 ℃,溶液pH为10,水解时间为2.0 h,加酶量为4000 U/mL进行验证实验。测得芸豆蛋白酶解液的总抗氧化能力为186.97 U/mg pro,这与预测值187.42 U/mg pro误差在±1.00 U/mg pro内,说明采用正交优化得到的碱性蛋白酶酶解芸豆蛋白质的最佳酶解条件参数准确可靠。
3 结论
本文研究了英国红芸豆蛋白质的酶解条件,分别对蛋白酶的选择,以及对所选的蛋白酶进行单因素实验和正交实验确定其最佳的酶解条件的研究。
利用多种蛋白酶对芸豆蛋白质进行酶解,通过对总抗氧化能力的比较,结果显示,碱性蛋白酶酶解芸豆蛋白质获得的酶解液总抗氧化能力较强,所以选用碱性蛋白酶酶解英国红芸豆蛋白。
通过单因素实验、正交实验确定了碱性蛋白酶的酶解最佳条件为温度为55 ℃,酶解时间为2.0 h,pH为10,蛋白质溶液为5%时,加酶量为4000 U/mL,加酶量随着蛋白质溶液的浓度加大,按照相应的比例增加。此时的总抗氧化能力高达186.97 U/mg pro。
[1]党根友,冯佰利,高冬丽,等.不同芸豆品种种子发育过程中贮藏蛋白积累研究[J].西北植物学报,2008,28(7):1366-1370.
[2]周大寨,朱玉昌,周毅锋.芸豆蛋白质的提取及超滤分离研究[J].食品科学,2008,29(8):386-390.
[3]柴岩,冯佰利,孙世贤.中国小杂粮品种[M].2007:1-20.
[4]Sathe S K. Dry bean protein functionality[J]. Critical Reviews in Biotechnology,2002,22(2):175-223.
[5]Atsushi Yokomizo,Yoko Takenaka,Tetsuo Takenaka. Antioxidative activity of peptides prepared from okara protein. Food Sci Technol Res,2002,8(4):357-359.
[6]Kong B H,Xiong Y L. Antioxidant activity of zein hydrolysates in a Liposome system and the possible mode of action[J]. J. Agric. Food Chem,2006,54(16):6059-6068.
[7]周丽卿. 鹰嘴豆多肽的制备及其改性研究[D].杨凌:西北农林科技大学,2012.
[8]吕飞,许宙,程云飞.米糠蛋白质提取及应用研究进展[J]. 食品与机械,2014,30(3):234-238.
[9]王璇. 黑豆肽的制备及其抗氧化活性的研究[D].郑州:河南工业大学,2012.
[10]石丽梅,唐学燕,何志勇,等.玉米抗氧化肽对于中式香肠的氧化稳定性的影响[J].食品科技,2008,(10):135-138.
[11]贾俊强,马海乐,曲文娟,等.超声预处理大米蛋白制备抗氧化肽[J].农业工程学报,2008,24(8):288-293.
[12]刘清,谢奇珍,师建芳.菜籽蛋白活性肽研究[J].粮食与油脂,2008(3):4-6.
[13]裴小平,唐道邦,肖更生,等.抗氧化肽制备的应用现状及趋势[J].食品工业科技,2009,30(2):319-322.
[14]张昊,任发政.天然抗氧化肽的研究进展[J].食品科学,2008,29(4):443-447.
[15]张洪利,康大力.抗氧化肽的研究进展.安徽农业科学,2011,39(2):660-661.
[16]吕飞,许宙,程云飞.米糠蛋白质提取及应用研究进展[J]. 食品与机械,2014,30(3):234-238.
[17]李峰,潘瑶,陈奇.大豆活性肽酶解制备的工艺条件研究[J].食品科学,2010,31(10):69-74.
[18]陈毓荃.生物化学实验方法和技术[M].北京科学出版社,2002:10-12.
[19]任海伟,朱冬梅,王玉丽,等. 芸豆肽抗氧化活性研究[J]. 食品科学,2010,31(21):105-109.
[20]李艳红. 鹰嘴豆蛋白酶解物的制备及其抗氧化肽的研究[D].无锡:江南大学,2008.
[21]王璇. 黑豆肽的制备及其抗氧化活性的研究[D].郑州:河南工业大学,2012.
[22]郭延熙.米糠抗氧化肽的酶法制备及其特性的研究[D]. 长沙:中南林业科技大学,2013.
[23]姜锡瑞.酶制剂应用手册[M].北京:中国轻工业出版社,1999:232-241.
Research of enzymolysis technology of the British red kidney bean protein antioxidant peptide
GAO Jia-wei,HAN Jing,ZUO Yu-hu,ZHANG Hong-wei,CUI Su-ping*
(Heilongjiang Bayi Agricultural University,Daqing 163319,China)
Study of enzymolysis technology of kidney bean protein antioxidative peptide with the British red kidney beans as raw material.First of all,the degree of hydrolysis and total antioxidant capacity as evaluation index for screening of enzyme.alkaline protease was selected from six different enzymes by single factor and orthogonal design.The results showed that the kidney bean protein could be effective hydrolyzed by the alkaline protease and the highest antioxidant capacity of enzymolysis products.The optimal conditions were substrate concentration of 5.0%(w/v),enzyme concentration of 4000 u/mL,pH10,temperature of 55 ℃,hydrolyzing time of 2 h,under this condition of the total antioxidant capacity to 186.97 U/mgpro. British red kidney beans peptide showed strong antioxidant activity.
kidney bean protein(KBP);alkaline pro-tease;enzymatic hydrolysis;antioxidant peptide
2016-08-26
高嘉唯(1991-),女,在读硕士研究生,研究方向:食品科学,E-mail:xialedi@163.com。
*通讯作者:崔素萍(1968-),女,博士,教授,从事食品生物化学和分子生物学的教学与科研工作,E-mail:cuisup@163.com。
黑龙江省农垦总局科技局项目(HNK125B-13-03);黑龙江省教育厅项目(JG2012010458)。
TS209.1
B
:1002-0306(2017)03-0234-05
10.13386/j.issn1002-0306.2017.03.036

