格雷夫斯病患者外周血CD4+CD25+Foxp3+调节性T细胞及尿碘的检测及临床意义
黄 飞, 毕建华, 郝兰香, 刘艳梅
(江苏省盐城市第一人民医院内分泌科, 江苏 盐城 224000)
格雷夫斯病患者外周血CD4+CD25+Foxp3+调节性T细胞及尿碘的检测及临床意义
黄 飞, 毕建华, 郝兰香, 刘艳梅
(江苏省盐城市第一人民医院内分泌科, 江苏 盐城 224000)
目的:探讨格雷夫斯病(GD)患者外周血中的CD4+CD25+Foxp3+调节性T细胞比例以及尿碘水平。方法:选取2016年4月至2016年10月我院确诊但未治疗的GD患者与健康受检者各40例,以流式细胞术测定CD4+CD25+Foxp3+调节性T细胞,以砷铈催化分光光度法测定尿碘。结果:观察组患者CD4+CD25+Foxp3+Treg在CD4+CD25+T细胞以及CD4+T细胞中所占比例明显低于对照组(P<0.05),尿碘检测水平相比对照组受检者显著提高(P<0.05)。结论:GD患者外周血中的CD4+CD25+ Foxp3+调节性T细胞相比健康人群明显减少而尿碘明显升高,提示CD4+CD25+Foxp3+调节性T细胞与碘可能参与GD的发生与发展。
格雷夫斯病; CD4+CD25+Foxp3+调节性T细胞; 尿 碘
格雷夫斯病(GD,Graves Disease)是导致甲状腺功能亢进症的最常见致病因素,在全部甲亢患者中所占比例超过85%[1]。GD患者中将近80%体内有抗促甲状腺激素受体抗体(TRAB,Thyrotrophin Receptor Antibody),在病理组织学上的典型表现为甲状腺以及眼睛等效应器官中出现淋巴细胞浸润。浸润细胞中有自身反应性T细胞,这些T细胞与特异性损伤存在较为密切的关系[2]。CD4+CD25+Foxp3+Treg在机体内部可以通过多种方式起到免疫抑制的功能,而近年来的研究证实叉头状转录因子P3(Foxp3,Transcription factor forkhead box p3)能够特异性表达于CD4+CD25+Foxp3 +Treg,同时可以在发育成熟与功能表达中发挥作用[3]。本次研究主要探讨GD患者外周血中的调节性T细胞、尿碘水平与相关免疫机制的关系。
1 资料与方法
1.1 一般资料:选取我院2016年4月至2016年10月我院收治的未治疗GD患者40例作为观察组,所有患者可存在突眼、甲状腺肿大、高代谢症候群典型甲亢症状或甲亢症状不典型,但通过血清相关检测联合确诊,检验存在血清促甲状腺激素(TSH)水平降低,甲状腺激素水平升高,所有患者均未服用糖皮质激素以及非甾体类抗菌药物。排除合并其他自身免疫性疾病的患者,排除急慢性感染、肿瘤患者,排除肝、肾、心、肺等重要脏器存在严重器质性病变的患者,排除妊娠期与哺乳期患者。观察组患者中,男12例,女28例,年龄15 至48岁,平均(24.92±6.38)岁。选取同期在我院健康体检的40例患者作为对照组,对照组患者中,男11例,女29例,年龄17至49岁,平均(25.03±6.43)岁。两组受检者的性别、年龄等相关资料进行统计学比较后发现无明显差异(P>0.05),均衡性良好。
1.2 制备方法
1.2.1 采集方法:两组受检者抽取3mL空腹外周静脉血,在无菌环境下以含有0.2mL肝素钠的真空抗凝试管完成。同时采集患者空腹晨尿10mL,在-20℃的冰箱内保存待检。
1.2.2 制备方法:分别配置浓度为40%与75%的Percoll分离液,恢复到室温。在15mL的离心管中加入3mL浓度为75%的Percoll分离液,对试管壁进行润湿。以注射器抽取3mL浓度为40%的Percoll分离液,沿着管壁缓慢注入,尽量保持界面分离。以1:1的比例将肝素抗凝血与磷酸盐缓冲液混合均匀。在20℃的环境下以每分钟2000转的速度离心处理20min。在离心处理后能够发现单个核细胞在两层Percoll分离液中密集,表现为白膜状,将这层细胞抽取后放入新的离心管中。加入2mL磷酸盐缓冲液混合均匀,在4℃环境下以300G的条件离心处理10min,丢弃上部清液,并再次加入2mL缓冲液吹打均匀,以同样的条件离心处理10min,丢弃上部清液。之后以磷酸盐缓冲液调整细胞浓度为1×107/mL,将制备好的人外周血单核细胞(PBMC)悬液在4℃的环境下保存。
1.2.3 染色方法:以3个流式试管分别标记为检测管、同型对照管、空白管,分别加入100μl调整好的PBMC悬液,在检测管与同型对照管中加入预混的APC-CD25抗体与FITC-CD4抗体20μl,空白管不加任何抗体。在4℃且避光的环境下孵育30min。在3个试管中分别加入2mL未加热的流式染色缓冲液,在4℃环境下以300G的速度离心处理10min,丢弃上部清液。
1.2.4 固定渗透与封闭方法:在每个试管中加入1mL固定液或者渗透液,充分混合均匀。在4℃且避光的环境下孵育45min。在每个试管中分别加入2mL配置好的1x渗透缓冲液,在4℃的环境下以300G的速度离心处理10min,丢弃上部清液后,再分别加入2mL的1x渗透缓冲液,以同样的条件离心处理10min,再丢弃上部清液。以100μl的1x渗透缓冲液重悬细胞。在检测管与同型对照管中分别加入正常的鼠血清2μl,混合均匀,空白管不加。在4℃的背光环境下孵育15min。
1.2.5 细胞内Foxp3染色:在检测管中加入20μl的PE-Foxp抗体,在同型对照管中加入20mL的PE-鼠IgG2a同型对照,空白管不加。在4℃的背光环境下孵育45min。每个试管中分别加入2mL的1x渗透缓冲液,在4℃的环境下以300G的速度离心处理10min,丢弃上部清液后,再分别加入2mL的1x渗透缓冲液,以同样的条件离心处理10min,再丢弃上部清液。以300μl流式染色缓冲液重悬细胞。
1.3 检测方法:CD4+CD25+Foxp3+Treg细胞检测方法选择流式细胞仪检测,在仪器初始化后以标准荧光微球校正,依次检测标准,每个标本检测10000个细胞,圈定淋巴细胞群。以CellQuest获取并分析数据。尿碘检测方法选择砷铈催化分光光度法。
1.4 统计学方法:本组数据采用SPSS15.0软件包进行处理,计数资料比较采用卡方检验,计量指标采用表示,组间比较进行t检验,均以P<0.05为有统计学意义。
2 结 果
2.1 外周血CD4+CD25+Foxp3+Treg比较:两组受检者CD4+CD25+Foxp3+Treg比例的统计结果,见表1。观察组患者外周血中CD4+CD25+T细胞在CD4+T细胞中所占比例与对照组相比无显著差异(P>0.05)。观察组患者CD4+CD25+Foxp3+Treg在CD4+CD25+T细胞中所占比例明显低于对照组(P<0.05),CD4+ CD25+Foxp3+Treg在CD4+T细胞中所占比例明显低于对照组(P<0.05)。
表1 两组受检者CD4+CD25+Foxp3+Treg比例的统计结果比较(s))
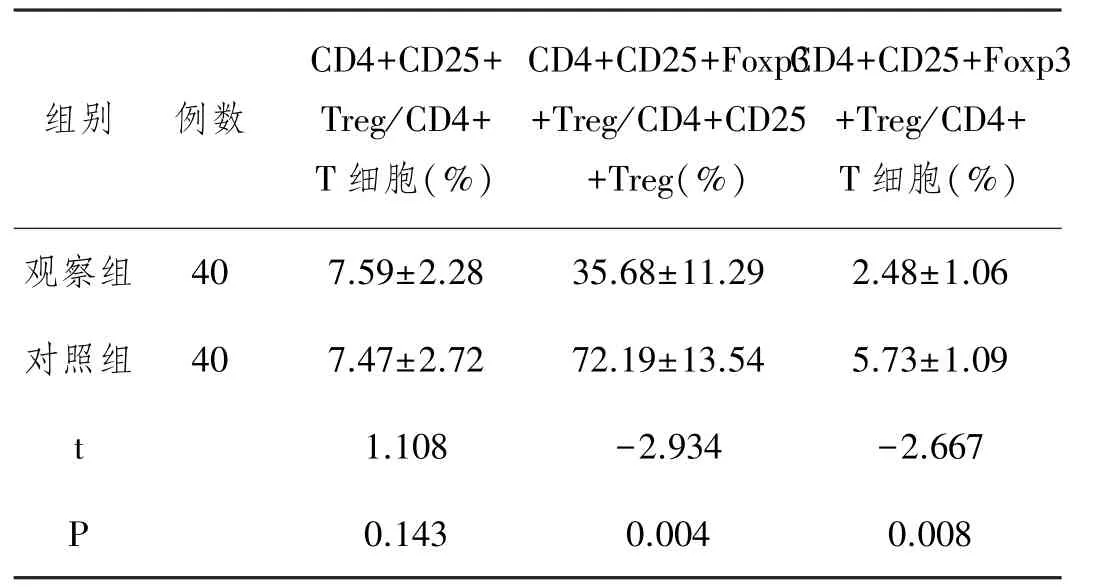
表1 两组受检者CD4+CD25+Foxp3+Treg比例的统计结果比较(s))
组别 例数CD4+CD25+ Treg/CD4+ T细胞(%) CD4+CD25+Foxp3 +Treg/CD4+CD25 +Treg(%) CD4+CD25+Foxp3 +Treg/CD4+ T细胞(%)观察组 40 7.59±2.28 35.68±11.29 2.48±1.06对照组 40 7.47±2.72 72.19±13.54 5.73±1.09 t 1.108 -2.934 -2.667 P 0.143 0.004 0.008
2.2 尿碘比较:两组受检者尿碘水平检测统计结果,见表2。观察组患者尿碘检测水平相比对照组受检者显著提高(P<0.05)。
表2 两组受检者尿碘水平检测结果比较(s))
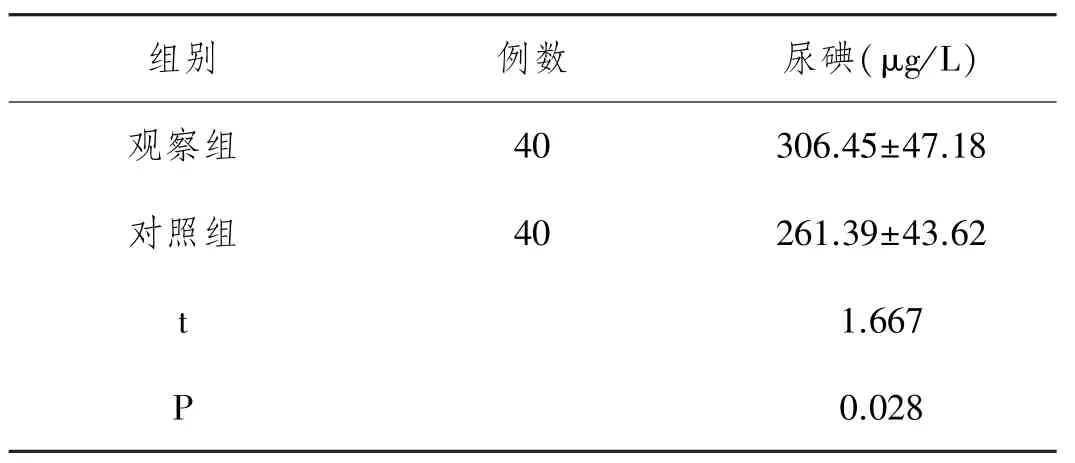
表2 两组受检者尿碘水平检测结果比较(s))
组别 例数 尿碘(μg/L)观察组 40 306.45±47.18对照组 40 261.39±43.62 t 1.667 P 0.028
3 讨 论
GD临床上较为常见,主要临床表现为甲状腺功能亢进,部分患者伴有以眼外肌损害为主要特征的突眼症,有的还表现出特殊的皮肤损害。GD病理改变主要为机体内部大量的自身抗体,特别是针对甲状腺细胞TSH受体的TRAb[4]。已经能够确定的发病因素包括体液免疫以及细胞免疫。近年来研究证实,调节性T细胞在维持机体免疫耐受中发挥重要作用,其数量的减少和功能的减弱将引起自身免疫疾病,而增加机体内调节性T细胞数量则可起到缓解和治疗自身免疫病的作用[5]。体外实验显示,CD4+CD25+Foxp3+ Treg细胞能够显著抑制效应性T细胞的增殖和IFN-γ的产生,可以多种方式影响自身免疫系统,从而对GD多重自身免疫病理过程产生影响。
Foxp3+是叉头/翼状螺旋转录因子家族中的一员,在CD4+CD25+调节T细胞的发育以及成熟中作用较为明显。CD4+CD25+Foxp3+Treg在机体中选择性抑制自身反应性T细胞以及部分效应性T细胞,同时也是免疫系统自身稳定性以及保持的重要机制[6]。在不同的内环境因素以及疾病中,CD4+CD25+Foxp3+ Treg有不同的机制同时发挥不同的作用,包括细胞膜分子调节、细胞因子抑制、转录因子等。本次临床研究中,GD患者外周血中CD4+CD25+T细胞在CD4+T细胞中所占比例与健康人群相比无显著差异,表明CD4 +CD25+T细胞群可能并未参与到GD的疾病发生与进展中。而GD患者CD4+CD25+Foxp3+Treg在CD4+ CD25+T细胞以及CD4+T细胞中所占比例均低于健康人群,表明CD4+CD25+Foxp3+Treg减少可能对GD疾病的发生有显著的作用,而 Foxp3阳性的 CD4+ CD25+调节性T细胞是具有免疫功能负向调节的淋巴细胞群。GD患者CD4+CD25+T细胞比例没有明显改变,而CD4+CD25+Foxp3+Treg明显减少,提示具有免疫抑制活性的Foxp3+Treg缺乏与GD发病存在明显的关系。
GD发生以及发展中碘摄入量的提高也是重要的影响因素。碘不仅是人体必需的微量元素,同时也是甲状腺激素的主要合成原料。有研究发现碘含量的过度升高可能通过多种机制参与GD疾病的发生以及进展,包括促使甲状腺球蛋白抗原变化、诱导甲状腺细胞死亡、诱导甲状腺滤泡上皮细胞表达肿瘤坏死因子、诱导人类白细胞抗原等。尿碘含量中位数是反映人群碘营养状况的关键指标,在2001年ICCIDD、WHO以及UNICEF的碘摄入量标准中,健康的碘营养中位数指标为100至200μg/L。本次研究中GD患者的尿碘含量中位数为306.45μg/L,相比健康人群明显升高,提示GD患者尿碘水平显著升高,而碘可能是导致GD发病的原因之一。
[1] 阮茂美,陈立波.2011版ATA/AACE《甲亢和其他病因甲状腺毒症诊治指南》解读[J].世界临床药物,2011,32 (9):564~570.
[2] 中华医学会核医学分会.131I治疗格雷夫斯甲亢指南(2013版)[J].中华核医学与分子影像杂志,2013,33 (2):83~95.
[3] 钱伟,张强,吴汉妮,等.Foxp3在Graves病患者外周血单个核细胞中的表达及临床意义[J].中国免疫学杂志,2011,27(1):76~78.
[4] 查兵兵,刘军,查英,等.Graves病患者131I治疗前后CD4 +CD25+Foxp3+调节性T细胞的变化[J].中国免疫学杂志,2012,28(11):1032~1035.
[5] 李晓娟,胡义平,刘燕,等.TF3-H4对CD4+CD25+调节性T细胞和CD4+CD25-效应性T细胞早期活化的影响[J].中国药理学通报,2012,28(3):371~374.
[6] 谢平,庞楠楠,郭新红,等.慢性淋巴细胞白血病患者外周血调节性T细胞的百分率及与预后的关系[J].细胞与分子免疫学杂志,2013,29(12):1307~1311.
A【doi】10.3969/j.issn.1006-6233.2017.01.049
1006-6233(2017)01-0147-03
江苏省盐城市医学科技发展计划项目,(编号:YK212006)
刘艳梅

