移植免疫耐受中调节性B细胞与调节性T细胞的依赖性关系研究*
李姝蓉,赵高平,杨卯竹,魏玲玲,邓绍平
(1.电子科技大学医学院,成都 610054;2.四川省医学科学院·四川省人民医院/电子科技大学附属医院器官移植研究所,成都 610072;3.四川省医学科学院·四川省人民医院/电子科技大学附属医院胃肠外科,成都 610072)
移植免疫耐受中调节性B细胞与调节性T细胞的依赖性关系研究*
李姝蓉1,2,赵高平1,3△,杨卯竹2,魏玲玲2,邓绍平1,2
(1.电子科技大学医学院,成都 610054;2.四川省医学科学院·四川省人民医院/电子科技大学附属医院器官移植研究所,成都 610072;3.四川省医学科学院·四川省人民医院/电子科技大学附属医院胃肠外科,成都 610072)
目的 探讨在联合抗Tim-1/抗CD45RB抗体诱导的移植耐受中调节性B细胞(Bregs)与调节性T细胞(Tregs)的关系。方法 建立BALB/c小鼠到C57BL/6小鼠的同种胰岛移植长期耐受模型,将长期耐受小鼠(LTS)的B细胞过继输注至接受胰岛移植的B细胞缺陷小鼠(μMT-/-)体内,或加用抗CD25抗体(PC61)去除CD25+Treg细胞,观察移植物的存活时间,用流式细胞仪检测Foxp3+Treg数量变化。将CD4+Foxp3-GFP-T细胞与Bregs细胞联合过继输注RAG小鼠体内,检测Foxp3+GFP+T细胞的扩增情况。建立小鼠皮肤移植模型,在双抗体治疗的同时加用抗CD20抗体祛除B细胞,观察对Tregs数量的影响。结果 继承性转移长期耐受小鼠的Bregs可诱导83.3%的小鼠长期耐受,但加用抗CD25 单抗后,胰岛移植物在较短时间(MST=20 d)内全部被排斥;继承性转移长期耐受小鼠Bregs可使Tregs数量明显增加(P<0.01),并且可诱导CD4+Foxp-T细胞表达Foxp3;用抗CD20抗体祛除B细胞后,双抗体诱导的皮肤移植受体小鼠体内Tregs数量明显减少(P<0.01)。结论 在双抗体诱导的移植耐受中,Bregs可能通过促进Tregs生成而延长移植物的存活。
移植耐受;调节性B细胞;T淋巴细胞,调节性
移植免疫耐受是指受者对移植器官抗原特异性应答的T 细胞与B 细胞,在抗原刺激下,不能被激活,不能产生特异性免疫效应细胞及特异性抗体,从而不能执行正常免疫应答的现象。20世纪50年代,Billingham等[1]首次在新生的小鼠模型中成功诱导了免疫耐受,这在免疫学的发展史上具有里程碑的意义 。在诱导免疫耐受的方法中,诱导抗原特异性的免疫调节细胞产生和增殖是一种有效的途径。负责免疫调控的细胞主要包括调节性T 淋巴细胞(regulatory T cells,Tregs)和调节性B 淋巴细胞(regulatory B cells,Bregs)。Tregs是不同于Th1和Th2的具有调节功能的T细胞群体,已有多项研究证实CD4+CD25+Treg具有免疫抑制作用。而近年来的研究表明,还存在有部分Bregs,也可通过其他多种调节机制,如分泌白细胞介素10(IL-10)、生长转化因子β(TGF-β)等,发挥免疫抑制功能,介导移植免疫耐受。本研究旨在探索此两类调节性免疫细胞之间的联系,有助于阐明Bregs与Tregs之间的相互作用机制,为建立以调节性细胞为基础的免疫治疗方式提供全新的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 WT C57BL/6小鼠(B6,H-2b) 55只,B细胞缺陷小鼠C57BL/6(μMT-/-B6,H-2b) 57只,BALB/c 小鼠(H-2d) 249只,Foxp3-GFP小鼠10只(C57BL/6背景),B6 RAG小鼠10只,以上小鼠均为雄性,体质量25~35 g,购于四川省医学科学院实验动物研究所,于清洁级的小鼠标准实验动物房饲养。
1.1.2 试剂 大鼠抗小鼠CD45RB抗体(HB220)、抗Tim-1抗体(RTM1-10)及抗CD25 抗体(PC61)购自美国Bio X Cell公司;抗CD20抗体(5D2)购自美国Genentech公司;LPS、链脲佐菌素(STZ)及Ficoll 400购自美国Sigma-Aldrich公司;Collagenase P购自美国Roche公司。 藻红蛋白(PE)标记的抗小鼠Foxp3 单克隆抗体、异硫氰酸荧光素(FITC)标记的抗小鼠CD4 单克隆抗体等免疫荧光染料均购自美国eBioscience 公司。MACS免疫磁珠B 细胞分离试剂盒购自德国Miltenyi Biotec公司。
1.2 方法
1.2.1 动物分组 (1)将接受胰岛移植的32只糖尿病受体B6 μMT-/-小鼠分为4组,每组8只,分别为无B细胞组、naive B细胞组、LTS B细胞组和LTS B细胞+PC61组。(2)将25只糖尿病受体B6 μMT-/-小鼠分为5组,每组5只。2组小鼠不接受胰岛移植,分别为naive B细胞组、LTS B细胞组;3组小鼠接受胰岛移植,分别为单纯移植组、移植+naive B细胞组、移植+LTS B细胞组。(3)将接受胰岛移植的10只糖尿病B6 RAG小鼠分为2组,每组5只,分别为CD4+Foxp3-GFP-T细胞+naive B细胞共输注组(naive B共转移组)和CD4+Foxp3-GFP-T细胞+LTS B细胞共输注组(Breg共转移组)。(4)将30只正常C57BL/6(B6)小鼠分为5组,每组6只,其中1组不进行皮肤移植,为naive组;其余4组分别为皮肤移植组、皮肤移植+双抗体组、皮肤移植+CD20组、皮肤移植+双抗体+CD20组。
1.2.2 胰岛移植 为建立小鼠胰岛移植模型,先将链脲佐菌素按200 mg/kg剂量注射于C57BL/6(B6)或B6 μMT-/-小鼠腹腔内,诱导糖尿病模型,Balb/C小鼠作为胰岛供体,用Collagenase P酶消化胰腺后再采用Ficoll 400 梯度分离法分离出胰岛细胞,手工挑选500个胰岛细胞移植到受体肾脏包膜下。抗Tim-1抗体500 μg在移植前1 d、300 μg在移植当天和第5天腹腔内注射;抗CD45RB抗体100 μg在移植后0、1、3、5、7 d腹腔注射;抗CD25抗体(PC61)250 μg在移植后1、6 d腹腔注射;抗CD20抗体 10 mg/kg 移植前8 d,5 mg/kg 移植当天腹腔注射。监测血糖,如连续2 d超过11.1 mmol/L,则判断为排斥。
1.2.3 皮肤移植 供体为BALB/c小鼠,受体为C57BL/6 小鼠。脱颈椎法处死供体BALB/c 小鼠,用剃毛器剃去背部鼠毛;取全厚度躯干部皮肤,组织剪和手术刀去除皮下脂肪及血管,剪成直径约为1 cm×1 cm的方形皮片,置于无菌PBS中备用。C57BL/6受鼠腹腔注射戊巴比妥纳(50 mg/kg)麻醉。制备受鼠背部移植床,将供体皮片置于移植床,缝合固定,无菌凡士林纱布覆盖,创可贴包扎固定,单笼饲养。抗CD45RB抗体和抗Tim-1抗体用法同胰岛移植,抗CD20抗体在移植前8、0 d,腹腔注射250 μg。每天观察移植物有无水肿、炎症、坏死、结痂和脱落等排斥情况,当移植皮片坏死超过80%即可认为完全排斥。
1.2.4 继承性细胞转移 (1)B细胞过继输注:分别取出双抗体治疗后胰岛移植物长期存活的受体小鼠,以及未使用任何治疗的野生小鼠脾脏,碾碎过滤后调成细胞悬液,用B细胞分离试剂盒及免疫磁珠细胞分选仪阴性选择出B细胞(纯度大于95%)。将5×106B细胞通过尾静脉注入受体B6 μMT-/-。(2)CD4+Foxp3-GFP-T细胞与B细胞联合过继输注: 取BALB/c小鼠胰岛移植到B6小鼠,并按上述方法注射抗Tim-1/抗CD45RB抗体诱导耐受。2周后,取受体小鼠和未经任何处理的B6小鼠脾脏,分别用磁珠分选获得Breg和naive B细胞。流式细胞仪分选Foxp3-GFP小鼠的CD4+Foxp3-GFP-T细胞,将4.5×106该细胞联合12×106分选出的Breg或naive B细胞经尾静脉注入接受移植的糖尿病B6 RAG小鼠。
1.2.5 流式细胞检测 获取脾脏,研磨后,用70 μm的尼龙网过滤,HBSS冲洗获得脾细胞悬液。裂解红细胞,洗涤,收集剩余细胞并用血细胞计数器计数。6孔板加含有0.1%叠氮化钠和2%胎牛血清的PBS,每孔加1×106个/mL。加入荧光标记的CD4,Foxp3抗体。Foxp3需固定破膜后再荧光标记。上机检测。
1.3 统计学处理 所有数据均采用GraphPad Prism 5.0版处理,生存分析采用Wilcoxon统计分析,CD4+Foxp3+Treg表达组间分析采用Student′st检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠排斥反应及生存时间比较 移植后未输注任何细胞的μMT-/-B6小鼠和输注naive B细胞的μMT-/-B6小鼠都在较短时间内发生排斥反应,最长存活天数分别为21、23 d。而输注了LTS B细胞的6只μMT-/-B6小鼠中,有5只(83.3%)移植物存活时间超过了100 d[平均存活时间(MST)≥37 d]。但是,用抗CD25 单抗(PC61)抑制CD25+Treg后,即使在移植当天同时接受LTS B细胞输注,受体μMT-/-B6小鼠也全部发生排斥,MST仅为23.2 d,见表1。
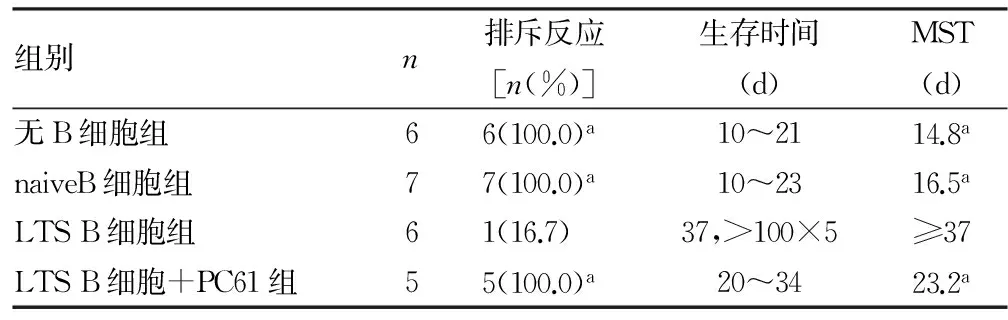
表1 各组小鼠排斥反应及生存时间比较
a:P<0.01,与LTS B细胞组比较。
2.2 各组小鼠脾脏中Foxp3+Treg数量比较 单纯移植组的小鼠、未移植的LTS B细胞组的小鼠,以及接受移植并输注了naive B细胞的小鼠脾脏中Foxp3+Treg数量均无明显增加。只有接受移植并输注了LTS B细胞的小鼠脾脏中的Foxp3+Treg明显增加(P<0.01),见图1。
2.3 Bregs诱导CD4+Foxp-T细胞表达Foxp3 CD4+Foxp3-GFP-T细胞与naiveB细胞共转移的小鼠脾脏内CD4+Foxp3+T细胞所占比例为7.37%,而与Breg共转移的小鼠脾脏内该细胞的比例为13.30%,后者达到前者的1.80倍,见图2。
2.4 去除Bregs导致双抗体诱导的Tregs减少 与只用双抗体诱导的皮肤移植组相比,加用抗CD20抗体祛除B细胞后,受体小鼠的CD4+T细胞中Foxp3+T细胞所占比例明显下降(P<0.01),见图3。
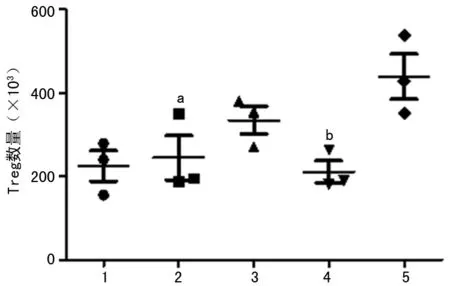
1:单纯移植组;2:naive B细胞组;3:LTS B细胞组;4:移植+naive B细胞组;5:移植+LTS B细胞组;a:P<0.05,b:P<0.01,与移植+LTS B细胞组比较。
图1 各组小鼠脾脏中Foxp3+Treg数量比较
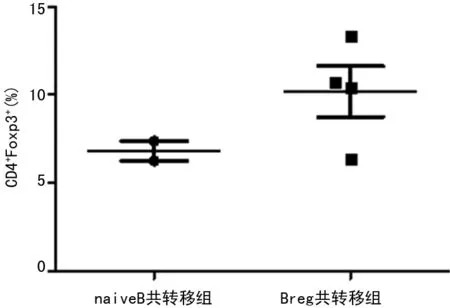
图2 Bregs诱导CD4+ Foxp- T细胞表达Foxp3
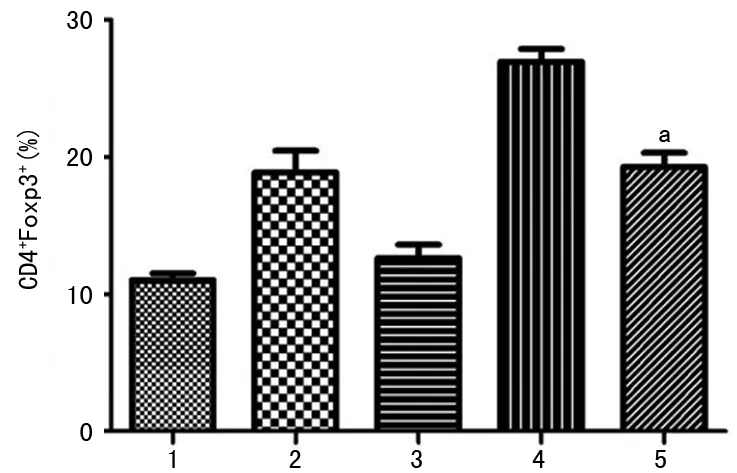
1:naive组;2:皮肤移植组;3:皮肤移植+CD20组;4:皮肤移植+双抗体组;5:皮肤移植+双抗体+CD 20组;a:P<0.01,与皮肤移植+双抗体组比较。
图3 祛除Bregs导致双抗体诱导的Tregs减少
3 讨 论
B细胞是另外一种最主要的免疫细胞,过去普遍认为其在获得性免疫反应过程中通过自身抗体或递呈抗原而扮演致病性角色。然而,新近研究证实部分B细胞也可发挥免疫抑制功能,介导移植免疫耐受,将这部分B细胞称为Bregs。在多个移植模型中,继承性转移B细胞可延长胰岛移植物的存活时间[2-4]。但Tregs在B细胞诱导的免疫耐受过程中的作用研究甚少。本研究在同种异体小鼠胰岛移植模型基础上,采用双抗体诱导形成长期耐受的小鼠,之后发现过继性输注LTS小鼠脾脏B细胞的确可诱导糖尿病B6 μMT-/-受体对胰岛移植物的耐受。但当Tregs的功能被抗体抑制后,耐受则不能形成,提示Bregs诱导耐受还需要Tregs的参与。
本研究进一步检测了过继性输注Bregs后Tregs的数量变化,发现移植后接受B细胞输注的受体小鼠脾脏中,CD4+Foxp3+T细胞数量与naive B共转移组相比有明显增加。并且,通过CD4+Foxp3-GFP-T细胞与B细胞的联合输注,证明Bregs在体内能够诱导Foxp3的表达,促进Tregs的增殖。此外,为了验证Tregs是受Bregs诱导而增加,本研究在小鼠同种异体皮肤移植模型中,用抗CD20抗体抑制B细胞,与作者的设想相符,B细胞被抑制后,双抗体诱导的Tregs显著减少,进一步证实了Bregs与Tregs之间存在相互作用的关系。在Langier等[5]的研究发现,B细胞可以诱导80%接受皮肤移植的小鼠形成耐受,且耐受个体的移植部位浸润的CD4+T细胞中90%为CD4+CD25+Foxp3+T细胞,该结果支持本研究中Bregs通过诱导CD4+Foxp3+Treg形成而促使移植物耐受的结论。
然而,Bregs到底是通过何种方式来促进CD4+Foxp3+Treg的增殖还尚未可知。Bregs最早提出是由于其可以分泌抑制性细胞因子IL-10,进而调控免疫应答[6-7]。这种B10细胞也是目前研究最为广泛,最被认可的一种Bregs的亚群。已有体外实验表明,IL-10对于Tregs的分化起促进作用[8-9]。同时,Carter等[10]发现患有自身免疫性关节炎的小鼠大量缺失可分泌IL-10的Bregs后,Foxp3+Treg的数量随之减少,从而导致其病情加重。由此作者猜测在本实验的移植模型中,Bregs也可能是通过分泌IL-10来诱导Tregs增加,但该猜想需要得到进一步的证实。
与上述猜想不符的是,Texier等[11]发现,输注耐受个体的B细胞能够诱导同种异体大鼠心脏移植耐受,并且可同时检测到移植受体外周血中有CD4+CD25+Treg细胞的积聚,但分泌IL-10的Bregs却没有增多。该结果提示,诱导Tregs形成的并非为IL-10,而可能是其他的细胞因子。早在2004年,日本的Sakaguchi[12]就证实TGF-β在免疫耐受中起重要作用,是一种有效的诱导Tregs的细胞因子。之后在一项关于小鼠气道过敏反应性疾病的体外实验中,研究人员选择性地转移了B细胞分泌的TGF-β后,小鼠的肺部炎症和哮喘均得到改善,并证实是由TGF-β诱导CD4+CD25-T细胞转变为CD4+CD25+Foxp3+Tregs,才使免疫反应得以抑制[13]。
此外,Kessel等[14]在一项关于人体Bregs与Tregs的体外研究中发现,虽然TGF-β可以诱导Tregs表达Foxp3,但并非是通过细胞因子来间接发挥作用,Bregs与Tregs直接的细胞接触才是诱导Tregs扩增的主要机制,因为当两种细胞分开培养时,Foxp3的表达几乎没有增加。
目前,国内外对Bregs与Tregs的相关性研究中,大多数均围绕体外试验或自身免疫性疾病。而在移植免疫领域,尤其是针对实验动物模型的体内研究则少有报道。本研究中,在建立大量的实体动物移植模型的基础上,得出了Bregs可能促进Tregs的扩增而延长移植物存活的结论。为更进一步阐明移植免疫耐受机制提供了新的思路,同时丰富了移植免疫耐受机制的基础理论。然而,在接受移植的受体内部环境中,Bregs与Tregs是否也通过IL-10或TGF-β相互作用;是否还存在其他相关细胞因子的参与;Bregs与Tregs直接接触的具体作用机制,如是否存在特定的信号通路;以及是否还存在其他可能的作用机制等问题都有待进一步研究。
[1]BillinghamRE,BrentL,MedawarPB.Activelyacquiredtoleranceofforeigncells[J].Nature,1953,172(4379):603-606.
[2]Ding Q,Yeung M,Camirand G,et al.Regulatory B cells are identified by expression of TIM-1 and can be induced through TIM-1 ligation to promote tolerance in mice[J].J Clin Invest,2011,121(9):3645-3656.
[3]Lee KM,Kim JI,Stott R,et al,Anti-CD45RB/anti-TIM-1-induced tolerance requires regulatoryB cells[J].Am J Transplant,2012,12(8):2072-2078.
[4]Rowe V,Banovic T,MacDonald KP,et al,Host B cells produce IL-10 following TBI and attenuate acute GVHD after allogeneic bone marrow transplantation[J].Blood,2006,108(7):2485-2492.
[5] Langier S,Galvani RG,Alves AP,et al.Prolonged acceptance of skin grafts induced by B cells places regulatory T cells on the histopathology scene[J].Braz J Med Biol Res,2012,45(10):942-947.
[6]Wolf SD,Dittel BN,Hardardottir F.and Janeway,C.A.Jr.1996.Experimental autoimmune encephalomyelitis induction ingenetically B cell-deficient mice[J].J Exp Med,1996,184(6):2271-2278.
[7]Yanaba K,Bouaziz JD,Haas KM,et al.A regularory B cell subset with a unique CD1d hi CD5+phenotype controls T cell-dependent inflammatory responses[J].J Immunity,2008,28(5):639-650.
[8]Levings MK,Sangregorio R,Galbiati F,et al.Ifn-alpha and IL-10 induce the differentiation of human type 1 T regulatory cells[J].J Immunol,2001,166(9):5530-5539.
[9]秦瑶,张梅.小鼠B10细胞的分离、鉴定及功能特征[J].中华微生物学和免疫学杂志,2013,33(11):819-827.
[10]Carter NA,Vasconcellos R,Rosser EC,et al.Mice lacking endogenous IL-10-producing regulatory B cells develop exacerbated disease and present with an increased frequency of Th1/Th17 but a decrease in regulatory T cells[J].J Immunol,2011,186(10):5569-5579.
[11] Texier LL,Thebault P,Lavault A,et al.Long-term allograft tolerance is characterized by the accumulation of B cells exhibiting an inhibited profile[J].Am J Transplantation,2011,11(3):429-438.
[12]Sakaguchi S.Naturally arising CD4+regulatory T cells for immunologic self-tolerance and negative control of immune responses[J].Annu Rev Immunol,2004,22(22):531-562.
[13]Singh A,Carson WF,Secor ER Jr,et al.Regulatory role of B cells in a murine model of allergic airway disease[J].J Immunol,2008,180(11):7318-7326.
[14]Kessel A,Haj T,Peri R,et al.Human CD19+CD25high B regulatory cells suppress proliferation of CD4+T cells and enhance Foxp3 and CTLA-4 expression in T-regulatory cells[J].Autoimmun Rev,2012,11(9):670-677.
Dependence relationship between regulatory B cells and regulatory T cells in transplantation immune tolerance*
LiShurong1,2,ZhaoGaoping1,3△,YangMaozhu2,WeiLingling2,DengShaoping1,2
(1.MedicalSchool,UniversityofElectronicScienceandTechnology,Chengdu,Sichuan610054,China; 2.InstituteofOrganTransplantation,SichuanProvincialAcademyofMedicalScience/SichuanProvincialPeople′sHospital/AffiliatedHospital,UniversityofElectronicScienceandTechnology,Chengdu,Sichuan610072,China;3.DepartmentofGastrointestinalSurgery,SichuanAcademyofMedicalScience·SichuanProvincialPeople′sHospital/AffiliatedHospital,UniversityofElectronicScienceandTechnology,Chengdu,Sichuan610072,China)
Objective To investigate the relationship between regulatory B cells (Bregs) and regulatory T cells(Tregs) in transplantation tolerance induced by dual anti-CD45RB/anti-TIM-1 antibody.Methods The longterm murine islet allograft transplant models from BALB/c to C57BL/6 were established.B cells purified from longterm survivors (LTS)were adoptively transferred to grafted B cell-deficient μMT-/-B6 recipients and treated with or without PC61.The allograft survival time was analyzed and the number of Foxp3+Treg cells was examined by flow cytometry.Murine skin allograft transplant models was established and treated with dual antibody.The change of the percentage of Treg cells was observed after B-cell depletion using anti-CD20 antibody.Results Adoptive transfer of Bregs in longterm tolerated murines could induce longterm tolerance in 83.3% of murines.But after adding CD25m monoclonal antibody,islet grafts were completely rejected in a short time(MST=20 d);adoptive transfer of Bregs in longterm tolerated murines could increase the Tregs number(P<0.01),moreover could induce CD4+Foxp-T cell to express Foxp3;after deleting B cells with CD20 antobody,Tregs cells number in the skin transplant recipient murine induced by dual antibody was remarkably reduced (P<0.01).Conclusion In transplantation tolerance induced by dual antibody,Breg cells may prolong the graft survival time possibly through promoting Treg generation.
transplantation tolerance;regulatory B cells;T-lymphocytes,regulatory
� 著·
10.3969/j.issn.1671-8348.2017.07.002
国家自然科学基金资助项目(81172832,81571565);四川省杰出青年基金资助项目(2013JQ0020);四川省青年科技创新团队专项计划(2014TD0010);四川省卫生和计划生育委员会课题(110190)。 作者简介:李姝蓉(1992-),在读硕士研究生,主要从事胰岛移植相关免疫细胞研究。△
,E-mail:gzhao@uestc.edu.cn。
R392.4
A
1671-8348(2017)07-0868-03
2016-08-26
2016-11-09)

