ITS2序列作为DNA条形码鉴定紫堇属植物的有效性研究
王丹依陈京徐攀李冉夏娇丽赵伟春
1.浙江中医药大学生命科学学院 杭州 310053 2.浙江省中医药研究院
ITS2序列作为DNA条形码鉴定紫堇属植物的有效性研究
王丹依1陈京1徐攀2李冉1夏娇丽1赵伟春1
1.浙江中医药大学生命科学学院 杭州 310053 2.浙江省中医药研究院
[目的]利用DNA条形码技术对6种紫堇属植物进行分子鉴定,评价内转录间隔区2(internal transcribed spacer 2,ITS2)序列对紫堇属植物的鉴别能力。[方法]从江苏南京、安徽合肥、浙江磐安、浙江缙云等地采集紫堇(Corydalis edulis)、黄堇(C.pallida)、小花黄堇(C.racemosa)、延胡索(C. yanhusuo)、东北延胡索(C.ambigua)和刻叶紫堇(C.incisa)6种紫堇属植物共29份样品。提取其DNA后用ITS2序列的通用引物进行PCR扩增并测序,运用CodonCode Aligner软件拼接和校对序列,MEGA5.1软件分析序列并构建K2P模型的邻接树。[结果]ITS2序列对所研究的29个样品的扩增和测序成功率均为100%。ITS2序列长度在225bp~248bp间,保守位点190个,变异位点71个,变异比例为27.2%。首次扩增获得小花黄堇和紫堇的ITS2序列并上传至GenBank。6个物种的种内遗传距离为0~0.0206,种间遗传距离为0.0403~0.1678,小花黄堇和黄堇的遗传距离最小;黄堇与刻叶紫堇的遗传距离最大。不同物种在邻接树中各自进化为单系。6种紫堇属植物的ITS2二级结构均有不同程度的差异。[结论]ITS2序列能够准确鉴定紫堇、黄堇、小花黄堇、延胡索、东北延胡索和刻叶紫堇这6种紫堇属植物,对中药鉴定具有潜在的应用价值。
紫堇属;DNA条形码;ITS2;遗传距离;分子鉴定
紫堇属(Corydalis DC.)隶属于罂粟科,为1年生、2年生或多年生草本,约428种。我国有298种,归入38组,南北各地均有分布,但以西南部最集中,产于青藏高原的约有120种,其中西藏就约有94种。浙江有15种,1变种,1变型,其中具有药用价值的有12种[1]。比较常见的中药有延胡索(C.yanhusuo)、夏天无(C.decumbens)和苦地丁(C.bungeana)等,具有清热解毒、止血镇痛、活血散瘀、祛风利气等功效。
紫堇属植物在形态上较为相似,无花时很难区别,极易混淆[2]。目前,关于紫堇属物种的鉴定方法主要有性状鉴别、显微鉴别、理化鉴别[3-5]等。随着现代分子生物学的发展,DNA条形码技术以其对生物物种鉴别具有高效、简便、客观等特点,为药用植物的鉴定提供了新的视野。DNA条形码概念由加拿大分类学家 Paul Hebert于2003年首次提出[6],是一种用基因组中的一段标准的、相对较短的DNA片段作为物种标记来鉴定物种的新方法,在不同物种间具有通用性。该技术在动物中已经得到广泛应用,在植物中的研究也正在快速发展,选择和评价可能的条形码片段是当前研究的热点。大量的样本研究表明内转录间隔区2(internal transcribed spacer 2,ITS2)作为候选条形码能较好的鉴定药用植物[7-9]。
本研究选取ITS2序列对江浙一带野外采集的6种紫堇属植物进行物种鉴别,考察该序列对该属植物的鉴定能力,以期建立快速准确鉴定该属植物的分子方法,确保临床用药的安全性。
1 材料
1.1 实验材料 29份紫堇属样品采自江苏南京、安徽合肥、浙江磐安、浙江缙云等地,经浙江中医药大学姚振生教授和浙江省中医药研究院浦锦宝副研究员依据形态学分类标准鉴定为紫堇、黄堇、小花黄堇、刻叶紫堇、延胡索和东北延胡索。样品编号、名称、采集地,见表1。样品经鉴定后用硅胶干燥保存。GEN BIOTECH CO.,LTD,批号:DP130227;2×Taq Master Mix购自北京康为世纪生物科技有限公司,批号:1312L;ITS2序列扩增引物:F-Primer:5’-ATGCGATACTTGGTGTGAAT-3’,R-Primer:5’-GACGCTTCTCCAGACTACAAT-3’由上海生物工程公司合成;2000DNA Marker购自上海莱枫生物科技有限公司,批号:G0417;琼脂糖购自基因有限公司,批号:111860;硅胶购自苏州盛达干燥剂厂,批号:201173021。
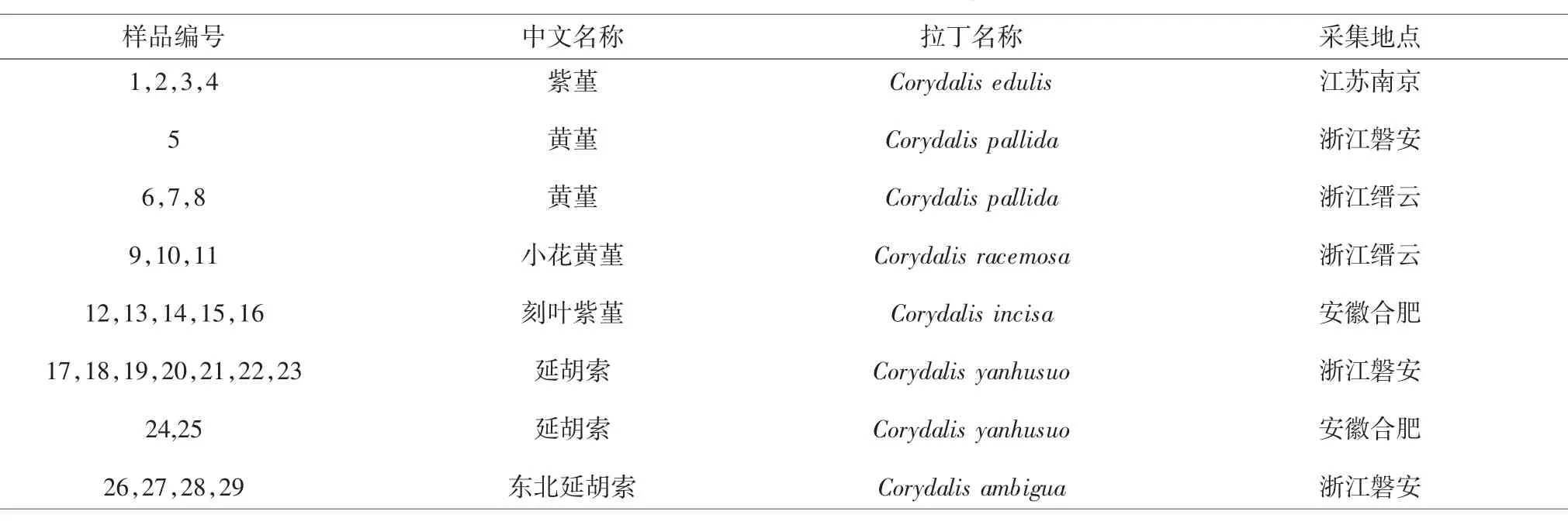
表1 紫堇属植物样品信息Tab.1 Information of Corydalis samples
1.3 仪器 混合球磨仪(MM400型,Retech-德国);电泳仪(DYY-6C型,北京市六一仪器厂);凝胶成像仪(Tanon-2500型,天能科技(上海)有限公司)。
2 方法
2.1 DNA提取 取经硅胶干燥的植物茎叶20mg~30 mg,置于1.5mL离心管中,加入2个直径2mm的钢珠,使用混合球磨仪研磨(30次/s,2min),植物基因组DNA提取试剂盒提取DNA。
2.2 PCR扩增 PCR反应体系(25 μL):2×Taq Master Mix 12.5μL,F-Primer 1μL,R-Primer 1μL,DNA模板(20ng·μL-1)2 μL,ddH2O 8.5μL。PCR反应条件:预变性94℃ 10min,变性94℃ 30s,退火56℃30s,延伸72℃ 30s,35个循环,再延伸72℃ 10min。
2.3 琼脂糖凝胶电泳 分别取5μL PCR扩增产物进行1.5%的琼脂糖凝胶电泳,以DL2000 DNA Marker作为分子量标准,凝胶成像仪观察DNA片段并拍照。
2.4 PCR产物测序及分析 PCR产物由上海美吉生物公司进行双向测序。测序引物同于PCR扩增引物,测序结果采用Codoncode Aligner软件进行校对拼接,去除低质量序列及引物区;利用MEGA5.1软件进行序列对比、变异位点分析,再计算遗传距离及构建邻接树[10]。用1000次重复bootstrap检验系统发育邻接树各分支的支持率,以支持率≥50%为阈值作为成功鉴别物种的界限[11]。根据ITS2数据库(http://its2.
1.2 试剂 植物基因组DNA提取试剂盒购自TIAN-bioapps.biozentrum.uni-wuerzburg.de/)预测ITS2二级结构,并分析结构上的差异。
3 结果
3.1 ITS2序列通用引物对样品的PCR扩增29份紫堇属植物样品均能用ITS2序列通用引物进行有效地PCR扩增,各样品均得到单一的高亮度条带,PCR扩增片段大小为450bp~470bp,符合PCR产物测序要求。
3.2 PCR扩增产物的测序、拼接及图谱解析 29个样品PCR扩增产物的测序成功率为100%。采用Codoncode Aligner软件对同一样品双向测序结果进行拼接、组装,并与ITS2序列数据库进行比对,解析PCR扩增产物的组成(部分结果见图1、2),再去除扩增产物两端的序列,得到各样品的ITS2序列并上传至GenBank。1~3号样品(紫堇)的ITS2序列完全相同,与4号样品(紫堇)存在1个碱基差异,长度均为243bp;5、6、8号样品(黄堇)的ITS2序列完全相同,与7号样品(黄堇)存在1个碱基差异,序列最长,均为248bp;9~11号样品(小花黄堇)的ITS2序列完全相同,序列长度为236bp;12~14号样品(刻叶紫堇)的ITS2序列相同,与15、16样品(刻叶紫堇)存在1个碱基差异,长度均为228bp;样品17~23(延胡索)的ITS2序列完全相同,长度为238bp,样品24(延胡索)的ITS2长度为242bp,样品25(延胡索)的ITS2长度为244bp;样品27、28(东北延胡索)的ITS2序列相同,与样品26(东北延胡索)存在1个碱基差异,长度均为226bp,样品29(东北延胡索)的ITS2序列最短,长度为225bp。
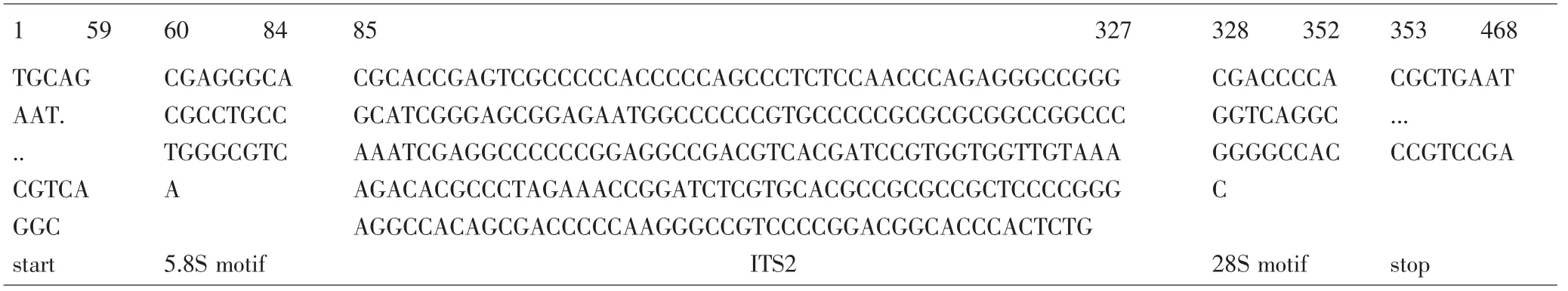
图1 样品1、2、3 PCR扩增产物的解析图谱Fig.1 PCR amplification sequence of sample 1,2 and 3
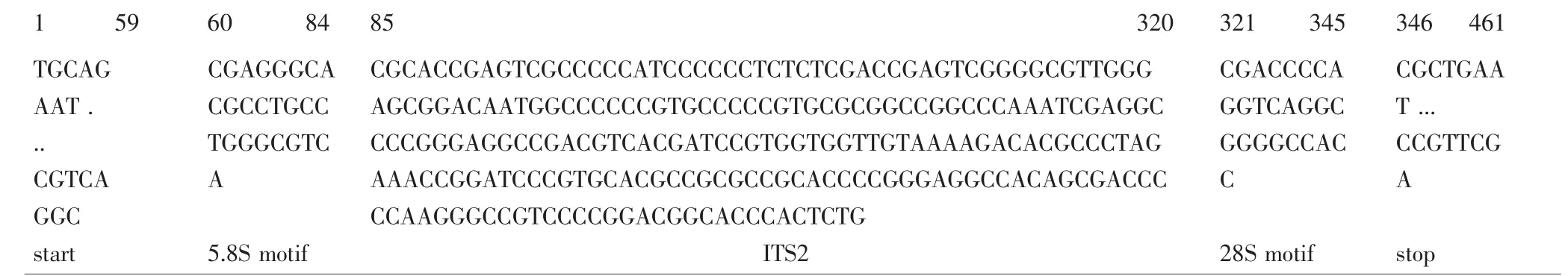
图2 样品9、10、11 PCR扩增产物的解析图谱Fig.2 PCR amplification sequence of sample 9,10 and 11
3.3 ITS2序列的多序列比对分析 如图3所示,29个样品ITS2序列的保守位点190个,变异位点71个,变异比例27.2%。江苏南京采集的紫堇样品(编号1~4)与川鄂黄菫(C.wilsonii,登录号:LN610772)和地柏枝(C.cheilanthifolia,登录号:HE603320)的同源性均为99%。浙江缙云和浙江磐安采集的黄堇样品(编号5~8,248bp)与GenBank中黄菫ITS2序列(登录号:X85446,147bp)相似性为59%。两者在+106、+124、+ 187、+197、+220、+223、+225、+226、+227、+237、+241碱基处有差异。浙江缙云采集的小花黄菫样品(编号9~11)与地柏枝相应序列(登录号:HE603320)同源性为99%,与紫堇样品(编号1~4)在+19、+27、+28、+ 30、+36、+38、+42、+43、+44、+46、+48、+55、+57、+59、+ 77、+99、+127、+185、+205碱基处有差异。安徽合肥的刻叶紫堇样品(编号12~16)与GenBank中刻叶紫堇相应序列(登录号:FJ469599,DQ912889)的同源性为100%。浙江磐安和安徽合肥采集的延胡索(编号17~ 25)与 GenBank中延胡索 ITS2序列(登录号:KT898276)的同源性为100%。浙江磐安采集的东北延胡索样品(编号26~29)与GenBank中东北延胡索ITS2序列(登录号:FJ469597)的同源性为100%。
3.4 遗传距离分析 如表2所示,6种紫堇属植物的种内遗传距离为0~0.0206,种间遗传距离为0.0403~0.1678,小花黄堇和黄堇的种间遗传距离最小,黄堇与刻叶紫堇的种间距离最大。6种植物ITS2序列的最小种间遗传距离明显大于最大种内遗传距离。
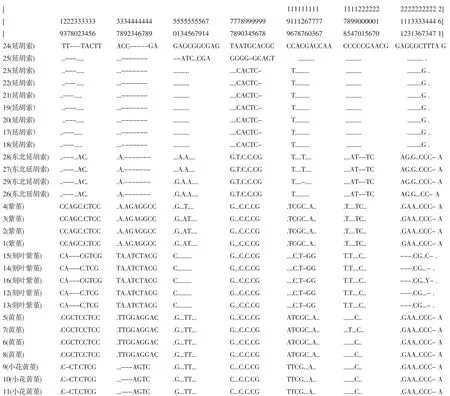
图3 紫堇属植物ITS2序列比对图Fig.3 Comparison of ITS2 sequence among Corydalis
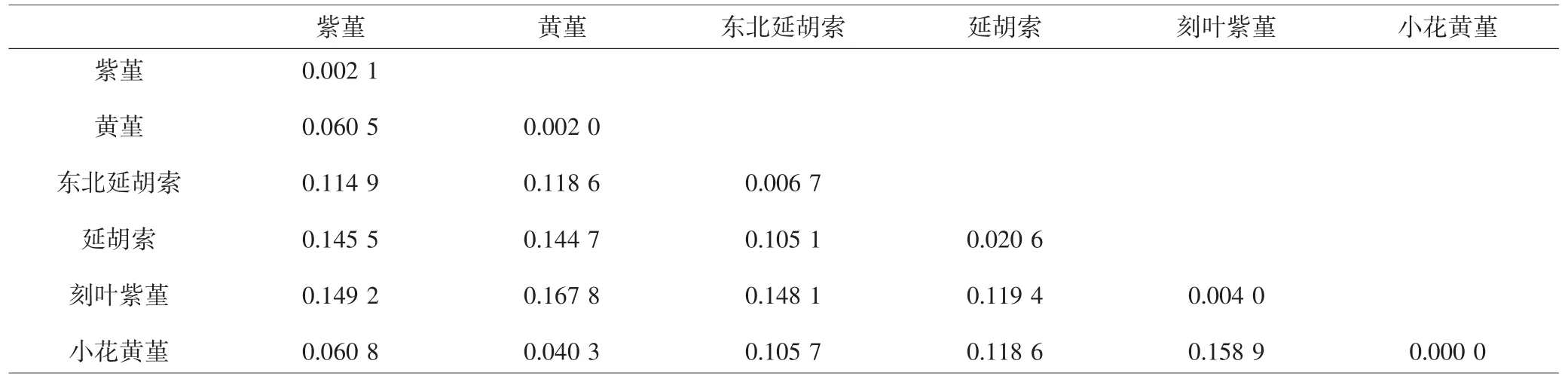
表2 紫堇属植物ITS2序列种内与种间相对遗传距离Tab.2 Inter-specific and intra-specific genetic distance of ITS2 in Corydalis
3.5 系统发育树的构建 如图4所示,各物种的不同样品均先聚为一支。在此基础上,紫堇与黄堇聚为一支,后又与小花黄堇聚为一支,表明三者亲缘关系较近,并与东北延胡索聚为一大支。其他不同来源的延胡索先聚为一支,后又与刻叶紫堇聚为一支。从系统发育邻接树可以看出不同物种的样本可以明确区分,形成层次分明,互不重叠的邻接树。
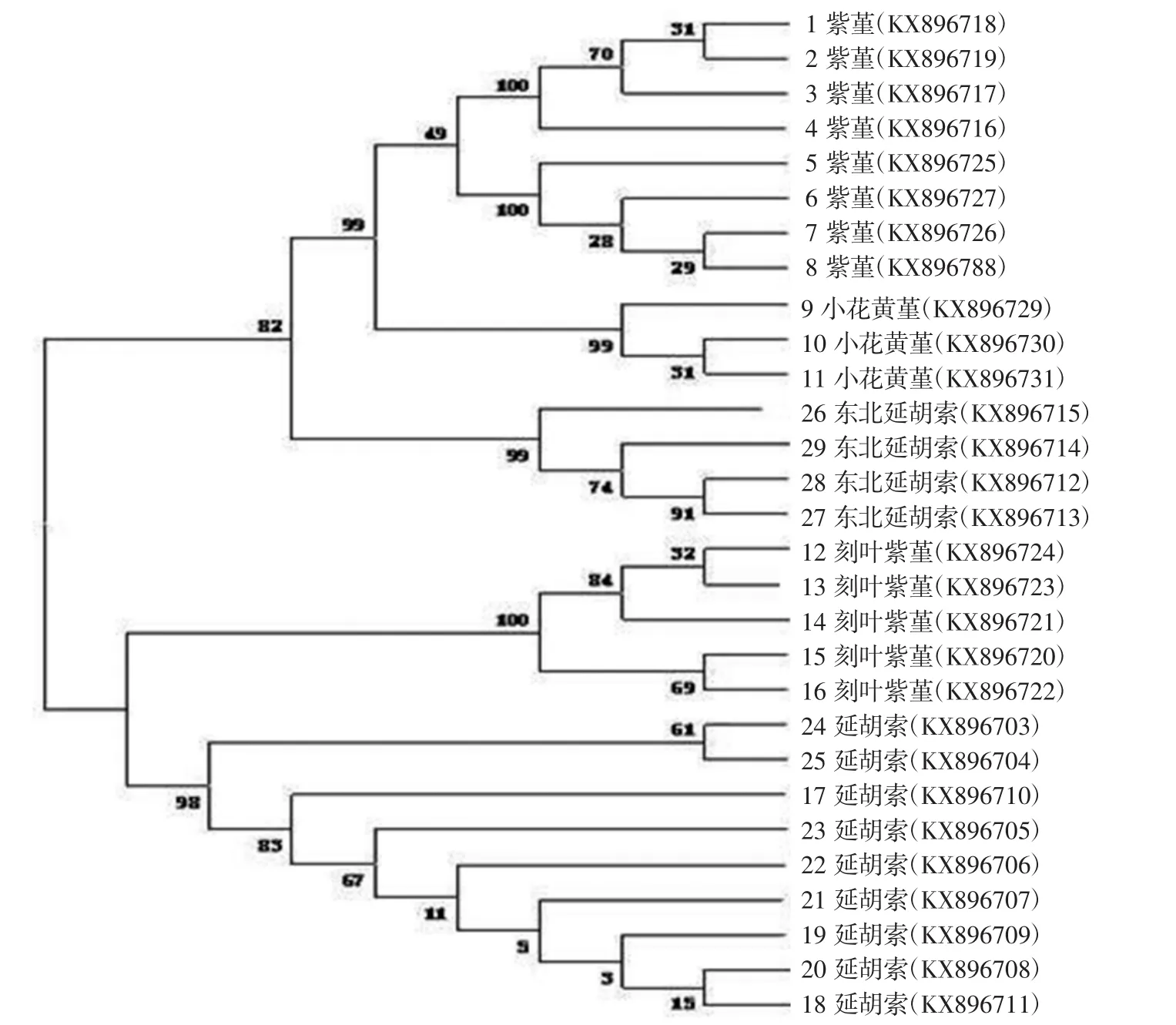
图4 基于ITS2序列构建的紫堇属植物的邻接树Fig.4 NJ-tree of Corydalis based on ITS2 sequence
3.6 二级结构的初步分析 结果见图5。延胡索、东北延胡索和刻叶紫堇3种植物的二级结构相似,均为中心一个主环连接4个侧链,但4个侧链又存在细微差异,可以相互区分。黄堇和小花黄堇的结构较为相似,但侧链结构存在差异。因此,该6种紫堇属植物可通过ITS2二级结构区分出来。
4 讨论
紫堇属植物具有较高的药用价值,但其形态又较相似。因此,准确鉴定各物种具有重要意义。本实验采用ITS2作为DNA条形码对紫堇属植物进行分子鉴定,获得了6种紫堇属植物的ITS2序列,其中包括小花黄堇和紫堇。在GenBank中有小花黄堇和紫堇的叶绿体基因组psbA-trnH序列,但未检索到两者的ITS2序列。本实验首次获得小花黄堇和紫堇的ITS2序列。进一步与GenBank中的ITS2序列进行比对分析表明,上述两个物种的ITS2序列与其他近缘种ITS2序列均具有良好的区分度,这为小花黄堇和紫堇的分类鉴定提供了新的、可靠的方法和手段,研究工作具有重要的科学意义。
紫堇花为粉红色、紫红色、紫色,黄菫的花为黄色,但二者均为具主根,地下无块茎,叶多为羽状分裂,苞片膜质,花距短,柱头常横向两臂,因此紫堇与黄菫同列为黄菫亚属[12]。本文ITS2序列聚类分析表明,紫堇与黄堇聚为一支,这与上述形态学鉴定的结果一致。在BLAST比对中,小花黄菫与地柏枝的同源性较高,这与形态学鉴定中将两者均列于小花黄堇组,亲缘关系较近相一致。东北延胡索聚为一支,不同来源的延胡索先聚为一支,后又与刻叶紫堇聚为一支,这一结果亦与这三个物种形态分析、文献考证等结果一致[13]。
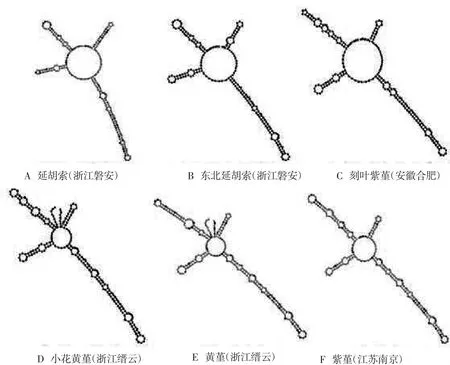
图5 紫堇属植物ITS2二级结构图Fig.5 Second structure of ITS2 of Corydalis
根据本文ITS2序列的多序列比对分析和系统邻接树的结果(图3和图4)可知,采自安徽合肥的2个延胡索样品(编号24、25)及采自浙江缙云的7个延胡索样品(编号17~23)分别聚为一支后再聚在一起;采自浙江缙云的3个黄堇样品(编号6~8)先聚为一支后再与采自浙江磐安的1个黄堇样品(编号5)聚在一起,而本实验中所有的样品均为非栽培种,表明同一物种在不同地域的遗传变异大于该物种在同一地域内的遗传变异,这可能反映不同地域的土壤、气温等外部环境条件对物种进化的影响。
在本实验中,黄菫的ITS2序列与GenBank中黄菫ITS2序列(登录号:X85446)相似性仅为59%,经比对发现GenBank中黄菫ITS2序列较本实验的4个黄菫样品缺失+1~+100碱基,该序列检测时间较早(1995年),序列可能并不完整。此外,GenBank中也未见该样品ITS2序列扩增的引物序列、样品的采集地等相关信息,这有待于进一步考证。
本文构建的邻接树中,6种植物均能很好的各自形成单系,样品间变异度适中,且其种间、种内遗传距离差异较大,结果表明ITS2序列的通用性较好。此外,ITS2序列可以进行RNA二级结构预测,解决高级分类阶元的多重序列对比困难的问题,其二级结构也有一定的鉴定应用价值。因此,ITS2序列适合作为鉴定该6种紫堇属植物的DNA条形码。但要确定ITS2序列是否对所有紫堇属植物都有鉴定效果,则需进一步扩大样本采集量来进行验证。
References:
[1] 姚振生,熊耀康.浙江药用植物资源志要[M].上海:上海科学技术出版社,2016:138-139. YAO Zhensheng,XIONG Yaokang.The medicinal plant resources of Zhejiang[M].Shanghai:Shanghai scientific and technical publishers,2016:138-139.
[2] 崔艳.延胡索与其四种混淆品的鉴别研究[J].中国民族民间医药,2009(23):20-23. CUI Yan.Identification study of Corydalis and its adulterants[J].Chinese Journal of Ethnomedicine and Ethnopharmacy,2009(23):20-23.
[3] 张燕.浙江紫堇属6种药用植物叶的表皮鉴定[J].北京联合大学学报,2011,25(2):47-49. ZHANG Yan.Leaf Epidermis Microscopic Identification to Six Kinds of Zhejiang Corydalis Medicinal Plants[J].
Journal of Beijing Union University,2011,25(2):47-49.
[4] 徐海波,张晓维,孙超,等.小黄紫堇的化学成分研究[J].中国药房,2013(35):3321-3322. XU Haibo,ZHANG Xiaowei,SUN Chao,et al.Chemical Constituents from Corydalis raddeana[J].China Pharmacy, 2013(35):3321-3322.
[5] 吕子明,孙武兴,段绪红,等.延胡索化学成分研究[J].中国中医药杂志,2012,37(2):22-27. LU Ziming,SUN Wuxing,DUAN Xuhong,et al.Chemicalconstituents from Corydalis yanhusuo [J].China Journal of Traditional Chinese Medicine and Pharmacy, 2012,37(2):235-237.
[6] Hebert PDN,Cywinska A,Ball SL,et al.Biological identifications through DNA barcodes[J].Proc R Soc Biol Sci SerB,2003,270:313.
[7] 于华会,杨志玲,杨旭,等.药用植物种质资源ITS序列研究进展[J].中草药,2010,41(3):491-496. YU Huahui,YANG Zhiling,YANG Xu,et al.Advances in studies on ITS sequence of medicinal plants germplasm resources[J].Chinese Traditional and Herbal Drugs,2010,41(3):491-496.
[8] Chen SL,Yao H,Han JP,et al.Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species[J].PLoS ONE,2010,5(1):e8613.
[9] 陈士林,宋经元,姚辉,等.药用植物DNA条形码鉴定策略及关键技术分析[J].中国天然药物,2009,7(5):322-327. CHEN Shilin,SONG Jingyuan,YAO Hui,et al.Strategy and key technique of identification of Chinese herbal medicine using DNA barcoding[J].Chinese Journal of Natural Medicines,2009,7(5):322-327.
[10]Kumar S,Nei M,Dudley J,et al.MEGA:a biologistcentric software for evolutionary analysis of DNA and protein sequences[J].Brief Bioinform,2008,9(4):299-306.
[11]郭静,王超,张宏彬,等.系统发生树构建方法综述[J].计算机应用研究,2013,30(3):648-654. GUO Jing,WANG Chao,ZHANG Hongbin,et al.Review of phylogenetic tree construction[J].Application Research of Computers,2013,30(3):648-654.
[12]王英伟.紫堇属的系统学研究[D].中国科学院植物研究所,2006. WANG Yingwei.Systematic study of the Corydalis DC [D].Institute of Botany,Chinese Academy of Science, 2006.
[13]徐攀,姚振生,陈京.紫堇属药物的本草考证[J].中华中医药杂志,2012,27(3):540-543. XU Pan,YAO Zhensheng,CHEN Jing.Herbalogical textual research on Corydalis DC[J].China Journal of Traditional Chinese Medicine and Pharmacy,2012,27(3):540-543.
Validation of the ITS2 Region as a Novel DNA Barcode for Identifying the Genus Corydalis
WANG Danyi1,CHEN Jing1,XU Pan2,et al 1.College of LifeSciences,Zhejiang Chinese Medical University,Hangzhou(310053),China;2.Science Technology Department of Zhejiang Province
[Objective]Using DNA barcoding technology to identify 6 species of the genus Corydalis,and evaluate the identification ability of the ITS2 sequence.[Methods]Twenty-nine samples of Corydalis edulis,C.pallida,C.racemosa,C.yanhusuo,C.ambigua and C.incise were collected from Nanjing Jiangsu,Hefei Anhui,Pan'an Zhejiang,and Jinyun Zhejiang,respectively.The genomic DNA extracted from the plants was PCR amplified with the universal primers of ITS2.Sequences were assembled and proofread using the CodonCode Aligner and analyzed by MEGA 5.1.The neighbor-joining(NJ)phylogenetic tree was constructed based on the Kimura-2-parameter model.[Results]ITS2 regions of all samples were successfully PCR amplified and sequenced.The lengths of them were 225bp~248bp.The conserved sites of them were 190.The variable sites were 71.The variation ratio was 27.2%.ITS2 sequences of C. edulis and C.racemosa were amplified for the first time and uploaded to GenBank.The intra-specific genetic distance of all samples was 0~0.0206.The inter-specific genetic distance of them was 0.0403~0.1678.The inter-specific genetic distance between C.racemosa and C.pallida was the smallest.The inter-specific genetic distance between C.pallida and C.incisa was the largest.Each species showed monophyletic on NJ-tree.The ITS2 secondary structure of each species was different.[Conclusion]ITS2 region as a barcode can accurately identify the genus Corydalis,and has a potential value of application for identification of traditional Chinese medicine.
Corydalis;DNA barcodes;ITS2;genetic distance;molecular identification
R331
:A
:1005-5509(2017)02-0097-06
10.16466/j.issn1005-5509.2017.02.001
2016-09-21)
浙江省科技计划项目 (2015C32076);国家中医药管理局项目 (201407002);浙江省中医药科技计划项目(2014PCZX004)
Fund projects:Science and Technology Plan ofZhejiang Province(2015C32076);State Administration ofTraditional Chinese MedicineofChina(201407002);TraditionalChinese Medicine Science and Technology Plan ofZhejiang Province (2014PCZX004)
赵伟春,E-mail:weichunzhao@hotmail.com

