TSHR在甲状腺乳头状癌中的表达及其临床意义
许少伟 杨熙鸿 刘木元 彭汉伟
TSHR在甲状腺乳头状癌中的表达及其临床意义
许少伟 杨熙鸿 刘木元 彭汉伟
目的 探讨促甲状腺激素受体(thyroid stimulating hormone receptor,TSHR)在甲状腺乳头状癌原发灶(papillary thyroid carcinomas,PTC)及对应转移淋巴结(lymph nodes,LN)中表达及其意义。方法 采用免疫组化法,检测45例PTC及LN标本中TSHR表达情况。统计学方法采用Wilcoxon 带符号秩检验、 Kruskal-Wallis法检验、卡方检验及logistic回归方法。结果 PTC中TSHR阳性表达率高于LN,分别为88.9%和68.9%,P=0.02。PTC中TSHR阳性细胞数、阳性强度、半定量积分均高于LN,分别为3±1.05、2±0.96、6±4.51和2±1.25、2±0.91、4±4.08,P=0.03、0.02、0.01。T1~2组、N1b组的LN TSHR表达半定量积分低于T3~4组,N1a组。侵袭性是LN中TSHR的强阳性表达与否的独立影响因素。结论 TSHR在PTC阳性表达率高于LN。N1b组、T1~2组的LN TSHR表达低于N1a组、T3~4组。
促甲状腺激素受体;甲状腺乳头状癌;转移淋巴结;免疫组织化学
(ThePracticalJournalofCancer,2017,32:196~199)
近年来,甲状腺癌的发病率显著升高,已为常见的恶性肿瘤之一。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的病理类型[1-3]。目前,PTC的治疗以手术为主,而内分泌治疗(TSH抑制治疗) 和131I治疗也扮演着越来越重要的角色[2,4-5]。研究报道,TSH抑制治疗及131I治疗的理论依据均与促甲状腺激素受体(TSHR)的功能和调控有关[6-8]。TSH作用于细胞膜表面的TSHR后,TSHR被激活后,才能进一步激活NIS受体,从而促进甲状腺癌细胞对碘的吸收。TSH抑制治疗和131I治疗的有效性可能与癌组织的TSHR水平呈正相关关系。因此,了解癌组织TSHR水平可以帮助预测治疗疗效,利于治疗手段的个体化选择。本研究在于了解PTC原发灶和转移淋巴结TSHR表达水平的差异分析及其与临床参数的关系,为探索PTC的个体化TSH抑制治疗和131I治疗提供参考。报告如下。
1 材料与方法
1.1 入组标准
1997年6月至2012年6月我科共收治甲状腺乳头状癌575例。符合下列条件者入组:①初次治疗;②术后病理确诊为PTC,并伴有颈部淋巴结转移者,即T1-4N1a-1bM0;③无合并其它恶性肿瘤;④术前未使用甲状腺素;⑤临床资料完整,原发灶和转移淋巴结的石蜡标本保存完好;⑥在本科行原发灶根治性切除+中央区清扫术(n=22例)或原发灶根治性切除+中央区清扫+侧颈改良清扫术(n=23例)。符合入组标准病例共45例。
1.2 试剂与方法
所有石蜡标本都采用4 μm切片,HE染色确认原发灶及对应多枚(中央区或侧颈部)淋巴结可见癌组织,分别取相邻切片行TSHR免疫组化染色。免疫组化按照常规技术完成,鼠抗人TSHR单克隆抗体及免疫组化盒为北京奥博森生物有限公司产品,增强型DAB显色盒为基因科技(上海)有限公司产品。以己知阳性的病理切片作为阳性染色对照,以磷酸盐缓冲液代替I抗为阴性空白对照。
1.3 判定标准
免疫组化结果判定采用盲法:结果由未知患者临床参数的病理科医生阅片判定。在光学显微镜下观察,以细胞膜和(或)细胞质染成棕黄色为阳性细胞。阳性细胞百分数评分:在光镜下随机选取5个视野,每个视野计数100个细胞,记录阳性细胞百分数:≤5%为0分;6%~25%为1分;25%~50%为2分;51%~80%为3分;>80%为4分;表达强度评分:无着色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。
TSHR表达水平的评价指标采用半定量积分,即表达强度和阳性细胞百分数评分的乘积:0~1 分为阴性(-),2~3 分为弱表达(+),4~6分为中度表达(++), 6分以上为强表达(+++);2分及以上为阳性表达。
1.4 统计学分析
应用SPSS 20.0进行统计学分析,配对等级资料使用Wilcoxon带符号秩检验,阳性率比较使用卡方检验。多组等级资料使用Kruskal-Wallis法检验,多因素分析采用Logistic回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 原发灶和转移淋巴结中TSHR表达情况
TSHR在PTC组织中的阳性表达位于细胞膜、细胞质。原发灶和转移淋巴结中TSHR阳性率分别为88.9%(40/45)和68.9%(31/45),差异具有统计学意义,χ2=5.40,P=0.02,见表1。原发灶TSHR表达水平高于转移淋巴结,半定量积分分别为6±4.51和4±4.08,P=0.01。
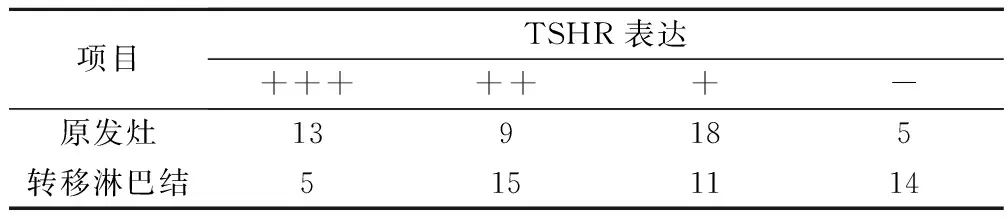
表1 原发灶和转移淋巴结中TSHR表达情况/例
2.2 TSHR表达与临床参数的关系
按性别、年龄、T分期、原发灶侵袭性[9-10]、N分期、淋巴结转移率(阳性淋巴结数/总淋巴结数×100%)、TNM分期、是否复发分组,采用logistic回归模型,分别分析各临床参数与原发灶和转移淋巴结中TSHR表达水平的关系,见表2。
各组原发灶TSHR表达半定量积分相近,差异无统计学意义,且无相关关系,P均>0.05。
转移淋巴结中TSHR半定量积分与T分期、N分期和原发灶侵袭性有相关关系,相关系数γ分别为0.24、-0.37和0.28;其中T1~2组转移淋巴结TSHR半定量积分低于T3~4组(2.0±3.05 vs 4.0±2.14),N1a组的转移淋巴结TSHR半定量积分高于N1b组(6.0±3.21 vs 3.0±2.24),P值分别为0.04、0.01。侵袭组转移淋巴结TSHR半定量积分高于非侵袭组(4.0±1.81 vs 2.0±3.04,P=0.05),差异具有统计学差异。
3 讨论
TSH抑制治疗的理论依据主要是[6-7]:TSH通过作用于甲状腺细胞表面的TSHR促进甲状腺细胞增殖,当在TSH水平下降时,甲状腺增殖减缓,腺体萎缩。PTC细胞表面也存在TSHR,口服甲状腺素可以反馈抑制垂体的TSH合成,降低血TSH 浓度,从而抑制PTC细胞的增殖,由此可能降低肿瘤的复发率,提高患者的生存率。131I治疗PTC的理论依据与TSHR-NIS(钠碘泵)调控有关[8,11]:TSHR激活可上调NIS表达,促进甲状腺细胞或癌细胞对131I的摄取和利用,发挥对碘代谢功能的调节作用。这种作用主要促进131I在细胞内聚集,使放射性核素与病变组织紧密结合,发挥治疗作用,而对正常组织的损伤尽可能减小;这也是131I治疗前1个月停用甲状腺素,促使TSH水平升高至30 mU/L以上或肌注人重组TSH的理论依据。因此,理论上讲,TSH抑制治疗和131I治疗的有效性取决于TSHR的水平和生物学效应。
研究发现,只有50.6%~86.7%的PTC细胞表达TSHR[12]。本研究结果提示TSHR在PTC原发灶和转移淋巴结中的阳性表达率分别为88.9%和68.9%,也就是说,PTC中仍存在部分原发灶和淋巴结TSHR低表达或表达缺失。因此TSH抑制治疗和131I治疗的受益者可能仅限于部分TSHR阳性患者,而对TSHR阴性患者只会带来TSH抑制或131I治疗所引起的远期副作用,如心血管事件、骨质疏松、粘膜干燥和骨髓抑制和第二原发肿瘤等[13]。
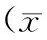
表2 原发灶和转移淋巴结中TSHR表达水平与其临床参数的关系±s)
近年来,ATA和NCCN等临床指南对TSH抑制治疗策略做了一些调整,即根据术后的复发风险分层及TSH抑制的副作用危险分层,调整TSH抑制指征和TSH目标值,并进行实时评估及更改,但并未提出基于TSHR表达水平的TSH抑制治疗策略[14-15]。实践中,癌组织的吸碘率是131I治疗的指征之一和剂量的参考指标,而癌组织的吸碘率是否与TSHR有关则未见研究报道。我们相信,随着对PTC原发灶和转移灶TSHR及其机制的研究的深入,PTC术后TSH抑制和131I治疗策略还将会有进一步的修改。对于TSHR低表达或表达缺失PTC患者,是否能从TSH抑制治疗和/或131I治疗中获益尚需进一步研究。131I治疗前全身扫描结果也提示转移淋巴结的摄碘率较原发灶低,甚至不吸碘。我们推测可能与淋巴结转移灶的TSHR表达水平低于原发灶有关。文献检索表明,目前研究主要集中于PTC原发灶的TSHR研究,对于转移性淋巴结的TSHR研究报道较少。本研究中配对比较发现原发灶TSHR表达水平明显高于转移淋巴结,中位半定量积分6±4.51 vs 4±4.08,P=0.01。这个结果与我们的假设相符。
有研究表明:原发灶TSHR的表达水平与肿瘤恶性程度呈负相关关系,即低分化、高侵袭性、淋巴结转移者TSHR表达较低[16]。也有研究认为,PTC原发灶中TSHR的表达与肿瘤病理分期、淋巴结转移、年龄有关,而与性别、肿瘤大小等因素不相关。也就是说,肿瘤的侵袭性越强,PTC原发灶的TSHR表达越低,反之亦然。
而本研究的结果却发现,原发灶的TSHR表达与性别、年龄、原发灶侵袭性、T分期、N分期、淋巴结转移率、TNM分期、是否复发等均未发现统计学相关关系。我们分析,这可能与入组标准有关:本研究中入组病例均有淋巴结转移,因而这些病例均存在一定程度的侵袭行为,这就造成了统计分析中原发灶原发灶ECS、T分期、N分期、淋巴结转移率、TNM分期、是否复发等分组时存在明显的选择偏倚。当然,我们不能排除因组别实际表达率的差距过小以及组间样本量不均衡造成的样本量不足所带来的统计结果误差。
另外,本研究发现:T1~2组转移淋巴结TSHR表达低于T3~4组、原发灶非侵袭组TSHR表达低于侵袭组。这说明,原发灶侵袭性越强,相应转移淋巴结的TSHR表达越低,我们认为,这可能是由于原发灶中的肿瘤细胞转移至淋巴结时仍然具有原始肿瘤细胞的生物学特性,而原发灶中的肿瘤细胞也只有部分表达TSHR,低表达的PTC细胞更容易发生转移,从而在颈部淋巴结形成转移灶多数为低表达PTC细胞的克隆,这就使得更多的淋巴结转移癌细胞呈TSHR低表达的表型。另外,本研究还发现,高N分期组(N1b组)的颈淋巴结TSHR表达水平低于低N分期组(N1a组)。
因为高N分期病例原发灶肿瘤细胞的侵袭性更强,发生区域淋巴结转移更早更广泛,反之亦然。因此,低N分期组颈淋巴结转移癌细胞更多为来源于TSHR高表达的原发肿瘤细胞的克隆。
由于目前尚未有关于PTC转移淋巴结TSHR表达情况的研究报道,对本研究结果的解释是否成立尚需更深入的研究。
本组所有病例在门诊进行随访观察,随访期为10~185个月,中位随访时间为75个月。全组术后复发4例,其中3例为同侧颈部淋巴结复发,1例为对侧甲状腺复发;对复发病例的TSHR的进一步分析发现,这些病例的TSHR均呈低表达。虽然由于样本量小(n=45)且终点事件(即肿瘤复发)发生数量少(n=4),统计学上不接受TSHR的低表达影响PTC的预后;的假设,但是,我们不能排除该假设成立的可能性。因此,我们认为TSHR表达的差异可能与癌细胞的分化程度有关,也是造成术后辅助治疗疗效差异的原因之一。
[1] Gansler T,Ganz PA,Grant M,et al.Sixty years of CA:a cancer journal for clinicians〔J〕.CA Cancer J Clin,2010,60(6):345-350.
[2] Cox AE,LeBeau SO.Diagnosis and treatment of differentiated thyroid carcinoma〔J〕.Radiol Clin North Am,2011,49(3):453-462.
[3] 贺青卿,董学峰,于 芳.甲状腺乳头状癌淋巴转移的特点及临床处理策略〔J〕.中华内分泌外科杂志,2015,9(1):1-3.
[4] 高 明.甲状腺结节和分化型甲状腺癌诊治指南〔J〕.中国肿瘤临床,2012,29(17):1249-1272.
[5] 侯秀秀,葛明华.分化型甲状腺癌术后促甲状腺素抑制治疗现状〔J〕.国际肿瘤学杂志,2014(8):585-588.
[6] Fuhrer D,Tannapfel A,Sabri O,et al.Two somatic TSH receptor mutations in a patient with toxic metastasising follicular thyroid carcinoma and non-functional lung metastases〔J〕.Endocr Relat Cancer,2003,10(4):591-600.
[7] Fuhrer D,Brix K,Biebermann H.Understanding the Healt- hy Thyroid State in 2015〔J〕.Eur Thyroid J,2015,4(Suppl 1):1-8.
[8] D'Agostino M,Sponziello M,Puppin C,et al.Different expression of TSH receptor and NIS genes in thyroid cancer:role of epigenetics〔J〕.J Mol Endocrinol,2014,52(2):121-131.
[9] 刘天润,杨安奎,张官萍,等.侵袭性分化型甲状腺癌的治疗及预后分析〔J〕.中华普通外科杂志,2010,(8):616-620.
[10] 卢燕红,王圣应.甲状腺乳头状癌罕见的侵袭性变异型〔J〕.中华内分泌外科杂志,2014,8(1):71-73.
[11] Min JJ,Chung JK,Lee YJ,et al.Relationship between expression of the sodium/iodide symporter and131I uptake in recurrent lesions of differentiated thyroid carcinoma〔J〕.Eur J Nucl Med,2001,28(5):639-45.
[12] Tanaka K,Inoue H,Miki H,et al.Relationship between pr- ognostic score and thyrotropin receptor (TSH-R) in papillary thyroid carcinoma:immunohistochemical detection of TSH-R〔J〕.Br J Cancer,1997,76(5):594-9.
[13] Nixon IJ,Ganly I.Radioactive iodine use in patients with low-and intermediate-risk papillary thyroid cancer〔J〕.Future Oncol,2013,9(7):921-3.
[14] Tuttle RM,Haddad RI,Ball DW,et al.Thyroid carcinoma,version 2.2014〔J〕.J Natl Compr Canc Netw,2014,12(12):1671-80;quiz 1680.
[15] Haugen BR,Alexander EK,Bible KC,et al.2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer:The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer〔J〕.Thyroid,2016,26(1):1-133.
[16] 刘 翔,高 明.促甲状腺素抗氧化传导通路与甲状腺乳头状癌侵袭力的关系〔J〕.中华耳鼻咽喉头颈外科杂志,2009,44(4):287-291.
(编辑:吴小红)
Expression and Clinical Significance of TSHR in Papillary Thyroid Carcinoma
XUShaowei,YANGXihong,LIUMuyuan,etal.
TumorHospitalofShantouUniversityMedicalCollege,Shantou,515041
Objective To evaluate the expression of thyroid stimulating hormone receptor (TSHR) and the clinical significance in papillary thyroid carcinomas (PTC) and the lymph nodes (LN).Methods Immunohistochemistry method was used to examine the expression of TSHR in 45 cases of PTC and corresponding LN.Wilcoxon KrusKal-Wallis test、Chi-square test and Logistic regression were used in this article.Results Positive expression of TSHR in PTC was significantly higher than in LN.Positive for TSHR expressions in PTC were 88.9%,which is significantly higher than that in LN 68.9% (P=0.02).The scores of the percentage of positive cells,expression intensity,semi-quantitative of TSHR in the PTC and the metastatic LN were 3±1.05,2±0.96,6±4.51 and 2±1.25,2±0.91,4±4.08,P=0.03、0.02、0.01 respectively.Semi-quantitative of TSHR in LN of T1~2group(2±3.05)and N1b(3.0±2.2)group was notably lower than that of T3~4group(4±2.14)and N1agroup(6.0±3.2).Multivariate analysis showed that invasiveness of the primary was the only independent factor that affected strong expression of TSHR in the metastatic LN.Conclusion Positive expression of TSHR in PTC is significantly higher than in LN.TSHR expression of LN in T1~2group and N1bgroup are lower than that in T3~4group and N1agroup.
Thyroid stimulating hormone receptor;Papillary thyroid carcinoma;Metastatic lymph node;Immunohistochemistry
515041 汕头大学医学院附属肿瘤医院
彭汉伟
10.3969/j.issn.1001-5930.2017.02.007
R736.1
A
1001-5930(2017)02-0196-04
2016-03-22
2016-06-20)

