必特螺旋霉素的工业结晶过程
牛梦旗, 朱家文, 陈 葵, 吴艳阳, 杨生武, 应喜平
(1.华东理工大学化学工程研究所,上海 200237; 2.呼伦贝尔北方药业有限公司,内蒙古 牙克石 022150)
必特螺旋霉素的工业结晶过程
牛梦旗1, 朱家文1, 陈 葵1, 吴艳阳1, 杨生武2, 应喜平2
(1.华东理工大学化学工程研究所,上海 200237; 2.呼伦贝尔北方药业有限公司,内蒙古 牙克石 022150)
以未知杂质为考察的着重点,探索了25 ℃下必特螺旋霉素最佳结晶时的pH以及同一pH下温度对工业结晶的影响。利用高效液相色谱对结晶产品进行检测,并用外标法对必特螺旋霉素中各部分杂质进行了详细的分析,通过对比结晶过程有效组分和总未知杂质对螺旋霉素的选择性系数,在兼顾有效组分含量合格和杂质质量分数最低的前提下,确定最优结晶终点pH为7.5~8.0,最优结晶温度为25~35 ℃。该方法首次以未知杂质的含量变化来探索必特螺旋霉素结晶的规律,工业上便于实施,有利于指导工业生产。
必特螺旋霉素; 结晶pH; 选择性系数; 杂质
必特螺旋霉素(Bitespiramycin,BT)是一种十六元大环内酯类抗生素,由王以光等[1]采用基因重组技术研制开发的一类新药,为国内首例具有自主知识产权的大环内酯类抗生素。BT是多种结构类似组分的混合物,与螺旋霉素在体外有相似的抗菌活性,而在体内其药代动力学行为明显优于螺旋霉素[2]。
不同于其他抗生素,BT是一种由多组分组成的复合型抗生素。对BT结晶过程的研究已有诸多报道[3-5],而以未知杂质的质量分数变化作为结晶过程考察的重点,还鲜有报道。在BT工业生产中,未知杂质的去除是产品合格的难点。本研究将结晶操作设置在未知杂质析出率较低的pH范围内,同时兼顾有效组分质量分数和其他杂质的分离,进而达到BT纯化目标。25 ℃下,研究反应结晶终点pH对BT有效组分质量分数、总未知杂质质量分数以及各部分杂质质量分数的影响,并比较BT结晶过程中各组分和未知杂质对螺旋霉素的选择性系数,在确保有效组分合格的前提下,依据总未知杂质质量分数的变化趋势确定最优结晶pH。同时,本文亦探究了同一pH下温度对结晶过程中有效组分和杂质的影响。这种以未知杂质为切入点来研究BT结晶的工艺,综合了由于发酵差异造成的BT发酵液组分质量分数差异对提炼过程的影响,可以有效指导工业生产。
1 材料与方法
1.1 仪器
Water E2695高效液相色谱仪(美国Waters公司);TU-1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 材料
乙酸乙酯、磷酸二氢钠、硫酸、氢氧化钠、乙酸铵均为分析纯;乙腈为色谱纯;BT标准品,异戊酰螺旋霉素Ⅲ质量分数为48.1%;乙酰螺旋霉素标准品,效价为927 u/mg。BT反萃取液(BT效价为15 221 u/mL,其中异戊酰螺旋霉素Ⅲ质量分数为30.05%,异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ总质量分数为50.26%,总酰化螺旋霉素质量分数为86.44%,未知杂质质量分数为8.98%)从溶媒萃取法提取工艺中得到,其初始发酵液由呼伦贝尔北方药业有限公司提供。
1.3 实验方法
经溶媒萃取法获得含有BT的反萃取液,向反萃取液中持续鼓入空气3 h,以去除溶于其中的微量乙酸丁酯,即得结晶液。滴加碱液中和H+使BT结晶析出,同一温度下分别控制不同的结晶终点pH,以及同一pH下分别控制不同的结晶温度。结晶液经抽滤烘干后得BT成品。
采用化学效价法[6-7]测定结晶后母液中BT的质量分数,可由分光光度计测定其吸光值实现。
用高效液相色谱(HPLC)[8-9]对BT结晶产品进行分析,用外标法计算组分质量分数。
2 结果与讨论
2.1 BT杂质分类
研究发现,BT中含有10余种螺旋霉素类衍生物[10],图1所示为BT的液相色谱图,根据液相色谱出峰原理可知,BT中各组分极性强弱不同,其极性顺序为:螺旋霉素Ⅲ>乙酰螺旋霉素Ⅱ>乙酰螺旋霉素Ⅲ>丙酰螺旋霉素Ⅱ>丙酰螺旋霉素Ⅲ>丁酰螺旋霉素Ⅱ>异戊酰螺旋霉素Ⅰ>丁酰螺旋霉素Ⅲ>异戊酰螺旋霉素Ⅱ>异戊酰螺旋霉素Ⅲ。
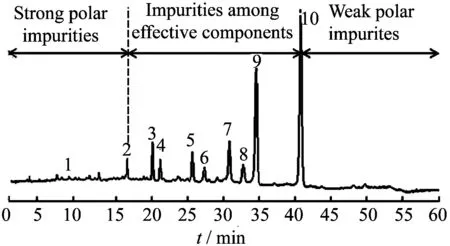
1—Spiramycin Ⅲ; 2—Acetylspiramycin Ⅱ; 3—Acetylspiramycin Ⅲ; 4—Propionylspiramycin Ⅱ; 5—Propionylspiramycin Ⅲ; 6—Butanoylspiramycin Ⅱ; 7—(iso)Valeryspiramycin Ⅰ; 8—Butanoylspiramycin Ⅲ; 9—(iso)Valeryspiramycin Ⅱ; 10—(iso)Valeryspiramycin Ⅲ
依据各组分极性强弱的不同,将极性大于乙酰螺旋霉素Ⅱ的杂质命名为强极性杂质,将极性在乙酰螺旋霉素Ⅱ与异戊酰螺旋霉素Ⅲ之间的杂质命名为组分间杂质,将极性小于异戊酰螺旋霉素Ⅲ的杂质命名为弱极性杂质。工业生产中BT合格品组分的质量分数为[11]:异戊酰螺旋霉素Ⅲ,w≥30%;异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ,w≥60%;总酰化螺旋霉素,w≥80%;螺旋霉素,w≤1%;总未知杂质,w≤5%。
2.2 BT各组分选择性系数与结晶析出率的关系
2.2.1 化学效价 调节结晶液至某一特定pH,BT在结晶产品和母液中达到反应平衡,反应方程式如下:
(1)
为便于研究,结晶产品中的BT量用化学效价(Chemical Titer)来表示。将结晶液过滤,所得滤饼烘干,即得BT产品,总效价Tp可表示如下:
(2)
其中,cp为BT产品的化学效价,单位为u/mg;m为BT产品的质量,单位为mg。
未结晶水相中BT的总化学效价Ts可表示如下:
(3)
其中,cs为未结晶水相BT的化学效价,单位为u/mL;V为溶液总体积,单位为mL。
以BT中i组分作考察对象,结晶液经过滤后得母液,则i组分在结晶母液中的总效价可表示为:
(4)
其中Tri为i组分在结晶母液中的总效价;Tsi为i组分在未结晶水相中的总效价;Tpi为i组分在结晶产品中的总效价,单位均为u。
2.2.2 分配系数i组分在结晶产品和母液中的分配系数A可表示如下:
(5)
2.2.3 选择性系数 假设组分1的分配系数为A1,组分2的分配系数为A2,则组分2对组分1的选择性系数K可表示为:
(6)
式中,Y1为组分1的结晶收率;Y2为组分2的结晶收率,可分别表示如下:
(7)
(8)
式中,wp1、ws1分别为组分1在结晶产品和未结晶水相中的质量分数;wp2、ws2分别为组分2在结晶产品和未结晶水相中的质量分数,利用HPLC分析成品即可得到各个组分的质量分数。
选择性系数K值越大,则结晶操作对组分2的选择性越高,对组分1的去除越有利。BT中螺旋霉素的极性大于各有效组分,故以螺旋霉素为基准,在某一pH下,比较各有效组分对螺旋霉素的选择性系数,可以表征同一pH下各组分结晶析出率的差异。
如图2所示,随着分子极性的降低,各组分对螺旋霉素的选择性系数逐渐增大,说明在螺旋霉素结晶析出率相同的前提下,各组分结晶析出率的大小顺序为:异戊酰螺旋霉素Ⅲ>异戊酰螺旋霉素Ⅱ>丁酰螺旋霉素Ⅲ>异戊酰螺旋霉素Ⅰ>丁酰螺旋霉素Ⅱ>丙酰螺旋霉素Ⅲ>丙酰螺旋霉素Ⅱ>乙酰螺旋霉素Ⅲ>乙酰螺旋霉素Ⅱ,且各组分在该结晶pH下均有析出,而析出率的不同最终会影响产品的组分分布。
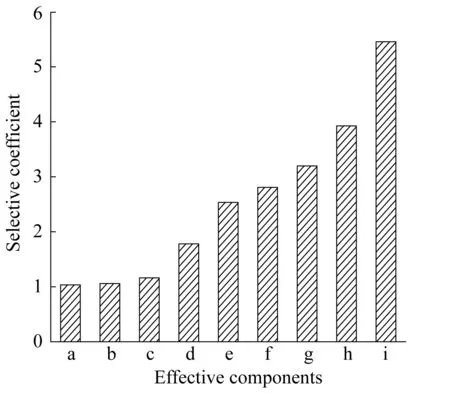
a—Acetylspiramycin Ⅱ; b—Acetylspiramycin Ⅲ; c—Propionylspiramycin Ⅱ; d—Propionylspiramycin Ⅲ; e—Butanoylspiramycin Ⅱ; f—(iso)Valeryspiramycin Ⅰ; g—Butanoylspiramycin Ⅲ; h—(iso)Valeryspiramycin Ⅱ; i—(iso)Valeryspiramycin Ⅲ
2.3 结晶终点pH对组分分布的影响
2.3.1 结晶液pH及结晶收率的变化 当温度为25 ℃时,向效价为15 221 u/mL的70 mL BT结晶液中滴加1.0 mol/L的NaOH溶液,结晶液的pH随NaOH滴加体积的变化如图3所示,可见在结晶后期pH的变化较为迅速。
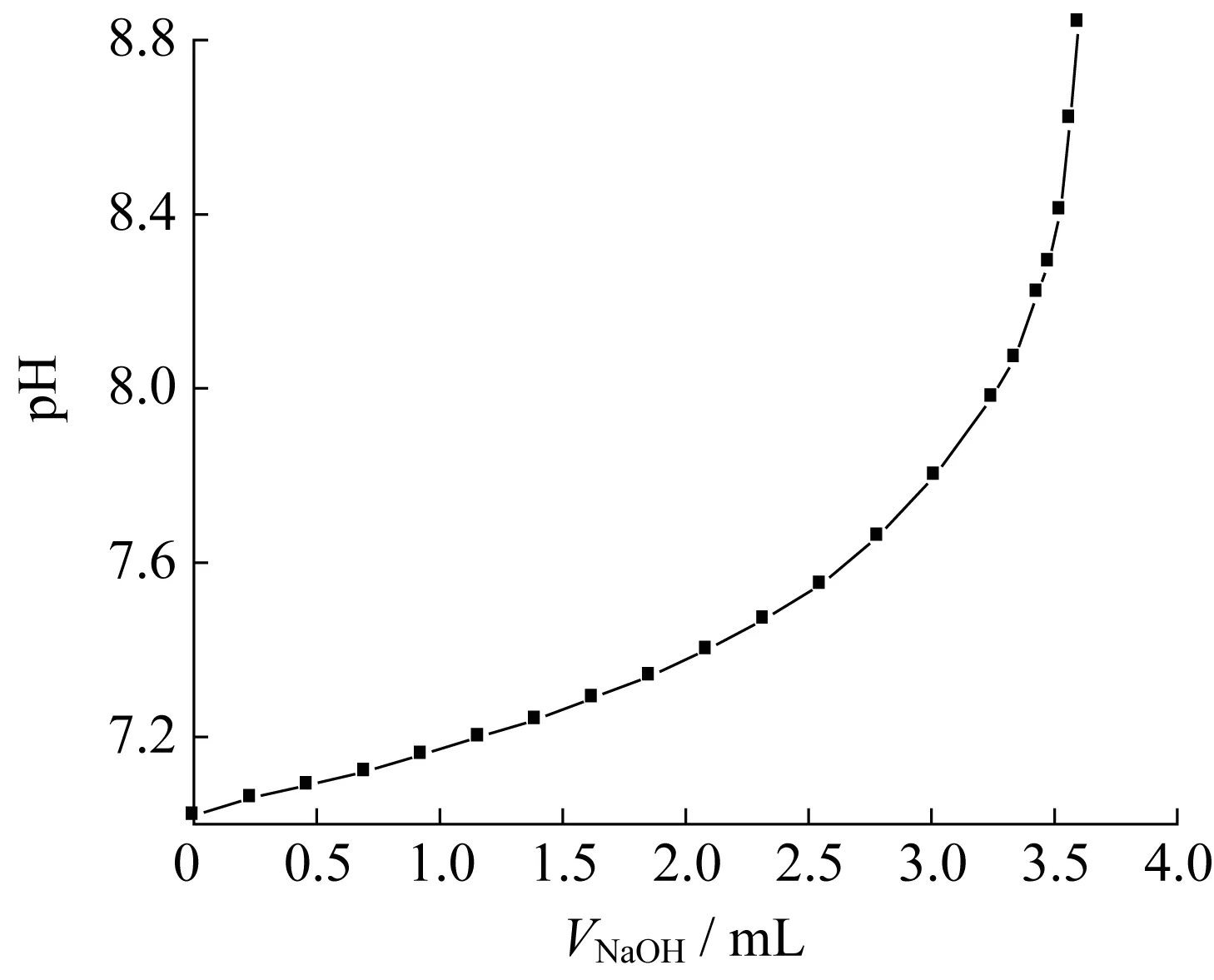
图3 结晶pH随NaOH体积的变化
BT在过碱条件下,苷键及酯键均易水解使产物降解[12-13],控制合适的终点pH,可以有效避免因pH过高而使BT失效。图4所示为产品收率与母液效价随pH的变化情况,随着结晶终点pH的提高,母液中BT的量逐渐减少,结晶产品收率与过滤后的母液效价均趋于稳定。当pH=8.2时,结晶收率为88.73%;当pH=8.4时,结晶收率为89.07%,说明结晶液中绝大部分BT已结晶析出。综合考虑BT在碱性条件下的稳定性和结晶收率,将终点pH控制在低于8.5为宜。

图4 产品收率及母液效价随pH的变化
2.3.2 选择性系数和组分质量分数随pH的变化 图5所示为有效组分和总未知杂质对螺旋霉素的选择性系数随终点pH的变化,随着终点pH的升高,异戊酰螺旋霉素Ⅲ、异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ总和、总酰化螺旋霉素的选择性系数先增加后逐渐降低,在pH为7.5~8.0时达到最大值,而在此范围内,总未知杂质的选择性系数有一最小值,因此将结晶终点pH控制在这一范围内是合适的。
图6所示为BT成品中有效组分质量分数随结晶终点pH的变化。由图可见,随着结晶终点pH的升高,异戊酰螺旋霉素Ⅲ质量分数及异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ总质量分数均呈现下降的趋势,而总酰化螺旋霉素质量分数则趋于平稳。当pH>8.0时,异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ总质量分数低于60%,未达到合格标准。由前述可知,有效组分异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ极性均偏弱,在同一结晶pH下,弱极性组分异戊酰螺旋霉素Ⅲ的结晶析出率最大,异戊酰螺旋霉素Ⅱ和异戊酰螺旋霉素Ⅰ次之,随着pH的升高,强极性组分的析出率逐渐增大,使异戊酰螺旋霉素Ⅲ质量分数和异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ总质量分数随结晶pH的升高而降低。有效组分极性在强、弱极性范围内均有分布,故总酰化螺旋霉素质量分数随pH的增加呈波动状态。

图5 不同终点pH下各组分的选择性系数变化
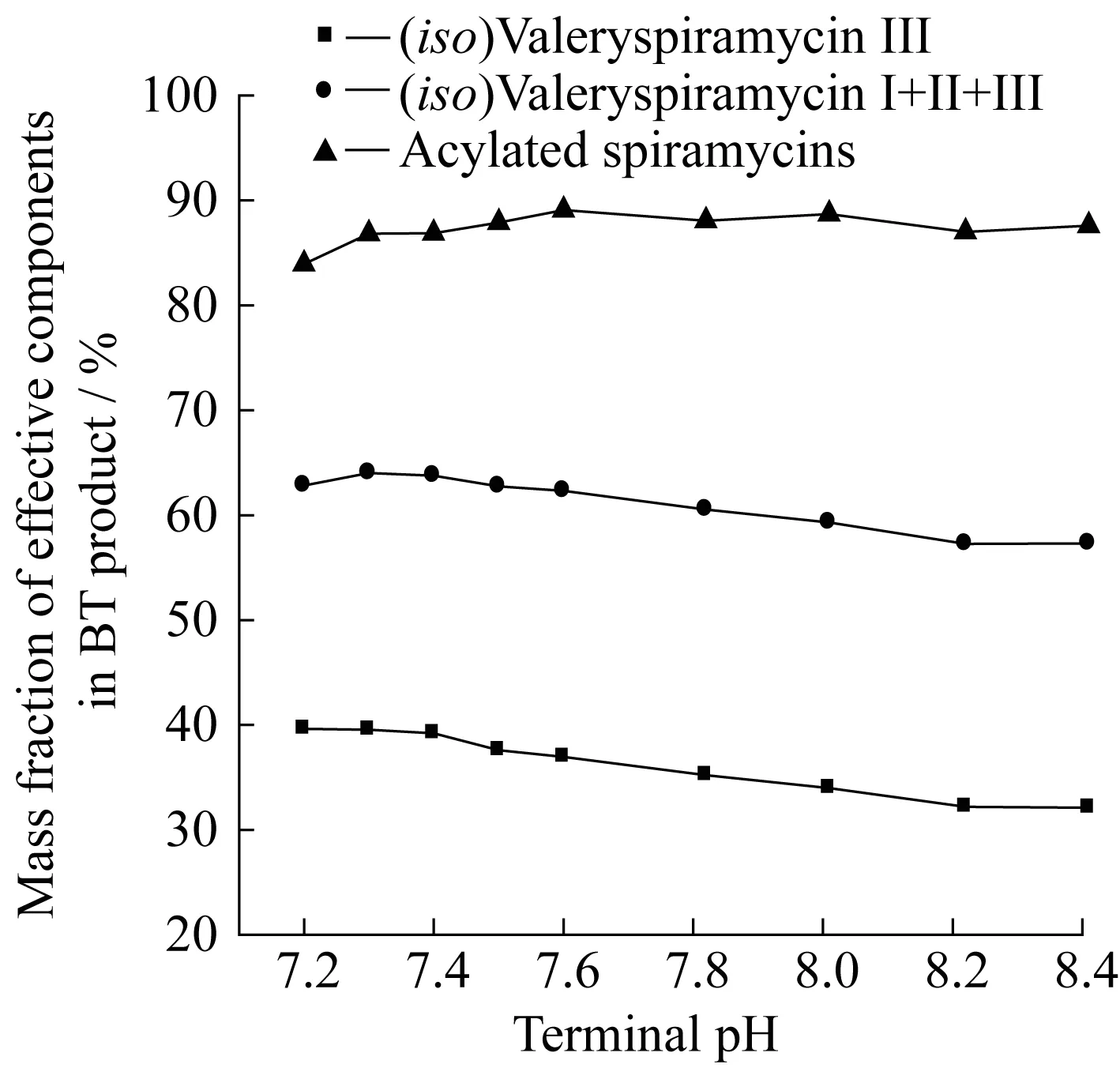
图6 有效组分质量分数随终点pH的变化
图7所示为总未知杂质和各部分杂质质量分数随结晶终点pH的变化,由图可知,总未知杂质质量分数先减小后增大,当结晶终点pH为7.5~8.0,总未知杂质质量分数低于5%,达到了合格的标准。强极性杂质、组分间杂质以及弱极性杂质质量分数随pH的变化趋势有所不同,强极性杂质质量分数随终点pH的增大而逐渐增大,组分间杂质质量分数先减小后增大,而弱极性杂质质量分数则逐渐减小。当pH=7.2时,未知杂质质量分数为7.07%,此时弱极性杂质质量分数为1.54%,组分间杂质质量分数为4.13%。然而,过于增大结晶终点pH,只能使强极性杂质大量析出结晶,亦在一定程度上增加了未知杂质的质量分数,降低产品品质。如图7,当pH=8.4时,未知杂质质量分数为6.02%,强极性杂质质量分数为2.38%,而此时组分间杂质质量分数为3.10%,这说明过高或过低的pH均能使组分间杂质质量分数变大,合适的结晶pH能合理均衡杂质和有效组分的比例。

图7 未知杂质随结晶终点pH的变化
2.4 结晶温度对组分分布的影响
向浓度为15 221 u/mL的70 mL BT结晶液中滴加1.0 mol/L的NaOH溶液,分别在20,30,40,50,60 ℃下进行结晶操作,控制BT结晶终点pH为7.75。图8所示为有效组分和总未知杂质对螺旋霉素的选择性系数随温度的变化。随着结晶温度的升高,异戊酰螺旋霉素Ⅲ、异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ总和、总酰化螺旋霉素的选择性系数先增加后降低,而在25~35 ℃范围内,总未知杂质的选择性系数有一最小值。
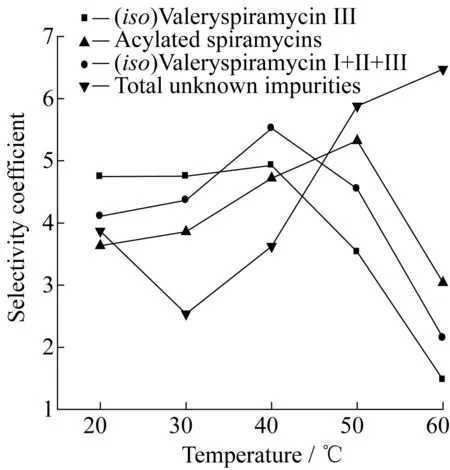
图8 不同温度下各组分的选择性系数变化
BT在水溶液中的溶解度具有随温度升高而降低的负溶解特性[3],因此,控制相同的结晶终点pH,升高温度可以使更多的BT从水相中结晶出来。图9所示为BT成品中有效组分的质量分数随结晶温度的变化,图10所示为总未知杂质和各部分杂质质量分数随结晶温度的变化。可以推测,极性不同的组分其结晶析出率受温度影响较大,弱极性组分在低温下的结晶析出率较大,随着温度的升高,强极性组分析出率逐渐增大,有效组分和杂质含量呈现如图9、10所示的变化趋势。综合考虑BT成品中组分分布,将结晶温度控制在25~35 ℃。

图10 未知杂质质量分数随温度的变化
3 优化工艺与传统工艺对比分析
传统工艺以效价和结晶回收率决定结晶终点pH,pH控制在8.2~8.5。优化工艺基于BT组分分布特点决定结晶终点pH,pH控制在7.5~8.0。
为进一步说明优化工艺可行,进行3批验证实验。25 ℃下,分别控制结晶终点pH为8.2~8.5和7.5~8.0,将结晶抽滤烘干,用HPLC法分析BT成品中有效组分、螺旋霉素以及未知杂质的质量分数并列于表1。由表可见,与传统工艺相比,优化工艺将结晶终点pH控制在7.5~8.0,异戊酰螺旋霉素Ⅲ、异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ总质量分数明显提高,螺旋霉素、未知杂质质量分数明显降低,优化工艺中的第2批和第3批的BT成品均达到了合格的标准,表明将结晶终点pH控制在7.5~8.0可有效提高BT成品的合格率。

表1 优化工艺与传统工艺结果比较
4 结 论
结晶过程是工业生产中分离纯化BT很重要的一部分,杂质的质量分数是决定产品能否合格的关键因素。利用高效液相色谱对成品进行梯度洗脱,在保证有效组分合格和未知杂质质量分数尽可能低的前提下,确定最优结晶终点pH。本研究结果表明,当结晶终点pH控制在7.5~8.0,结晶温度为25~35 ℃时,可以使杂质质量分数达到最小,从而优化产品质量,指导工业生产。验证实验表明,25 ℃下,将pH控制在7.5~8.0可有效提高异戊酰螺旋霉素Ⅲ的质量分数和异戊酰螺旋霉素Ⅰ、Ⅱ、Ⅲ的总质量分数,降低螺旋霉素和总未知杂质的质量分数,提高BT成品的合格率。
[1]尚广东,戴剑漉,王以光.生技霉素稳定型基因工程菌的构建[J].生物工程学报,1999(2):44-48.
[2]SHI Xiangguo,ZHONG Dafang,SUN Yuming,etal.Metabolites of a novel antibiotic bitespiramycin in rat urine and bile[J].Chinese Chemical Letters,2004,15(4):431-434.
[3]岳公敬.可利霉素结晶过程研究[D].上海:华东理工大学,2012.
[4]张筱君.树脂吸附-分步结晶法分离纯化可利霉素工艺研究[D].上海:华东理工大学,2014.
[5]侯丽萍.异戊酰螺旋霉素Ⅲ分离制备过程研究[D].上海:华东理工大学,2013.
[6]谭俊,邓芊,郝玉有,等.抗生素化学效价的快速高通量分析方法[J].中国抗生素杂志,2009,34(10):606-608.
[7]任钧如.麦迪霉素化学效价测定法[J].抗生素,1981(6):66-67.
[8]LUAN Chunfang,CONG Yanwei,ZHANG Qi,etal.HPLC method research of picoplatin——A new platinum anti-cancer drug and its impurities[J].Precious Metals,2012,33(S1):253-257.
[10]WANG Mingjuan,XUE Jing,ZOU Wenbo,etal.Identification of the components of bitespiramycin by liquid chromatography-mass spectrometry[J].Journal of Pharmaceutical and Biomedical Analysis,2012,66(1):402-410.
[11]WAN Qianyu,CHEN Kui,ZHU Jiawen,etal.Separation and purification of bitespiramycin by counter-current extraction[J].Separation Science and Technology,2015,50(17):2649-2657.
[12]SHI Xiangguo,ZHANG Shuqiu,Paul Fawcet J,etal.Acid catalyzed degradation of some spiramycin derivatives found in the antibiotic bitespiramycin[J].Pharmaceutical and Biomedical Analysis,2004,36(3):593-600.
[13]冯闻铮,亓平言,周倜,等.螺旋霉素在酸碱溶液中的降解动力学[J].药学学报,1997,32(12):934-937.
Crystallization Process of Bitespiramycin
NIU Meng-qi1, ZHU Jia-wen1, CHEN Kui1, WU Yan-yang1, YANG Sheng-wu2, YING Xi-ping2
(1.Chemical Engineering Research Center,East China University of Science and Technology, Shanghai 200237,China; 2.Hulun Buir North Pharmaceutical Co. Ltd,Yakeshi 022150, Inner Mongolia,China)
Taking unknown impurities as the focal point,the optimum crystallization pH value was investigated at 25 ℃.The effect of temperature on crystallization process was explored at a certain pH value.Gradient elution was utilized to analyze components and impurities in product.Selectivity coefficients of effective components and total unknown impurities to spiramycin were compared with each other.In view of qualified effective compositions and lower impurities contents,the most suitable terminal pH value of crystallization operation was 7.5-8.0,temperature was 25-35 ℃.The variation of unknown impurities contents was first adopted to explore bitespiramycin crystallization in the existing studies,which would have a profound guiding significance for the practical production.
bitespiramycin; crystallization pH value; selectivity coefficient; impurities
1006-3080(2017)01-0023-06
10.14135/j.cnki.1006-3080.2017.01.004
2016-05-18
上海市科委生物医药科技重点项目(10431901500)
牛梦旗(1989-),女,山东菏泽人,硕士生,主要从事抗生素分离纯化的研究。E-mail:niu1259900193@163.com
陈 葵,E-mail:chenkui@ecust.edu.cn
TQ460.6+3
A

