GKN1在胃GIST的表达及其与生物行为的相关性研究*
罗 云, 王崇树, 谢梦忆, 张雨顺, 符致明, 陈佳慧, 谢贤镛
(1.川北医学院附属医院胃肠外科; 2.川北医学院肝胆胰肠研究所; 3.南充市中心医院普外二科; 4.川北医学院附属医院病理科, 四川 南充 637000)
GKN1在胃GIST的表达及其与生物行为的相关性研究*
罗 云1,2, 王崇树1△, 谢梦忆2, 张雨顺2, 符致明2, 陈佳慧3, 谢贤镛4
(1.川北医学院附属医院胃肠外科; 2.川北医学院肝胆胰肠研究所; 3.南充市中心医院普外二科; 4.川北医学院附属医院病理科, 四川 南充 637000)
目的: 检测胃动蛋白基因1(gastrokine 1,GKN1)在胃间质瘤和瘤旁组织中的表达,分析其与GIST生物学行为的关系,方法: 选取30例川北医学院附属医院病理科胃GIST及瘤旁组织石蜡标本,应用免疫组化检测GKN1在胃GIST和瘤旁组织中的表达;收集20例川北医学院附属医院普外科手术并经病理及免疫组化确诊的胃GIST肿瘤组织及瘤旁新鲜组织标本,应用实时荧光定量聚合酶链反应(real time fluorescence quantitative polymerase chain reaction,RT-PCR) 和Western blot 的方法检测GKN1在GIST肿瘤组织和瘤旁组织中的表达情况,同时分析实验数据与临床资料的关系。 结果: GKN1主要表达在胃粘膜组织,GKN1的表达在胃GIST中显著低于瘤旁组织(P<0.05),GKN1蛋白高度表达于极低危险组的胃GIST,GKN1 mRNA的表达与性别、年龄及核分裂像无差异(P>0.05),但胃GIST的GKN1 mRNA表达量:直径(≤5cm)组明显高于直径(>5cm)组(P<0.05),极/低危组显著高于中/高危组(P<0.05)。结论: GKN1可能在胃GIST中从极低危到高危的发展过程中起着一定的作用,对鉴别其生物学行为有一定的指示和参考作用。
胃GIST;胃动蛋白基因1;生物学行为
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是一种具有恶性潜能的非定向分化的消化道间叶性肿瘤,其发病率约为1~2/10万[1]。GIST的发病部位主要为胃部,占60%~70%[2], 5年生存率为35%~65%[3]。GIST的临床表现往往不典型,据统计15%的GIST患者在就诊时已出现转移[4]。手术切除和分子靶向治疗是目前治疗GIST的主要模式。而GIST的危险度评估十分重要,这关系到手术时机、术式选择及分子靶向治疗等[5]。目前国内多推荐采用中国GIST诊断治疗共识(2013年版)的评估标准,评估方面主要为核分裂像、肿瘤大小、破损及部位[6]。这些方面在GIST危险度评估仍较复杂,如核分裂像必须获取GIST标本进行病理学检查才能得出结果。目前尚未报到哪一种肿瘤标志物或基因能更准确、更简便地鉴别GIST的危险度、良恶性及预后。
GKN1位于人染色体2p13.3,翻译的肽链由183~185个氨基酸组成[7]。GKN1 mRNA及其蛋白主要高度表达于正常胃上皮细胞中,也可表达在口腔黏膜、上皮化生组织(如Barrett食管)、胎盘、卵巢肿瘤及平滑肌组织中[8-11],研究表明[12-20]GKN1具有保护胃黏膜、促进受伤黏膜修复、抑制肿瘤进展等功能。本研究旨在通过检测GKN1在胃GIST及瘤旁正常组织中的表达,分析GKN1与胃GIST的相互关系,推论GKN1在胃GIST良恶性发展过程中可能扮演的角色,为胃GIST的生物学行为评估寻找新的参考手段和方法。
1 资料与方法
1.1 一般资料
选取30例川北医学院附属医院病理科胃GIST及瘤旁组织的石蜡标本。收集20例川北医学院附属医院普外科胃GIST肿瘤组织及瘤旁新鲜组织标本(距肿瘤边缘大于2cm),病例入选标准: (1) 胃GIST初治手术的患者,(2)术前均未行放化疗或伊马替尼等分子靶向治疗;(3)术后病理免疫组化证实为胃GIST。在收集的20例胃GIST手术新鲜标本中,患者年龄46~79岁,平均61.85±9.24岁;其中男11例,女9例;肿瘤直径范围:1~12cm,直径(cm)≤5:10例,直径(cm)>5:10例;核分裂像(/50HP)≤5:17例,>5:3例;按照中国GIST诊断治疗共识(2013年版)对病例进行危险度评估:极低危4例,低危5例,中危7例,高危4例。
1.2 主要试剂
免疫组化Gastrokine 1抗体,购自Abcam公司;二抗试剂盒及DAB试剂盒,购自北京中杉金桥生物技术有限公司;Trizol 试剂,购自Invitrogen公司;荧光定量PCR试剂盒,购自DBI Bioscience公司;逆转录试剂盒,购自TaKaRa公司;单克隆鼠抗GAPDH抗体,购自上海良森生物科技有限公司;RIPA裂解液、SDS-PAGE凝胶配制试剂盒、超敏ECL化学发光即用型底物,购自碧云天生物有限公司;PCR仪,ROCHE公司,半干转印系统,购自BIO-RAD公司;Fusion Solo成像系统,购自VILBER公司。
1.3 免疫组化方法检测GKNl的表达
切片(厚度3μm),裱于防脱载玻片上,置37℃恒温箱过夜,于二甲苯中脱蜡及梯度酒精中水化,置入3%过氧化氢溶液,灭活内源性过氧化物酶,微波炉中以中火加热20分钟抗原修复,滴加1:150的一抗在37℃恒温箱孵育2小时,滴加二抗后,DAB显色,再苏木素复染,自来水蓝化,置入梯度酒精脱水;透明、封片。用正常胃黏膜做阳性对照组,用PBS代替一抗做阴性对照组,免疫组化结果判读:大于30%的上皮细胞胞浆黄染被认为阳性,反之为阴性[21]
1.4 实时荧光定量PCR法检测 GKN1 mRNA含量
Trizol试剂盒提取细胞总RNA,紫外分光光度计及电泳分别检测RNA的纯度和完整性较好后,采用PrimeScriptTMRT逆转录试剂盒(Takara;Code:RR037A) 进行RNA逆转录,条件:37℃ 15min,85℃ 15sec,4℃ forever。GKN1和 β-actin的引物由上海生工生物工程股份有限公司合成。gastrokine 1上游引物5’-AATAACAACGGATGGGACT-3’下游引物5’-AGGGATTGAATGGAGGG-3’,β-actin上游引物5’-GAGCTACGAGCTGCCTGACG-3’,下游引物5’-GTAGTTTCGTGGATGCCACAG-3’,荧光定量PCR反应条件:预变性 95℃ 10min,变性95℃ 10s,退火60℃ 30s,延伸72℃ 30s,循环40次,△Ct为GKN1所得的Ct值与内参β-actin所得的Ct值之差。△Ct值越高,基因表达越低。
1.5 Western Blot法检测 GKN1 蛋白的表达
用含有蛋白酶抑制剂的RIPA裂解液提取蛋白质,BCA法检测蛋白浓度,将样本蛋白与上样缓冲液混合,于沸水中煮5min使蛋白变性后分装保存。GKN1及GAMDH均选择12%的分离胶,上层胶采用5%的浓缩胶。电泳凝胶配制好后上样。电泳电压,浓缩胶为80V 20~30 min,分离胶为120V,采用半干式转膜,12v转膜70min。5%脱脂奶粉中封闭1h,PVDF膜放入稀释的一抗液中(1 ∶1000),4℃冰箱内孵育过夜。TBST洗膜3次后,将PVDF膜置于二抗液中(1 ∶1 000),在室温轻摇1小时后,TBST 再次洗膜3次,ECL显色液显色。
1.6 统计学数据分析
采用SPSS21.0软件分析,连续性变量用均数±标准差,计量资料采用t检验,计数资料用卡方检验,P值<0.05 认为有统计学意义。
2 结果
2.1 免疫组化结果
GKN1主要表达在胃粘膜组织,而在胃GIST组织中低表达或无表达(图1、2),30例患者中,胃GIST与瘤旁组织的GKN1免疫组化表达强度比较,见表1。GKN1在胃GIST和瘤旁组织中的表达差异有计学意义(χ2=20.376,P<0.05)。
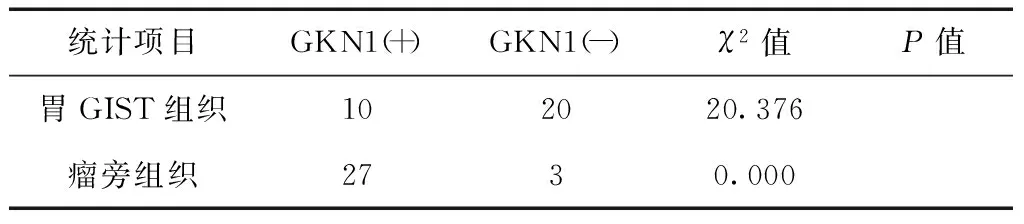
表1 胃GIST组织及瘤旁组织的GKNl免疫组化表达强度比较
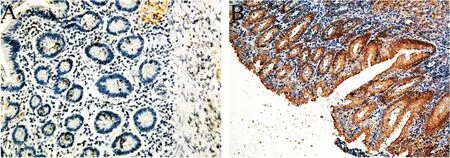
图1 GKN1的免疫组化表达:
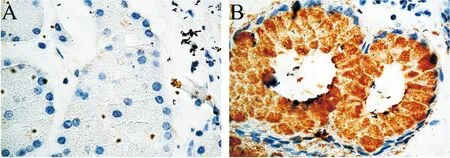
图2 GKN1的免疫组化表达:A:GIST(-),
2.2 荧光定量PCR检测结果
胃GIST和瘤旁组织中 GKN1 mRNA △Ct 均值之差为4.21±3.84,差异有统计学意义(配对样本t检验,t=4.900,P<0.001),见图3。
分析GKN1 mRNA 在胃GIST的表达与患者性别、年龄及核分裂像的关系,差异无统计学意义(独立样本t检验,P>0.05),但GKN1 mRNA 在胃GIST的表达与肿瘤直径、危险度分级的关系,差异有计学意义(独立样本t检验,P<0.05),胃GIST直径(≤5cm)组的GKN1 mRNA 表达量明显高于直径大于5cm的胃GIST组;同时,极/低危组GKN1 mRNA 表达量明显高于中/高危组。GKN1 mRNA 的表达与临床病理特征的关系见表2。

图3 GKN1 mRNA 的△Ct 均值在胃GIST和瘤旁组织中的比较
(注:由于瘤旁组织△Ct值为负数,故上图为两组数据纵坐标以-2为起始点)
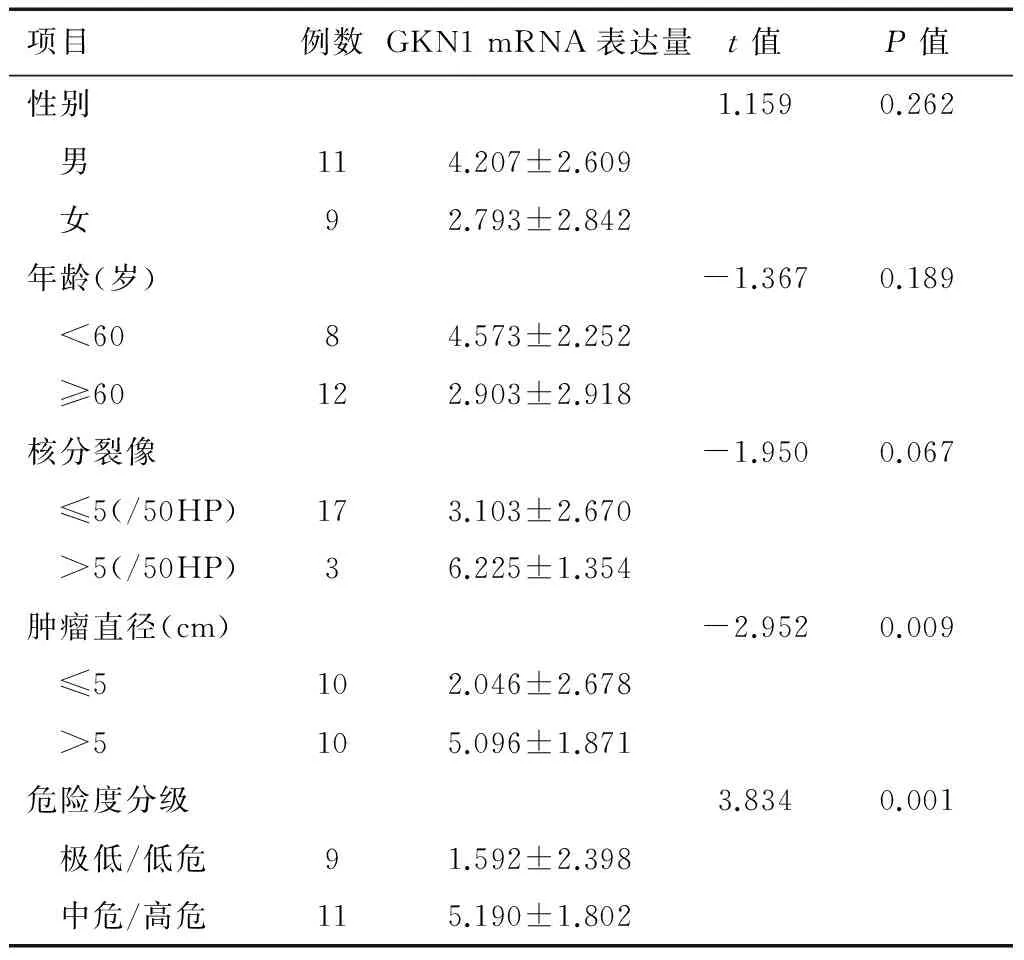
表2 GKN1 mRNA 的表达在临床病理特征中的比较
2.3 Western Blot实验结果
用Western Blot检测GKN1蛋白在胃GIST组织与瘤旁组织,极低危、低危、中危和高危胃GIST中的表达见图4、5。 GKN1蛋白在胃GIST与瘤旁组织的相对灰度值表达差异有统计学意义(配对t检验,t=-11.729,P<0.05);GKN1蛋白在极低危险度的胃GIST中高度表达,而在其他危险度的胃GIST蛋白表达较低,见图6、7。

图4 GKN1在胃GIST与瘤旁组织的灰度值表达,GAPDH为内参

图5 GKN1在极低危、低危、中危和高危胃GIST的灰度值表达,GAPDH为内参
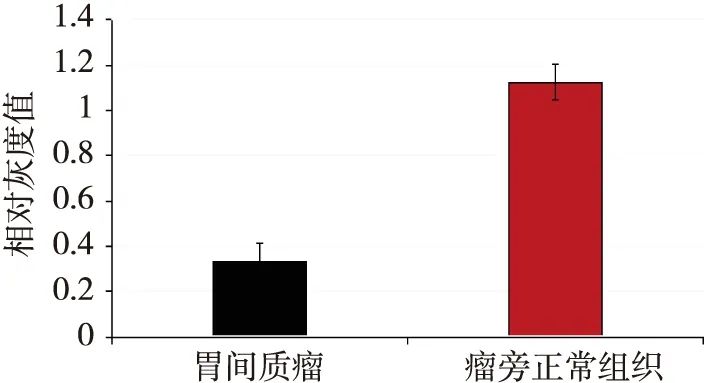
图6 GKN1在胃GIST与瘤旁组织的相对灰度值直方图比较
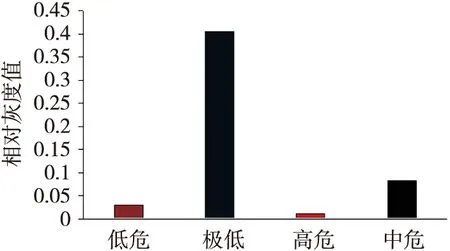
图7 GKN1在GKN1在极低危、低危、中危和高危胃GIST的相对灰度值直方图比较
3 讨 论
GIST是一种最常见的消化系统间叶组织的肿瘤,临床表现缺乏特异性,组织学上由梭形细胞和(或)上皮细胞组成,主要是由KIT或者PDGFRA基因突变导致,野生型GIST较少见,主要与琥珀酸脱氢酶缺陷等相关联[21]。由于GIST临床表现缺乏特异性,最终确诊需要靠组织学和免疫组化,必要时还需进行基因突变检测才能确定。GIST免疫组化CD117 和DOG1的阳性表达率分别高达96%及95%[2]。随着现代先进的辅查技术发展,加之对GIST的临床诊断治疗认识不断深入,对于胃GIST的诊断已不再是一件难题,然而进一步对GIST的生物学行为评估十分重要,这关系到手术时机和方法的选择、靶向治疗方案的制定及预后评估等诸多问题,而这些问题又直接关系病人预后。目前临床上主要根据GIST的核分裂像、肿瘤大小、是否破损及肿瘤原发部位来评估GIST的生物学行为。
GKN1成为近来胃相关疾病研究的热点,它具有抑制肿瘤发生发展的功能,有研究发现GKN1的表达从胃炎、慢性胃炎、萎缩性胃炎及化生、胃溃疡到胃癌依次逐渐下调[12],本研究采用免疫组化、PCR和Westem Blot法分别从基因和蛋白质两个水平检测 GKN1在胃GIST组织和瘤旁组织的表达,并分析其与GIST临床病理特征的相互关系。结果显示GKNl主要表达在胃粘膜层,无论在基因还是蛋白质水平,胃GIST组织中GKN1的表达均显著低于瘤旁组织, GKN1 mRNA的表达与患者性别、年龄及核分裂像无相关性,但与胃GIST的直径(≤5cm与>5cm)及危险度分组(极/低危组与中/高危组)存在相关性。这表明GKN1可能在胃GIST的从极低危至高位的发展过程中起着一定的作用,对鉴别恶性生物学行为也有一定的指示作用。
本研究认为,GKN1可能与胃GIST危险程度有关,并通过试验部分证实了GKN1与胃GIST的生物学行为的相关性,对GKN1的表达水平划定一参考范围,为其生物学行为评估提供另一种可供参考的手段和方法。但必须指出,在本研究中,样本量小,方法并非完全随机对照,胃GIST患者随访时间较短,GKN1的表达与患者复发及生存时间的关系,还有待于进一步的深入研究。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任。
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Asali PG, Jost L,Reichardt P, et al. Gastrointestinal stromal tumor:ESMO clinical recommendations fordiagnosis, treatment andfollow-up[J]. Ann Oncol,2008,19(2):35-38.
[2] Doyle LA,Hornick JL.Gastrointestinal stromal tumours:from KIT to succinate dehydrogenase[J].Histopathology, 2014,64(1):53-67.
[3] Iorio N, Sawaya RA, Friedenberg FK.Review article: the biology, diagnosis and management of gastrointestinal stromal tumours[J]. Alimentary Pharmacology and Therapeutics, 2014,39(12):1376-1386.
[4] 罗 云, 王崇树, 魏寿江,等. 巨大胃肠道间质瘤39例临床分析[J]. 中国普通外科杂志, 2015, 24(10):1383-1388.
[5] 蔡建辉.胃间质瘤的诊断与外科治疗[J].中华普外科手术学杂志,2011,5(2):146-150.
[6] 中国CSCO胃肠间质瘤专家委员会.中国GIST诊断治疗共识(2013年版)[J].中华胃肠外科杂志,2014,17(4):393-398.
[7] Oien KA, McGregor F, Butler S,et al.Gastrokine 1 is abundantly and specifically expressed in superficial gastric epithelium, down-regμlated in gastric and shows high evolutionary conservation[J].J Pathol, 2004, 203(3):789-797.
[8] Chen P, Lingen M, Sonis ST, et al. Role of AMP-18 in oral mucositis[J].Oral Oncol, 2011, 47(9):831-839.
[9] Fahlbusch FB,Ruebner M,Huebner H, et al.The tumor suppressor gastrokine-1 is expressed in placenta and contributes to the regulation of trophoblast migration[J].Placenta,2013,34(11):1027-1035.
[10]Hnia K, Notarnicola C, De S BP, et al. Biochemical properties of gastrokine-1 purified from chicken gizzard smooth muscle.[J]. Plos One, 2008, 3(12): e3854.
[11]罗 云, 王崇树. 胃动蛋白基因1在胃黏膜相关疾病中的作用[J]. 中国普外基础与临床杂志, 2015(9):1143-1147.
[12]Yoon JH,Seo HS,Choi SS,et al.GKN1inhibits the carcinogenic potentials of Helicobacter pylori CagA[J].Carcinogenesis,2014,35(11):2619-2629.
[13]Xing R, Li W, Cui J, et al.GKN1induces senescence through p16/Rb pathway activation in gastric cancer cells[J].Gut,2012, 61(1):43-52.
[14]Yoon JH, Choi YJ,Choi WS,et al.GKN1-miR-185-DNMT1 axis suppresses gastric carcinogenesis through regulation of epigenetic alteration and cell cycle[J].Clinical Cancer Research,2013,19(17):4599-4610.
[15]Yoon JH,Kang YH,Choi YJ,et al.GKN1functions as a tumor suppressor by inhibition of epithelial-mesenchymal transition in gastric cancers[J].Journal of Cancer Research and Clinical Oncology,2011,137(11):1697-1704.
[16]Choi WS,Seo HS,Song KY,et al.GKN1expression in the human gastric mucosa is closely associated with the degree of gastritis and DNA methylation[J].J Gastric Cancer,2013,13(4):232-241.
[17]Resnick MB,Sabo E,Meitner PA,et al.Global analysis of the human gastric epithelial transcriptome altered by Helicobacter pylori eradication in vivo[J].Gut,2006,55(12):1717-1724.
[18]Nardone G,Martin G,Rocco A,et al.Molecular expression of GKN1in normal ucosa and in Helicobacter pylori-related preneoplastic and neoplastic gastric lesions[J].Cancer Biol Ther,2008,7(12):1890-1895.
[19]Kim O, Yoon JH, Choi WS, et al. GKN1inhibits gastrin-induced cell proliferation[J]. Gastric Cancer, 2016, 19(2): 381-391.
[20]Yoon JH, Soog JH, Zhang C, et al. Inactivation of the Gastrokine 1 gene in gastric adenomas and carcinomas[J]. J Pathol, 2011, 223(5): 618-625.
[21]罗 云,杨显金,王崇树.胃肠道间质瘤基因突变与分子靶向治疗的研究进展[J]. 肿瘤预防与治疗, 2015, 28(4):217-222.
The Relationship between Expression of GKN1 and Biological Behavior in Gastric Stromal Tumor*
Luo Yun1,2,Wang Chongshu1,Xie Mengyi2,et al
(1.TheFirstDepartmentofGeneralSurgery,AffiliatedHospitalofNorthSichuanMedicalCollege;Nanchong637000,Sichuan,China; 2.InstituteofHepato-Biliary-PancreasandIntestinalDisease,NorthSichuanMedicalCollege;Nanchong637000,Sichuan,China)
Objective: To detect the expression of GKN1 in gastric GIST and peritumoral tissue, analyzing the correlation between the expression level of GKN1 and biological behavior of gastric GIST. Methods: Gastric GIST and adjacent normal tissues of 30 gastric GIST patients were selected from the paraffin specimens in the department of pathology. The expression values of GKN1 in these tissues were detected by immunohistochemistry. The expression of GKN1 in 20 Fresh specimens of gastric GIST and adjacent normal tissues was quantified by real-time fluorescence quantitative polymerase chain reaction (RT-PCR) and Western Blot.Meanwhile, the experimental data combined with clinical data were analyzed. Results: GKN1 mainly expressed in the gastric mucosa, the expression of GKN1 in the gastric GIST was significantly lower than in peritumoral tissue (P<0.05). GKN1 highly expressed in a very low risk of gastric GIST. There was no significant relationship for the expression of GKN1 mRNA in the sex, age, mitotic index of gastric GIST(P>0.05). The expression of GKN1 mRNA in the diameter (≤5cm) of gastric GIST group was significantly higher than the diameter (>5cm) (P<0.05), and in very low risk/low risk group was significantly higher than moderate/high risk group (P>0.05). Conclusion: GKN1 play a role in the development of gastric GIST from very low risk level to high risk level, and has the certain instruction and reference effect to identify biological behavior.
Gastric stromal tumor; Gastrokine 1; Biological behavior
2016- 08- 14
2017- 01- 15
*四川省卫生厅科研项目(编号:120430)
罗 云(1985-),男,重庆人,在读硕士研究生,主要从事消化道肿瘤的基础与临床工作。
△王崇树,E-mail:chongs-wang@163.com
R735.2
A
10.3969/j.issn.1674- 0904.2017.01.006

