沉默Versican基因对鼠源性肝癌细胞株Hepa1-6体外增殖及迁移影响的研究*
李之曦, 王 力, 刘燕扬, 王喻义, 罗 锋, 曹 丹
(1.四川大学华西医院肺癌中心, 成都 610041; 2.四川大学华西医院腹部肿瘤科, 成都 610041)
沉默Versican基因对鼠源性肝癌细胞株Hepa1-6体外增殖及迁移影响的研究*
李之曦1, 王 力1, 刘燕扬1, 王喻义1, 罗 锋1, 曹 丹2△
(1.四川大学华西医院肺癌中心, 成都 610041; 2.四川大学华西医院腹部肿瘤科, 成都 610041)
目的: 检测Versican基因在鼠源性肝癌细胞的表达情况,观察沉默Versican基因对肝癌细胞增殖及迁移能力的影响。 方法: 采用Western blot技术检测鼠源性肝癌细胞株Hepa1-6中Versican的表达。构建沉默Versican基因的shRNA质粒(shVCAN)稳定转染Hepa1-6,通过荧光显微镜观察shVCAN质粒转染效率,采用RT-PCR及Western blot技术检测Versican基因的沉默效率。CCK-8法检测稳定转染shVCAN质粒后Hepa1-6的增殖能力变化;划痕及Transwell实验检测稳定转染shVCAN质粒后Hepa1-6的迁移能力变化;免疫荧光及Western blot检测稳定转染shVCAN质粒后Hepa1-6上皮细胞-间质细胞转化(epithelial-mesenchymal transition, EMT)相关蛋白的表达情况。 结果: 鼠源性肝癌细胞株Hepa1-6中Versican蛋白呈阳性表达。荧光显微镜显示shVCAN质粒稳定转染Hepa1-6效率高;RT-PCR及Western blot显示,shVCAN质粒稳定转染Hepa1-6后,其内的Versican表达受到明显抑制。此外,shVCAN质粒稳定转染Hepa1-6后,其增殖及迁移能力降低,差异具有统计学意义(P<0.05)。同时,免疫荧光及Western blot显示,shVCAN质粒稳定转染的Hepa1-6内,EMT相关蛋白E-cadherin的表达上调,N-cadherin的表达下调。结论: 沉默鼠源性肝癌细胞株Hepa1-6内Versican基因的表达,其增殖及迁移能力均受到抑制,其部分机理可能与沉默Versican基因引发Hepa1-6内E-cadherin上调及N-cadherin下调有关。
肝癌; Versican; 增殖; 迁移; 上皮细胞-间质细胞转化
原发性肝癌(primary hepatic cancer,PHC)是我国最常见的恶性肿瘤之一,其中肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的90%左右[1]。在我国的癌症患者中,肝癌位居死亡原因第二位,是预后最差的肿瘤之一。肝癌预后凶险,治疗效果不理想,平均生存期仅4~5个月[2]。由于肝癌的早期症状多不明显,且极易发生血道转移,故大部分肝癌患者就诊时已属中晚期,失去了手术治疗的最佳时机,其5年生存率只有7%,绝大多数患者死于肝癌的局部复发或侵袭转移[3]。因此,抑制或者延缓肝癌的侵袭转移成为治疗的首要目的,更加有效的,新的治疗策略需要基于对肝癌的侵袭转移机制的深入理解,而寻找出有效的干预靶点则是提高肝癌患者总体疗效的关键所在。
Versican是细胞外基质中的一种大分子的硫酸软骨素蛋白多糖,是机体重要的多功能分子,在许多恶性肿瘤如肺癌、乳腺癌、大肠癌等组织中呈表达上调[4]。研究证实[5],肿瘤细胞自身会分泌大量的Versican,通过TLR2(toll-like receptor 2)激活巨噬细胞、内皮细胞和成纤维细胞,上调炎性因子的表达,从而营造并维持肿瘤炎性微环境。此外,Versican还参与了恶性肿瘤的转移过程,我们的既往研究发现[6],沉默Versican能明显抑制黑色素瘤的迁移能力。由此看来,Versican在炎症的发生发展及肿瘤的转移过程中扮演着至关重要的角色。若能在肿瘤原位沉默或敲除Versican基因的表达,则有希望减少或延缓肿瘤微环境相关炎症性改变,同时拮抗或逆转肿瘤的浸润及转移能力,最终抑制肿瘤进展。
肝癌的发生发展离不开肝脏微环境的变化[7]。有研究报道,炎症可以促进肝癌的发生及发展[8-9],这提示Versican可能涉及了肝癌的发生发展过程,然而其是否能调节肝癌微环境炎性改变,是否参与调控肝癌转移,目前尚无相关文献报道。本研究旨在初步探讨Versican基因在鼠源性肝癌细胞中的表达情况,设计并构建沉默Versican基因的shRNA质粒(shVCAN)稳定转染肝癌细胞,观察shVCAN质粒的转染效率及在肝癌细胞中的对Versican基因的沉默效率,同时验证转染后的肝癌细胞生物学行为的改变情况及部分可能的相关机理,以期为后续的肝癌炎性微环境研究提供参考依据。
1 材料与方法
1.1 材料
1.1.1 质粒 质粒shVCAN(pcDNA6.2-GW/EmGFP-MIR-VCAN)及质粒shC(pcDNA6.2-GW/EmGFP-miR-negative)均购自Invitrogen公司,寡聚单链DNA序列见表1,质粒图谱见图1。

表1 miRNA 寡聚单链DNA序列(附阴性对照序列)
1.1.2 细胞株 小鼠肝癌细胞株Hepa1-6购自中国科学院上海细胞生物研究所,由本实验室保种。
1.1.3 主要试剂 培养基DMEM (Dulbecco’s Modified Eagle Medium,杜尔伯科改良伊格尔培养基)购自Gibco公司,杀稻瘟菌素Blasticidin S HCl购自Invitrogen公司,转染试剂LipofecTAMine2000购自Invitrogen公司;Cell Counting Kit-8购自Dojindo公司,Versican多克隆抗体购自Abcam公司,Anti-β actin antibody购自武汉博士德生物工程公司,E-cadherin及N-cadherin均购自Santa Cruz公司。

图1 pcDNA6.2-GW/EmGFP-miR图谱
1.2 实验方法
1.2.1 细胞培养 Hepa1-6用含10 %胎牛血清的DMEM培养液,放入37℃,5%CO2培养箱中培养。
1.2.2 细胞瞬时转染 细胞瞬时转染操作参照Invitrigen公司的脂质体转染试剂LipofecTAMine2000使用说明书进行。取鼠源性肝癌细胞株Hepa1-6(2×105/孔)接种于6孔板中,待细胞贴壁后,按一定比例分别加入LipofecTAMine2000及Invitrigen公司提供的4对miRNA 寡聚单链DNA,放入37℃,5%CO2培养箱中培养4~6h后吸除转染液,并加入DMEM完全培养基于37℃,5%CO2培养箱中继续培养24h。
1.2.3 细胞稳定转染 取鼠源性肝癌细胞株Hepa1-6(2×105/孔)接种于6孔板中,待细胞贴壁后,按一定比例分别加入LipofecTAMine2000及筛选出的沉默效率最高的1对miRNA 寡聚单链DNA所构建的相应质粒,放入37℃,5%CO2培养箱中培养4~6h后吸除转染液,并加入DMEM完全培养基于37℃,5%CO2培养箱中继续培养48h。通过杀稻瘟菌素Blasticidin S HCl(3.5μg/mL)进行筛选,通过荧光显微镜观察,待有GFP+绿色荧光单克隆细胞团形成时,反复多次挑取阳性克隆,用含Blasticidin S HCl(3.5μg/mL)的选择性DMEM完全培养基进行扩大培养。
1.2.4 RT-PCR 取各处理组的Hepa1-6细胞,分别提取总RNA,采用两步法进行RT-PCR反应,RT的反应条件为:94℃ 5min,94℃ 30s,60~61℃(退火温度随引物而不同)30s,72℃ 30s,36个循环,72℃ 5min。反应产物行1.5%琼脂糖凝胶电泳,凝胶成像系统(GelDoc型,Bio-RAD公司)成像。GAPDH引物:上游5’-ACCACAGTCCATGCCA-3’下游5’-TCCACCACCCTGTTGC-3’。
1.2.5 Western blot 细胞中加入适量RAPI:PMSF(Phenylmethanesulfonyl fluoride,苯甲基磺酰氟)(100 ∶1)裂解,离心提取总蛋白,按照BCA(bicinchoninic acid,聚氰基丙烯酸正丁酯)法测定总蛋白浓度,上样量为每孔30μg总蛋白。在所提取的蛋白中加入上样缓冲液,98℃变性10 min。100V恒压电泳,电泳后进行湿式电转。转膜后用5%牛奶封闭液封闭1h,一抗的Versican,E-cadherin、N-cadherin用0.05%TBST缓冲液按1 ∶1000稀释,4℃孵育过夜,0.05%TBST洗3次,每次15~20min。加入二抗稀释液(1 ∶1000),室温孵育1h,0.05%TBST洗3次,每次15~20min。使用ECL化学发光法检测,试验重复3次。
1.2.6 细胞增殖与活性检测试剂盒(Cell Counting Kit-8,CCK-8)法检测细胞增殖 取生长良好的细胞悬液,计数并将细胞浓度调整到1×103/孔,接种于96孔板。每天每种细胞各取出3个孔,加入培养基与CCK-8以10 ∶1混合的培养液110μL,同时在仅含培养液的孔加入CCK-8作为空白对照,继续培养4h,重复该步骤3~5天。用Micro-ELISA仪读取吸光值,计算出存活细胞百分数,绘制细胞生长曲线。
1.2.7 划痕及Transwell实验检测细胞迁移能力 划痕实验:在6孔板中加入约(1~2)×105个细胞,培养至各组细胞形成细胞单层后用枪尖头沿培养板底部呈“一”字形划痕。用无血清培养液洗细胞3次,加入完全培养基,培养24h后取样,拍照。Transwell实验:用无血清DMEM培养液按1 ∶2.5稀释Matrigel胶,包被Transwell小室底部,将其放入24孔培养板中,置于细胞培养箱,待胶凝。消化收集细胞,用无血清DMEM培养基悬浮并计数。在小室外加入1mL按1 ∶1混合的条件培养液和DMEM完全培养基,在小室内加入400μL细胞悬液,细胞数为1×104。培养24~48h后,取出Transwell小室,PBS轻轻冲洗,用棉签将胶及微孔膜上层的细胞轻轻擦掉,950mL/L酒精固定10~15min,苏木素染色10~15min。用PBS洗净后显微镜下观察计数细胞。
1.2.8 免疫荧光实验 取生长状态良好的细胞接种于覆有盖玻片的6孔板,制备细胞爬片。PBS清洗爬片,4%的多聚甲醛固定爬片15min;5%BSA(bovine serum albumin,牛血清白蛋白)室温孵育细胞30 min。滴加免疫荧光一抗,湿盒内4℃孵育过夜;次日二抗室温避光孵育1h,DAPI(4’,6-diamidino-2-phenylindole,4’,6-二脒基-2-苯基吲哚)复染细胞核;最后抗荧光淬灭剂封片,显微镜玻片观察采集图像并拍照记录。
1.3 统计学方法
2 结 果
2.1 稳定沉默Versican基因的鼠源性肝癌细胞株Hepa1-6的构建
通过RT-PCR技术从Invitrigen公司提供的4对miRNA 寡聚单链DNA序列中筛选出沉默效率最高的1对序列(MIR-VCAN-4F及MIR-VCAN-4R序列信息详见表1),根据此序列,我们构建了沉默Versican基因的质粒shVCAN及空载体对照质粒shC。待shVCAN及shC质粒稳定转染Hepa1-6后,首先,通过荧光显微镜观察质粒转染效率(图2a),绿色荧光蛋白(green fluorescent protein,GFP)阳性细胞占90%以上。
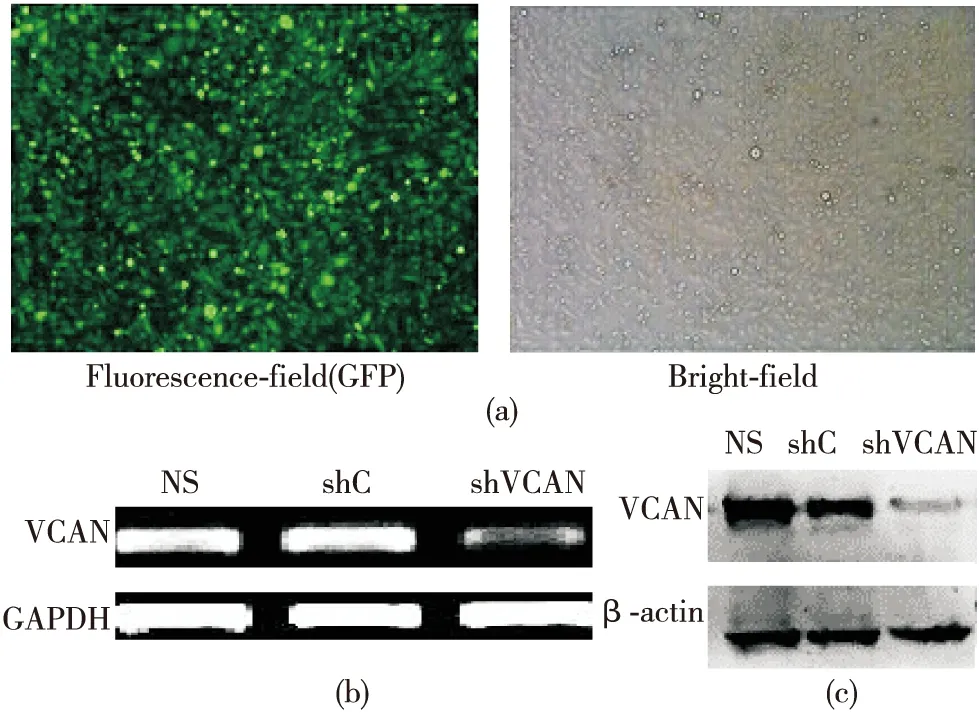
图2 成功构建沉默Versican基因的鼠源性肝癌细胞株Hepa1-6
(a)荧光显微镜观察稳定转染效率
(b)RT-PCR验证稳定转染shVCAN及shC后Hepa1-6中 Versican表达
(c)Western blot验证稳定转染shVCAN及shC后Hepa1-6中 Versican表达
接下来,采用RT-PCR及Western blot技术分别在RNA水平及蛋白水平验证Hepa1-6内Versican基因的沉默效率,结果显示:Versican基因无论在RNA水平还是蛋白水平上,其表达在Hepa1-6/shVCAN中都明显低于Hepa1-6/shC及正常Hepa1-6(图2b-c)。此外,稳定转染的Hepa1-6,在连续传代及冻存复苏后,仍具有强的GFP荧光表达且通过RT-PCR及Western blot证实Hepa1-6/shVCAN中Versican仍处于明显低表达状态。以上结果提示,Versican在鼠源性肝癌细胞株Hepa1-6内呈现阳性表达,同时,我们已成功构建了稳定转染shVCAN的Hepa1-6。
2.2 CCK-8法检测稳定沉默Versican后Hepa1-6的增殖
本研究采用CCK-8法检测Hepa1-6/shVCAN、Hepa1-6/shC及正常Hepa1-6增殖活性的变化。结果显示,以正常Hepa1-6作为对照,在72h时,Hepa1-6/shVCAN较Hepa1-6/shC活细胞数量减少(P<0.05);其余观察点(24,48,96h)Hepa1-6/shVCAN较Hepa1-6/shC,其增殖率的下降无统计学差异(图3)。该实验结果表明:沉默Versican对Hepa1-6在72h时的增殖有一定的抑制作用。
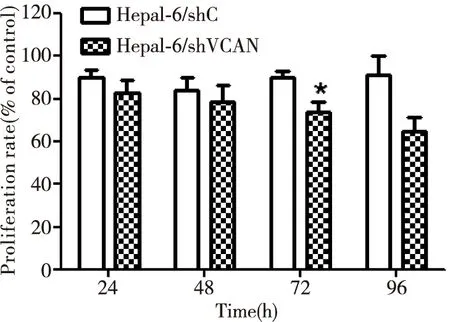
图3 CCK-8检测稳定沉默Versican后Hepa1-6的增殖变化shVCAN vs. shC, *P<0.05
2.3 划痕实验检测稳定沉默Versican后Hepa1-6的迁移
本实验采用划痕实验检测Hepa1-6在稳定沉默Versican后其迁移能力的变化,结果显示,在24h及48h时,以正常Hepa1-6作为对照,Hepa1-6/shVCAN较Hepa1-6/shC的迁移细胞数量明显减少(P<0.01)(图4)。该实验结果表明:沉默Versican可抑制Hepa1-6的迁移能力。
2.4 Transwell实验检测稳定沉默Versican后Hepa1-6的迁移
采用Transwell实验检测Hepa1-6/shVCAN、Hepa1-6/shC及正常Hepa1-6的迁移能力变化。结果显示:以穿过Transwell小室的正常Hepa1-6数量作为对照,48h时, Hepa1-6/shVCAN数量较Hepa1-6/shC明显减少(P<0.01)(图5)。该实验结果表明:沉默Versican能有效地抑制Hepa1-6的迁移能力。
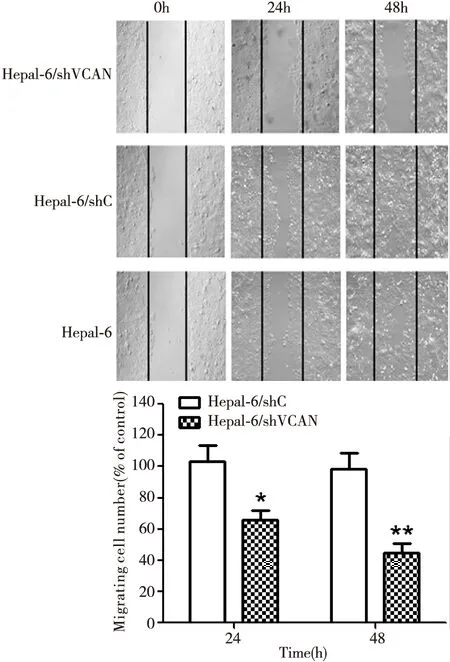
图4 划痕实验检测稳定沉默Versican后Hepa1-6的迁移能力shVCAN vs. shC, *P<0.05, **P<0.01
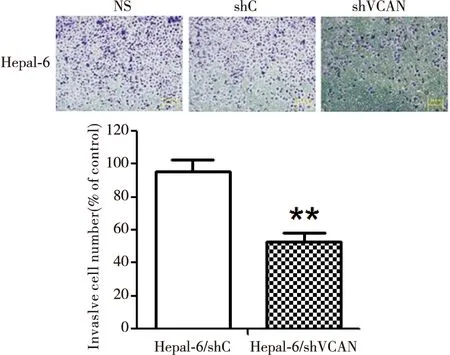
图5 Transwell实验检测稳定沉默Versican后Hepa1-6的迁移能力。shVCAN vs. shC, **P<0.01
2.5 免疫荧光及Western-blot检测稳定沉默Versican后Hepa1-6内EMT(epithelial-mesenchymal transition,上皮间质转化)通路相关蛋白的变化
我们通过免疫荧光检测稳定沉默Versican对Hepa1-6中EMT相关特征性蛋白E-cadherin及N-cadherin表达的改变。结果显示,相对于Hepa1-6/shC及正常Hepa1-6而言,Hepa1-6/shVCAN中E-cadherin的表达水平上调,而N-cadherin的表达水平下调(图6a)。通过Western blot检测,我们同样发现,与Hepa1-6/shC及正常Hepa1-6相比,在Hepa1-6/shVCAN中,E-cadherin的表达上调,而N-cadherin的表达下调(图6b)。结果提示,沉默Versican基因后Hepa1-6迁移能力的改变可能与Hepa1-6中EMT通路相关蛋白发生的改变关系密切。
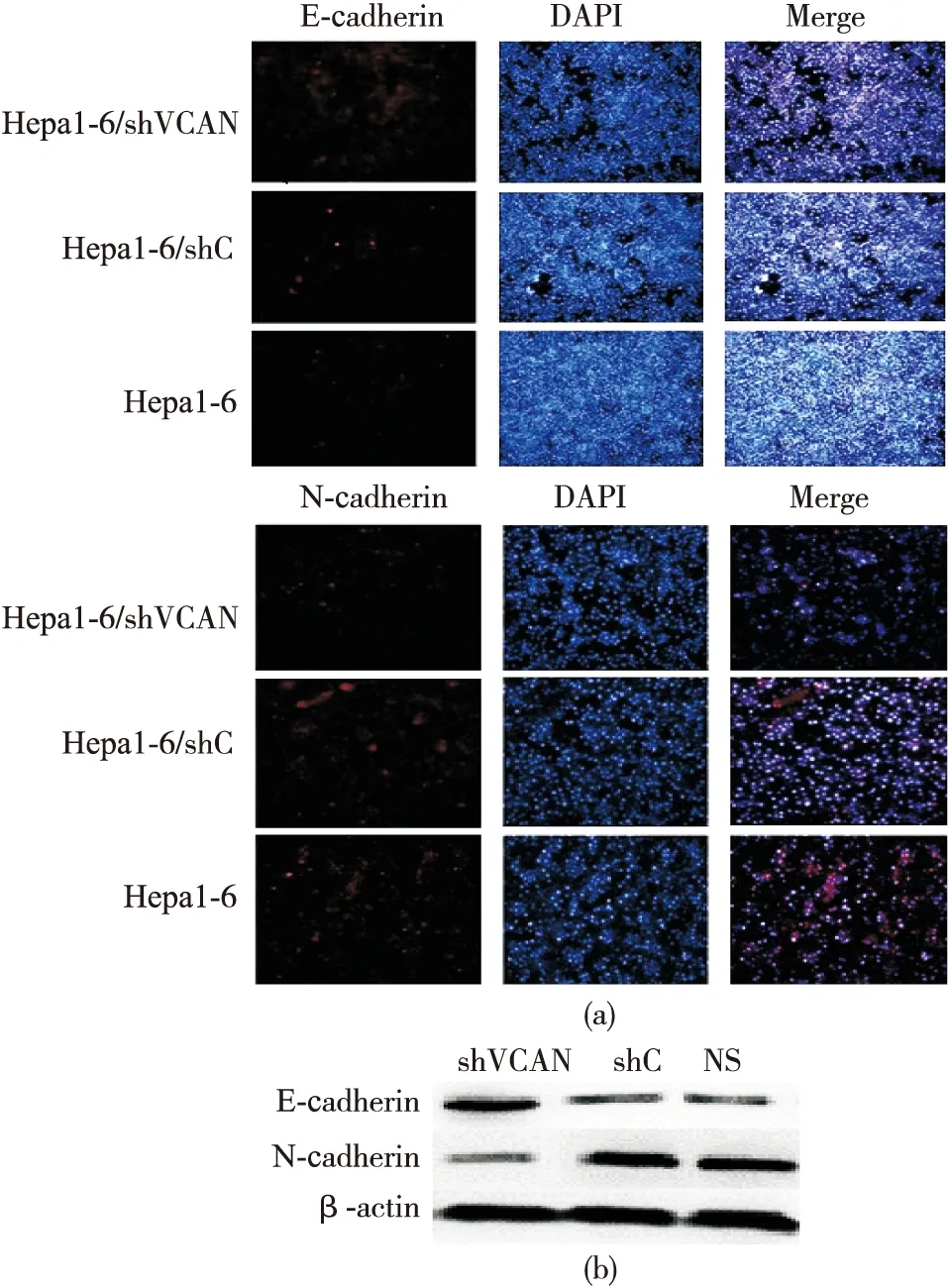
图6 免疫荧光技术及Western blot验证稳定沉默Versican后Hepa1-6中E-cadherin及N-cadherin表达的改变
(a)免疫荧光检测Hepa1-6中E-cadherin及N-cadherin表达
(b)Western blot检测Hepa1-6中E-cadherin及N-cadherin表达
3 讨 论
肝癌是一种高度恶性肿瘤,发病隐匿,容易早期局部扩散及远处转移,其预后凶险,死亡率高,患者总生存期短[10]。与其他肿瘤一样,针对肝癌的传统治疗方法具有特异性差,愈后差和容易复发等缺点,绝大多数患者死于肝癌的局部复发或侵袭转移。肝癌的发生、发展和转移均涉及极其复杂的多基因调控异常过程,因此,研究肝癌的病因及侵袭转移机制具有十分重要的理论和现实意义。
Versican是一种具有多个炎症配体结合位点的大分子硫酸软骨素蛋白多糖,存在于大多数软组织细胞外基质中。通常,它处于低表达状态,但当组织发生炎症时急剧上升。在人类中,Versican由位于5q14.3染色体的单基因编码,人与鼠存在86%的一致性,表明该蛋白多糖的高度保守性。近年来,不断有研究发现,Versican在许多恶性肿瘤如肺癌、乳腺癌、大肠癌等肿瘤组织中表达上调,且与恶性肿瘤的转移密切相关。
由于肝癌是一种与炎症密切相关的恶性肿瘤,炎症可以促进肝癌的发生和发展,那么我们推测,Versican可能在肝癌的发生发展过程中扮演重要角色。为了验证此假设,我们构建了沉默Versican的shRNA质粒(shVCAN),并将其稳定转染到小鼠肝癌细胞Hepa1-6中。Hepa1-6是来源于C57L/J小鼠的BW7756肝癌细胞株,表达AFP,免疫原性弱但恶性度较高,病理特征类似临床肝细胞癌组织,同时也是目前C57BL/6背景下唯一的肝癌细胞株。通过GFP荧光观察,我们证实了shVCAN及shC质粒的转染效率高,进一步通过RT-PCR及Western blot证实了Versican在Hepa1-6/shVCAN中的表达明显低于Hepa1-6/shC及正常Hepa1-6。接下来,我们对转染前后Hepa1-6的生物学行为进行了检测,结果发现,在72h时,Hepa1-6/shVCAN较Hepa1-6/shC及正常Hepa1-6活细胞数量减少,说明沉默Versican能抑制Hepa1-6的增殖,然而其增殖抑制是否与Versican介导的凋亡诱导、细胞周期抑制及细胞自噬有关[11-13],仍需进一步探索;此外,我们的研究结果显示,沉默Versican后,Hepa1-6的迁移能力明显受阻。既往多项研究也曾得到相似的结果。例如有研究发现, 沉默Versican可以干扰CD44-EGFR/ErbB2通路从而减弱黑色素瘤细胞的迁移能力[14]。
如前所述,我们已然发现沉默Versican能抑制鼠源性肝癌细胞株Hepa1-6的增殖及迁移能力,而迁移能力的改变与恶性肿瘤的转移过程密切相关。恶性肿瘤的转移涉及到肿瘤细胞表型的改变以及对周围环境的改变,是多步骤、多阶段的过程。目前已经发现,EMT在生物的发育、组织修复和肿瘤转移中发挥着重要作用,是肿瘤发展和肿瘤转移过程的重要标志性转变。既往研究表明,肿瘤细胞在发生转移的过程中,会伴随着肿瘤细胞EMT[15-16]。这一过程包括E-钙粘蛋白介导的细胞-细胞间的粘附丧失和细胞外基质降解,使得上皮肿瘤细胞失去了细胞极性,从而获得了较高的侵袭与迁移能力。EMT的发生是以E-cadherin、细胞角蛋白等上皮性标志物表达下调,N-cadherin、Vimentin等间叶性标志物表达上调为特点,而且发生EMT的肿瘤细胞细胞间迁移和侵袭能力增强[17-18]。有文献报道[19],Versican在EMT胞外基质重构过程中起到重要的作用。如上所述,我们的研究发现在沉默Versican基因后,鼠源性肝癌细胞株Hepa1-6的迁移能力是受到明显抑制。那么我们猜测,上述实验现象的部分机理可能与沉默Versican基因后Hepa1-6中EMT通路相关蛋白发生了改变有关。为了证实稳定沉默Versican可能对Hepa1-6的EMT过程中胞外基质的重构产生影响,我们采用免疫荧光技术及Western blot在细胞水平探讨稳定沉默Versican对EMT相关特征性蛋白E-cadherin及N-cadherin表达的改变,结果发现,与Hepa-6/shC及正常Hepa1-6相比,沉默Versican上调了E-cadherin的表达,下调了N-cadherin的表达,提示沉默Versican后Hepa1-6迁移能力的改变可能与Hepa1-6的EMT通路相关蛋白发生了改变有关。
目前,Versican与肝癌的关系,以及其对肝癌细胞的增殖、迁移及部分机理的研究尚未见报道。Versican可作为肝癌发生、进展、迁移和侵袭等过程中一个重要的检测指标及潜在靶点,其在肝癌发生发展中的机制和意义还有待进一步深入研究,同时也为我们后续进一步研究Versican与肝癌炎性微环境的改变关系提供了一定的参考依据。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任。
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Siegel R, Naishadham D, Jemal A, et al. Cancer statistics [J]. CA Cancer J Clin, 2013, 63(1):11-30.
[2] Folkman J. Tumor angiogenesis: therapeutic implications [J]. N Engl J Med, 1971, 285(21): 1182-1186.
[3] Holleb AI, Folkman J. Tumor angiogenesis [J]. CA Cancer J Clin, 1972, 22(4): 226-229.
[4] Wu YJ, La Pierre DP, Wu J, et al. The interaction of Versican with its binding partners [J]. Cell Research, 2005, 15(7): 483-494.
[5] Aspberg A, Adam S, Kostka G, et al. Fibulin-1 is a ligand for the C-type lectin domains of aggrecan and Versican [J]. J Biol Chem, 1999, 274(29): 20444-20449.
[6] Wang Z, Li ZX, Wang YY, et al. Versican silencing improves the antitumor efficacy of endostatin by alleviating its induced inflammatory and immunosuppressive changes in the tumor microenvironment [J]. Oncol Rep, 2015, 6(33):2981-2991.
[7] Inokawa Y, Inaoka K, Sonohara F, et al. Molecular alteration in the carcinogenesis and progression of hepatocellular carcinoma: Tumor factors and background liver factors [J]. Oncol Lett, 2016, 12(5):3662-3668.
[8] Lu K, Liu G, Yang L, et al. Sustainable inflammation transforms hepatic cells by causing oxidative stress injury and potential epithelial-mesenchymal transition [J]. Int J Oncol. 2016, 49(3):971-980.
[9] Matter MS, Marquardt JU, Andersen JB, et al. Oncogenic driver genes and the inflammatory microenvironment dictate liver tumor phenotype [J]. Hepatology, 2016, 63(6):1888-1899.
[10]Navarro AN, Kondo E, Kawamoto H, et al. Isolation and propagation of a human CD133(-) colon tumor-derived cell line with tumorigenic and angiogenic properties [J]. Cell Transplant, 2010, 19(6):865-877.
[11]Feng LX, Sun P, Mi T, et al. Agglutinin isolated from Arisema heterophyllum blume induces apoptosis and autophagy in A549 cells through inhibiting PI3K/Akt pathway and inducing ER stress [J]. Chin J Nat Med, 2016, 14(11):856-864.
[12]方胜涛, 林采余, 张全波,等.海芋粗提物对人肝癌细胞的细胞毒和凋亡诱导作用 [J]。肿瘤预防与治疗,2011,24(2):69-73。
[13]Zhu Y, Wei W, Ye T, et al. Small molecule TH-39 potentially targets Hec1/Nek2 interaction and exhibits antitumor efficacy in K562 cells via G0/G1 cell cycle arrest and apoptosis indcution [J]. Cell Physiol Biochem, 2016, 40(1-2):297-308.
[14]Hernandez D, Miquel SL, Docampo MJ, et al. V3 versican isoform alters the behavior of human melanoma cells by interfering with CD44/ErbB-dependent signaling [J]. J Biol Chem, 2011, 286(2):1475-1485.
[15]Yan S, Holderness BM, Li Z, et al. Epithelial-mesenchymal expression phenotype of primary melanoma and matched metastases and relationship with overall survival [J]. Anticancer Res, 2016, 36(12):6449-6456.
[16]Feng M, Feng J, Chen W, et al. Lipocalin2 suppresses metastasis of colorectal cancer by attenuating nf-kb-dependent activation of snail and epithelial mesenchymal transition [J]. Mol Cancer, 2016, 15(1):77.
[17]Wang YJ, Liu JZ, Lv P, et al. Long non-coding RNA CCAT2 promotes gastric cancer proliferation and invasion by regulating the E-cadherin and LATS2 [J]. Am J Cancer Res, 2016, 6(11):2651-2660.
[18]Chen H, Chen Q, Luo Q. Expression of netrin-1 by hypoxia contributes to the invasion and migration of prostate carcinoma cells by regulating YAP activity [J]. Exp Cell Res, 2016, 349(2):302-309.
[19]Gao D, Vahdat LT, Wong S, et al. Microenvironmental regulation of epithelial-mesenchymal transitions in cancer [J]. Cancer Res, 2012, 72(19):4883-4889.
Silencing Versican Influences Proliferation and Migration of Mouse Original Hepatocellular Carcinoma Cells Hepa1-6 in Vitro*
Li Zhixi, Wang Li, Liu Yanyang, et al
(LungCancerCenter,WestChinaHospitalofSichuanUniversity,Chengdu610041,Sichuan,China)
Objective: To detect the expression of Versican and study the impacts of silencing Versican on the proliferation and migration of hepatocellular carcinoma cells. Methods: The expression of Versican in mouse original hepatocellular carcinoma cells Hepa1-6 was detected by Western blot. Constructing plasmid silencing Versican stably transfected Hepa1-6 cells. The transfected effect of the plasmid in Hepa1-6 cells was observed under fluorescence microscope. The silenced effects of Versican in Hepa1-6 cells were detected by RT-PCR and Western blot. The CCK-8 assay was used to detect the proliferative ability of Hepa1-6/shVCAN. Migration ability of Hepa1-6/shVCAN was examined by Scratch and Transwell assays. The expression of EMT-related proteins was detected by immunofluorescence and Western blot. Results: The expression of Versican in Hepa1-6 cells was positive. The transfected effect of the shVCAN plasmid in Hepa1-6 cells was high under fluorescence microscope.The expression of Versican in Hepa1-6 cells was obviously inhibited after transfected shVCAN plasmid shown by RT-PCR and Western blot analysis. Moreover, the abilities of proliferation and migration of Hepa1-6 cells were also significantly suppressed after transfected shVCAN plasmid compared with those of Hepa1-6/shC and Hepa1-6 cells (P<0.05). The immunofluorescence and Western blot analysis revealed that the expression level of E-cadherin was up-regulated while N-cadherin was down-regulated in Hepa1-6/shVCAN cells compared with those in Hepa1-6/shC and Hepa1-6 cells. Conclusion: Silencing the expression of Versican could inhibit the proliferative and migration abilities of mouse original hepatocellular carcinoma cells Hepal-6 and the partly mechanisms may be related to the up-regulation of E-cadherin and down-regulation of N-cadherin.
Primary Hepatic Cancer; Versican; Proliferation; Migration; Epithelial-mesenchymal Transition
2016- 10- 25
2017- 01- 11
*国家自然科学基金(编号:81071864)
李之曦(1985-),男,四川成都人,博士,讲师,主要研究方向:肿瘤生物治疗的基础与临床研究。
△曹 丹,副教授,E-mail:caodan316@163.com
R735.7;R730.231
A
10.3969/j.issn.1674- 0904.2017.01.004
•应用基础研究•

